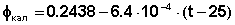Как измерить эдс гальванического элемента
Как измерить эдс гальванического элемента
ПРАКТИКУМ ПО ФИЗИЧЕСКОЙ И КОЛЛОИДНОЙ ХИМИИ
для студентов биолого-почвенного факультета
Работа № 3
ИЗМЕРЕНИЕ ЭДС ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА
1. Определить ЭДС гальванического элемента Якоби-Даниэля.
2. Определить электродные потенциалы медного и цинкового электродов.
3. Рассчитать относительные ошибки определения, используя табличные значения величин.
Для определения ЭДС гальванических элементов компенсационным методом используется потенциометр Р-37. Прежде чем приступать к работе, необходимо ознакомиться с приведенной ниже инструкцией по работе с потенциометром.
1. К соответствующим клеммам потенциометра подключают вспомогательную батарею, гальванометр, нормальный и испытуемый элементы.
2. Устанавливают рабочий ток потенциометра. Для этого по уравнению (1) вычисляют ЭДС нормального элемента Е при температуре опыта t (°С) и выставляют это значение на температурных декадах потенциометра:
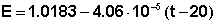
Переключатель режимов потенциометра ставят в положение I А и, включая на короткое время гальванометр нажатием кнопки «измерение», поворотом ручек регулировки тока добиваются компенсации нормального элемента (при включении гальванометра стрелка не должна отклоняться). Затем ставят переключатель в положение I В и повторяют те же операции.
3. Для измерения ЭДС испытуемого элемента переключатель режимов ставят в положение Х1 и, включая гальванометр, добиваются компенсации поворотом ручек декад; после того, как стрелка гальванометра при включении его в цепь перестанет отклоняться, считывают значение ЭДС элемента из окошечек декад.
3.1 Определение ЭДС гальванического элемента Якоби-Даниэля
Элемент Якоби-Даниэля состоит из медной пластинки, опущенной в раствор сульфата меди, и цинковой пластинки, опущенной в раствор сульфата цинка. Медную пластинку перед погружением в раствор тщательно зачищают наждачной бумагой, промывают дистиллированной водой и электролитически покрывают слоем меди. Цинковый электрод амальгамируют, погружая его на несколько секунд в раствор нитрата ртути; выделившуюся капельку ртути растирают по поверхности электрода фильтровальной бумагой.
В два стакана наливают растворы СuSО4 и ZnSО4 (концентрация задается преподавателем), соединяют полуэлементы при помощи электролитического ключа (полоска фильтровальной бумаги, смоченная раствором хлорида калия) и полученный гальванический элемент включают в измерительную схему.
По уравнению (2) рассчитывают теоретическое значение ЭДС элемента Етеор, сопоставляют его с найденным Еэксп.
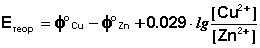
По уравнению (3) вычисляют относительную ошибку опыта r; полученные данные оформляют в таблицу 1.
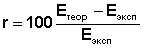
3.2 Определение электродных потенциалов меди и цинка
Экспериментально определить скачок потенциала на границе электрод-раствор невозможно; поэтому в электрохимии под термином «электродный потенциал» понимается ЭДС гальванического элемента, составленного из данного электрода и нормального водородного электрода, электродный потенциал которого принят равным нулю. В настоящей работе потенциалы отдельных электродов определяют, измеряя ЭДС гальванического элемента, составленного из испытуемого электрода и насыщенного каломельного электрода, потенциал которого точно известен. Зависимость потенциала насыщенного каломельного электрода от температуры (°С) имеет следующий вид:
Таблица 2
Зависимость потенциала насыщенного каломельного электрода от температуры
| t, °C | Φкал, B | t, °C | Φкал, B | t, °C | Φкал, B |
| 15 16 17 18 | 0.2503 0.2497 0.2490 0.2483 | 19 20 21 22 | 0.2477 0.2471 0.2464 0.2458 | 23 24 25 26 | 0.2451 0.2445 0.2438 0.2431 |
Для определения потенциалов медного и цинкового электродов составляют следующие цепи:
Измеряют ЭДС каждой цепи (Е1 и Е2 соответственно) и, зная, что ЭДС равна разности потенциалов электродов, вычисляют потенциал испытуемых электродов:
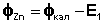
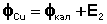
Полученные экспериментальные величины сопоставляют с рассчитанными по уравнению Нернста (3.6) и определяют относительную ошибку эксперимента r. Результаты оформляют в таблицу 3.
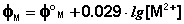
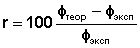
| Металл | [M 2+ ] | Е, В | Φтеор, В | Φэксп, В | r, % |
Copyright © С. И. Левченков, 2006.
КАК РАССЧИТАТЬ ЭДС ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА
Э.Д.С. гальванического элемента определяется по формуле, применение которой рассмотрим в данной статье.
Гальванический элемент является прибором, который позволяет при посредстве химической реакции получить электрическую энергию. А происходит это потому, что один металл готов отдать свои электроны другому, тот же, в свою очередь, их принять.
Но что обеспечивает такую готовность, какая сила заставляет эти электроны перемещаться?
Для сравнения способности одного металла отдавать свои электроны другому измеряют и рассчитывают электродвижущую силу (обозначим ее как Э.Д.С.)
Что такое Э.Д.С. и от чего она зависит
Сила, позволяющая перемещаться электронам по цепи в гальваническом элементе, называется электродвижущей силой (E) , которая в данном случае означает то же, что и напряжение, и потенциал. Поэтому Э.Д.С. измеряется в вольтах.
Вспомним, что 1 вольт (В) представляет собой электродвижущую силу, которая позволяет заряду в 1 кулон (Кл) приобрести энергию в 1 джоуль (Дж).
ЭДС гальванического элемента определяется многими факторами:
— проводимым в элементе химическим процессом;
— концентрацией участников процесса (как реагентов, так и продуктов);
Если гальванический элемент работает в стандартных условиях, то его Э.Д.С. называется стандартной и обозначается Е°.
Стандартные электродные потенциалы
Еще со времен Галилея известно, что все в мире относительно. С тех пор любые события, процессы и явления мы можем рассматривать относительно других событий, процессов или явлений.
Чтобы понять, какова же Э.Д.С. конкретного металла, нужно сравнить ее с такой Э.Д.С., величина которой нам наверняка известна. Для этого был составлен гальванический элемент с газообразным водородом в качестве электрода.
Как устроен и как работает гальванический элемент с водородным электродом
Значение потенциала водородного электрода, с которым будут сравниваться величины измеряемых потенциалов электродов гальванического элемента, условно принимается на ноль.
Конечно же сам водород подключить к цепи мы не можем, так как это газообразное вещество.
Итак, в цепь включена тонкая платиновая Pt пластинка, имеющая дополнительное покрытие из платины, осажденной на ее поверхности электролитическим путем. Здесь адсорбируется газообразный водород, который дополнительно удерживается стеклянной колбой. Последняя же заполнена электролитом: 2н. раствором серной кислоты H2SO4. Кроме того, сюда из баллона подается водород H2.
Схематично рассмотренный гальванический элемент записывают так:
После замыкания цепи стрелка прибора покажет величину потенциала 0,76 В.
ЭДС гальванического элемента с водородным электродом
Итак. Стрелка вольтметра остановилась на значении 0,76 В. Это и есть величина Э.Д.С. гальванического элемента, устройство которого мы рассмотрели.
Поскольку в гальваническом элементе всегда одновременно протекают два противоположных процесса: окисление и восстановление, то Э.Д.С. элемента будет представлена суммой двух потенциалов: окислительного и восстановительного соответственно
Поскольку в ходе процесса окисляется цинк, посчитанное (и измеренное) значение Э.Д.С. будет относиться не столько ко всему элементу, сколько к цинковому аноду.
Именно таким же образом, имея в распоряжении стандартный водородный электрод, были получены значения других стандартных электродных потенциалов.
Э.Д.С. гальванического элемента определяется по формуле, учитывающей электродные потенциалы участников процесса
Возможны случаи, когда электрод в одном гальваническом элементе является анодом, а в другом (в паре с другим металлом) катодом. Иными словами, в зависимости от ситуации он может как окисляться, так и восстанавливаться. Какой же электродный потенциал будет иметь металл?
В таких ситуациях работает правило:
потенциалы окислительного и восстановительного процессов имеют одинаковое численное значение и противоположны по знаку
Например, для цинка:
Важно отметить, что в справочных таблицах стандартных электродных потенциалов принято отображать только восстановительные процессы. Поэтому, если электрод, значение Э.Д.С. которого вам надо взять из такой таблицы, является участником окислительного процесса, вы находите в ней значение Э.Д.С. для него, как для участника восстановительного процесса, и меняете знак на противоположный.
Итак, в самом общем случае Э.Д.С. гальванического элемента определяется по формуле:
Необходимо учесть, что
Э.Д.С. гальванического элемента всегда положительна
Определим Э.Д.С. гальванического элемента, состоящего из медного и цинкового электродов, погруженных в растворы их солей:
Для вычисления воспользуемся справочной таблицей стандартных электродных потенциалов металлов и формулой для расчета Э.Д.С., учитывая, что из двух значений потенциалов, меньшее будет соответствовать окислительным процессам на аноде, а большее – восстановительным процессам на катоде.
Ряд напряжений металлов. Что это такое и каково его значение
Если измерить указанным выше образом значения стандартных электродных потенциалов металлов и расположить их в порядке возрастания, то получится знаменитый ряд напряжений металлов (не совсем верный термин). Лучше его называть рядом стандартных электродных потенциалов металлов. Он имеет еще несколько названий: электрохимический ряд активности металлов, ряд Бекетова. В нем кроме металлов присутствует единственный неметалл водород. Надеемся, теперь понятно, почему.
Li Rb K Cs Ba Sr Ca Na Mg Be Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Cu Hg Ag Pt Au
Каково же значение данного ряда?
По величинам стандартных электродных потенциалов можно предположить, насколько ярко выражены те или иные свойства соответствующих металлов:
2) Все металлы, стоящие в данном ряду левее водорода (т.е. имеющие отрицательное значение потенциала) вытесняют его из разбавленных кислот (кислот, подобных соляной, серной).
3) Каждый предыдущий металл ряда вытесняет все последующие из растворов их солей. Например:
Этот вывод можно подтвердить расчетами:
А вот такая реакция не возможна:
И это также легко подтверждается вычислением Э.Д.С. предполагаемого окислительно-восстановительного процесса:
Полученное отрицательное значение Э.Д.С. говорит о том, что переход электронов с меди на железо не возможен.
4) Если построить из металлов данного ряда гальванический элемент, то его Э.Д.С. будет тем больше, чем больше разность стандартных электродных потенциалов этих металлов.
Например, какой окислительно-восстановительный процесс будет идти эффективнее: вытеснение железа из его соли магнием или цинком? Для ответа на этот вопрос необходимо посчитать Э.Д.С. обоих процессов и сравнить полученные значения:
В обоих случаях Э.Д.С. положительна. Значит, процессы возможны. Однако, взаимодействие сульфата железа (II) с магнием более эффективно, чем с цинком почти в 6 раз.
Примеры вычислений Э.Д.С. гальванического элемента и электродных потенциалов
Разберем еще несколько примеров, в которых применяется формула, по которой определяется Э.Д.С. гальванического элемента.
Задача 1. Рассчитайте, будет ли протекать реакция при погружении пластинки железа в 1М раствор сульфата никеля.
Так как значение Э.Д.С. предполагаемой окислительно-восстановительной реакции положительное, то такая реакция возможна.
Задача 2. Рассчитайте Э.Д.С., укажите направление движения электронов в имеющейся комбинации электродов:
Окисляется свинцовый Pb анод, его электроны будут переходить на серебряный Ag катод.
Задача 3. Подтвердите расчетом, будет ли металлический никель растворяться: а) в 2М растворе серной кислоты; б) в растворе сульфата калия с той же активностью ионов.
Задача 4. Определите возможность протекания в водном растворе реакции между хлором и хлоридом железа (II).
Задача 5. Вычислите стандартную Э.Д.С. гальванического элемента, в котором протекает реакция:
Важный вывод из этой задачи:
значение Э.Д.С. гальванического элемента зависит от концентраций участников окислительно-восстановительного процесса, но не зависит от их количеств.
Количество вещества йода, которое мы умножили в окислительной полуреакции на три для соблюдения электронного баланса, не имеет значения, и поэтому величину стандартного электродного потенциала этой полуреакции на три умножать не нужно. Так же поступают во всех подобных случаях.
Таким образом, ЭДС гальванического элемента определяется по формуле, учитывающей значения стандартных электродных потенциалов. Она позволяет определить эффективность окислительно-восстановительного процесса, как в гальваническом элементе, так и при взаимодействии металла с раствором соли другого металла.
Измерение ЭДС гальванических элементов


Измерение ЭДС гальванических элементов
Элемент близок к нулю. Людмила Фирмаль
По этой причине ED C Противоположный знак и значение от внешнего источника тока Можно регулировать по-разному. Измерения в Гальванометр для регистрации также включен. Ток и вольтметр для измерения напряжения. В данный момент Выходное напряжение внешнего источника тока равно ED C гал Банический элемент (компенсация мгновенного E D C), ток цепи Равен нулю (указатель гальванометра не отклоняется).
Метр, ток через элемент маленький, значит он маленький Разница между ЭД и напряжением ячейки. Метод измерения ЭД элемента С очень удобен для экспериментов. Психическое определение термодинамической функции тока Реакция излечения.
Потому что сопротивление болта высокое. Людмила Фирмаль
Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Задачи к разделу Электродные процессы, Гальванический элемент
В настоящем разделе представлены типовые задачи на гальванические элементы: Определение ЭДС гальванического элемента, составление схемы гальванического элемента, определение энергии химической реакции в кДж.
Задача 1. Вычислите значение э.д.с. гальванического элемента:
(-) Mg / MgSO4 // CuSO4 / Cu (+)
Напишите процессы на аноде и катоде, реакцию, генерирующую ток, и определите в кДж энергию химической реакции, превращающуюся в электрическую.
Решение.
Дана схема гальванического элемента, из которой видно, что анодом является магний, а катодом — медь
(-) Mg / MgSO4 // CuSO4 / Cu (+)
Mg 0 + Cu 2+ = Mg 2+ + Cu
Вычислим ЭДС гальванического элемента:
ЭДС =0,337 + 2,37 = 2,71 В
Задача 2. Рассчитайте ЭДС гальванического элемента, составленного из стандартного водородного электрода и свинцового электрода, погруженного в 0,01 М раствор PbCl2. На каком электроде идёт процесс окисления, а на каком — восстановление?
Решение.
В данной паре потенциал свинца имеет более отрицательное значение, поэтому анодом является свинец:
Pb 0 + 2H + = Pb 2+ + H2
Определим электродный потенциал свинца:
Вычислим ЭДС гальванического элемента:
ЭДС = 0 + 0,185 = 0,185 В
Задача 3. По уравнению токообразующей реакции составьте схему гальванического элемента:
Ni + СuSO4 = NiSO4 + Cu Напишите уравнения анодного и катодного процессов. Рассчитайте стандартную ЭДС.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Ni2+/Ni и E 0 Cu2+/Cu
В данной паре потенциал никеля имеет более отрицательное значение, поэтому анодом является никель:
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Ni 0 + CuSO4 = NiSO4 + Cu 0
Составим схему гальванического элемента:
(-) Ni 0 |NiSO4 || CuSO4|Cu 0 (+)
Рассчитаем стандартную ЭДС реакции:
ЭДС = 0,337 – (- 0,250) = 0,587 В
Задача 4. Составьте схему гальванического элемента из магния и свинца, погруженных в растворы их солей с концентрацией ионов:
[Mg 2+ ] = 0,001 моль/л, [Pb 2+ ] = 1 моль/л. Напишите уравнения реакций, протекающих на катоде и аноде. Рассчитайте стандартную ЭДС этого элемента.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Mg2+/Mg и E 0 Pb2+/Pb
В данной паре потенциал магния имеет более отрицательное значение и является анодом:
Mg 0 + Pb 2+ = Mg 2+ + Pb 0
Составим схему гальванического элемента:
(-) Mg 0 |Mg 2+ || Pb 2+ |Pb 0 (+)
Применяя уравнение Нернста, найдем EPb2+/Pb и EMg2+/Mg заданной концентрации:
Рассчитаем стандартную ЭДС реакции
Задача 5. Как изменится (увеличится, уменьшится) или останется постоянной масса пластины из кобальта, погруженной в раствор, содержащий соли Fe (II), Mg, Ag (I). Напишите молекулярные уравнения реакций.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Mg2+/Mg, E 0 Co2+/Co, E 0 Fe2+/Fe, E 0 Ag+/Ag
Протекание реакции возможно при условии, когда E 0 восст 0 ок.
В нашем случае восстановителем является кобальт и условие E 0 восст 0 ок соблюдается только для пары
Co 0 + Ag + = Co 2+ + Ag 0
Молекулярное уравнение, например:
В процессе пластина из кобальта будет растворяться, но одновременно на ее поверхности будет осаждаться серебро.
Из уравнения реакции видно, что при взаимодействии 1 моль кобальта, образуется 2 моль серебра.
Мольная масса кобальта M(Co) = 59 г/моль, мольная масса серебра M(Ag) = 108 г/моль.
Найдем массы металлов:
n = m/M, m = n∙M
Таким образом, масса осажденного серебра больше, чем масса растворенного кобальта, т.е. масса пластины из кобальта увеличится.
В случаях, когда пластина опущена в раствор соли железа или соли магния ее масса не изменится, т.к. кобальт не вытесняет эти металлы из их солей. Т.е. реакции не происходит и масса пластины остается неизменной.
Задача 6. Составьте схему гальванического элемента, уравнения полуреакций анодного и катодного процессов, молекулярное уравнение реакции, проходящей при работе гальванического элемента, анодом которого является никель. Подберите материал для катода. Рассчитайте стандартную ЭДС этого гальванического элемента.
Решение.
По условию задачи материал анода известен – никель. Электродный потенциал анода всегда имеет более отрицательное значение, т.е. анод состоит из более активного металла, чем катод.
Поэтому нам надо подобрать такой металл, значение потенциала которого, будет иметь большее значение, чем значение электродного потенциала никеля. Например, медь:
Составим уравнения полуреакций анодного и катодного процессов и молекулярное уравнение реакции, проходящей при работе гальванического элемента.
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Ni 0 + CuSO4 = NiSO4 + Cu 0
Составим схему гальванического элемента:
(-) Ni 0 |NiSO4 || CuSO4|Cu 0 (+)
Рассчитаем стандартную ЭДС реакции