Как кальций попадает в кости
Кальций в костях, а не в сосудах!
Дефицит кальция – это серьезная проблема, особенно, у людей старше 50 лет. Недостаток этого элемента в нашем организме может приводить к серьезным последствиям, в том числе к остеопорозу – хрупкости костной ткани. Однако, бесконтрольный дополнительный прием кальция – не такая уж безобидная процедура. Дело в том, что избыток кальция, точно также как его недостаток может негативно влиять на здоровье человека. Итак, попробуем разобраться в этом вопросе.
ЗА: кальций спасает кости

Если человек недополучает кальций, организм начинает активно брать его взаймы у костной ткани: портятся зубы, становятся ломкими ногти, редеют волосы. Теряют свою эластичность суставы, происходит усиленный износ и деформация хрящевой ткани. Появляются ощущения усталости, ломоты и боли в спине, особенно в крестце и пояснице, вызванные компрессионными микротрещинами тел позвонков. Начинает постепенно деформироваться скелет: уменьшаться рост, искривляться позвоночник. В итоге, с возрастом любая пустяковая травма может привести к незарастающим переломам, способным навсегда приковать человека к постели.
Сегодня определены суточные нормы потребления кальция, необходимые для поддержания нормального кальциевого обмена. Для взрослого человека они составляют 1 – 1,2 г кальция в день. К сожалению, в погоне за здоровьем и красотой мы начинаем бесконтрольно поглощать кальциевые добавки, часто забывая о том, что кальций имеется в каждом выпитом нами глотке воды, в овощах, фруктах, молочных продуктах. Необходимую дозу кальция можно получить, выпив всего 2 стакана коровьего молока или съев горстку кунжутных семечек.
Осень важно, чтобы каждый человек понимал: если ваш пищевой рацион богат кальцием, то дополнительно его принимать следует с большой осторожностью. Почему?
ПРОТИВ: кальций оседает в сосудах

Если у человека есть проблема с мочевыделительной системой, избыточное потребление кальция может приводить к формированию камней в почках и развитию мочекаменной болезни. В дальнейшее камни могут, покидая почки, застревать в мочеточниках вызывая достаточно сильные болевые ощущения, известные как почечная колика.
Помимо этого избыток кальция может поражать клапанный аппарат сердца, приводя к нарушению эластичности клапанов и как следствие – к развитию сердечной недостаточности.
Таким образом, избыток кальция, равно как и его дефицит может быть опасен для здоровья человека. Но решение есть. Во-первых, следует принимать то количество кальция, которое действительно вам показано. А во-вторых, следить за тем, чтобы кальций усваивался правильно: в нужном месте и в нужном количестве.
Управляем кальцием
Усвоение кальция зависит от многих обстоятельств: возраста, имеющихся заболеваний, кислотности желудочного сока, состояния гормональной системы. Но есть вещества, без которых полноценное и безопасное усвоение кальция попросту невозможно. Речь идет о двух витаминах: D3 и К2. Именно эти 2 витамина составляют основу новой биодобавки – корректора кальциевого обмена – «Трансактиватор кальция. Леколайк».
Роль витамина D3 в организме человека многогранна. Витамин D3 предупреждает слабость мускулов, повышает иммунитет, участвует в нормализации функций щитовидной железы, способствует нормальной свертываемости крови. От него зависит восприимчивость организма к кожным заболеваниям, болезням сердца. Однако, основная функция витамина D3 – улучшение всасываемости кальция и обеспечение нормального роста и развития костей. Именно поэтому он должен быть обязательным «спутником» кальция.
Витамин К2 решает две другие важнейшие задачи. Во-первых, без витамина К2 наши кости были бы хуже и больше ломались, даже при достаточном потреблении кальция. Дело в том, что в организме человека есть клетки, которые формируют кость, и клетки, которые ее разрушают. Происходит, так называемый, процесс костного ремоделирования. С возрастом деятельность клеток-«разрушителей» резко активизируется, и начинает преобладать над работой «строителей. Дополнительный прием витамина К2 препятствует процессу разрушения костной ткани. Таким образом, витамин К2 является необходимым в профилактике остеопороза. Во-вторых, витамин К2 «направляет» кальций в кости, препятствуя его отложению в почках, сосудистых стенках. 
Так, совмещение приема кальциевых препаратов с приемом витаминов К2 и D3 улучшит усвоение кальция, поможет замедлить потерю костной массы и снизить риск переломов, а также предотвратит «оседание» кальция на стенках кровеносных сосудов.
Никогда не поздно подумать об улучшении обеспечения своего организма кальцием – этот элемент необходим нам вне зависимости от того, сколько нам лет. Кальций должен поступать в организм человека на протяжении всей его жизни.
Не важно, предпочитаете ли вы получать кальций из пищи или из кальциевых препаратов, дополнительный прием «Трансактиватор кальция. Леколайк» улучшит усвоение кальция и обеспечит его правильный метаболизм. А именно, направит кальций в те места, где он действительно необходим – кости и зубы, предотвращая его отложение в мягких тканях, суставах и стенках сосудов.
Как кальций попадает в кости
Н.Ю. Карпова (1), М.А.Рашид (2), Т.В. Казакова (1), М.Е. Ядров (2)
(1) Кафедра факультетской терапии им. А.И. Нестерова ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава России, Москва; (2) ГБУЗ «Онкологический клинический диспансер № 1» ДЗ г. Москвы (филиал № 1)
Введение
В повседневной клинической практике врач сталкивается с необходимостью оценивать кальциево-костный гомеостаз в двух случаях: при наличии изменений концентрации минералов в биологических жидкостях организма и при получении патологических результатов денситометрии [1]. Однако нарушения минерального и костного обменов могут быть следствием различных заболеваний и патологических состояний: первичного поражения органов или систем человеческого организма (первичный гиперпаратиреоз), реакции на изменение минерального состава крови (вторичный гиперпаратиреоз), выраженных колебаний содержания минералов в сыворотке крови или моче (онкологические заболевания в целом и костные метастазы в частности), осложнения необратимого заболевания (хроническая почечная недостаточность) [2]. Для адекватной оценки состояния пациента, назначения дополнительных обследований и определения характера терапии требуется знание физиологических особенностей указанных процессов в норме и при патологии.
Механизмы регулирования костного и кальциевого обменов
Костный скелет является основным физиологическим депо для кальция и в меньшей степени – для магния и фосфора. Содержание кальция в скелете контролируется сложными взаимосвязанными механизмами, включающими участие органов желудочно-кишечного тракта (ЖКТ) и почек, действие которых на уровне костной ткани (КТ) опосредуется остеобластами и остеокластами. Источником кальция для скелета является пища. Неабсорбированный кальций выводится в основном с калом и в небольшом количестве активно секретируется в просвет ЖКТ. Незначительные потери кальция наблюдаются при потении и усиленном шелушении кожи. Значительные потери кальция наблюдаются во время беременности (через плаценту к плоду) и во время лактации (через грудное молоко). Абсорбированный из пищи кальций попадает в межклеточное пространство и встраивается в скелет благодаря процессу минерализации органического костного матрикса – остеоида. Оставшаяся часть кальция фильтруется почками в объеме около 6 г/сут, из которых 98% реабсорбируется в ток крови [3, 4].
В регуляции костного и минерального обменов принимают участие: 4 гормона (кальцемические) – паратиреоидный гормон (ПТГ), кальцитонин, фактор роста фибробластов-23 (ФРФ-23) и активные формы витамина D; 3 органа-мишени – кости, почки и ЖКТ; 3 костных минерала – кальций, магний, фосфор [4]. Понимание причин и следствий нарушений работы вышеуказанных элементов является ключевым для адекватного лечения минерального и костного дисбаланса.
В целом кальциемические гормоны определяют содержание минералов в биологических жидкостях организма (моча и кровь) и их действие на уровне органов-мишеней изучено довольно подробно. Однако на клеточном и внутриклеточном уровнях обмен кальция остается малоизученным. Кальций (как фосфор и магний) попадает в центральный кровоток из КТ, почек, ЖКТ, и наоборот. Эти транспортные пути могут проходить через клетки (трансклеточно) или в обход клеток (параклеточно, периклеточно) [5–7]. Параклеточный транспорт, как правило, происходит пассивно – путем диффузии по направлению минерального градиента (downhill diffusion), и не подвержен гормональной регуляции. Диффузия также может происходить через специальные клеточные каналы, которые в определенное время открываются или закрываются [8, 9].
Трансклеточный транспорт осуществляется против минерального градиента (uphill diffusion) и является активным. Для данного процесса требуется дополнительная энергия, получаемая при гидролизе АТФ и создающая электромеханический градиент на поверхности специализированных мембранных структур, именуемых портами, обменниками или помпами. Существует три подтипа портов: «унипорты» (транспортируют одно вещество), «симпорты» (транспортируют два вещества в одном направлении) и «антипорты» (транспортируют более одного вещества в двух направлениях). В указанном процессе также принимают участие высокоспециализированные кальций-связывающие белки. Наряду с описанными механизмами существуют котранспорт и обменный транспорт с вовлечением других ионов, включая калий, натрий, хлориды, водород и бикарбонаты, что иногда также требует дополнительной энергии. Сходные процессы наблюдаются внутри клеток, где происходит перераспределение кальция между митохондриями и цитозолем [8, 9]. Предполагается, что изменения содержания минералов во внеклеточной среде во многом нивелируются их внутриклеточным перераспределением.
Обратный процесс заключается в переходе кальция (и других минералов) из клеток во внеклеточный «отсек». Таковым для эритроцитов является окружающая плазма крови, а для клеток почечного эпителия – моча. Для костных клеток внеклеточным отсеком служат костный мозг и капиллярная кровь. Трансклеточный транспорт кальция зависит от работы ряда белков, включая кальмодулин, кальбиндин, интегральный мембранный белок, а также от активности щелочной фосфатазы. Экспрессия последних трех веществ опосредуется метаболитами витамина D. По-видимому, выход кальция из клеток осуществляется теми же структурами, что и его вход. В отличие от кальция для фосфора специализированных связывающих белков не описано [6, 7].
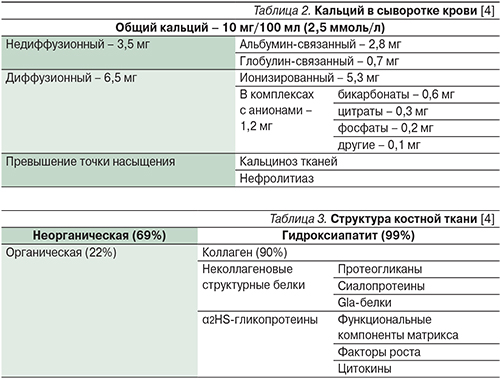
Предполагается, что на молекулярном уровне кальциемические гормоны осуществляют свое действие через описанные мембранные структуры и связывающие белки. Например, витамин D усиливает всасывание кальция через потенцирование синтеза кальбиндина в энтероцитах. В почечных канальцах ПТГ и ФРФ-23 регулируют транспорт кальция и фосфатов, а витамин D поддерживает их концентрацию в крови, регулируя всасывание в кишечнике и (возможно) выделение с мочой [10–12]. Распределение кальция в организме человека представлено в табл. 1.
Метаболизм кальция
Содержание кальция в сыворотке крови и во внеклеточной жидкости у млекопитающих жестко регулируется в узком диапазоне, обеспечивая оптимальную жизнедеятельность клеток. Физиологическую роль в организме человека играет исключительно ионизированный кальций. Его концентрация находится в крови на пределе «насыщения» и тесно взаимосвязана с концентрацией фосфатов. Внутриклеточный кальций, являющийся вторичным «мессенджером» для большинства физиологических процессов, также подвержен жесткой регуляции. Однако его концентрация на порядок ниже внеклеточной [1–3].
Биологическими функциями, в которых активно участвует кальций, являются [4]:
Основное депо кальция находится в КТ, а его внекостная часть составляет около 10%. В среднем с пищей должно поступать около 1 г кальция в сутки, из которых 500 мг всасываются, а оставшаяся часть выводится с калом. Ежесуточно приблизительно 10 г кальция фильтруется почечными клубочками, и подавляющая его часть реабсорбируется канальцами, лишь 200–300 мг выводятся с мочой. Костный скелет потребляет около 250 мг кальция в сутки. Для данного процесса типична высокая вариабельность.
Костный метаболизм кальция зависит от доли «лабильного» (обменного) кальция, находящегося у поверхности костных клеток. Однако точной анатомической локализации «отсеков» лабильного и нелабильного кальция в настоящее время не существует. Участниками костного метаболизма являются остеобласты и остеокласты. В случае патологии костный обмен может быть ускоренным (гиперпаратиреоз) или замедленным (гипопаратиреоз) с соответствующими изменениями концентраций кальция в сыворотке крови и моче. Регуляторами костного обмена выступают витамин D и ПТГ, точками приложения действия которых являются КТ, почки и ЖКТ, обеспечивая изменения содержания кальция в сыворотке крови. Кальцитонин предположительно угнетает костную резорбцию и в меньшей степени участвует в обмене кальция как такового [5].
Около 50% кальция сыворотки крови находится в ионизированном состоянии, остальная часть – в связанном с белками плазмы виде или в комплексах с различными анионами (табл. 2).
Концентрация ионизированного кальция у здорового человека составляет 1,25±0,07 ммоль/л. Регулирование содержания кальция крови осуществляют кальциемические гормоны и, вероятно, половые стероиды [1–3].
Костный обмен
Кость состоит из минерального и органического компонентов (табл. 3). Минеральная часть в основном представлена гидроксиапатитом, а органическая – коллагеном 1-го типа, входящего в структуру костного матрикса. Органическая часть является продуктом жизнедеятельности остеобластов. Минералы находятся в кости в двух формах: кристаллы гидроксиапатита типичны для зрелой ткани, аморфные массы фосфата кальция – для созревающей. Равновесие двух компонентов обеспечивает кости ее целостность и функциональную состоятельность. Витамин D является ключевым гормоном для начала минерализации, но в дальнейшем его роль уменьшается за счет включения локальных механизмов (концентрация минералов, наличие нуклеаторов, отсутствие ингибиторов минерализации) [1, 13].
По структуре КТ подразделяется на кортикальную и трабекулярную. Кортикальная кость составляет 80% скелета человека, трабекулярная – оставшиеся 20%. При этом за счет особенностей строения площадь поверхности трабекулярной кости в 4–5 раз больше кортикальной. Соответственно, метаболическая активность трабекулярной КТ выше. Процент ежегодного ремоделирования трабекулярной КТ составляет 20–30%, кортикальной – не более 10%. У взрослого человека КТ претерпевает полное ремоделирование каждые 3 года. До 20–25 лет происходит быстрое накопление костной массы до пикового значения, в последующем наблюдается фаза плато, а с 40 лет начинается ее возрастная потеря [4]. В целом женщины обладают меньшей костной массой за счет ее меньшего (на 30%) пикового значения и ускоренной потери после менопаузы. В настоящее время активно изучаются генетические и эпигенетические механизмы, ответственные за соотношение процессов остеосинтеза и остеорезорбции [14].
Клеточный пул костного скелета представлен остеобластами, остео-цитами (замурованными в зрелой кости остеобластами), выстилающими клетками и остеокластами. Два основных представителя клеточных линий имеют различное происхождение. Остеокласты происходят из гематопоетических стволовых клеток, способных дифференцироваться в макрофаги, гранулоциты, эритроциты, мегакариоциты, тучные клетки, В- и Т-лимфоциты. Остеобласты имеют в качестве предшественника мезенхимальную стволовую клетку, которая дает начало хондро-, мио-, адипоцитам и фибробластам. В настоящее время возможность фенотипической модуляции отдельных клеточных представителей в пределах одной линии считается доказанной. На этапе формирования зрелой кости остеокласты подвержены слиянию и последующему апоптозу, а остеобласты – трансформации в остеоциты и клетки выстилки. Лишь малая часть остеобластов подвергается апоптозу. Этим объясняется разная скорость остеосинтеза (медленная) и остеорезорбции (быстрая), что клинически определяет диагностическую ценность маркеров костного ремоделирования [3, 4].
Лишь недавно была расшифрована роль остеоцитов в костном метаболизме. Доказано, что после формирования КТ остеоциты остаются в костных лакунах и в последующем образуют микроскопические канальцы, соединяющие их с другими остеоцитами, остеобластами и мелкими сосудами. Тем самым в кости формируется своеобразный «клеточный синцитий», способствующий передвижению минералов в зоны активного синтеза и их взаимодействию с костным матриксом. Другой функцией остеоцитов является передача механических стимулов (аналог нейронов в нервной ткани), в конечном счете определяющая скорость ремоделирования в различных зонах КТ. Также установлено, что остеоциты являются биологически активными клетками. Среди продуктов их синтеза в настоящее время изучается склеростин (фактор, ингибирующий образование кости), который рассматривается в качестве экспериментальной «мишени» антиостеопоротической терапии в будущем [15].
Гиперкальциемия при различных патологических состояниях
В клинической практике снижение уровня кальция в сыворотке крови встречается довольно редко, преимущественно у детей, манифестируя тетанией. У взрослых гипокальциемия, как правило, служит следствием дефицита витамина D и кальция в пищевом рационе, проявлением отдельных заболеваний эндокринной системы (первичный гипопаратиреоз, синдром Кона) или симптомом хронической почечной недостаточности. Лечение этих состояний подробно описано в соответствующих руководствах [1–3].
Гораздо чаще практикующий врач сталкивается с гиперкальциемией, прогноз которой гораздо серьезнее. Гиперкальциемия играет роль в танатогенезе в случае развития кардиальных (злокачественные нарушения ритма) или неврологических (гиперкальциемическая кома) осложнений. Впервые гиперкальциемия была описана при онкологических заболеваниях [16]. Оказалось, что ее могут вызывать как костные метастазы, так и некоторые вещества, продуцируемые опухолевыми клетками. Нередко два указанных процесса сосуществуют, поскольку опухолевые клетки не в состоянии резорбировать кость непосредственно, а активируют соответствующие остекласты путем межклеточного взаимодействия или посредством высвобождения определенных субстанций. Наиболее вероятным кандидатом на роль такого агента в настоящее время считается ПТГ-связанный пептид (ПТГ-СП) [17]. В случае солидных опухолей повышение экспрессии ПТГ-СП наблюдается в 80% случаев. Было установлено, что ПТГ-СП может продуцироваться как нормальными, так и злокачественными клетками.
О его роли в генезе гиперкальциемии косвенно говорит тот факт, что эктопическая продукция нативного ПТГ встречается крайне редко. Исходно гиперэкспрессия ПТГ-СП была отмечена при опухолях из железистого эпителия. Повышение уровня ПТГ-СП наблюдается в половине случаев рака молочной железы или простаты. При наличии сопутствующей гиперкальциемии экспрессия ПТГ-СП возрастает в разы. Доказано, что для опухолей, сопровождающихся на начальном этапе развития повышением образования ПТГ-СП, характерно облигатное костное метастазирование в будущем. В последующем сходные результаты были получены при злокачественных опухолях других локализаций, включая рак легких.
Интересно, что повышение уровня ПТГ-СП может наблюдаться и при неонкологических заболеваниях, сопровождающихся гиперкальциемией. В частности, его продукция макрофагами определяет течение заболевания и выраженность гиперкальциемии при саркоидозе. В последнее время появились данные, связывающие гиперкальциемию с повышением концентрации метаболитов витамина D, что нередко наблюдается при лимфомах и других гемобластозах. За счет усиления остеорезорбции гиперкальциемию могут также вызывать отдельные цитокины (в частности, интерлейкин-1), а также фактор роста опухолей β. В то же время гиперпродукция простагландинов при ряде опухолей в настоящее время не считается причиной гиперкальциемии [18].
Кальций и остеопороз
Роль нарушений кальциевого гомеостаза в развитии остеопороза прослежена в наблюдательных исследованиях [19]. Большинство населения земного шара в настоящее время не потребляет достаточного количества кальция (800–1000 мг/сут) по причине неправильного пищевого рациона, нарушения всасывания кальция в кишечнике или непереносимости молочных продуктов [20]. Сходная ситуация существует с витамином D, являющимся кофактором всасывания кальция в кишечнике. Дополнительными причинами дефицита витамина D являются недостаточная инсоляция и генетические мутации [21]. Большинство постменопаузальных женщин страдают D-дефицитом и имеют низкую минеральную плотность КТ [22–24].
В то же время препараты кальция не способствовали в клинических исследованиях предотвращению развития остеопороза или снижению темпа его прогрессирования. Следует отметить, что в большинстве работ использовался цитрат кальция, потребление которого приводило к резкому повышению уровня кальция в сыворотке крови, и способствовало развитию т.н. синдрома кальциевых добавок, проявляющегося быстрым формированием нефролитов и прогрессированием сердечно-сосудистых заболеваний. При этом положительного влияния на формирование КТ отмечено не было [25, 26]. В связи с этим препараты кальция были исключены из большинства алгоритмов терапии остеопороза ведущих медицинских ассоциаций [20, 27, 28].
В то же время нельзя не отметить некоторые особенности результатов упомянутых работ [28, 29]:
Последующие работы показали, что дефицит пищевого кальция не всегда коррелирует с выраженностью возрастной потери КТ. Частично это объясняется индивидуальной вариабельностью последней. Как правило, снижение уровня кальция в крови в первую очередь компенсируется активацией физиологических механизмов его всасывания из кишечника, увеличением реабсорбции в почках и вымывания из костного скелета. Также имеет место различная этническая предрасположенность к остеопорозу [30].
Тем не менее увеличение потребления пищевых продуктов, богатых кальцием (включая искусственно обогащенные), наряду с достаточным потреблением витамина D и остеогенными физическими нагрузками является ключевым элементом программ по предотвращению остеопороза, а также компонентом схемы его лечения [31, 32].
Заключение
Клиническое значение нарушений костного и кальциевого метаболизма определяется их выраженностью и коморбидным фоном.
В большинстве случаев при наличии гипокальциемии следует предполагать заболевание почек, первичный гипопаратиреоз, мальабсорбцию или дефицит витамина D. При выявлении гиперкальциемии очень высокой становится вероятность обнаружения онкологического заболевания или первичного гиперпаратиреоза. Оценка индивидуального риска возникновения патологических переломов при нарушениях костного и кальциевого метаболизма проводится по общепринятым правилам [33]. Последующее проведение денситометрии для определения минеральной плотности костной ткани позволяет устанавливать правильный диагноз и определять индивидуальную тактику ведения пациента. Перед назначением комбинированных с витамином D препаратов кальция следует оценивать характер привычного питания и определять риск сердечно-сосудистых осложнений. Суточная доза кальция должна находиться в пределах 1000–1500 мг/сут.
Литература
1. Deftos L.J. Clinical Essentials of Calcium and Skeletal Metabolism. Professional Communication Inc. 1st Edition, 1998. Р. 1–208.
2. Gupta A., March L. Treating osteoporosis. Aust. Prescr. 2016;39(2):40–6.
3. Brown E.M. Physiology of Calcium Homeostasis. In: The Parathyroid. 2nd Edition, 2001. Р. 167–82.
4. Shaker J.L., Deftos L. Calcium and Phosphate Homeostasis. Endotext
5. Drezner M.K. Phosphorus Homeostasis and Related Disorders. In: Principles of Bone Biology. 2nd Edition, 2002. Р. 321–38.
6. Yanagawa N., Lee D.B. Renal Handling of Calcium and Phosphorus. In: Disorders of Bone and Mineral Metabolism. 1992. Р. 3–40.
7. Favus M.J. Intestinal Absorption of Calcium, Magnesium, and Phosphorus. In: Disorder of Bone and Mineral Metabolism. 1992. Р. 57–82.
8. Reuss L. Basic Mechanisms of Ion Transport. In: The Kidney. 3rd Edition, 2000. Р. 85–106.
9. Berger U.V., Peng J.B., Hedier M.A. The membrane transporter families in mammals. In: The Kidney. 3rd Edition, 2000. Р. 107–38.
10. Watts N.B. Estrogens, Estrogen agonists/antagonists, and calcitonin. In: Primer on the Metabolic Bone Diseases and Disorders of Mineral Metabolism. 8th Edition, 2013. Р. 408–11.
11. White K.E., Econs M.J. Fibrobalst growth factor-23 (FGF23). In: Primer on the Metabolic Bone Diseases and Disorders of Mineral Metabolism. 8th Edition, 2013. Р. 188–94.
12. Bhattacharyya N., Chong W.H., Gafni R.A., Collins M.T. Fibrobalst growth factor 23: state of the field and future directions. Trends Endocrinol. Metab. 2012;23:610–18.
13. Kruger M.C., Wolber F.M. Osteoporosis: Modern Paradigms for Last Century’s Bones. Nutrients. 2016;8(6):pii: E376.
14. Riancho J.A. Epigenetics of Osteoporosis: Critical Analysis of Epigenetic Epidemiology Studies. Curr. Genomics. 2015;16(6):405–10.
15. McClung MR, Grauer A., Boonen S. Romosozumab in Postmenopausal Women with Low Bone Mineral Density. N. Engl. J. Med 2014;370:412–20.
16. Deftos L.J. Hypercalcemia in malignant and inflammatory diseases. Endocrinol. Metab. Clin. North Am. 2002;31:1–18.
17. Nissenson R.A. Juppner H. Parathyroid Hormone. In: Primer on the Metabolic Bone Diseases and Disorders of Mineral Metabolism. 8th Edition, 2013. P. 208–14.
18. Deftos, L.J. Immunoassays for PTH and PTHrP. In: The Parathyroids. Second Edition, 2001. P. 143–65.
19. Beto J.A. The role of calcium in human aging. Clin. Nutr. Res. 2015;4:1–8.
20. Kim K.M., Choi H.S., Choi M.J., Chung H.Y. Calcium and vitamin D supplementations: 2015 position statement of the Korean Society for Bone and Mineral Research. J. Bone Metab. 2015;22:143–49.
21. Carmeliet G., Dermauw V., Bouillon R. Vitamin D signalling in calcium and bone homeostasis: A delicate balance. Best Pract. Res. Clin. Endocrinol. Metab. 2015;29:621–31.
22. Godala M., Materek-Kusmierkiewicz I., Moczulski D., Gaszynska E., Szatko F., Tokarski S., Kowalski J. Assessment of 25(OH)D vitamin concentration in plasma of residents of Lodz with metabolic syndrome in pre- and postmenopausal period. Prz. Meopauzalny. 2014;13:293–97.
23. Gonzalez G. Vitamin D status among healthy postmenopausal women in South America. Dermatoendocrinol. 2013;5:117–20.
24. Stolarczyk A., Horvath A., Szczechura M., Kaminska M., Dziechciarz P. High prevalence of vitamin D insufficiency in community-dwelling postmenopausal Polish women. Prz. Menopauzalny. 2014;13:289–92.
25. Machado M.C., Bruce-Mensah A., Whitmire M., Rizvi A.A. Hypercalcemia associated with calcium supplement use: Prevalence and characteristics in hospitalised patients. J. Clin. Med. 2015;4:414–24.
26. Manson J.E., Bassuk S.S. Calcium supplements: Do they help or harm? Menopause. 2014;2:106–8.
27. Golden N.H., Abrams S.A. Committee on Nutrition. Optimising bone health in children and adolescents. Pediatrics. 2014;134:e1229–43.
28. Reid I.R., Bistow S.M., Bolland M.J. Calcium supplements: Benefits and risks. J. Intern. Med. 2015;278:354–68.
29. Cesareo R., Iozzino M., D’onofrio L., Terrinoni I., Maddaloni E., Casini A., Campagna G., Santonati A., Palermo A. Effectiveness and safety of calcium and vitamin D treatment for postmenopausal osteoporosis. Minerva Endocrinol. 2015;40:231–37.