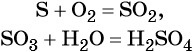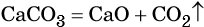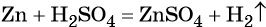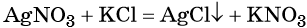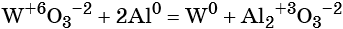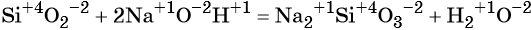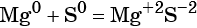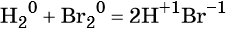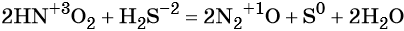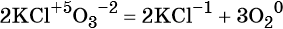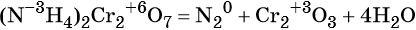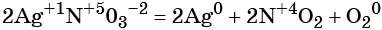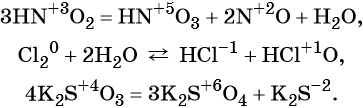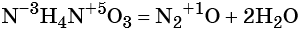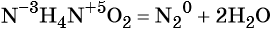Как классифицируют химические реакции по числу
Классификация химических реакций
Темы кодификатора ЕГЭ: Классификация химических реакций в органической и неорганической химии.
В ходе химической реакции разрушаются химические связи, и образуются новые.
Химические реакции классифицируют по разным признакам. Рассмотрим основные виды классификации химических реакций.
Классификация по числу и составу реагирующих веществ
По составу и числу реагирующих веществ разделяют реакции, протекающие без изменения состава веществ, и реакции, протекающие с изменением состава веществ:
1. Реакции, протекающие без изменения состава веществ (A → B)
К таким реакциям в неорганической химии можно отнести аллотропные переходы простых веществ из одной модификации в другую:
Sромбическая → Sмоноклинная.
2. Реакции, протекающие с изменением состава
Как правило, в названии таких реакций есть приставка «де». Реакции разложения в органической химии происходят, как правило, с разрывом углеродной цепи.
2KI + Cl2 → 2KCl + I2.
Замещаться могут как отдельные атомы, так и молекулы.
В органической химии реакции замещения — это такие реакции, в ходе которых часть органической молекулы замещается на другие частицы. При этом замещенная частица, как правило, соединяется с частью молекулы-заместителя.
По числу частиц и составу продуктов взаимодействия эта реакция больше похожа на реакцию обмена. Тем не менее, по механизму такая реакция является реакцией замещения.
AB + CD = AC + BD
К реакциям обмена относятся реакции ионного обмена, протекающие в растворах; реакции, иллюстрирующие кислотно-основные свойства веществ и другие.
Пример реакции обмена в неорганической химии — нейтрализация соляной кислоты щелочью:
NaOH + HCl = NaCl + H2O
Пример реакции обмена в органической химии — щелочной гидролиз хлорэтана:
Классификация химических реакций по изменению степени окисления элементов, образующих вещества
По изменению степени окисления элементов химические реакции делят на окислительно-восстановительные реакции, и реакции, идущие без изменения степеней окисления химических элементов.
В неорганической химии к таким реакциям относятся, как правило, реакции разложения, замещения, соединения, и все реакции, идущие с участием простых веществ. Для уравнивания ОВР используют метод электронного баланса (количество отданных электронов должно быть равно количеству полученных) или метод электронно-ионного баланса.
В органической химии разделяют реакции окисления и восстановления, в зависимости от того, что происходит с органической молекулой.
Реакции окисления в органической химии — это реакции, в ходе которых уменьшается число атомов водорода или увеличивается число атомов кислорода в исходной органической молекуле.
Реакции восстановления в органической химии — это реакции, в ходе которых увеличивается число атомов водорода или уменьшается число атомов кислорода в органической молекуле.
Классификация реакций по тепловому эффекту
По тепловому эффекту реакции разделяют на экзотермические и эндотермические.
Экзотермические реакции — это реакции, сопровождающиеся выделением энергии в форме теплоты (+Q). К таким реакциям относятся почти все реакции соединения.
Исключения — реакция азота с кислородом с образованием оксида азота (II) — эндотермическая:
Реакция газообразного водорода с твердым йодом также эндотермическая:
Экзотермические реакции, в ходе которых выделяется свет, называют реакциями горения.
Также экзотермическими являются:
Эндотермические реакции — это реакции, сопровождающиеся поглощением энергии в форме теплоты (— Q). Как правило, с поглощением теплоты идет большинство реакций разложения (реакции, требующие длительного нагревания).
Также эндотермическими являются:
Классификация химических реакций по агрегатному состоянию реагирующих веществ (по фазовому составу)
Для классификации реакций по фазовому состоянию полезно уметь определять фазовые состояния веществ. Это достаточно легко сделать, используя знания о строении вещества, в частности, о типах кристаллической решетки.
Вещества с ионной, атомной или металлической кристаллической решеткой, как правило твердые при обычных условиях; вещества с молекулярной решеткой, как правило, жидкости или газы при обычных условиях.
Обратите внимание, что при нагревании или охлаждении вещества могут переходить из одного фазового состояния в другое. В таком случае необходимо ориентироваться на условия проведения конкретной реакции и физические свойства вещества.
Таким образом, паровая конверсия метана — гомогенная реакция.
Классификация химических реакций по участию катализатора
Катализатор — это такое вещество, которое ускоряет реакцию, но не входит в состав продуктов реакции. Катализатор участвует в реакции, но практичсеки не расходуется в ходе реакции. Условно схему действия катализатора К при взаимодействии веществ A + B можно изобразить так: A + K = AK; AK + B = AB + K.
В зависимости от наличия катализатора различают каталитические и некаталитические реакции.
Все реакции, протекающие с участием в клетках живых организмов, протекают с участием особых белковых катализаторов — ферментов. Такие реакции называют ферментативными.
Более подробно механизм действия и функции катализаторов рассматриваются в отдельной статье.
Классификация реакций по способности протекать в обратном направлении
Обратимые реакции — это реакции, которые могут протекать и в прямом, и в и обратном направлении, т.е. когда при данных условиях продукты реакции могут взаимодействовать друг с другом. К обратимым реакциям относятся большинство гомогенных реакций, этерификация; реакции гидролиза; гидрирование-дегидрирование, гидратация-дегидратация; получение аммиака из простых веществ, окисление сернистого газа, получение галогеноводородов (кроме фтороводорода) и сероводорода; синтез метанола; получение и разложение карбонатов и гидрокарбонатов, и т.д.
Необратимые реакции — это реакции, которые протекают преимущественно в одном направлении, т.е. продукты реакции не могут взаимодействовать друг с другом при данных условиях. Примеры необратимых реакций: горение; реакции, идущие со взрывом; реакции, идущие с образованием газа, осадка или воды в растворах; растворение щелочных металлов в воде; и др.
Классификация химических реакций
Наиболее часто под химическими реакциями понимают процесс превращения исходных веществ (реагентов) в конечные вещества (продукты).
Химические реакции записываются с помощью химических уравнений, содержащих формулы исходных веществ и продуктов реакции. Согласно закону сохранения массы, число атомов каждого элемента в левой и правой частях химического уравнения одинаково. Обычно формулы исходных веществ записывают в левой части уравнения, а формулы продуктов – в правой. Равенство числа атомов каждого элемента в левой и правой частях уравнения достигается расстановкой перед формулами веществ целочисленных стехиометрических коэффициентов.
Химические уравнения могут содержать дополнительные сведения об особенностях протекания реакции: температура, давление, излучение и т.д., что указывается соответствующим символом над (или «под») знаком равенства.
Все химические реакции могут быть сгруппированы в несколько классов, которым присущи определенные признаки.
Классификация химических реакций по числу и составу исходных и образующихся веществ
Согласно этой классификации, химические реакции подразделяются на реакции соединения, разложения, замещения, обмена.
В результате реакций соединения из двух или более (сложных или простых) веществ образуется одно новое вещество. В общем виде уравнение такой химической реакции будет выглядеть следующим образом:
Реакции соединения в большинстве случаев экзотермические, т.е. протекают с выделением тепла. Если в реакции участвуют простые вещества, то такие реакции чаще всего являются окислительно-восстановительными (ОВР), т.е. протекают с изменением степеней окисления элементов. Однозначно сказать будет ли реакция соединения между сложными веществами относиться к ОВР нельзя.
Реакции, в результате которых из одного сложного вещества образуется несколько других новых веществ (сложных или простых) относят к реакциям разложения. В общем виде уравнение химической реакции разложения будет выглядеть следующим образом:
Большинство реакций разложения протекает при нагревании (1,4,5). Возможно разложение под действием электрического тока (2). Разложение кристаллогидратов, кислот, оснований и солей кислородсодержащих кислот (1, 3, 4, 5, 7) протекает без изменения степеней окисления элементов, т.е. эти реакции не относятся к ОВР. К ОВР реакциям разложения относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления (6).
Реакции разложения встречаются и в органической химии, но под другими названиями — крекинг (8), дегидрирование (9):
При реакциях замещения простое вещество взаимодействует со сложным, образуя новое простое и новое сложное вещество. В общем виде уравнение химической реакции замещения будет выглядеть следующим образом:
Реакции замещения в своем большинстве являются окислительно-восстановительными (1 – 4, 7). Примеры реакций разложения, в которых не происходит изменения степеней окисления немногочисленны (5, 6).
Реакциями обмена называют реакции, протекающие между сложными веществами, при которых они обмениваются своими составными частями. Обычно этот термин применяют для реакций с участием ионов, находящихся в водном растворе. В общем виде уравнение химической реакции обмена будет выглядеть следующим образом:
NaOH + HCl = NaCl + H2O (2)
Классификация химических реакций по изменениям степеней окисления
В зависимости от изменения степеней окисления элементов, входящих в состав реагентов и продуктов реакции все химические реакции подразделяются на окислительно-восстановительные (1, 2) и, протекающие без изменения степени окисления (3, 4).
2Mg + CO2 = 2MgO + C (1)
Mg 0 – 2e = Mg 2+ (восстановитель)
С 4+ + 4e = C 0 (окислитель)
N 5+ +3e = N 2+ (окислитель)
Классификация химических реакций по тепловому эффекту
В зависимости от того, выделяется ли или поглощается тепло (энергия) в ходе реакции, все химические реакции условно разделяют на экзо – (1, 2) и эндотермические (3), соответственно. Количество тепла (энергии), выделившееся или поглотившееся в ходе реакции называют тепловым эффектом реакции. Если в уравнении указано количество выделившейся или поглощенной теплоты, то такие уравнения называются термохимическими.
2Mg + O2 = 2MgO + 602, 5 кДж (2)
Классификация химических реакций по направлению протекания реакции
По направлению протекания реакции различают обратимые (химические процессы, продукты которых способны реагировать друг с другом в тех же условиях, в которых они получены, с образованием исходных веществ) и необратимые (химические процессы, продукты которых не способны реагировать друг с другом с образованием исходных веществ).
Для обратимых реакций уравнение в общем виде принято записывать следующим образом:
Примерами необратимых реакций может служить следующие реакции:
Свидетельством необратимости реакции может служить выделение в качестве продуктов реакции газообразного вещества, осадка или малодиссоциирующего соединения, чаще всего воды.
Классификация химических реакций по наличию катализатора
С этой точи зрения выделяют каталитические и некаталитические реакции.
Катализатором называют вещество, ускоряющее ход химической реакции. Реакции, протекающие с участием катализаторов, называются каталитическими. Протекание некоторых реакций вообще невозможно без присутствия катализатора:
Нередко один из продуктов реакции служит катализатором, ускоряющим эту реакцию (автокаталитические реакции):
MeO+ 2HF = MeF2 + H2O, где Ме – металл.
Примеры решения задач
| Задание | Установите, какие из приведенных ниже реакций относятся к окислительно-восстановительным, и укажите окислитель и восстановитель: |
Fe 2+ — e → Fe 3+ (восстановитель) 2O 0 + 2e → O 2- (окислитель)
| Задание | Допишите уравнения реакций. Какие из них обратимые, а какие нет? В случае необратимой реакции поясните ответ. |
Необратимая реакция, т.к. образуется осадок – хлорид серебра
Необратимая реакция, т.к. образуется осадок – сульфат бария
Необратимая реакция, т.к. выделяется газ – оксид серы (VI)
Химические реакции их классификация (Схема, Таблица)
Химическая реакция — это превращение одного или нескольких исходных веществ (реагентов) в другие вещества, при этом ядра атомов не меняются, происходит только перераспределение электронов и ядер, и образуются новые химические вещества. При химических реакциях не изменяется общее число ядер атомов и изотопный состав химических элементов (в отличие от ядерных реакций).
Классификация химических реакций схема
Химические реакции классифицируются по тепловому эффекту, по изменению степени окисления атомов в реагирующих веществах, по числу и составу исходных и образующихся веществ, и по признаку обратимости.
Классификация химических реакций по числу и составу исходных и образующихся веществ
Реакция, в которой из одного исходного вещества образуется несколько новых веществ
Реакция между простым и сложным веществами, в результате которой атомы простого вещества замещают атомы одного из элементов сложного вещества
Реакция, в результате которой два вещества обмениваются своими составными частями, образуя два новых вещества
NaOH + HCl → NaCl + H2O
Реакция, в результате которой из двух или нескольких веществ образуется одно новое
Классификация химических реакций по тепловому эффекту
Тепловой эффект химической реакции — это количество теплоты (Q), которое выделяется или поглощается в химической реакции.
Реакция, проходящая с поглощением теплоты
Реакция, проходящая с выделением теплоты
Термохимическое уравнение — уравнение химической реакции, в котором указан тепловой эффект реакции:
Термохимические расчеты основаны на законе Гесса:
— тепловой эффект химической реакции зависит от состояний исходных веществ и продуктов реакций, но не зависит от промежуточных стадий процесса
— тепловой эффект химической реакции равен сумме теплот образования продуктов реакции эа вычетом суммы теплот образования исходных веществ
Классификация химических реакций по признаку обратимости
Такая реакция, которая в данных условиях протекает одновременно в двух взаимно противоположных направлениях
Такая реакция, которая в данных условиях протекает до конца, т. е. до полного превращения исходных реагирующих веществ в конечные продукты реакции
Таблица признаки необратимости реакций
Реакция идет с выделением большого количества теплоты
Хотя бы один продукт реакции покидает сферу реакции (выпадает в осадок или выделяется в виде газа)
В результате реакции образуются малодиссоциируе-мые вещества
HCl + NaOH → NaCl + H2O
Классификация химических реакций по изменению степени окисления
Проходящая с изменением степени окисления атомов (окислительно-восстановительная)
реакция, при которой происходит переход электронов от одних атомов, молекул или ионов к другим
Проходящая без изменения степени окисления
Реакция, в которой степень окисления каждого атома после реакции остается неизменной
Влияние изменения условий на положение химического равновесия
Изменение условий, при которых система находится в состоянии химического равновесия
Изменение скоростей прямой и обратной реакции в начальный момент
Направление смешения положения равновесия
В большей степени возрастает скорость эндотермической реакции
В сторону эндотермической реакции
В большей степени понижается скорость эндотермической реакции
В сторону экзотермической реакции
В большей степени возрастает скорость реакции, протекающей с уменьшением числа молей газообразных веществ
В сторону уменьшения числа молей газообразных веществ в системе
В большей степени понижается скорость реакции протекающей с уменьшением числа молей газообразных веществ
В сторону увеличения числа молей газообразных веществ в системе
Возрастает скорость реакции, по которой вводимое вещество расходуется
В сторону реакции, по которой вводимое вещество расходуется
Уменьшается скорость реакции, где реагентом является вещество, концентрация которого уменьшается
В сторону реакции, по которой образуется вещество, концентрация которого уменьшается
Скорости прямой и обратной реакции изменяются одинаково
Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии
Классификацию химических реакций в неорганической и органической химии осуществляют на основании различных классифицирующих признаков.
По числу и составу исходных и полученных веществ различают реакции соединения, разложения, обмена и замещения.
Реакциями соединения называют химические реакции, в результате которых сложные молекулы получаются из двух и более простых, например:
Реакциями разложения называют химические реакции, в результате которых простые молекулы получаются из более сложных, например:
Реакциями замещения называют химические реакции, в результате которых атом или группа атомов в молекуле вещества замещается на другой атом или группу атомов, например:
Реакциями обмена называют химические реакции, протекающие без изменения степеней окисления элементов и приводящие к обмену составных частей реагентов, например:
По изменению степеней окисления химических элементов, входящих в состав реагирующих веществ, реакции делят на окислительно-восстановительные и не окислительно-восстановительные.
Окислительно-восстановительными называют реакции, сопровождающиеся изменением степеней окисления химических элементов, входящих в состав реагентов:
Не окислительно-восстановительными называют реакции, в которых степень окисления химических элементов, входящих в состав реагентов, не изменяется.
Окислительно-восстановительные реакции разделяют на следующие основные типы: реакции межмолекулярного окисления-восстановления, реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции конмутации.
Реакциями межмолекулярного окисления-восстановления называют реакции, в которых обмен электронами происходит между различными атомами, молекулами или ионами, например:
(сера — окислитель, магний — восстановитель).
(бром — окислитель, водород — восстановитель).
(окислитель — азотистая кислота, восстановитель — сероводород).
Таким образом, атом-окислитель и атом-восстановитель в данных реакциях принадлежат разным веществам.
Реакциями внутримолекулярного окисления-восстановления называют реакции, в которых атом-окислитель и атом-восстановитель входят в состав одной и той же молекулы.
(окислитель — атом хлора в степени окисления +5, восстановитель — атом кислорода в степени окисления –2).
(окислитель — атом хрома в степени окисления +6, восстановитель — атом азота в степени окисления –3).
(окислители — атомы серебра в степени окисления +1 и азота в степени окисления +5, восстановитель — атом кислорода в степени окисления –2).
Реакциями диспропорционирования называют реакции, в которых молекулы или ионы одного и того же вещества реагируют друг с другом как окислитель и восстановитель. При этом содержащиеся в данном соединении атомы с переменной промежуточной степенью окисления переходят один в высшую, другой — в низшую степень окисления, например:
Реакциями конмутации называют реакции окисления-восстановления, в результате которых происходит выравнивание степеней окисления атомов одного и того же элемента, например:
(окислитель — атом азота в степени окисления +5, восстановитель — атом азота в степени окислителя –3).
(окислитель — атом азота в степени окисления +3, восстановитель — атом азота в степени окислителя –3).
По тепловому эффекту, сопровождающему химические реакции, их разделяют на экзотермические и эндотермические.
Экзотермическими называют химические реакции, идущие с выделением теплоты. Условное обозначение изменения энтальпии ΔH, а теплового эффекта реакции Q. Для экзотермических реакций Q > 0, а ΔH 0.
В соответствии с агрегатным состоянием реагентов различают гомогенные и гетерогенные химические реакции.
Гомогенными называют реакции, протекающие в однородной среде.
Гетерогенными называют реакции, протекающие в неоднородной среде, на поверхности соприкосновения реагирующих веществ, находящихся в разных фазах, например твёрдой и газообразной, жидкой и газообразной, в двух несмешивающихся жидкостях.
Тренировочные задания
1. Реакция 3CaО + P2O5 = Ca3(PO4)2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
2. Реакция Na2SO4 + Ba(OH)2 = BaSO4 + 2NaOH относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
3. Реакция H2SO4 + Fe = FeSO4 + H2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
4. Реакция CaCO3 = CaO + CO2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
5. Реакция разложения описана уравнением
6. Реакция соединения описана уравнением
7. К каталитическим процессам относят реакцию между
1) калием и водой
2) серой и хлором
3) азотом и литием
4) азотом и водородом
8. К экзотермическим реакциям относится взаимодействие
1) азота с кислородом
2) углерода с углекислым газом
3) воды с углеродом
4) углерода с кислородом
9. К окислительно-восстановительным реакциям не относится взаимодействие
1) натрия и хлора
2) брома и водорода
3) гидроксида калия и уксусной кислоты
4) кальция и уксусной кислоты
10. К реакциям замещения относится взаимодействие
1) серной кислоты и гидроксида натрия
2) серной кислоты и железа
3) серной кислоты и оксида натрия
4) серной кислоты и хлорида бария
11. К экзотермическим реакциям относится
1) взаимодействие соляной кислоты и гидроксида калия
2) взаимодействие азота и кислорода
3) гидролиз сульфата меди
4) разложение карбоната натрия
12. К эндотермическим реакциям относится
1) взаимодействие азота и кислорода
2) взаимодействие азотной кислоты и гидроксида лития
3) взаимодействие кислорода и водорода
4) взаимодействие воды и оксида калия
13. К окислительно-восстановительным реакциям не относится взаимодействие
1) натрия и брома
2) натрия и кислорода
3) оксида калия и воды
4) натрия и уксусной кислоты
14. Взаимодействие брома с гидроксидом калия относится к реакциям
1) нейтрализации
2) межмолекулярного окисления-восстановления
3) диспропорционирования
4) обмена
15. Взаимодействие азота и кислорода относится к реакциям
1) соединения, эндотермическим
2) соединения, экзотермическим
3) разложения, эндотермическим
4) обмена, экзотермическим
16. К эндотермическим реакциям относится взаимодействие
1) азота и лития
2) азота и кислорода
3) кислорода и кальция
4) углерода и кислорода
17. Взаимодействие оксида кальция и воды относится к реакциям
1) каталитическим, экзотермическим
2) разложения, эндотермическим
3) соединения, экзотермическим
4) обмена, эндотермическим
18. К каталитическим экзотермическим реакциям относится
1) получение фосфорной кислоты из оксида фосфора (V) и воды
2) разложение карбоната кальция
3) синтез аммиака из простых веществ
4) получение соляной кислоты из хлора и водорода
19. При нагревании нитрата серебра происходит реакция
1) соединения
2) разложения
3) замещения
4) обмена
20. Реакция, протекающая по схеме: CaCO3 = CaO + CO2 − Q, является реакцией
1) экзотермического разложения
2) разложения
3) замещения
4) эндотермического разложения