Как молекулы действуют друг на друга
Взаимодействие молекул в физике с примерами
Взаимодействие молекул:
Оглядитесь вокруг, и вы увидите множество физических тел. Это и ваш сосед, с которым вы сидите за партой, и сама парта. Это и стул, на котором вы сидите, и ручка, которой вы пишете, и т. п. Все эти тела, как вы уже знаете, состоят из разделенных промежутками частичек, которые постоянно двигаются. Тогда почему частички, из которых состоят физические тела, не разлетаются во все стороны? Более того, тела не только не рассыпаются на отдельные моле кулы — наоборот, чтобы их растянуть, сломать, разорвать, нужно приложить усилие. Попробуем разобраться, почему так.
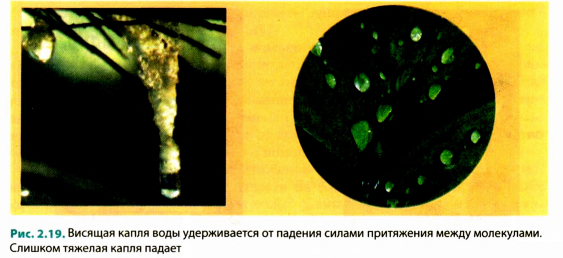
Причина того, что все тела вокруг нас не распадаются на отдельные молекулы, очевидна: молекулы притягиваются друг к другу. Каждая молекула притягивается к соседним молекулам, а те, в свою очередь,— к ней. Именно благодаря межмолекулярному притяжению твердые тела сохраняют свою форму, жидкость собирается в капли (рис. 2.19), скотч прилипает к бумаге, чернила оставляют след на листе, прижатые друг к другу срезами свинцовые цилиндры крепко схватываются (рис. 2.20).
В науке установлено, что притяжение между молекулами действует всегда. Почему же тогда разбитая чашка не становится целой после того, как ее обломки прижмут друг к другу? С какой бы силой мы ни прижимали друг к другу части сломанного карандаша, они также не соединятся в целый карандаш.
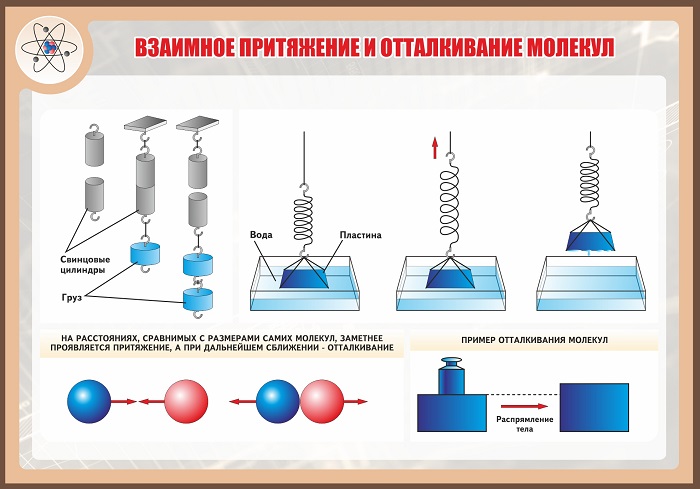
Дело в том, что притяжение между молекулами становится заметным только на очень малых расстояниях (таких, которые можно сравнить с размерами самих частичек). Прижимая обломки чашки или части сломанного карандаша, мы приближаем на такие расстояния только очень малое количество молекул. Расстояние же между большинством из них остается таким, что молекулы практически не взаимодействуют. Теперь становится понятным, почему для того, чтобы свинцовые цилиндры слиплись, необходимо предварительно отшлифовать срезы, а кусочки мягкого воска или пластилина легко слипнутся и без всякого шлифования.
Два сухих листа невозможно сблизить настолько, чтобы они соединились. Однако если смочить листы водой, то они слипнутся, так как молекулы воды приблизятся к молекулам бумаги настолько, что межмолекулярное притяжение уже будет удерживать листы друг возле друга (рис. 2.21).
Межмолекулярное притяжение также является причиной смачивания или несмачивания тела определенными жидкостями (рис. 2.22).
Межмолекулярное отталкивание:
Выше мы доказали, что между молекулами существует притяжение. Учитывая это, возникает целый ряд вопросов. Почему же молекулы газов, в беспорядке двигаясь и постоянно сталкиваясь между собой, не слипаются
Рис. 2.22. Капелька воды растекается по поверхности чистого стекла (смачивает ее), поскольку притяжение между молекулами жидкости больше, чем между молекулами жидкости и стекла (о). Притяжение между молекулами воды больше, чем между молекулами воды и жира, которым покрыты перья водоплавающих птиц поэтому вода не смачивает их (вспомните выражение «как с гуся вода») (б) в один большой ком? Почему, если сжать, например, губку, она через некоторое время восстановит свою форму?
Дело в том, что молекулы не только притягиваются друг к другу, но и отталкиваются. Если расстояние между ними станет очень малым (немного меньше размера молекулы), то межмолекулярное отталкивание становится более сильным, чем притяжение. Попробуйте сжать, например, монетку. Вы не сможете заметно уменьшить ее размеры, так как молекулы монетки будут отталкиваться друг от друга. Так же вы не сможете заметно уменьшить объем жидкости даже с помощью мощного пресса.
Именно межмолекулярное притяжение и отталкивание удерживает молекулы жидкостей и твердых веществ на более или менее определенных расстояниях, которые приблизительно равны размерам самих молекул. В случае уменьшения расстояния молекулы начинают отталкиваться друг от друга, а в случае увеличения — притягиваться, поэтому как для сближения, так и для отдаления молекул необходимо приложить усилие.
Молекулы взаимодействуют между собой: они одновременно притягиваются и отталкиваются. Межмолекулярное взаимодействие проявляется на расстояниях, которые можно сравнить с размерами самих молекул.
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Известно, что все физические тела состоят из огромного количества молекул. Расстояния между ними сравнимы с их размерами. Почему предметы не распадаются в пыль? Ощутить силу притяжения между двумя частицами невозможно из-за того, что она очень маленькая.
Однако в том случае, когда одновременно действует взаимное притяжение и отталкивание молекул, в которое вовлечено большое их количество, это легко заметить. С такими явлениями человек часто встречается в своей жизни.
Взаимное притяжение молекул
Твёрдые предметы способны сохранять свою цельность. Это происходит благодаря наличию притяжения между мельчайшими частицами вещества — молекулами.
В жидкостях эта связь гораздо слабее, поэтому они способны течь. Это связано с тем, что здесь расстояния между частицами увеличиваются. У газов они ещё больше. Здесь силы притяжения из-за больших расстояний фактически не действуют, позволяя веществу расширяться и заполнять весь доступный объём.
В наличии описанных сил легко убедиться, наблюдая физические явления реальной жизни.
Баланс различных сил, действующих между частицами, имеет важное значение в кристаллах.
Здесь их результатом является образование кристаллической решётки, которая имеет повторяющуюся структуру. При этом молекулы и атомы находятся в строго определённых местах.
Если разделить кусок свинца на две части и отполировать получившийся разрез до блеска, то можно наблюдать необычный эффект. Если обе части прислонить друг к другу, то они прилипнут без всяких видимых причин.
Если поднять одну часть, то другая поднимется вместе с ней. Такое соединение легко выдерживает вес до пяти килограммов. Физика объясняет, что в этом опыте демонстрируется притяжение, существующее между частицами.
Когда человек пытается разломать предмет, то он стремится преодолеть силы, которые притягивают частицы друг к другу. При этом видно, что одни предметы подвергаются воздействию легко, а строение других демонстрируют высокую прочность. Разница между ними состоит в том, что у них различная сила притяжения.
Взаимное отталкивание молекул
Связь между частицами ощущается только на очень маленьком расстоянии. Как только оно начинает значительно превосходить собственные размеры молекул, то сила притяжения резко уменьшается.
В связи с этим возникает вопрос о том, от чего возникает расстояние между ними. Если бы действовало только притяжение, то частицы находились бы вплотную друг к другу, не оставляя промежутков.
Дело в том, что существует также отталкивание. Молекулы устанавливаются на таком расстоянии, когда обе этих силы, направленные противоположно, уравновешиваются.
Можно провести опыт в классе и убедится в действии, которое производит отталкивание. Можно привести такой пример. Если смять резиновую игрушку и отпустить, то она начнёт расправляться до тех пор, пока не примет прежнее положение.
Если части сломанного предмета прислонить друг к другу, то притяжение не возникнет из-за того, что молекулы нельзя подвести на достаточно близкое расстояние, когда такая сила начинает действовать. Эту проблему обычно преодолевают двумя способами:
располагают между частями другие молекулы (например, клей);
может происходить диффузия, когда молекулы одного вещества проникают в другое;
нагревают их, увеличивая подвижность.
Притяжение может быть не только между предметами, состоящими из одного и того же вещества, но и между разными объектами и веществами. Например, если плоский кусок стекла разместить на поверхности воды, а потом поднять его. В этой ситуации заметно, что для этого придётся приложить определённую силу.
Жидкости и твердые тела
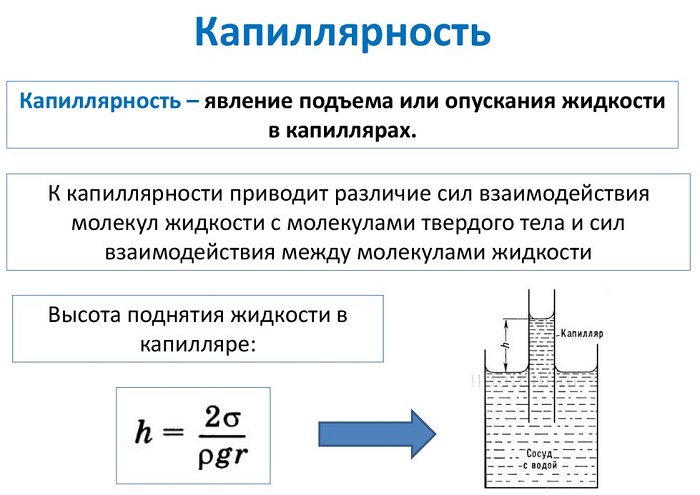
Одной из эффектных демонстраций взаимодействия частиц являются капиллярные явления. Жидкость внутри узкой трубочки естественным образом поднимается вверх, преодолевая силу тяжести без дополнительных усилий.
Это явление широко используется в технике и живой природе. Так, в человеческом теле имеется большая сеть капиллярных кровеносных сосудов, работа которой зависит от взаимодействия крови и стенок сосудов.
Нередко бывает так, что опущенное в жидкость тело после поднятия остаётся смоченным. Этот результат говорит о том, что притяжение молекул воды и тела сильнее по сравнению с тем, которое имеется у жидкости.
Иногда, выполняя такой опыт, получают другой результат. Например, парафиновая пластинка, вынутая из воды, останется сухой. В этой ситуации частицы жидкости притягиваются друг к другу с большей силой, чем к пластине.
Явление смачивания или его отсутствия часто используется. Например, водоплавающие птицы, постоянно находясь в воде, тем не менее не смачиваются.
Основные выводы
Силы притяжения и отталкивания, действующие между молекулами, позволяют телам сохранять целостность, удерживая между ними определённые промежутки. Они в разных веществах могут проявляться различным образом.
В жидкостях и газах силы сцепления молекул друг с другом намного слабее, чем в твёрдых телах, а в кристаллах они создают жёсткую решётку высокой прочности.
Аллотропия. Взаимодействие между молекулами
Содержание
Мы уже знаем, что молекула и атомы – наименьшие частицы, составляющие то или иного вещества. Однако, иметь знания о составляющих вещество молекулах недостаточно, чтобы описать его свойства. Например, пар и лед состоят из одинаковых молекул воды, но свойства у них отличаются.
Вспомните конструктор «Лего». Мы высыпаем из коробки просто кучу деталей, которые можно собрать и построить дом или автомобиль, в зависимости от того, каким образом одни и те же детали будут нами соединены.
Аналогично обстоит дело и с веществом. Чтобы его описать, необходимо не только знать атомный и молекулярный состав, но и способы соединения частиц, а также их взаимодействия.
Свойство разных простых веществ состоять из одинаковых частиц называется аллотропией, а сами вещества – аллотропными модификациями.
Самым большим количеством аллотропных модификаций обладает углерод (рисунок 14). Его атом получил свое название от вещества, состоящего из атомов угля.
Из таких же самых атомов состоят сажа, графит и алмаз. Просто атомы в них по-другому расположены и по-другому взаимодействуют. Поэтому, их свойства сильно отличаются: из твердого алмаза делают режущие инструменты, а из мягкого графита – стержни для карандашей.

Взаимное притяжение молекул
Если же все молекулы находятся в беспрерывном движении, почему твердые и жидкие тела не распадаются? Значит, молекулы как-то взаимодействуют между собой, взаимно притягиваются друг к другу.
Но, если вы сломаете карандаш, он же не склеится обратно? Из этого можно сделать просто вывод, что притяжение между молекулами действует только на очень коротком расстоянии. Притяжение между молекулами разных тел неодинаково, что объясняется различной прочностью.
Рассмотрим следующий опыт: если у двух цилиндров идеально ровно срезать поверхности и прижать их друг к другу, вам удастся разорвать их только при большой нагрузке (рисунок 16).

Заметим, что притяжение между молекулами становится заметным, когда расстояние между ними не превышает размеров самих молекул.
Если мы попытаемся таким же образом соединить осколки стекла, то из-за неровностей у нас ничего не выйдет – расстояние между молекулами окажется слишком велико.
Но если нагреть куски стекла, то стекло станет возможно починить. На том же принципе происходит соединение кусков металла при сварке или пайке.
Но почему тогда между молекулами существуют промежутки? По логике вещей, они должны намертво слипнуться. Но этого не происходит, поскольку между молекулами (атомами) в то же время существуют силы отталкивания.
На расстояниях, сравнимых с размерами самих молекул (атомов), заметнее проявляется притяжение, а при дальнейшем сближении – отталкивание (рисунок 17).
Рассмотрим примеры, подтверждающие существование отталкивания между молекулами. Если вы несильно скомкаете лист бумаги, постепенно он начнет расправляться, так как при сжатии молекулы оказались настолько близко друг к другу, что начало проявляться отталкивание. Другие явление связаны со смачиванием твердого тела жидкостью. Взгляните на рисунок 18.

На пружине с помощью нитей закреплена стеклянная пластина, ее подносят к емкости с водой так, чтобы она легла на поверхность жидкости.
Когда мы пытаемся оторвать платину от поверхности воды, пружина заметно растягивается. Это доказывает существование притяжения между молекулами.
К тому же, мы можем заметить, что стеклянная пластина теперь покрыта тонким слоем воды – это значит, что разрыв произошел там, где молекулы воды соприкасаются друг с другом, а не с поверхностью стекла.
Благодаря эффекту смачивания мы можем вытирать мокрые предметы, но с другой стороны, вода может и не смачивать тела (парафин/воск/жир) – это означает, что молекулы жидкости притягиваются друг к другу с большей силой, чем к молекулам твердого тела.
Как молекулы действуют друг на друга
Силы взаимодействия молекул
Атом состоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки. Заряд ядра равен суммарному заряду всех электронов, поэтому в целом атом электрически нейтрален.
Молекула, состоящая из одного или нескольких атомов, тоже электрически нейтральна.
Рассмотрим взаимодействие между молекулами на примере двух неподвижных молекул.
Между телами в природе могут существовать гравитационные и электромагнитные силы.
Так как массы молекул крайне малы, ничтожно малые силы гравитационного взаимодействия между молекулами можно не рассматривать.
На очень больших расстояниях электромагнитного взаимодействия между молекулами тоже нет.
Но, при уменьшении расстояния между молекулами молекулы начинают ориентироваться так, что их обращенные друг к другу стороны будут иметь разные по знаку заряды (в целом молекулы остаются нейтральными), и между молекулами возникают силы притяжения.
При еще большем уменьшении расстояния между молекулами возникают силы отталкивания, как результат взаимодействия отрицательно заряженных электронных оболочек атомов молекул.
В итоге на молекулу действует сумма сил притяжения и отталкивания. На больших расстояниях преобладает сила притяжения (на расстоянии 2-3 диаметров молекулы притяжение максимально), на малых расстояниях сила отталкивания.
Существует такое расстояние между молекулами, на котором силы притяжения становятся равными силам отталкивания. Такое положение молекул называется положением устойчивого равновесия.
Находящиеся на расстоянии друг от друга и связанные электромагнитными силами молекулы обладают потенциальной энергией.
В положении устойчивого равновесия потенциальная энергия молекул минимальна.
В веществе каждая молекула взаимодействует одновременно со многими соседними молекулами, что также влияет на величину минимальной потенциальной энергии молекул.
Кроме того, все молекулы вещества находятся в непрерывном движении, т.е. обладают кинетической энергией.
Таким образом, структура вещества и его свойства (твердых, жидких и газообразных тел) определяются соотношением между минимальной потенциальной энергией взаимодействия молекул и запасом кинетической энергии теплового движения молекул.
Строение и свойства твердых, жидких и газообразных тел
Строение тел объясняется взаимодействием частиц тела и характером их теплового движения.
Твердое тело
Твердые тела имеют постоянную форму и объем, практически несжимаемы.
Минимальная потенциальная энергия взаимодействия молекул больше кинетической энергии молекул.
Сильное взаимодействие частиц.
Тепловое движение молекул в твердом теле выражается только лишь колебаниями частиц (атомов, молекул) около положения устойчивого равновесия.
Из-за больших сил притяжения молекулы практически не могут менять свое положение в веществе, этим и объясняется неизменность объема и формы твердых тел.
Жидкость
Жидкости имеют определенный объем, но не имеют своей формы, они принимают форму сосуда, в которой находятся.
Минимальная потенциальная энергия взаимодействия молекул сравнима с кинетической энергией молекул.
Слабое взаимодействие частиц.
Тепловое движение молекул в жидкости выражено колебаниями около положения устойчивого равновесия внутри объема, предоставленного молекуле ее соседями
Молекулы не могут свободно перемещаться по всему объему вещества, но возможны переходы молекул на соседние места. Этим объясняется текучесть жидкости, способность менять свою форму.
В жидкостях молекулы достаточно прочно связаны друг с другом силами притяжения, что объясняет неизменность объема жидкости.
В жидкости расстояние между молекулами равно приблизительно диаметру молекулы. При уменьшении расстояния между молекулами (сжимании жидкости) резко увеличиваются силы отталкивания, поэтому жидкости несжимаемы.
По своему строению и характеру теплового движения жидкости занимают промежуточное положение между твердыми телами и газами.
Хотя разница между жидкостью и газом значительно больше, чем между жидкостью и твердым телом. Например, при плавлении или кристаллизации объем тела изменяется во много раз меньше, чем при испарении или конденсации.
Газы не имеют постоянного объема и занимают весь объем сосуда, в котором они находятся.
Минимальная потенциальная энергия взаимодействия молекул меньше кинетической энергии молекул.
Частицы вещества практически не взаимодействуют.
Газы характеризуются полной беспорядочностью расположения и движения молекул.
Расстояние между молекулами газа во много раз больше размеров молекул. Малые силы притяжения не могут удержать молекулы друг около друга, поэтому газы могут неограниченно расширяться.
Газы легко сжимаются под действием внешнего давления, т.к. расстояния между молекулами велики, а силы взаимодействия пренебрежимо малы.
Давление газа на стенки сосуда создается ударами движущихся молекул газа.
Урок 4. Взаимодействие молекул
В уроке 4 «Взаимодействие молекул» из курса «Химия для чайников» выясним что из себя представляет межмолекулярное взаимодействие; рассмотрим влияние сил Ван-дер-Ваальса на температуры плавления и кипения; определим роль электроотрицательности в образовании ковалентной полярной и водородной связи. Но нельзя обсуждать взаимодействие молекул, не зная их строения, поэтому не пройдите мимо прошлого урока «Схема образования молекул».
Межмолекулярное взаимодействие
Между молекулами в веществе всегда присутствует некоторое притяжение друг к другу, которое называется межмолекулярным взаимодействием. Притяжение молекул друг к другу не такое сильное, как взаимодействие между атомами в молекуле, и недостаточно для образования химических связей, но достаточно для того, чтобы сделать их слегка «клейкими» друг к другу.
Силы Ван-дер-Ваальса
Силы взаимодействия молекул, вызываемые мгновенными флюктуациями распределения электронов в атомах, называются силами Ван-дер-Ваальса. Заумно прозвучало? Далее все встанет на свои места. Силы Ван-дер-Ваальса являются одним из видов межмолекулярного взаимодействия, но можно считать эти силы взаимодействия молекул основными. Просто запомните, что именно благодаря силам Ван-дер-Ваальса в природе существуют три агрегатных состояния вещества.
Температура плавления и кипения
Ковалентная полярная химическая связь
«Силу» атома определяет его электроотрицательность: чем больше электроотрицательность химического элемента, тем сильнее он притягивает к себе электроны.
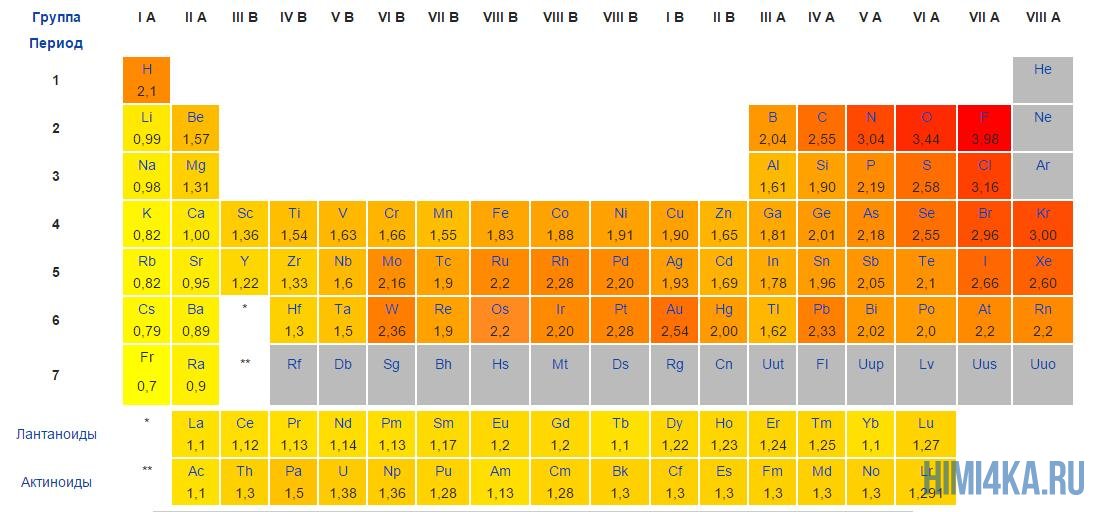
Постарайтесь запомнить самые электроотрицательные химические элементы в порядке возрастания их электроотрицательности: I, Br, N, Cl, O, F. За помощью вы всегда можете обратиться к таблице электроотрицательности, которая расположена ниже.
Образование водородной связи
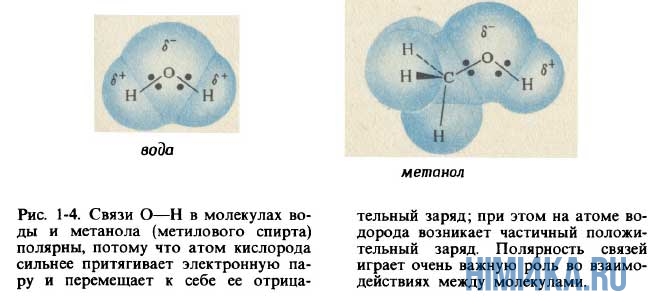
Очевидно, что молекулы воды образованы ковалентной полярной химической связью, поскольку электроотрицательность кислорода больше, чем у водорода. Поэтому атом кислорода в молекуле воды несет в себе небольшой отрицательный заряд, а атомы водорода — небольшие положительные заряды.
Надеюсь урок 4 «Взаимодействие молекул» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.