Как называется белковая часть фермента
Функции белковой и небелковой части сложных ферментов
28. Классификация ферментов.Тип катализируемой химической реакции в сочетании с названием субстрата (субстратов) служит основой для систематического наименования ферментов. Согласно Международной классификации, ферменты делят на шесть главных классов, в каждом из которых несколько подклассов: 1) оксидоредуктазы; 2) трансферазы; 3) гидролазы; 4) лиазы; 5) изомеразы; 6) лигазы(синтетазы). Оксидоредуктазы.К классу оксидоредуктаз относят ферменты, катализирующие с участием двух субстратов окислительно-восстановительные реакции, лежащие в основе биологического окисления. Систематические названия их составляют по форме «донор: акцептор оксидоредуктаза». Например, лактат: НАД + оксидоредуктаза для лактатдегидрогеназы (ЛДГ). Различают следующие основные оксидоредуктазы: аэробные дегидро-геназы или оксидазы, катализирующие перенос протонов(электронов) непосредственно на кислород; анаэробные дегидрогеназы, ускоряющие перенос протонов (электронов) на промежуточный субстрат, но не на кислород; цитохромы, катализирующие перенос только электронов. К этому классу относят также гемсодержащие ферменты каталазу и пероксидазу, катализирующие реакции с участием перекиси водорода. Трансферазы.К классу трансфераз относят ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов. Наименование их составляется по форме «донор: транспортируемая группа – трансфераза». Различают трансферазы, катализирующие перенос одноуглеродных остатков, ацильных, гликозильных, альдегидных или кетонных, нуклеотидных
29. Химотрипсин. Механизм действия. Химотрипсин – протеаза, катализирующая гидролиз пептидной связи, рядом с которой находится ароматическая аминокислота (Trp, Phe,Tyr). Реакция, катализируемая химотрипсином, иллюстрирует принцип стабилизации переходного состояния и является классическим примером общего кислотно-основного катализа и ковалентного катализа. Каталитический цикл состоит из двух фаз, в первой из которых разрывается пептидная связь субстрата и образуется эфирная связь между
карбонильным углеромом пептида и OH-группой Ser195 : формируется ацил-фермент (интермедиат). Во второй фазе происходит гидролиз эфирной связи и регенерация свободного фермента.
30. Орнитиновый цикл. Цикл мочевины или орнитиновый цикл (цикл Кребса-Хензелейта)— последовательность биохимических реакций млекопитающих и некоторых рыб, в результате которой азотсодержащие продукты распада преобразуются в мочевину, которая в свою очередь выделяется почками. В большинстве случаев таким образом происходит превращение аммиака. Реакции в митохондрии: Непосредственно перед циклом происходит образование карбомоилфосфата из аммиака, воды и углекислого газа при участии фермента карбомоилфосфат-синтетазы(на схеме не показано). Данная реакция происходит с затратой энергии двух молекул АТФ и образованием двух молекул АДФ. При участии орнитин-карбомоил-трансферазы (орнитинтранскарбомоилазы) остаток карбомоилфосфата присоединяется к молекуле орнитина, что приводит к образованию молекулы цитрулина, которая переносится в цитозоль. Реакции в цитоплазме: В цитоплазме цитрулин с аспарагиновой кислотой при участии фермента аргининсукцинат-синтетазы образует совместно аргининосукцинат. В ходе данной реакции расходуется энергия превращения одной молекулы АТФ в АМФ (что эквивалентно превращению двух молекул АТФ в АДФ). Образовавшийся в ходе реакции дифосфатгидролизируется для обеспечения необратимости процесса (на схеме не показано). Под действием фермента аргининосукцинат-лиазы аргининосукцинат распадается на фумарат и аргинин. Аргинин в свою очередь гидролизируется при участии аргиназы (аргининогидролазы) с образованием мочевины и орнитина, который сразу же переносится в митохондрию и цикл повторяется вновь. Суммарное уравнение реакций: 2NH3 + CO2 + 3ATФ + аспарагиновая кислота + 3H2O → мочевина + фумарат + 2AДФ +2Фн+ АМФ + ФФн Энергетический выход цикла составляет затрату четырёх макроэргических связей на одну молекулу мочевины, поскольку пирофосфат далее превращается до фосфата. Следует заметить, что полученная в процессе реакции аргининосукциназы молекула фумарата снижает энергетическую стоимость цикла. Фумарат, реагируя с молекулой воды в цитозоле, дает малат. Малат же вступает в цикл Кребса и с помощью NAD окисляется. Продуктами этой реакции являются NADH и оксалоацетат. NADH вступает вдыхательную электронтранспортную цепь. Окисление NADH дает примерно 2,5 молекул АТФ, следовательно, стоимость цикла мочевины после этих дополнительных реакций составляет 1,5 молекул АТФ.
Параграф 4 Состав ферментов
Автор – Анисимова Елена Сергеевна. Авторские права защищены.
Курсив можно не зубрить.
Замечания можно присылать по почте: exam_bch@mail.ru
https://vk.com/bch_5
Параграф № 4: «Состав ферментов».
4.1. СОСТАВ ферментов.
Есть ферменты, которые состоят из одной или нескольких полипептидных цепей (ППЦ) –
такие ферменты называют ПРОСТЫМИ.
(При этом структура простых ферментов с одной ППЦ третичная, а с несколькими ППЦ – четвертичная).
Многим ферментам для работы нужны не только ППЦ (белковая часть),
но и вещества небелковой природы. –
Эти вещества называются небелковой частью или КОФАКТОРАМИ,
а ферменты, для работы которых нужны кофакторы, называются СЛОЖНЫМИ ферментами.
Белковую часть сложного фермента называют АПОФЕРМЕНТОМ,
а комплекс апофермента с кофактором (то есть весь сложный фермент), называются ХОЛОФЕРМЕНТОМ («холо» означает «весь, полный):
апофермент + кофактор = холофермент.
ТИПЫ КОФАКТОРОВ.
Кофакторы, как и все вещества, бывают неорганическими и органическими.
Неорганические представлены ионами металлов: Zn2+, Мn2+, Fe2+ и т.д.
(Это одна из причин, по которым в пище должны быть микроэлементы п.110 –
потому что без них не работают многие ферменты).
Органические кофакторы отличаются по прочности связывания с апоферментами:
прочно связанные кофакторы называются простетическими группами
(примеры: ФАД, биотин),
а непрочно связанные называются коферментами (пример: НАД+).
Обычно прочны ковалентные связи, но иногда и несколько нековалентных прочно связывают: например, ТПФ связан прочно, хоть и нековалентно.
Часто коферментами называют любые органические кофакторы,
то есть и настоящие коферменты, и простетические группы.
В дальнейшем слово «коферменты» (или КоФ) будет использоваться вместо слов «органические кофакторы».
Ф У Н К Ц И Я КОФАКТОРОВ. –
Об ионах металлов нужно прочесть в п. 5;
ионы металлов могут играть роль электрофилов и т.д.
Коферменты выполняют функцию переносчиков разных групп
или атомов в химических реакциях при работе ферментов.
Например, ТГФ переносит одноуглеродные группы,
а ФАД переносит пару атомов водорода (два протона и два электрона).
При этом непрочно связанные с апоферментом коферменты фактически являются субстратами и продуктами при работе ферментов.
С О С Т А В КОФЕРМЕНТОВ.
Большинство КоФ состоит из витамина и дополнительного компонента,
и это часто отражено в названии коферментов:
названия тоже состоят из названия витамина и дополнительного компонента.
Образуются коферменты путем присоединения к витамину дополнительного компонента.
Например, из витамина фолат и 4 (тетра) атомов водорода образуется и состоит кофермент, который так и называется:
тетра/гидро/фолат (ТГФ); дополнительный компонент в ТГФ – это четыре атома водорода.
Из витамина тиамина (В1) и пирофосфата (дифосфата) состоит кофермент тиамин/пирофосфат (ТПФ).
Из витамина пиридоксаля (В6) состоит кофермент пиридоксаль/фосфат (ПФ).
В состав коферментов входят в основном водорастворимые витамины;
из жирорастворимых витаминов кофермент образует только витамин К.
О б р а з о в а н и е кофермента путем присоединения к витамину водорода
называется восстановлением и катализируется редуктазами.
Образование кофермента из витаминов путем присоединения фосфата
называется фосфорилированием и катализируется киназами
(с участием АТФ в качестве источника фосфата).
Некоторые коферменты образуются путем присоединения нуклеотида
(такие коферменты, как НАД, ФАД, ФМН, КоА и т.д).
К В12 (кобаламину) нужно добавить или метил (тогда получится КоФ метил/кобаламин),
или дезокси/аденозин (нуклеоЗид) – получится кофермент дезоксиаденозил/кобаламин.
К витамину пантотенату нужно добавить тиоэтиламин, АДФ и фосфат.
Некоторые КоФ образуются не из витаминов, а путем сложного синтеза при участии витаминов. Например, гем.
Кроме органической части, гем содержит ион железа (органическая часть гема называется порфирином).
Витамин В12 и образующиеся из него коферменты тоже содержат металл – кобальт
(это отражено в названии В12 – кобаламин).
Некоторые коферменты являются просто витаминами:
например, к биотину или аскорбату (витамин С) не нужно присоединять дополнительные группы.
Витамины потому и должны поступать в организм с пищей,
чтобы из них или при их участии образовывались кофакторы (органические).
Иначе в организме мало кофакторов, а без коферментов не работают многие ферменты,
снижается скорость многих реакций,
накапливаются вредные субстраты
и возникает дефицит нужных продуктов (особенно АТФ).
Все это приводит к смерти при сильном дефиците даже некоторых витаминов
(при авитаминозах: без С – цинга, без В1 – бери-бери и т.д.).
Относительно небольшой дефицит витаминов (при гиповитаминозе) приводит
к ухудшению внешнего вида, самочувствия, настроения
(мало гормонов счастья серотонина и др.), к анемии, к дефициту «сил», к слабости, к снижению иммунитета и т.д..
Функция А, Д и Е другая – из А и Д образуются гормоны – см. п.9-19.
4. 2. А к т и в н ы й ц е н т р (АЦ). См. п.58.
Активный центр – это участок молекулы фермента,
в котором происходит реакция,
то есть связывание субстратов и их превращение в продукты.
АЦ образован атомами 3-4-х радикалов ППЦ.
Порядковые номера радикалов АЦ не соседние,
то есть, к примеру, не № 27, 28 и 29, а 14, 56 и 117.
Радикалы АЦ должны оказаться рядом, чтобы сформировать АЦ – это
сближение радикалов АЦ происходит за счет определенного расположения ППЦ в пространстве при формировании третичной или четвертичной структуры.
Активный центр должен иметь определенную форму –
для этого радикалы должны быть определенным образом расположены относительно друг друга.
Правильную ориентацию радикалов в пространстве обеспечивает конформация всей молекулы фермента.
Конформация молекулы фермента может изменяться
под действием веществ-регуляторов
при их связывании с молекулой фермента
или в результате изменений среды (например, при изменении рН).
Изменения конформации молекулы фермента приводят либо к появлению АЦ,
либо к исчезновению;
появление АЦ приводит к активации молекулы фермента,
а исчезновение АЦ – к инактивации (к ингибированию).
При превращении третичной структуры в первичную (то есть при денатурации)
происходит отдаление радикалов АЦ, то есть разрушение АЦ.
Именно поэтому после денатурации белки не могут работать (ППЦ есть, но АЦ нет).
С т р у к т у р а АЦ.
В АЦ часть атомов может заниматься прежде всего связыванием субстратов –
эта часть АЦ называется связывающим участком.
Другая часть атомов АЦ занимается прежде всего самим катализом – эта часть АЦ называется каталитическим участком.
Небелковая часть фермента неспецифична и может входить в состав разных ферментов и выполнять разные функции



Белковая часть (апофермент) отвечает за активность и специфичность.
Функции белковой и небелковой части фермента.
Скорость ферментативной реакции зависит от концентрации фермента.
Активность ферментов регулируется.
Ферменты классифицируют по химической структуре:
| Ферменты (энзимы) | ||
| Простые | Сложные (холоферменты) | |
| (состоят из аминокислот, относятся пищеварительные ферменты: пепсин, трипсин, амилаза, ДНК-аза) | Белковая часть (апофермент состоит из аминокислот) | Небелковая (кофактор; витамины, нуклеотиды, ионы Ме: Fe, Mg, Co, Zn) |
Кофактор делят на 2 группы в зависимости от прочности связи:
1. кофермент – легкоотделяемая небелковая часть
2. простетическая группа – трудноотделяемая часть фермента.
2. Небелковая часть (кофактор) отвечает за превращение субстрата («руки» фермента – разрыв связи, перенос).
Пример: Фермент аминотрансфераза состоит из белковой части и небелковой, которая представлена пиридоксальфосфатом (витамин B6). Этот кофермент обеспечивает перенос NH2-группы с аминокислоты на кетокислоту. Удаление белковой части приводит к потере специфичности (фермент начинает переносить еще 15 групп) и теряет активность.
Пример: Гем входит в состав каталазы, которая обеспечивает расщепление H2O2. Гем входит также в состав цитохромов, которые осуществляют перенос электронов.
Каталаза Бел.ч Гем
Цитохромы Бел.ч Гем
Коферменты делят:
1. Переносчики р и 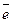
Пример: НАД (витамин В5) – нуклеотид
ФАД (витамин В2) – нуклеотид
2. Переносчики различных функциональных групп – трансферазы.
Пример: Пиродоксальфосфат (ПФ) – NH2
Белок-фермент: описание, роль, свойства, функция и особенности
В каждой клетке организме постоянно происходят сотни различных биохимических процессов. Все они сопровождаются распадом и окислением питательных веществ, поступающих извне.
Процессы сложные, многосоставные, и об их особенностях можно рассказывать долго. Но все они протекают быстро благодаря катализаторам биохимических реакций, которыми являются белки-ферменты.
Что они собой представляют? Какова их роль, свойства, функции? Об этом сейчас речь и пойдет.
Определение
Итак, белок-фермент – это совокупность сложных молекул белка и рибосом либо их целые комплексы. Именно они ускоряют все происходящие в живых системах химические реакции. Происходит это, разумеется, определенным образом.
Каждый фермент «свернут» в определенную структуру. И он ускоряет конкретную, соответствующую его характеристикам реакцию. Кстати, в таком «тандеме» реагенты именуют субстратами. А получившиеся в результате реакции вещества – продуктами.
Ферменты по отношению к субстратам весьма специфичны. Аденозинтрифосфатазы, например, катализируют исключительно отщепление остатков фосфорной кислоты от аденозинтрифосфорной. Другой пример – киназа фосфорилазы. Она, в свою очередь, переносит к субстрату остатки только фосфорной кислоты.
Регуляция активности
Белки-ферменты могут действовать по-разному. Их активность регулируется двумя типами веществ:
К слову, синтезируются белки-ферменты на рибосомах. Эти органеллы производят их из аминокислот, основываясь на генетическую информацию.
Состав
Есть еще множество вопросов, касающихся белков-ферментов, расщепляющие различные вещества, поступающие в организм. Почему, например, их молекулы больше, чем у субстратов? И каким вообще образом аминокислоты, которые сами не могут ускорять химические реакции, создают мощнейшие каталитические системы, соединяясь в специфические последовательности?
Но зато медицине многое известно об их составе. Каждый фермент представляет собой соединение собственно белковых частей и связанные с ними активные центры. В их молекулах принято отличать активный А-центр – это место в пространственной структуре, с которым контактирует субстрат S. Также есть белковая часть – ее именуют либо апоэнзимом, либо апоферментом.
Можно еще объяснить иначе. Ферменты образованы из полипептидов – это такие вещества, которые состоят из остатков аминокислот. А те, в свою очередь, являются органическими соединениями, содержащие в себя как аминные, так и карбоксильные группы.
Специфика воздействия
Состоящие из остатков аминокислот белки-ферменты обеспечивают одну либо несколько однотипных реакций (каждый).
К примеру, жиры внутри клеток и в пищеварительном тракте расщепляются липазой. Это водорастворимый фермент, не действующий на белки и полисахариды. В то же время вещество, расщепляющее гликоген или крахмал, не оказывает никакого эффекта на жиры.
Интересно, что каждый молекула фермента осуществляет от нескольких тысяч до миллионов действий в минуту. В ходе этих процессов белок не расходуется вообще. Наоборот, он образует симбиоз с реагирующими веществами, ускоряя их превращения. После окончания он выходит из реакции в неизменном виде.
Свойства
Их тоже надо рассмотреть, изучая роль белков-ферментов. Вообще, свойства этих веществ можно выделить в такой список:
Последние качества обусловлены регулируемой активностью ферментов. Благодаря этой специфике удается изменять скорость превращения веществ вы зависимости от условий среды, в которых они находятся.
Интересно, что у некоторых белков-ферментов, расщепляющих жиры, углеводы и прочие элементы, есть стереохимическая специфичность. Так называется их способность катализировать превращение лишь одного стереоизомера субстрата. К примеру, фумароза способна расщепить исключительно транс-изомер-фумаровую кислоту. Взаимодействовать с cis-изомером она уже не будет.
Зависимость от температуры
Она довольно весомая. С повышением температуры на каждые десять градусов скорость ферментативной реакции увеличивается примерно в два-три раза.
Но, если сравнивать с минеральными катализаторами, то закономерность эта дает о себе знать только в конкретном температурном интервале, который может варьироваться от 0°C до 37-40 °C.
Когда же фермент начинает работать на максимуме? Наибольшая активность проявляется тогда, когда и температура достигает предела в 40 °C. Если она поднимется еще выше, то начнется денатурация.
Ферменты, подчиняющиеся данной закономерности, принято называть термолабильностью. Это – ключевое качество, отличающие белки от минеральных катализаторов.
Но есть среди ферментов термостабильные соединения, на которые высокие температуры негативно не воздействуют. Более того, некоторые из них их выдерживают, и даже под их влиянием проявлять максимальную активность. К таковым относится миокиназа мышц. Она сохранит активность даже в том случае, если температура достигнет 100 °C.
При 0 °C ферментативная реакция практически прекращается. Но это ингибирование обратимо. При нормальном температурном режиме активность вещества восстановится. Это доказывают ферменты, которые были выделены из туши мамонтов, годами находившихся в условиях ледникового периода. При создании нормальной температуры они проявляли хорошую активность.
Классификация
Рассказывая об особенностях и функциях белков-ферментов, нужно отметить, что на данный момент известно более 2000 их видов. Но количество постоянно увеличивается.
Условно ферменты делятся на 6 групп. В качестве критерия классификации выступает характер реакций, который они вызывают.
Также стоит упомянуть, что процесс синтеза или расщепления какого-либо вещества в клетке обычно делится на ряд химических операций. Каждая из них выполняется отдельным белком-ферментом. Группы таких элементов составляют некий биохимический конвейер.
По сути, каждый фермент – это своеобразная молекулярная машина. Благодаря определенному расположению аминокислот и пространственной структуре своих компонентов, он имеет способность узнавать «свой» субстрат среди остальных. Поэтому присоединение выполняется мгновенно, что и обуславливает скорость химических реакций.
Обратные связи
Всем вышеперечисленным не ограничиваются свойства белков-ферментов. Не был отмечен вниманием еще один немаловажный нюанс.
Дело в том, что в белковых молекулах многих ферментов имеются участки, способные узнавать еще и конечный продукт – тот, который, так сказать, «сходит» с полиферментного биохимического конвейера.
Плохо, если его слишком много. Потому что в таком случае активность начального фермента начинает тормозиться. Ничем не лучше, если конечного продукта мало. Потому что тогда фермент активируется.
Собственно говоря, таким образом множество биохимических процессов и происходит. Это – обратные связи, обеспечивающие саморегуляцию. Если задуматься и провести параллель, то такие же принципы прослеживаются в работе современной технике. В природных механизмах, в живых клетках, все аналогично.
Сходство с минеральными катализаторами
Что же, исходя из вышесказанного, можно понять, какую функцию выполняют белки-ферменты. Теперь нужно немного поговорить об их сходствах с минеральными катализаторами. Можно выделить такой перечень:
Последний факт особенно интересен. Такая особенность обусловлена тем, что фермент в ходе своей реакции начинает взаимодействовать с субстратом, образуя промежуточное соединение – фермент-субстратный комплекс.
Что же происходит? Конформация субстрата меняется, ковалентные связи напрягаются, а потому энергии, необходимой для разрыва, требуется меньше.
Как можно видеть, казалось бы сложный процесс на самом деле можно очень просто объяснить, если вникнуть в подробности.
ЦЕНТР БИОТЕХНОЛОГИЙ И ВОССТАНОВИТЕЛЬНОЙ МЕДИЦИНЫ

Ферменты, как белки.Коферменты и субстраты.
Ферменты как белки. Все ферменты являются белками, простыми или сложными (т.е. содержащими наряду с белковым компонентом небелковую часть). См. также БЕЛКИ.
Ферменты – крупные молекулы, их молекулярные массы лежат в диапазоне от 10 000 до более 1 000 000 дальтон (Да). Для сравнения укажем мол. массы известных веществ: глюкоза – 180, диоксид углерода – 44, аминокислоты – от 75 до 204 Да. Ферменты, катализирующие одинаковые химические реакции, но выделенные из клеток разных типов, различаются по свойствам и составу, однако обычно обладают определенным сходством структуры.
Не все белки, присутствующие в живых организмах, являются ферментами. Так, иную функцию выполняют структурные белки, многие специфические белки крови, белковые гормоны и т.д.
Коферменты и субстраты. Многие ферменты с большой молекулярной массой проявляют каталитическую активность только в присутствии специфических низкомолекулярных веществ, называемых коферментами (или кофакторами). Роль коферментов играют большинство витаминов и многие минеральные вещества; именно поэтому они должны поступать в организм с пищей. Витамины РР (никотиновая кислота, или ниацин) и рибофлавин, например, входят в состав коферментов, необходимых для функционирования дегидрогеназ. Цинк – кофермент карбоангидразы, фермента, катализирующего высвобождение из крови диоксида углерода, который удаляется из организма вместе с выдыхаемым воздухом. Железо и медь служат компонентами дыхательного фермента цитохромоксидазы.
Вещество, подвергающееся превращению в присутствии фермента, называют субстратом. Субстрат присоединяется к ферменту, который ускоряет разрыв одних химических связей в его молекуле и создание других; образующийся в результате продукт отсоединяется от фермента. Этот процесс представляют следующим образом:
Продукт тоже можно считать субстратом, поскольку все ферментативные реакции в той или иной степени обратимы. Правда, обычно равновесие сдвинуто в сторону образования продукта, и обратную реакцию бывает трудно зафиксировать.
Механизм действия ферментов. Скорость ферментативной реакции зависит от концентрации субстрата [S] и количества присутствующего фермента. Эти величины определяют, сколько молекул фермента соединится с субстратом, и именно от содержания фермент-субстратного комплекса зависит скорость реакции, катализируемой данным ферментом. В большинстве ситуаций, представляющих интерес для биохимиков, концентрация фермента очень мала, а субстрат присутствует в избытке. Кроме того, биохимики исследуют процессы, достигшие стационарного состояния, при котором образование фермент-субстратного комплекса уравновешивается его превращением в продукт. В этих условиях зависимость скорости (v) ферментативного превращения субстрата от его концентрации [S] описывается уравнением Михаэлиса – Ментен:
где KM – константа Михаэлиса, характеризующая активность фермента, V – максимальная скорость реакции при данной суммарной концентрации фермента. Из этого уравнения следует, что при малых [S] скорость реакции возрастает пропорционально концентрации субстрата. Однако при достаточно большом увеличении последней эта пропорциональность исчезает: скорость реакции перестает зависеть от [S] – наступает насыщение, когда все молекулы фермента оказываются занятыми субстратом.
Выяснение механизмов действия ферментов во всех деталях – дело будущего, однако некоторые важные их особенности уже установлены. Каждый фермент имеет один или несколько активных центров, с которыми и связывается субстрат. Эти центры высокоспецифичны, т.е. «узнают» только «свой» субстрат или близкородственные соединения. Активный центр формируют особые химические группы в молекуле фермента, ориентированные друг относительно друга определенным образом. Происходящая так легко потеря ферментативной активности связана именно с изменением взаимной ориентации этих групп. Молекула субстрата, связанного с ферментом, претерпевает изменения, в результате которых разрываются одни и образуются другие химические связи. Чтобы этот процесс произошел, необходима энергия; роль фермента состоит в снижении энергетического барьера, который нужно преодолеть субстрату для превращения в продукт. Как именно обеспечивается такое снижение – до конца не установлено.
Ферментативные реакции и энергия. Высвобождение энергии при метаболизме питательных веществ, например при окислении шестиуглеродного сахара глюкозы с образованием диоксида углерода и воды, происходит в результате последовательных согласованных ферментативных реакций. В животных клетках в превращениях глюкозы в пировиноградную кислоту (пируват) или молочную кислоту (лактат) участвуют 10 разных ферментов. Этот процесс называется гликолизом. Первая реакция – фосфорилирование глюкозы – требует участия АТФ. На превращение каждой молекулы глюкозы в две молекулы пировиноградной кислоты расходуются две молекулы АТФ, но при этом на промежуточных этапах из аденозиндифосфата (АДФ) образуются 4 молекулы АТФ, так что весь процесс в целом дает 2 молекулы АТФ.
Далее пировиноградная кислота окисляется до диоксида углерода и воды при участии ферментов, ассоциированных с митохондриями. Эти превращения образуют цикл, называемый циклом трикарбоновых кислот, или циклом лимонной кислоты. См. также МЕТАБОЛИЗМ.
Окисление одного вещества всегда сопряжено с восстановлением другого: первое отдает атом водорода, а второе его присоединяет. Катализируют эти процессы дегидрогеназы, обеспечивающие перенос атомов водорода от субстратов к коферментам. В цикле трикарбоновых кислот одни специфические дегидрогеназы окисляют субстраты с образованием восстановленной формы кофермента (никотинамиддинуклеотида, обозначаемого НАД), а другие окисляют восстановленный кофермент (НАД × Н), восстанавливая другие дыхательные ферменты, в том числе цитохромы (железосодержащие гемопротеины), в которых атом железа попеременно то окисляется, то восстанавливается. В конечном итоге восстановленная форма цитохромоксидазы, одного из ключевых железосодержащих ферментов, окисляется кислородом, попадающим в наш организм с вдыхаемым воздухом. Когда происходит горение сахара (окисление кислородом воздуха), входящие в его состав атомы углерода непосредственно взаимодействуют с кислородом, образуя диоксид углерода. В отличие от горения, при окислении сахара в организме кислород окисляет собственно железо цитохромоксидазы, но в конечном итоге его окислительный потенциал используется для полного окисления сахаров в ходе многоступенчатого процесса, опосредуемого ферментами.
На отдельных этапах окисления энергия, заключенная в питательных веществах, высвобождается в основном маленькими порциями и может запасаться в фосфатных связях АТФ. В этом принимают участие замечательные ферменты, которые сопрягают окислительные реакции (дающие энергию) с реакциями образования АТФ (запасающими энергию). Этот процесс сопряжения известен как окислительное фосфорилирование. Не будь сопряженных ферментативных реакций, жизнь в известных нам формах была бы невозможна.
Ферменты выполняют и множество других функций. Они катализируют разнообразные реакции синтеза, включая образование тканевых белков, жиров и углеводов. Для синтеза всего огромного множества химических соединений, обнаруженных в сложных организмах, используются целые ферментные системы. Для этого нужна энергия, и во всех случаях ее источником служат фосфорилированные соединения, такие, как АТФ.