Как называется kmno4 в химии
Сильнейший окислитель — перманганат калия
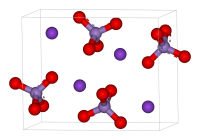
Перманганат калия (в обиходе просто марганцовка) — неорганическое вещество, соль калия и марганцовой кислоты. Формула вещества — KMnO4, химически правильное название — марганцовокислый калий. Массово реактив получают электролизом манганата калия.
Свойства
Марганцовка представляет собой кристаллический 
Перманганат калия — очень сильный окислитель. Активно вступает в реакции с органическими и неорганическими кислотами, вплоть до взрыва. Взаимодействие с химически активными реактивами в порошкообразной форме (алюминием, магнием, кальцием, серой, фосфором) может приводить к самовоспламенению и взрыву. Бурно реагирует с легковоспламеняющимися химикатами, многими органическими веществами (глицерином, сахарозой, танинами и т.п.) — начинается экзотермическая реакция, которая тоже может закончиться взрывом.
Меры предосторожности
Марганцовокислый калий относится к веществам 2 класса опасности как взрывоопасное вещество и к 4-му классу опасности по влиянию на человеческий организм.
Хранят реактив в герметично укупоренных емкостях небольшого объема на крытых сухих складах, вдали от нагревательных приборов. Не допускается совместное хранение с легковоспламеняющимися веществами, органическими веществами.
На производствах, имеющих дело с марганцовкой, помещения должны быть снабжены вентиляцией, работникам следует использовать респираторы и защитные очки.
 |  |  |
| Банка для реактивов 100 мл из темного стекла | Очки защитные закрытые 3Н11 PANORAMA | Квадратная банка из темного стекла, 1000 мл |
Кристаллы химиката и его концентрированные растворы при контакте с кожей или слизистыми оболочками вызывают химический ожог. Проглатывание раствора высокой концентрации вызывает отравление. Его симптомы: сильная боль во рту, гортани, животе; отек гортани, который может привести к удушью. Слизистые рта становятся коричневого или фиолетового цвета. Начинается тошнота, рвота, диарея. Могут появиться судороги, двигательное возбуждение, желудочное кровотечение, проблемы в работе почек, печени сердца. При появлении этих симптомов следует срочно обратиться к врачу.
Применение
Следует отметить, что использование марганцовки требует огромной осторожности, чтобы не нанести себе еще больший вред, пытаясь вылечить что-либо. Именно поэтому, по возможности, стоит предпочесть ей другие лекарственные средства.
Перманганат калия ГОСТ 20490-75
| Перманганат калия | |
|---|---|
 | |
 | |
| Систематическое наименование | Перманганат калия |
| Традиционные названия | Марганцовокислый калий, марганцовка |
| Хим. формула | KMnO4 |
| Состояние | твердое (хрупкие кристаллы) |
| Молярная масса | 158,034 г/моль |
| Плотность | 2,703 г/см³ |
| Т. разл. | 240 °C |
| Мол. теплоёмк. | 119,2 Дж/(моль·К) |
| Энтальпия образования | -813,4 кДж/моль |
| Растворимость в воде | 6,38 (20 °C) |
| Рег. номер CAS | ГОСТ 5777-84 ГОСТ 20490-75 |
| Рег. номер CAS | 7722-64-7 |
| PubChem | 516875 |
| Рег. номер EINECS | 231-760-3 |
| SMILES | |
| Рег. номер EC | 231-760-3 |
| RTECS | SD6475000 |
| Номер ООН | 1490 |
| ChemSpider | 22810 |
| Токсичность | низкая |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Содержание
Физические свойства
Внешний вид: тёмно-фиолетовые кристаллы с металлическим блеском. Показатель преломления составляет 1,59 (при 20 °C).
Растворяется в воде (см. таблицу), жидком аммиаке, ацетоне (2:100), метаноле, пиридине.
Термодинамические свойства
| Стандартная энтальпия образования ΔH | −813,4 кДж/моль (т) (при 298 К) |
|---|---|
| Стандартная энергия Гиббса образования G | −713,8 кДж/моль (т) (при 298 К) |
| Стандартная энтропия S | 171,71 Дж/(моль·K) (т) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 119,2 Дж/(моль·K) (т) (при 298 К) |
Химические свойства
Является сильным окислителем. В зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI). Примеры реакций приведены ниже (на примере взаимодействия с сульфитом калия):
При соприкосновении с концентрированной серной кислотой перманганат калия взрывается, однако при аккуратном соединении с холодной кислотой реагирует с образованием неустойчивого оксида марганца(VII):
при этом в качестве промежуточного продукта может образовываться интересное соединение — оксосульфат марганца MnO3HSO4. По реакции с фторидом иода(V) можно получить аналогичный оксофторид:
При нагревании разлагается с выделением кислорода (этим способом пользуются в лаборатории для получения чистого кислорода). Схему реакции упрощённо можно представить уравнением:
На самом деле реакция идёт намного сложнее, например, при не очень сильном нагревании её можно примерно описать уравнением:
Реагирует с солями двухвалентного марганца, например:
Эта реакция в принципе обратна дисмутации (диспропорционирование) K2MnO4 на MnO2 и KMnO4.
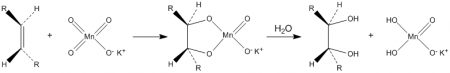
Окисляет органические вещества. В частности, разбавленные растворы перманганата калия в щелочной и нейтральной среде окисляют алкены до диолов (реакция Вагнера):
Водные растворы перманганата калия термодинамически нестабильны, но кинетически довольно устойчивы. Их сохранность резко повышается при хранении в темноте.
При смеси с пероксидом водорода протекает следующая реакция:
Применение
Применение этой соли чаще всего основано на высокой окисляющей способности перманганат-иона, обеспечивающей антисептическое действие.
Медицинское применение
| Другие названия | |
|---|---|
| Лекарственные формы | |
| Классификация | |
| Химическое соединение | |
| Перманганат калия | |
| Kalii permanganas | |
| ИЮПАК | Перманганат калия |
| Брутто-формула | KMnO₄ |
| CAS | 7722-64-7 |
| PubChem | 516875 |
| DrugBank | 13831 |
| Фармакол. группа | Антисептики и дезинфицирующие средства |
| АТХ | D08AX06 |
| порошок для приготовления раствора | |
| KMnO4, Калия перманганат, Марганцовка, Хамелеон минеральный, Марганцевокислый калий, Марганцовокислый калий, Калий марганцевокислый | |
| Перманганат калия | |
Разбавленные растворы (около 0,1 %) перманганата калия нашли широчайшее применение в медицине как антисептическое средство, для полоскания горла, промывания ран, обработки ожогов. В качестве рвотного средства для приёма внутрь при отравлениях морфином, аконитином и некоторыми другими алкалоидами используют разбавленный (0,02—0,1 %) раствор перманганата калия.
Фармакологическое действие
Антисептическое средство. При соприкосновении с органическими веществами выделяет атомарный кислород. Образующийся при восстановлении препарата оксид образует с белками комплексные соединения — альбуминаты (за счёт этого калия перманганат в малых концентрациях оказывает вяжущее, а в концентрированных растворах — раздражающее, прижигающее и дубящее действие). Обладает также дезодорирующим эффектом. Эффективен при лечении ожогов и язв. Способность калия перманганата обезвреживать некоторые яды лежит в основе использования его растворов для промывания желудка при отравлениях неизвестным ядом и пищевых токсикоинфекциях. При попадании внутрь всасывается, оказывая действие (приводит к развитию метгемоглобинемии).
Показания
Смазывание язвенных и ожоговых поверхностей — инфицированные раны, язвы и ожоги кожи. Полоскание полости рта и ротоглотки — при инфекционно-воспалительных заболеваниях слизистой оболочки полости рта и ротоглотки (в том числе при ангинах). Для промывания и спринцеваний при гинекологических и урологических заболеваниях — кольпиты и уретриты. Для промываний — желудка при отравлениях, вызванных приёмом внутрь алкалоидов (морфин, аконитин, никотин), синильной кислотой, фосфором, хинином; кожи — при попадании на неё анилина; глаз — при поражении их ядовитыми насекомыми.
Противопоказания
Способ применения и дозы
Наружно, в водных растворах для промывания ран ( 0,1—0,5 % ), для полоскания рта и горла ( 0,01—0,1 % ), для смазывания язвенных и ожоговых поверхностей ( 2—5 % ), для спринцевания ( 0,02—0,1 % ) в гинекологической и урологической практике, а также промывания желудка при отравлениях.
Предосторожности
Активно взаимодействует при нагреве и даже при комнатной температуре с большинством восстановителей, например, органическими веществами (сахарозой, танинами, глицерином и многими другими), легкоокисляющимися веществами, поэтому при смешивании происходит саморазогревание, что иногда вызывает самовоспламенение смеси (с концентрированным раствором глицерина, или безводным — всегда) и может привести к взрыву.
Другие сферы применения
Получение
Химическое или электрохимическое окисление соединений марганца, диспропорционирование манганата калия. Например:
Последняя реакция происходит при электролизе концентрированного раствора манганата калия и эндотермична, она является основным промышленным способом получения перманганата калия.
Ограничение на покупку
Входит в IV список прекурсоров ПККН в России (допускается исключение некоторых мер контроля).
14 июня 2013 года на Украине был признан прекурсором и внесён в список наркотических веществ.
Перманганат калия
Калия перманганат (распространённое название в быту — марганцовка) (лат. Kalii permanganas) — калиевая соль марганцевой кислоты ( K Mn O 4).
Содержание
Получение [ ]
Химическое или электрохимическое окисление соединений марганца, диспропорционирование манганата калия. Например:
Последняя реакция происходит при электролизе концентрированного раствора манганата калия и эндотермична, она является основным промышленным способом получения перманганата калия.
Физические свойства [ ]
Термодинамические свойства [ ]
| Стандартная энтальпия образования ΔH | −813,4 кДж/моль (т) (при 298 К) |
| Стандартная энергия Гиббса образования G | −713,8 кДж/моль (т) (при 298 К) |
| Стандартная энтропия образования S | 171,71 Дж/моль·K (т) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 119,2 Дж/моль·K (т) (при 298 К) |
Химические свойства [ ]
Сильный окислитель. Стандартные окислительно-восстановительные потенциалы приведены в таблице.
В зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI). Примеры реакций приведены ниже (на примере взаимодействия с сульфитом калия :
Однако надо отметить, что в последняя реакция (в щелочной среде) идёт по указаной схеме только при недостатке восстановителя и высокой концентрации щёлочи, которая обеспечивает замедление гидролиза манганата калия.
При соприкосновении с концентрированной серной кислотой перманганат калия взрывается, однако при аккуратном соединении с холодной кислотой реагирует с образованием неустойчивого оксида марганца(VII):
при этом в качестве промежуточного продукта может образовываться интересное соединение — оксосульфат марганца MnO3HSO4. По реакции с фторидом йода(V) можно получить аналогичный оксофторид :
При нагревании разлагается с выделением кислорода (этим способом пользуются в лаборатории для получения чистого кислорода). Схему реакции упрощённо можно представить уравнением:
На самом деле реакция идёт намного сложнее, например, при не очень сильном нагревании её можно примерно описать уравнением:
Реагирует с солями двухвалентного марганца, например:
Эта реакция коммутации в принципе обратна дисмутации ( диспропорционирование ) K2MnO4 на MnO2 и KMnO4.
Применение [ ]
Применение этой соли основано на высокой окисляющей способности перманганат-иона.
См. также [ ]
bg:Калиев перманганат bs:Kalijum permanganat cs:Manganistan draselný da:Kaliumpermanganat de:Kaliumpermanganat en:Potassium permanganate eo:Kalia permanganato es:Permanganato de potasio fi:Kaliumpermanganaatti fr:Permanganate de potassium hu:Kálium-permanganát it:Permanganato di potassio ja:過マンガン酸カリウム lt:Kalio permanganatas lv:Kālija permanganāts nl:Kaliumpermanganaat no:Kaliumpermanganat pl:Manganian(VII) potasu pt:Permanganato de potássio ro:Permanganat de potasiu simple:Potassium permanganate sk:Manganistan draselný sr:Калијум перманганат sv:Kaliumpermanganat zh:高锰酸钾
Перманганат калия
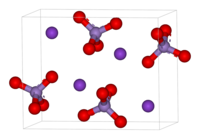
| Перманганат калия | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Перманганат калия |
| Химическая формула | KMnO4 |
| Физические свойства | |
| Состояние (ст. усл.) | твердое (хрупкие кристаллы) |
| Отн. молек. масса | 158,03 а. е. м. |
| Молярная масса | 158,03 г/моль |
| Плотность | 2.703 г/см³ |
| Термические свойства | |
| Температура разложения | 240 °C |
| Молярная теплоёмкость (ст. усл.) | 119,2 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | -813.4 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 6.38 (20 °C) |
| Классификация | |
| Рег. номер CAS | 7722-64-7 |
| SMILES | O- [Mn](=O)(=O)=O.K+ |
| Регистрационный номер EC | 231-760-3 |
| RTECS | SD6475000 |
Содержание
Физические свойства
Внешний вид: тёмно-фиолетовые кристаллы с металлическим блеском. Показатель преломления σ 1,59 (при 20 °C).
Растворяется в воде (см. таблицу), жидком аммиаке, ацетоне (2:100), метаноле, пиридине.
| Температура, °C | 10 | 20 | 25 | 30 | 40 | 50 | 65 |
| Растворимость, г/100 г воды | 4,22 | 6,36 | 7,63 | 9 | 12,5 | 16,8 | 25 |
Термодинамические свойства
| Стандартная энтальпия образования ΔH | −813,4 кДж/моль (т) (при 298 К) |
| Стандартная энергия Гиббса образования G | −713,8 кДж/моль (т) (при 298 К) |
| Стандартная энтропия S | 171,71 Дж/моль·K (т) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 119,2 Дж/моль·K (т) (при 298 К) |
Химические свойства
Однако надо отметить, что последняя реакция (в щелочной среде) идёт по указанной схеме только при недостатке восстановителя и высокой концентрации щёлочи, которая обеспечивает замедление гидролиза манганата калия.
При соприкосновении с концентрированной серной кислотой перманганат калия взрывается, однако при аккуратном соединении с холодной кислотой реагирует с образованием неустойчивого оксида марганца(VII):
при этом в качестве промежуточного продукта может образовываться интересное соединение — оксосульфат марганца MnO3HSO4. По реакции с фторидом йода(V) можно получить аналогичный оксофторид:
При нагревании разлагается с выделением кислорода (этим способом пользуются в лаборатории для получения чистого кислорода). Схему реакции упрощённо можно представить уравнением:
На самом деле реакция идёт намного сложнее, например, при не очень сильном нагревании её можно примерно описать уравнением:
Реагирует с солями двухвалентного марганца, например:
Водные растворы перманганата калия термодинамически нестабильны, но кинетически довольно устойчивы. Их сохранность резко повышается при хранении в темноте.
Применение
Применение этой соли чаще всего основано на высокой окисляющей способности перманганат-иона, обеспечивающей антисептическое действие.
формула
группа
Медицинское применение
Разбавленные растворы (около 0,1 %) перманганата калия нашли широчайшее применение в медицине как антисептическое средство, для полоскания горла, промывания ран, обработки ожогов. В качестве рвотного средства для приёма внутрь при некоторых отравлениях используют разбавленный раствор.
Фармакологическое действие
Антисептическое средство. При соприкосновении с органическими веществами выделяет атомарный кислород. Образующийся при восстановлении препарата оксид образует с белками комплексные соединения — альбуминаты (за счет этого калия перманганат в малых концентрациях оказывает вяжущее, а в концентрированных растворах — раздражающее, прижигающее и дубящее действие). Обладает также дезодорирующим эффектом. Эффективен при лечении ожогов и язв. Способность калия перманганата обезвреживать некоторые яды лежит в основе использования его растворов для промывания желудка при отравлениях неизвестным ядом и пищевых токсикоинфекциях. При попадании внутрь всасывается, оказывая действие (приводит к развитию метгемоглобинемии).
Показания
Смазывание язвенных и ожоговых поверхностей — инфицированные раны, язвы и ожоги кожи. Полоскание полости рта и ротоглотки — при инфекционно-воспалительных заболеваниях слизистой оболочки полости рта и ротоглотки (в том числе при ангинах). Для промывания и спринцеваний при гинекологических и урологических заболеваниях — кольпиты и уретриты. Для промываний — желудка при отравлениях, вызванных приемом внутрь алкалоидов (морфин, аконитин, никотин), синильной кислотой, фосфором, хинином; кожи — при попадании на нее анилина; глаз — при поражении их ядовитыми насекомыми.
Противопоказания
Побочные действия
Способ применения и дозы
Наружно, в водных растворах для промывания ран (0.1-0.5 %), для полоскания рта и горла (0.01-0.1 %), для смазывания язвенных и ожоговых поверхностей (2-5 %), для спринцевания (0.02-0.1 %) в гинекологической и урологической практике, а также промывания желудка при отравлениях.
Взаимодействие
Другие сферы применения
Получение
Химическое или электрохимическое окисление соединений марганца, диспропорционирование манганата калия. Например:



Последняя реакция происходит при электролизе концентрированного раствора манганата калия и эндотермична, она является основным промышленным способом получения перманганата калия.
Галерея
М. Пресняков,
Кристаллы марганцовокислого калия.
2010.
Порошок перманганата калия
(под микроскопом)