Как называется модель атома предложенная резерфордом
Планетарная модель атома.
Планетарная модель атома, или модель Резерфорда — это историческая модель строения атома, предложенная Эрнестом Резерфордом как результат эксперимента с рассеиванием альфа-частиц.
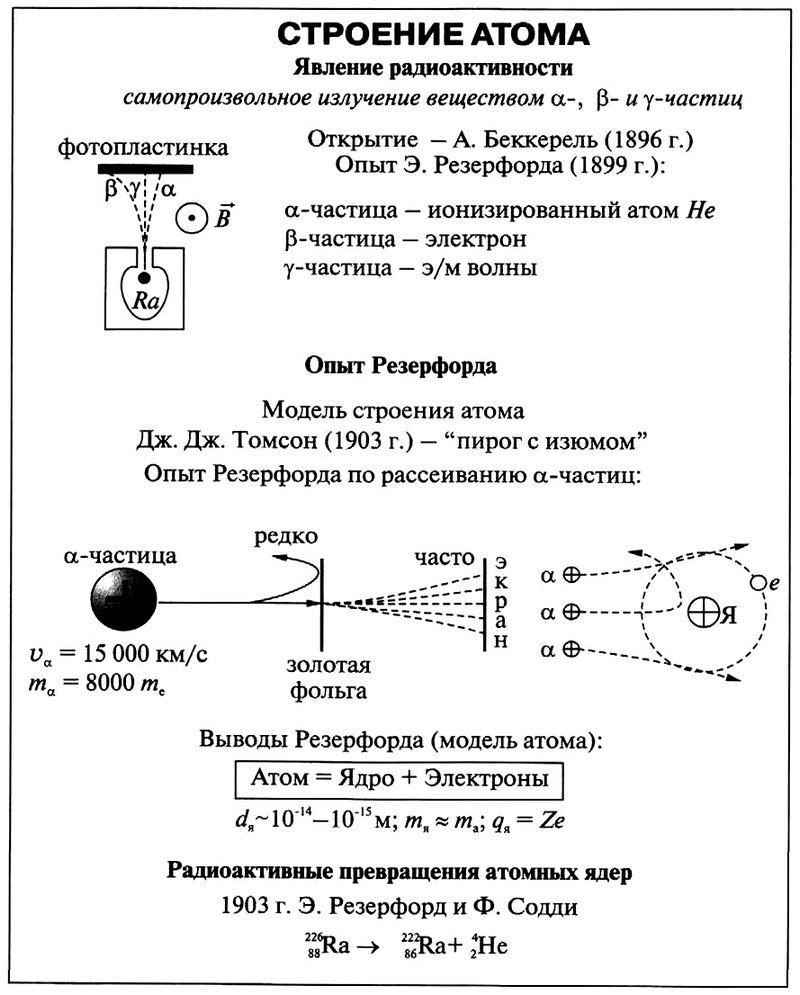
Для вычисления распределения «+» заряда в атоме, английский ученый Э. Резерфорд провел исследование рассеяния α-частиц фольгой из разных веществ. Большинство α-частиц беспрепятственно, практически не отклоняясь, проходило сквозь фольгу, и лишь 1 из 2000 частиц отклонялась на углы, большие 90°. Результатом этих экспериментов в 1911 г. стало предложение Резерфордом следующей модели строения атома.
Атом состоит из положительно заряженного ядра, вокруг него обращаются электроны, каждый по своей орбите, как планеты Солнечной системы, обращающиеся вокруг Солнца. Именно поэтому модель назвали планетарной.
Положительный заряд ядра qядра связан с числом электронов Z в атоме при помощи соотношения:

Заряд ядра и число электронов в атоме, соответственно, совпадает с порядковым номером элемента в таблице Д. И. Менделеева.
В целом атом является электронейтральным. Электрон, отрываясь или присоединяясь к атому (как результат столкновения, например, либо при разных химических процессах) может образовывать положительно либо отрицательно заряженные ионы.
Простая и наглядная модель атома Резерфорда отлично объясняла результаты этих опытов. Но основываясь на этой модели строения атома нельзя объяснить факт существования атома и его устойчивость.
Это несоответствие опыта выводам теории связано с попыткой применения законов классической физики к внутриатомным явлениям (которые, как выяснилось, подчиняются законам квантовой механики).
Выход из образовавшейся в теории атома ситуации нашел датский физик Нильсом Бором.
Планетарная модель атома Резерфорда
«Каждый, кто надеется, что преобразования атомных ядер станут источником энергии, исповедует вздор.»
Эрнест Резерфорд
Модель Томсона была первым пробным шагом в познании микромира. Однако она не отвечала на многие вопросы. Требовался новый нестандартный взгляд для создания модели, способной разрешить возникшие противоречия.
Модель атома, предложенная Томсоном, давала только общее представление о строении атома и не согласовывалась со все новыми данными экспериментов и теоретических вычислений. Настало время создания другой модели, способной согласовать теорию и эксперимент.
Этого не может быть. Или факты — упрямая вещь
К 1904 году японский физик Хантаро Нагаока разработал раннюю «планетарную модель» атома — так называемый «атом типа Сатурна». Модель была разработана по аналогии с расчетами устойчивости колец Сатурна. И хотя впоследствии модель и оказалась ошибочной, два следствия из нее все-таки оказались пророческими:
Годом раньше немецкий физик Филипп фон Ленард попытался создать модель, которая не предполагала раздельное существование в атоме противоположных зарядов. Атом, согласно модели Ленарда, состоит из нейтральных частиц — динамид, каждая из которых является электрическим дуплетом. Расчеты, выполненные Ленардом, показали, что эти частицы должны иметь очень маленькие размеры, то есть большая часть объема атома представляет собой пустоту.
В 1909 году Ганс Гейгер и Эрнест Марсден под руководством Эрнеста Резерфорда решили попытаться найти экспериментальное подтверждение модели Томсона и провели ставшие классическими опыты по рассеиванию альфа-частиц на тонкой золотой фольге. Альфа-частицы были выбраны благодаря своей большей массе (в 7350 раз больше массы электрона), поэтому они не должны претерпевать сколь-нибудь заметного отклонения при взаимодействии с электронами. Это позволяет исследовать только положительную составляющую атома. Источником альфа-частиц послужил радий. Частицы, проходящие через золотую фольгу, рассеивались, и это рассеяние регистрировалось по сцинтилляционным вспышкам на экране из сульфида цинка.
В начале эксперимента исследовались только малые углы отклонения альфа-частицы. И тут выяснилось, что подавляющее большинство частиц проходили сквозь фольгу, как раскаленная дробинка через кусок масла, словно мишень была прозрачна для бомбардирующих ее частиц. Наблюдалось лишь весьма незначительное отклонение порядка одного градуса.
Затем Резерфорд поручил молодому сотруднику Марсдену выяснить, могут ли частицы рассеиваться на большие углы. В частности, до 180°. И вот зимним днем 1909 года Марсден остановил на университетской лестнице Резерфорда и сказал: «Вы были правы, профессор: они возвращаются». Это было невероятно и противоречило существующей модели атома. Таким образом, вместо доказательства правоты Томсона эксперименты Резерфорда доказали ее несостоятельность.
Тот факт, что альфа-частицы возвращались, говорил о том, что они столкнулись с преградой — очень массивной положительно заряженной частицей, но эти столкновения происходили очень редко, в среднем — одно на восемь тысяч. А это уже свидетельство о том, что. Впрочем, именно над этим и задумался Резерфорд.
Альфа-частица (а-частица)— положительно заряженная частица, образованная двумя протонами и двумя нейтронами, по сути это ядро атома гелия. Поток альфа-частиц называют альфа-лучами, или альфа-излучением.
И все-таки он вертится!
И задумался он на целых два года. К 1911 году результатом его раздумий явилась новая модель строения атома. Однако обо всем по порядку.
Альфа-частицы, проходя через фольгу, проходят сквозь атомы золота в большинстве случаев без отклонений.
Из этого следуют два вывода. Первый: легкие электроны практически не влияют на движение тяжелой альфа-частицы. Вывод второй: так как альфа-частицы в большинстве случаев отклоняются на малые углы, атом в большей части своего объема пустой.
Небольшая часть альфа-частиц все же отклоняется на значительные углы. А значит, вывод третий такой: центральная часть атома очень маленьких размеров, но в ней сосредоточена почти вся масса атома, и эта центральная часть имеет положительный заряд. Она и получила название ядра атома.
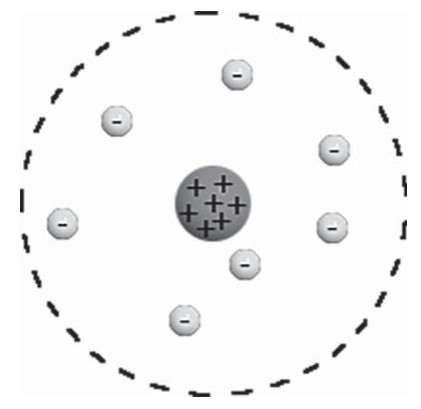
Согласно Резерфорду, атом состоит из массивного положительного ядра и вращающихся по определенным орбитам вокруг него электронов, что само по себе напомнило Солнечную систему, поэтому модель и получила название планетарной.
Если представить атом в виде сферы диаметром один километр — его ядро будет размером с мелкую монету.
Однако и эта модель атома оказалась в противоречии с классической физикой. Согласно теории Максвелла, любой ускоренно движущийся заряд должен непрерывно излучать электромагнитные волны. Поскольку электроны, вращаясь вокруг ядра, движутся с центростремительным ускорением, они должны непрерывно излучать электромагнитные волны. На самом же деле в нормальном состоянии атомы не излучают!
Таким образом, эти факты были несовместимы с планетарной моделью атома Резерфорда, если рассматривать ее с позиции классической электродинамики.
Разрешения этих противоречий были еще впереди. Пока же количество вопросов значительно превышало число удобоваримых объяснений. Тем не менее, это был значительный шаг на пути понимания устройства мира. Добавим лишь, что рассеяние микрочастиц на других частицах или атомных ядрах — это квантовый процесс, а для его описания необходимо уравнение Шредингера, которого в 1911 году еще попросту не было.
Строение атома
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: планетарная модель атома.
Атомы каждого химического элемента имеют строго индивидуальный линейчатый спектр, присущий только данному элементу и не меняющийся от опыта к опыту. Как это можно объяснить? Как вывести формулу, дающую весь набор частот атомного спектра? Чтобы сделать это, нужно узнать, как устроен атом.
Модель Томсона
Первую модель строения атома придумал английский физик Джозеф Джон Томсон (удостоенный Нобелевской премии за открытие электрона). В конечном счёте она оказалась неверной, но сыграла важную роль, будучи стимулом последующих экспериментальных исследований Резерфорда. Физики называли модель Томсона «пудинг с изюмом».
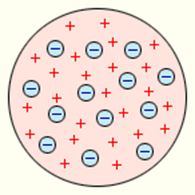
Согласно Томсону атом представляет собой шар размером порядка см. По этому шару некоторым образом распределён положительный заряд, а внутри шара, подобно изюминкам, находятся электроны (рис. 1 ).
Рис. 1. Модель атома Томсона
Суммарный заряд электронов в точности равен положительному заряду шара, поэтому атом в целом электрически нейтрален.
Излучение атомов объясняется колебаниями электронов около положений равновесия (как вы помните, любой ускоренно движущийся заряд излучает электромагнитные волны). Однако вся совокупность экспериментальных данных по атомным спектрам не укладывалась в модель Томсона. Например, для некоторых химических элементов были подобраны формулы, хорошо описывающие их спектры, но эти формулы из модели Томсона никак не следовали.
Опыты Резерфорда
Но в те времена об атомных ядрах ещё ничего не знали — о них Резерфорду лишь предстояло догадаться, глядя на результаты своих знаменитых опытов!
Планетарная модель атома
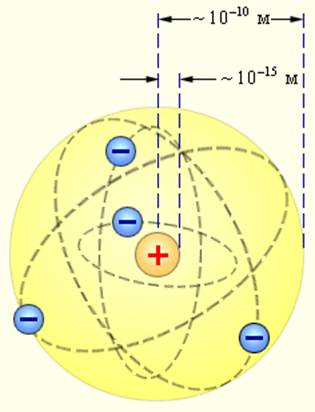
Эта величина на пять порядков (в сто тысяч раз!) меньше размера атома. Так на смену модели Томсона пришла планетарная модель атома (рис. 3 ).
Рис. 3. Планетарная модель атома
В центре атома находится крошечное положительно заряженное ядро, вокруг которого, словно планеты вокруг Солнца, движутся электроны. Между ядром и электронами действуют силы кулоновского притяжения, но упасть на ядро электроны не могут за счёт своего движения — точно так же, как и планеты не падают на Солнце, хоть и притягиваются к нему.
Заряд ядра по модулю равен суммарному заряду электронов, так что атом в целом электрически нейтрален. Однако электроны могут быть выбиты из своих орбит и покинуть атом — тогда атом превращается в положительно заряженный ион.
Масса электронов составляет очень малую часть общей массы атома. Например, в атоме водорода всего один электрон, и его масса в раз меньше массы ядра. Следовательно, почти вся масса атома сосредоточена в ядре — и это при том, что ядро в сто тысяч раз меньше самого атома.
Чтобы лучше почувствовать соотношение масштабов атома и ядра, представьте себе, что атом стал размером с Останкинскую телебашню ( м). Тогда ядро окажется горошиной размером мм, лежащей у вас на ладони. И тем не менее, почти вся масса атома заключена в этой горошине!
Как называется модель атома предложенная резерфордом
Раздел ОГЭ по физике: 4.2. Опыты Резерфорда по рассеянию альфа-частиц. Планетарная модель атома.
Первую модель строения атома предложил Джозеф Джон Томсон, после того как он открыл электрон — частицу с наименьшим электрическим зарядом. Он представлял атом в виде шара из положительно заряженного вещества, в который вкраплены электроны. При этом положительный заряд шара равен суммарному заряду электронов. Модель атома Томсона называют «пудингом с изюмом». Используя эту модель, можно было объяснить электрическую проводимость веществ, явление электризации тел и др.
Проводя опыты по изучению строения вещества, Резерфорд показал несостоятельность модели Томсона. Резерфорд облучал тонкую металлическую фольгу α-частицами, имеющими большую энергию. В соответствии с моделью Томсона а-частицы должны были отражаться от атома. Однако очень небольшое число частиц рассеивалось на углы от 90° до 180°. Большинство частиц проходило через фольгу, отклоняясь от направления движения на незначительные углы.
В результате экспериментов Резерфорд предложил новую модель строения атома, названную планетарной моделью. Он сделал следующие выводы:
Таким образом, в соответствии с моделью атома Резерфорда в центре атома расположено положительное ядро, вокруг которого движутся отрицательно заряженные электроны. Поскольку масса электронов мала, то масса атома в основном сосредоточена в ядре.
Так как атом в целом нейтрален, то положительный заряд ядра должен быть равен суммарному заряду электронов. Число электронов в нейтральном атоме равно порядковому номеру Z элемента в периодической системе Д.И. Менделеева. Заряд атомного ядра qR равен произведению Z и заряда электрона е: qR= Z • е.
Конспект урока «Опыты Резерфорда. Планетарная модель атома».
Первая попытка создания модели атома на основе накопленных экспериментальных данных (1903 г.) принадлежит Дж. Томсону. Он считал, что атом представляет собой электронейтральную систему шарообразной формы радиусом, примерно равным 10 –10 м. Положительный заряд атома равномерно распределен по всему объему шара, а отрицательно заряженные электроны находятся внутри него (рис. 6.1.1). Для объяснения линейчатых спектров испускания атомов Томсон пытался определить расположение электронов в атоме и рассчитать частоты их колебаний около положений равновесия. Однако эти попытки не увенчались успехом. Через несколько лет в опытах великого английского физика Э. Резерфорда было доказано, что модель Томсона неверна.
Модель атома Дж. Томсона
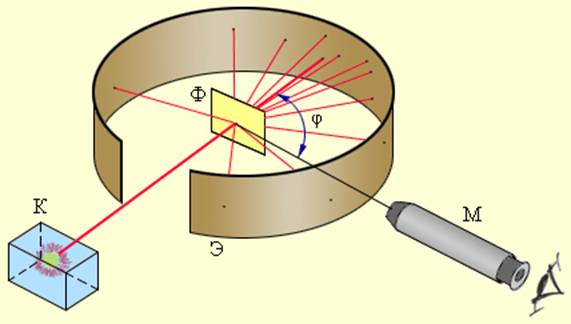
Первые прямые эксперименты по исследованию внутренней структуры атомов были выполнены Резерфордом и его сотрудниками Э. Марсденом и Хансом Гейгером в 1909–1911 годах. Резерфорд предложил применить зондирование атома с помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал α-частицы с кинетической энергией около 5 МэВ (скорость таких частиц очень велика – порядка 10 7 м/с, но все же значительно меньше скорости света). α-частицы – это полностью ионизированные атомы гелия. Они были открыты Резерфордом в 1899 году при изучении явления радиоактивности. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома. Схема опыта Резерфорда представлена на рис. 6.1.2.
Схема опыта Резерфорда по рассеянию α-частиц. K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп
От радиоактивного источника, заключенного в свинцовый контейнер, α-частицы направлялись на тонкую металлическую фольгу. Рассеянные частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом с помощью микроскопа. Наблюдения рассеянных α-частиц в опыте Резерфорда можно было проводить под различными углами φ к первоначальному направлению пучка. Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
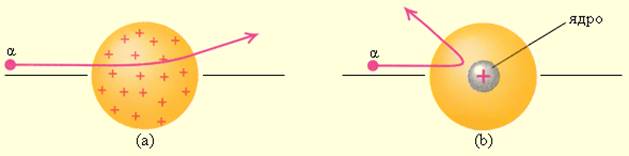
Этот результат был совершенно неожиданным даже для Резерфорда. Его представления находились в резком противоречии с моделью атома Томсона, согласно которой положительный заряд распределен по всему объему атома. При таком распределении положительный заряд не может создать сильное электрическое поле, способное отбросить α-частицы назад. Электрическое поле однородного заряженного шара максимально на его поверхности и убывает до нуля по мере приближения к центру шара. Если бы радиус шара, в котором сосредоточен весь положительный заряд атома, уменьшился в n раз, то максимальная сила отталкивания, действующая на α-частицу, по закону Кулона возросла бы в n 2 раз. Следовательно, при достаточно большом значении n α-частицы могли бы испытать рассеяние на большие углы вплоть до 180°. Эти соображения привели Резерфорда к выводу, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объеме. Эту часть атома Резерфорд назвал атомным ядром. Так возникла ядерная модель атома. Рис. 6.1.3 иллюстрирует рассеяние α-частицы в атоме Томсона и в атоме Резерфорда.
Рассеяние α-частицы в атоме Томсона (a) и в атоме Резерфорда (b)
Радикальные выводы о строении атома, следовавшие из опытов Резерфорда, заставляли многих ученых сомневаться в их справедливости. Не был исключением и сам Резерфорд, опубликовавший результаты своих исследований только в 1911 г. через два года после выполнения первых экспериментов. Опираясь на классические представления о движении микрочастиц, Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, под действием кулоновских сил со стороны ядра вращаются электроны (рис. 6.1.4). Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро.
Планетарная модель атома Резерфорда. Показаны круговые орбиты четырех электронов
Планетарная модель атома, предложенная Резерфордом, несомненно явилась крупным шагом вперед в развитии знаний о строении атома. Она была совершенно необходимой для объяснения опытов по рассеянию α-частиц, однако оказалась неспособной объяснить сам факт длительного существования атома, т. е. его устойчивость. По законам классической электродинамики, движущийся с ускорением заряд должен излучать электромагнитные волны, уносящие энергию. За короткое время (порядка 10 –8 с) все электроны в атоме Резерфорда должны растратить всю свою энергию и упасть на ядро. То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам.