Как называется наука о ферментах
Параграф 8. ферменты. медицинская энзимология
Автор текста – Анисимова Елена Сергеевна.
Авторские права защищены. Продавать текст нельзя.
Курсив не зубрить.
Замечания можно присылать по почте: exam_bch@mail.ru
https://vk.com/bch_5
Параграф № 8:
«Медицинская энзимология».
(Таблицы в отдельном файле.)
Наука о ферментах называется энзимологией (энзим – это фермент). Медицинские аспекты ферментов изучает раздел, который называется клинической энзимологией (медицинской). Задачи этого раздела такие же, как у медицинской науки в целом, то есть 1) изучение патогенеза (см. энзимопатии), 2) диагностика (энзимодиагностика) и 3) само лечение (энзимотерапия).
Патия – это болезнь (патология). Энзимопатия (ЭП) – это болезнь, причиной которой является неправильная работа фермента (нарушение функции фермента), то есть недостаточная или избыточная активность фермента. Многие заболевания являются именно энзимопатиями (примеры далее). Энзимопатии – частный случай протеинопатий (заболеваний, обусловленных нарушением функции белка). Почему неправильное функционирование фермента приводит к патологии? Потому что при изменении активности фермента изменяется скорость его реакции и вследствие этого изменяются концентрации субстратов и продуктов реакции (то есть химический состав клетки или внеклеточной среды, в т. ч. крови). При повышенной активности фермента реакция ускоряется, ускоряется снижение [субстрата] и увеличение [продукта]. И, наоборот, при пониженной активности фермента реакция замедляется, что приводит к накоплению субстрата и дефициту продукта. Избыток и дефицит веществ в организме может быть опасным для жизни. (Примеры веществ, накопление которых опасно и которые должны вступить в реакции, чтобы превратиться в менее ядовитые вещества: аммиак, билирубин. Примеры веществ, дефицит которых опасен и которые должны постоянно вырабатываться при реакциях: АТФ, глюкоза).
П Р И Ч И Н О Й энзимопатии может быть дефект гена (мутация) – такие ЭП называют первичными или наследственными (потому что гены передаются по наследству от родителей к детям). Если причиной ЭП является не дефект гена, а что-то другое (дефицит кофакторов в пище), то ЭП называется вторичной или приобретенной.
Причиной может быть: 1) генетическая особенность (первичная ЭП), 2) избыток субстрата (например, избыток пуринов в пище способствует работе фермента КсО и приводит к подагре), 3) утечка активного фермента из поврежденных клеток (см. панкреатит). Последствия: ускорение реакции и вследствие этого дефицит субстратов и накопление продуктов. Примеры: активность фермента трипсина в крови приводит к избытку брадикинина и поэтому к коллапсу при панкреатите, повышенная активность фермента ксантин/оксидазы приводит к избыточному образованию мочевой кислоты и вследствие этого способствует подагре (в том числе риску для почек), повышенная активность моноамин/оксидазы (МАО) способствует возникновению дефицита гормонов счастья (серотонина и дофамина, норадреналина) и вследствие этого – тяжелым эндогенным депрессиям.
Л Е Ч Е Н И Е: Повышенная активность ферментов корректируется снижением их активности ингибиторами, то есть принцип действия лекарств при лечении заболеваний, обусловленных повышенной активностью ферментов – ингибирование этих ферментов. Ингибирование МАО применяется при лечении некоторых депрессий, ингибирование КсО – при лечении подагры (особенно при почечной недостаточности), ингибиторы трипсина – при лечении панкреатита.
Энзимопатии, обусловленные П О Н И Ж Е Н Н О Й активностью ферментов.
Причины: 1) дефект гена (муьация), кодирующего фермент (первичная ЭП), 2) дефицит в пище веществ, из которых образуются кофакторы фермента (витаминов или микроэлементов), 3) недостаточная функция органа, который должен вырабатывать фермент. Последствия: снижение скорости реакции и вследствие этого накопление субстратов и дефицит продуктов. Лечение. 1). Если активность фермента снижена из-за дефицита кофакторов, то нужно ввести в организм кофакторы (нормализовать питание, добавив в него недостающие витамины или микроэлементы; или вводить вещества путем инъекций – это практикуется при патологии ЖКТ, при которой вещества не всасываются). 2). Если в организме не хватает ППЦ ферментов, нужно введение ферментов (заместительная терапия). Но введение ферментов возможно в ЖКТ (пищеварительные ферменты при их недостаточности из-за патологии ЖКТ, перорально), в кровь (тканевой активатор плазмина для «разжижения» крови при повышенной вязкости, свертываемости, тромбозах); можно применить ферменты наружно (заживлению раны способствует ее очищение от гноя с помощью нанесения средств, содержащих пептидазы – ферменты, расщепляющие белки). Восполнение дефицита внутриклеточных ферментов проблематично, так как ферменты не поступают из крови в клетки, не проходят через клеточные мембраны. То есть заместительная терапия ферментами в этом случае невозможна. Нужно сделать так, чтобы фермент вырабатывался внутри клетки. Для этого клетке нужен нормальный ген данного фермента. Введение в клетки нормальных генов с целью лечения первичных протеинопатий называется генотерапией. Генотерапия позволила бы лечить успешно, но пока применяется очень ограниченно, технологии только разрабатываются. Пример применения генотерапии – это терапия синдрома врожденного комбинированного иммунодефицита (СВИДа), причиной которого является мутация гена, кодирующего аденозин/дезаминазу.
В некоторых случаях можно смягчить симптомы энзимопатии: проблему дефицита продукта позволяет решить введение продуктов (заместительная терапия), а проблему с избытком субстрата позволяет решить снижение поступления субстратов.
Пример. «Фенил/кетонурия» (фенил/пировиноградная олигофрения = ФПО) развивается при сниженной активности фермента фенилаланин/гидроксилазы (чаще всего из-за мутации гена, но иногда из-за дефицита кофактора тетра/гидро/биоптерина) и сниженной вследствие этого скорости превращения фенилаланина в тирозин. Фенилаланин накапливается, что приводит к повреждению нейронов и развитию слабоумия (олигофрении). Предотвратить развитие ФПО можно, выявив ФПО у новорожденного и переведя его на пищу с минимальным содержанием фенил/аланина (минимум оставляется для синтеза белков: ребенку нужно расти). То есть при лечении ФПО применяется ограничение субстрата.
Другие примеры. При недостаточной активности ферментов синтеза мочевины снижается скорость превращения аммиака в мочевину. Это приводит к накоплению аммиака и угрозе для жизни. Поскольку аммиак в организме образуется в основном в результате катаболизма (распада) белка, то в этой ситуации возникает отвращение к белковой пище. Ограничение поступления белковой пищи позволяет улучшить самочувствие, но только при «мягких» формах заболевания, т.к. при полном отсутствии активности ферментов синтеза мочевины ребенок умирает вскоре после рождения.
ЭП с п о н и ж е н н о й активностью ферментов.
Курсив – на экзамен на «4 и 5».
ФСК – Фактор Свертывания Крови,
СВИД – Синдром Врожденного ИммуноДефицита,
СНПВ – синдром нарушенного переваривания и всасывания)
**
Э н з и м о д и а г н о с т и к а
– это применение ферментов для диагностики. Чаще всего определяется активность ферментов в сыворотке. (Определяется по скорости катализируемой ферментом реакции, а скорость реакции – по уменьшению количества субстрата или по увеличению количества продукта). Увеличение в сыворотке активности внутриклеточного фермента является признаком повреждения клетки (потому что наличие внутриклеточного фермента в сыворотке является результатом его «утечки» из поврежденной клетки). Чтобы узнать, какая именно ткань, орган или клетки повреждены, нужно определять активность того фермента, который есть только в клетках данной ткани (то есть ткане/специфичный фермент). Пример такого фермента – ЛДГ 1, который есть в миокарде. Часто для диагностики нужно определять активность не одного, а двух ферментов; или повышенная активность одного фермента может быть результатом повреждения двух разных органов. Например, на панкреатит указывает не амилаза, а сочетание амилазы и липазы в крови или амилазы в крови и в моче. А сама по себе повышенная активность в крови амилазы может быть результатом как панкреатита, так и паротита (воспаления слюнных желез).
Активность ферментов определяется с целью диагностики не только в крови, но и в моче: например, активность амилазы в моче указывает на панкреатит (если в моче нет других белков – это указывало бы на нарушение функции почек: вспомните «белок в моче»).
Кроме определения активности ферментов в биологических жидкостях при диагностике ферменты используют для ускорения реакций: например, фермент глюкозо/оксидаза используется для определения концентрации глюкозы.
Э н з и м о т е р а п и я.
Это применение ферментов или их ингибиторов в терапии заболеваний. И вообще применений в терапии знаний о ферментах.
Примеры энзимотерапии приводились выше.
Ферменты
Ферментативная активность может регулироваться активаторами и ингибиторами (активаторы — повышают, ингибиторы — понижают).
Белковые ферменты синтезируются на рибосомах, а РНК — в ядре.
Термины «фермент» и «энзим» давно используют как синонимы (первый в основном в русской и немецкой научной литературе, второй — в англо- и франкоязычной).
Наука о ферментах называется энзимологией, а не ферментологией (чтобы не смешивать корни слов латинского и греческого языков).
Содержание
История изучения
Термин фермент предложен в XVII веке химиком ван Гельмонтом при обсуждении механизмов пищеварения.
В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришёл к выводу, что этот процесс (брожение) катализируется некой жизненной силой, находящейся в дрожжевых клетках.
Более ста лет назад термины фермент и энзим отражали различные точки зрения в теоретическом споре Л. Пастера с одной стороны, и М. Бертло и Ю. Либиха — с другой, о природе спиртового брожения. Собственно ферментами (от лат. fermentum — закваска) называли «организованные ферменты» (то есть сами живые микроорганизмы), а термин энзим (от греч. ἐν- — в- и ζύμη — дрожжи, закваска) предложен в 1876 году В. Кюне для «неорганизованных ферментов», секретируемых клетками, например, в желудок (пепсин) или кишечник (трипсин, амилаза). Через два года после смерти Л. Пастера в 1897 году Э. Бухнер опубликовал работу «Спиртовое брожение без дрожжевых клеток», в которой экспериментально показал, что бесклеточный дрожжевой сок осуществляет спиртовое брожение так же, как и неразрушенные дрожжевые клетки. В 1907 году за эту работу он был удостоен Нобелевской премии. Впервые высокоочищенный кристаллический фермент (уреаза) был выделен в 1926 году Дж. Самнером. В течение последующих 10 лет было выделено ещё несколько ферментов, и белковая природа ферментов была окончательно доказана.
Каталитическая активность РНК впервые была обнаружена в 1980-е годы у пре-рРНК Томасом Чеком, изучавшим сплайсинг РНК у инфузории Tetrahymena thermophila. Рибозимом оказался участок молекулы пре-рРНК Tetrahymena, кодируемый интроном внехромосомного гена рДНК; этот участок осуществлял аутосплайсинг, то есть сам вырезал себя при созревании рРНК.
Функции ферментов
Подобно всем катализаторам, ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активации процесса. Химическое равновесие при этом не смещается ни в прямую, ни в обратную сторону. Отличительной особенностью ферментов по сравнению с небелковыми катализаторами является их высокая специфичность — константа связывания некоторых субстратов с белком может достигать 10 −10 моль/л и менее. Каждая молекула фермента способна выполнять от нескольких тысяч до нескольких миллионов «операций» в секунду.
Например, одна молекула фермента ренина, содержащегося в слизистой оболочке желудка телёнка, створаживает около 10 6 молекул казеиногена молока за 10 мин при температуре 37 °C.
При этом эффективность ферментов значительно выше эффективности небелковых катализаторов — ферменты ускоряют реакцию в миллионы и миллиарды раз, небелковые катализаторы — в сотни и тысячи раз. См. также Каталитически совершенный фермент
Классификация ферментов
По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов (КФ, EC — Enzyme Comission code). Классификация была предложена Международным союзом биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом:
Будучи катализаторами, ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям.
Соглашения о наименовании ферментов
Обычно ферменты именуют по типу катализируемой реакции, добавляя суффикс -аза к названию субстрата (например, лактаза — фермент, участвующий в превращении лактозы). Таким образом, у различных ферментов, выполняющих одну функцию, будет одинаковое название. Такие ферменты различают по другим свойствам, например, по оптимальному pH (щелочная фосфатаза) или локализации в клетке (мембранная АТФаза).
Кинетические исследования
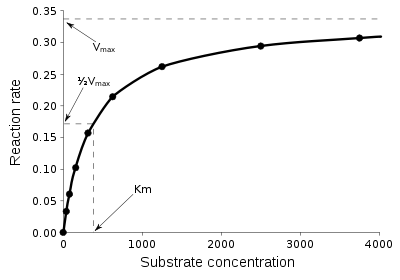
Простейшим описанием кинетики [ru] односубстратных ферментативных реакций является уравнение Михаэлиса — Ментен (см. рис.). На сегодняшний момент описано несколько механизмов действия ферментов. Например, действие многих ферментов описывается схемой механизма «пинг-понг».
Структура и механизм действия ферментов
Как и все белки, ферменты синтезируются в виде линейной цепочки аминокислот, которая сворачивается определённым образом. Каждая последовательность аминокислот сворачивается особым образом, и получающаяся молекула (белковая глобула) обладает уникальными свойствами. Несколько белковых цепей могут объединяться в белковый комплекс. Третичная структура белков разрушается при нагревании или воздействии некоторых химических веществ.
Активный центр ферментов
В активном центре условно выделяют [8] :
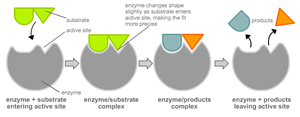
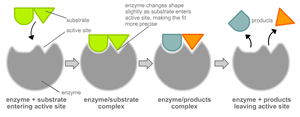
Чтобы катализировать реакцию, фермент должен связаться с одним или несколькими субстратами. Белковая цепь фермента сворачивается таким образом, что на поверхности глобулы образуется щель, или впадина, где связываются субстраты. Эта область называется сайтом связывания субстрата. Обычно он совпадает с активным центром фермента или находится вблизи него. Некоторые ферменты содержат также сайты связывания кофакторов или ионов металлов.
Фермент, соединяясь с субстратом:
Обычно присоединение фермента к субстрату происходит за счет ионных или водородных связей, редко — за счет ковалентных. В конце реакции её продукт (или продукты) отделяются от фермента.
В результате фермент снижает энергию активации реакции. Это происходит потому, что в присутствии фермента реакция идет по другому пути (фактически происходит другая реакция), например:
В отсутствие фермента:
В присутствии фермента:
где А, В — субстраты, АВ — продукт реакции, Ф — фермент.
Ферменты не могут самостоятельно обеспечивать энергией эндергонические реакции (для протекания которых требуется энергия). Поэтому ферменты, осуществляющие такие реакции, сопрягают их с экзергоническими реакциями, идущими с выделением большего количества энергии. Например, реакции синтеза биополимеров часто сопрягаются с реакцией гидролиза АТФ.
Для активных центров некоторых ферментов характерно явление кооперативности.
Специфичность
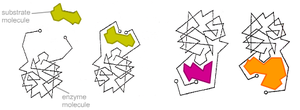
Ферменты обычно проявляют высокую специфичность по отношению к своим субстратам (субстратная специфичность). Это достигается частичной комплементарностью формы, распределения зарядов и гидрофобных областей на молекуле субстрата и в центре связывания субстрата на ферменте. Ферменты обычно демонстрируют также высокий уровень стереоспецифичности (образуют в качестве продукта только один из возможных стереоизомеров или используют в качестве субстрата только один стереоизомер), региоселективности (образуют или разрывают химическую связь только в одном из возможных положений субстрата) и хемоселективности (катализируют только одну химическую реакцию из нескольких возможных для данных условий). Несмотря на общий высокий уровень специфичности, степень субстратной и реакционной специфичности ферментов может быть различной. Например, эндопептидаза трипсин разрывает пептидную связь только после аргинина или лизина, если за ними не следует пролин, а пепсин гораздо менее специфичен и может разрывать пептидную связь, следующую за многими аминокислотами.
Модель «ключ-замок»
Модель индуцированного соответствия
Модификации
Многие ферменты после синтеза белковой цепи претерпевают модификации, без которых фермент не проявляет свою активность в полной мере. Такие модификации называются посттрансляционными модификациями (процессингом). Один из самых распространенных типов модификации — присоединение химических групп к боковым остаткам полипептидной цепи. Например, присоединение остатка фосфорной кислоты называется фосфорилированием, оно катализируется ферментом киназой. Многие ферменты эукариот гликозилированы, то есть модифицированы олигомерами углеводной природы.
Ещё один распространенный тип посттранляционных модификаций — расщепление полипептидной цепи. Например, химотрипсин (протеаза, участвующая в пищеварении), получается при выщеплении полипептидного участка из химотрипсиногена. Химотрипсиноген является неактивным предшественником химотрипсина и синтезируется в поджелудочной железе. Неактивная форма транспортируется в желудок, где превращается в химотрипсин. Такой механизм необходим для того, чтобы избежать расщепления поджелудочной железы и других тканей до поступления фермента в желудок. Неактивный предшественник фермента называют также «зимогеном».
Кофакторы ферментов
Некоторые ферменты выполняют каталитическую функцию сами по себе, безо всяких дополнительных компонентов. Однако есть ферменты, которым для осуществления катализа необходимы компоненты небелковой природы. Кофакторы могут быть как неорганическими молекулами (ионы металлов, железо-серные кластеры и др.), так и органическими (например, флавин или гем). Органические кофакторы, прочно связанные с ферментом, называют также простетическими группами. Кофакторы органической природы, способные отделяться от фермента, называют коферментами.
Фермент, который требует наличия кофактора для проявления каталитической активности, но не связан с ним, называется апо-фермент. Апо-фермент в комплексе с кофактором носит название холо-фермента. Большинство кофакторов связано с ферментом нековалентными, но довольно прочными взаимодействиями. Есть и такие простетические группы, которые связаны с ферментом ковалентно, например, тиаминпирофосфат в пируватдегидрогеназе.
Регуляция работы ферментов
У некоторых ферментов есть сайты связывания малых молекул, они могут быть субстратами или продуктами метаболического пути, в который входит фермент. Они уменьшают или увеличивают активность фермента, что создает возможность для обратной связи.
Ингибирование конечным продуктом
Метаболический путь — цепочка последовательных ферментативных реакций. Часто конечный продукт метаболического пути является ингибитором фермента, ускоряющего первую из реакций данного метаболического пути. Если конечного продукта слишком много, то он действует как ингибитор для самого первого фермента, а если после этого конечного продукта стало слишком мало, то первый фермент опять активируется. Таким образом, ингибирование конечным продуктом по принципу отрицательной обратной связи — важный способ поддержания гомеостаза (относительного постоянства условий внутренней среды организма).
Влияние условий среды на активность ферментов
Активность ферментов зависит от условий в клетке или организме — давления, кислотности среды, температуры, концентрации растворённых солей (ионной силы раствора) и др.
Множественные формы ферментов
Множественные формы ферментов можно разделить на две категории:
Изоферменты — это ферменты, синтез которых кодируется разными генами, у них разная первичная структура и разные свойства, но они катализируют одну и ту же реакцию. Виды изоферментов:
Собственно множественные формы (истинные) — это ферменты, синтез которых кодируется одним и тем же аллелем одного и того же гена, у них одинаковая первичная структура и свойства, но после синтеза на рибосомах они подвергаются модификации и становятся разными, хотя и катализируют одну и ту же реакцию.
Изоферменты разные на генетическом уровне и отличаются от первичной последовательности, а истинные множественные формы становятся разными на посттрансляционном уровне.
Медицинское значение
Связь между ферментами и наследственными болезнями обмена веществ была впервые установлена А. Гэрродом [ru] в 1910-е гг. Гэррод назвал заболевания, связанные с дефектами ферментов, «врожденными ошибками метаболизма».
Если происходит мутация в гене, кодирующем определенный фермент, может измениться аминокислотная последовательность фермента. При этом в результате большинства мутаций его каталитическая активность снижается или полностью пропадает. Если организм получает два таких мутантных гена (по одному от каждого из родителей), в организме перестает идти химическая реакция, которую катализирует данный фермент. Например, появление альбиносов связано с прекращением выработки фермента тирозиназы, отвечающего за одну из стадий синтеза темного пигмента меланина. Фенилкетонурия связана с пониженной или отсутствующей активностью фермента фенилаланин-4-гидроксилазы в печени.
В настоящее время известны сотни наследственных заболеваний, связанные с дефектами ферментов. Разработаны методы лечения и профилактики многих из таких болезней.
Практическое использование
Ферменты широко используются в народном хозяйстве — пищевой, текстильной промышленности, в фармакологии и медицине. Большинство лекарств влияют на течение ферментативных процессов в организме, запуская или приостанавливая те или иные реакции.
Ещё шире область использования ферментов в научных исследованиях и в медицине.
Энзимология
Термины «фермент» и «энзим» давно используют как синонимы (первый в основном в русской и немецкой научной литературе, второй — в англо- и франкоязычной).
Наука о ферментах называется энзимологией, а не ферментологией (чтобы не смешивать корни слов латинского и греческого языков).
Содержание
История изучения
Термин фермент предложен в XVII веке химиком ван Гельмонтом при обсуждении механизмов пищеварения.
В кон. ХVIII — нач. XIX вв. уже было известно, что мясо переваривается желудочным соком, а крахмал превращается в сахар под действием слюны. Однако механизм этих явлений был неизвестен [1]
В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришел к выводу, что этот процесс (брожение) катализируется некой жизненной силой, находящейся в дрожжевых клетках.
Более ста лет назад термины фермент и энзим отражали различные точки зрения в теоретическом споре Л. Пастера с одной стороны, и М. Бертло и Ю. Либиха — с другой, о природе спиртового брожения. Собственно ферментами (от лат. fermentum — закваска) называли «организованные ферменты» (то есть сами живые микроорганизмы), а термин энзим (от греч. ἐν- — в- и ζύμη — дрожжи, закваска) предложен в 1876 году В. Кюне для «неорганизованных ферментов», секретируемых клетками, например, в желудок (пепсин) или кишечник (трипсин, амилаза). Через два года после смерти Л. Пастера в 1897 году Э. Бюхнер опубликовал работу «Спиртовое брожение без дрожжевых клеток», в которой экспериментально показал, что бесклеточный дрожжевой сок осуществляет спиртовое брожение так же, как и неразрушенные дрожжевые клетки. В 1907 году за эту работу он был удостоен Нобелевской премии.
Функции ферментов
Подобно всем катализаторам, ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активации процесса. Химическое равновесие при этом не смещается ни в прямую, ни в обратную сторону. Отличительной особенностью ферментов по сравнению с небелковыми катализаторами является их высокая специфичность — константа связывания некоторых субстратов с белком может достигать 10 −10 моль/л и менее. См. также Каталитически совершенный фермент
Ферменты широко используются в народном хозяйстве — пищевой, текстильной промышленности, в фармакологии.
Классификация ферментов
По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов (КФ, EC — Enzyme Comission code). Классификация была предложена Международным союзом биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом:
Будучи катализаторами, ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям.
Соглашения о наименовании ферментов
Обычно ферменты именуют по типу катализируемой реакции, добавляя суффикс -аза к названию субстрата (например, лактаза — фермент, участвующий в превращении лактозы). Таким образом, у различных ферментов, выполняющих одну функцию, будет одинаковое название. Такие ферменты различают по другим свойствам, например, по оптимальному pH (щелочная фосфатаза) или локализации в клетке (мембранная АТФаза).
Кинетические исследования
Простейшим описанием кинетики односубстратных ферментативных реакций является уравнение Михаэлиса — Ментен (см. рис.). На сегодняшний момент описано несколько механизмов действия ферментов. Например, действие многих ферментов описывается схемой механизма «пинг-понг».
Структура и механизм действия ферментов
Как и все белки, ферменты синтезируются в виде линейной цепочки аминокислот, которая сворачивается определённым образом. Каждая последовательность аминокислот сворачивается особым образом, и получающаяся молекула (белковая глобула) обладает уникальными свойствами. Несколько белковых цепей могут объединяться в белковый комплекс. Третичная структура белков разрушается при нагревании или воздействии некоторых химических веществ.
Чтобы катализировать реакцию, фермент должен связаться с одним или несколькими субстратами. Белковая цепь фермента сворачивается таким образом, что на поверхности глобулы образуется щель, или впадина, где связываются субстраты. Эта область называется сайтом связывания субстрата. Обычно он совпадает с активным центром фермента или находится вблизи него. Некоторые ферменты содержат также сайты связывания кофакторов или ионов металлов.
У некоторых ферментов есть сайты связывания малых молекул, они могут быть субстратами или продуктами метаболического пути, в который входит фермент. Они уменьшают или увеличивают активность фермента, что создает возможность для обратной связи.
Для активных центров некоторых ферментов характерно явление кооперативности.
Специфичность
Ферменты обычно проявляют высокую специфичность по отношению к своим субстратам. Это достигается частичной комплементарностью формы, распределения зарядов и гидрофобных областей на молекуле субстрата и в центре связывания субстрата на ферменте. Ферменты демонстрируют высокий уровень стереоспецифичности, региоселективности и хемоселективности.
Модель «ключ-замок»
Модель индуцированного соответствия
Модификации
Многие ферменты после синтеза белковой цепи претерпевают модификации, без которых фермент не проявляет свою активность в полной мере. Такие модификации называются посттрансляционными модификациями (процессингом). Один из самых распространенных типов модификации — присоединение химических групп к боковым остаткам полипептидной цепи. Например, присоединение остатка фосфорной кислоты называется фосфорилированием, оно катализируется ферментом киназой. Многие ферменты эукариот гликозилированы, то есть модифицированы олигомерами углеводной природы.
Еще один распространенный тип посттранляционных модификаций — расщепление полипептидной цепи. Например, химотрипсин (протеаза, участвующая в пищеварении), получается при выщеплении полипептидного участка из химотрипсиногена. Химотрипсиноген является неактивным предшественником химотрипсина и синтезируется в поджелудочной железе. Неактивная форма транспортируется в желудок, где превращается в химотрипсин. Такой механизм необходим для того, чтобы избежать расщепления поджелудочной железы и других тканей до поступления фермента в желудок. Неактивный предшественник фермента называют также «зимогеном».
Кофакторы ферментов
Некоторые ферменты выполняют каталитическую функцию сами по себе, безо всяких дополнительных компонентов. Однако есть ферменты, которым для осуществления катализа необходимы компоненты небелковой природы. Кофакторы могут быть как неорганическими молекулами (ионы металлов, железо-серные кластеры и др.), так и органическими (например, флавин или гем). Органические кофакторы, прочно связанные с ферментом, называют также простетическими группами. Кофакторы органической природы, способные отделяться от фермента, называют коферментами.
Фермент, который требует наличия кофактора для проявления каталитической активности, но не связан с ним, называется апо-фермент. Апо-фермент в комплексе с кофактором носит название холо-фермента. Большинство кофакторов связано с ферментом нековалентными, но довольно прочными взаимодействиями. Есть и такие простетические группы, которые связаны с ферментом ковалентно, например, тиаминпирофосфат в пируватдегидрогеназе.