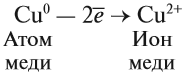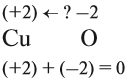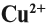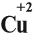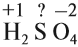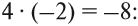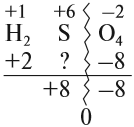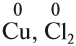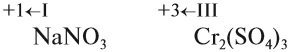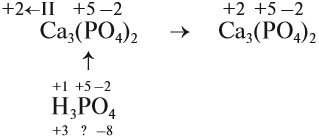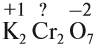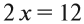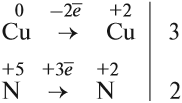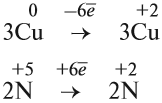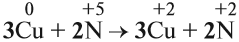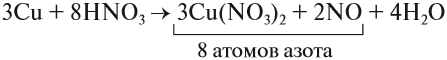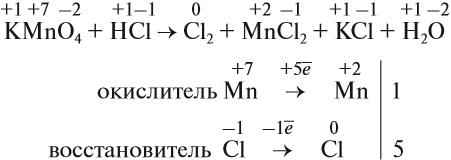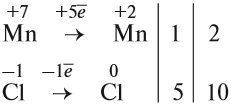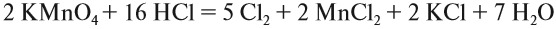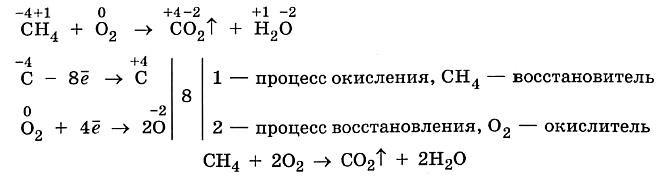Как называется процесс принятия электронов
Урок 7. Понятие об окислительно-восстановительных реакциях
При изучении строения атома, описании свойств некоторых элементов, химической связи неоднократно упоминалось о том, что атомы принимают или отдают электроны. Очевидно, существуют химические реакции, в ходе которых одни атомы отдают электроны другим атомам, которые их принимают.
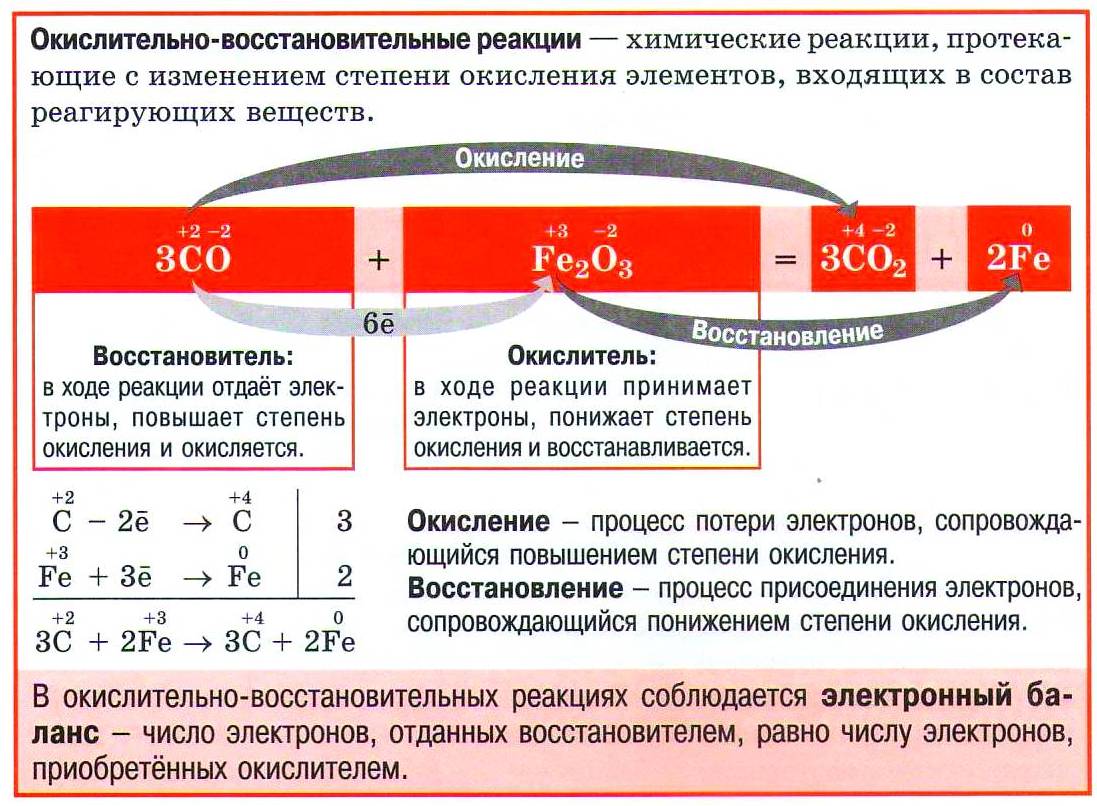
Процесс отдачи электронов называется окислением, а процесс приёма электронов — восстановлением. Оба процесса происходят одновременно, так как не могут отданные электроны исчезнуть в «никуда» — должна существовать частица, которая их присоединит, и наоборот. Поэтому процессы окисления и восстановления, протекающие одновременно, называются окислительно-восстановительными реакциями. При этом атом*, отдающий электроны, называется восстановителем, а атом, принимающий электроны, — окислителем.
* В окислительно-восстановительной реакции участвует реальная частица, входящая в понятие химического элемента, — атом, ион, радикал.
Что же происходит с такими атомами? Пусть атом меди в каком-то процессе отдаст два электрона:
Если эта реакция происходит в растворе, то можно увидеть, как жёлто-красный металл медь уменьшится в размерах, а раствор приобретает голубую окраску, характерную для ионов меди. Очевидно, что свойства исходного простого вещества, состоящего из атомов, и полученных ионов — различно.
Этот же процесс может происходить и при окислении меди кислородом:
Но ионов здесь не образуется, хотя признак реакции (изменение цвета) налицо. В таких случаях изменение состояния окисленности обозначают при помощи степени окисления. Так, атому кислорода, который для завершения внешнего энергетического (электронного) уровня должен присоединить 2 электрона, почти во всех соединениях приписывают степень окисления –2. Поскольку молекула СuО электронейтральна — атом меди приобретает степень окисления +2.
Заметьте: заряд иона записывается так:
сбоку, сначала число, потом заряд (причём цифра 1 не пишется). Степень окисления записывают по-другому:
над символом элемента, сначала заряд, потом число (причём не только пишется цифра 1, но может быть даже дробное число).
Этой формой записи подчеркивают различие этих понятий:
Величины этих зарядов могут совпадать, но очень часто они различаются. Рассчитаем, например, степени окисления элементов в химической формуле, соответствующей серной кислоте. При этом степень окисления кислорода равна –2, а водорода +1 (так как он может отдать только один электрон):
Суммарный заряд двух атомов водорода равен +2, а четырёх атомов кислорода:
Видно, что для того, чтобы молекула была электронейтральна, не хватает положительных зарядов, следовательно, степень окисления серы в серной кислоте равна +6. (Такого иона серы вообще не существует!)
При расчёте степеней окисления следует руководствоваться следующими правилами:
1. Степень окисления атомов химических элементов в простом веществе равна нулю:
2. Степени окисления атомов металлов в соединениях всегда положительны и равны их валентности:
4. Степень окисления химических элементов в кислотном остатке соли такие же, как в соответствующей кислоте:
5. Алгебраическая сумма степеней окисления в любом соединении равна нулю.
Задание 7.1. Расставьте степени окисления химических элементов в соединениях:
Если вы испытываете затруднения при расстановке степеней окисления, рекомендуется составлять простейшие математические уравнения.
Известные степени окисления
Суммарные степени окисления: +2 + 2х –14 = 0 (математическое уравнение, которое решается относительно «х»)
х = 6, т. е. степень окисления атома хрома в этом соединении равна +6.
Определив степени окисления элементов в уравнении реакции, можно определить, какой атом является окислителем, какой — восстановителем:
Задание 7.2. Определите окислитель и восстановитель в уравнениях реакций:
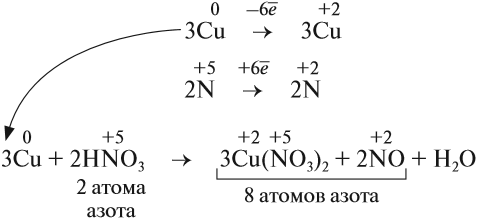
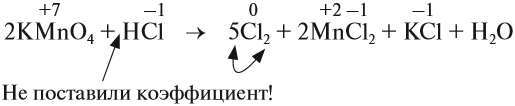
Из этих примеров видно, что число электронов, принятых окислителем, может отличаться от числа электронов, отданных восстановителем. Но этого быть не должно(!), так как при этом нарушается закон сохранения материи. Значит, число отданных электронов должно равняться числу принятых электронов. А для этого следует изменить число атомов окислителя и восстановителя, поставив соответствующие коэффициенты. Например, в данном случае:
Эти коэффициенты (3 и 2) означают, что три атома меди отдают шесть электронов, а два атома азота принимают шесть электронов:
Или в краткой форме:
Теперь осуществлён баланс (равенство) электронов, поэтому именно эти коэффициенты из электронного баланса (3 и 2) должны быть в уравнении реакции
Но теперь не осуществляется баланс по азоту! Где же допущена ошибка? Дело в том, что в электронном балансе учитываются только электронные процессы окисления и восстановления, т. е. учитываются только те атомы, которые меняют степени окисления, а часть атомов не изменила ее:
Отсюда правило: коэффициенты электронного баланса ставят только к тем атомам, которые с данной степенью окисления встречаются в химическом уравнении один раз.
Исправим ошибку и уравняем атомы остальных элементов:
Проверим по кислороду:
Правила расстановки коэффициентов методом электронного баланса
1. Расставить степени окисления.
2. Выписать элементы, изменившие степени окисления, указав число отданных и принятых электронов. Определить окислитель и восстановитель.
3. Поставить дополнительные коэффициенты, уравняв число отданных и принятых электронов.
4. Проверить эти коэффициенты: они должны соответствовать числу атомов данного элемента в молекуле. Например, если дополнительный коэффициент нечётный, а в молекуле чётное число атомов (например, Сl2), то оба дополнительных коэффициента удваиваются.
5. Проверенные коэффициенты переносят в уравнение, считая атомы, к тем элементам, которые с данной степенью окисления встречаются в уравнении ОДИН раз.
6. Затем уравнивают атомы:
7. Проверяют по кислороду.
Рассмотрим эти правила на примере. Требуется уравнять (т. е. расставить коэффициенты в уравнении реакции):
1, 2, 3.
4. Поскольку число атомов хлора в молекуле чётное (2), а коэффициент к хлору нечётный (5), удвоим оба дополнительных коэффициента:
Обратите внимание, что перед молекулой хлора поставлен коэффициент 5, а не 10, так как нужно считать атомы хлора: 5 · 2 = 10 атомов.
6. Уравняем остальные атомы:
7. Атомы кислорода до и после реакции пересчитайте сами.
Задание 7.3. Уравнять методом электронного баланса:
Вы можете проверить степень усвоения материала этой главы, выполнив упражнения ЕГЭ из разделов 4, 28 и частично 36.
Выводы
Окислительно-восстановительные реакции (ОВР) — это процессы, в которых изменяются степени окисления атомов. Степени окисления атомов изменяются потому, что один атом (окислитель) принимает электрон от атома восстановителя. При этом число принятых и отданных электронов должно быть одинаковым. На этом основан метод электронного баланса, при помощи которого расставляют коэффициенты в уравнениях ОВР.
Как называется процесс принятия электронов
Ключевые слова конспекта по химии для 11 класса: Окислительно-восстановительные реакции. Степень окисления. Окисление и восстановление. Окислитель и восстановитель. Метод электронного баланса.
Химия даёт множество примеров, иллюстрирующих один из основных философских законов — единства и борьбы противоположностей.
Единую структуру атома отражают его положительное ядро и отрицательно заряженные электроны оболочки. Природа амфотерных соединений заключается в единстве их кислотных и основных свойств. Обратимый гидролиз солей — это результат противоположных процессов: взаимодействия кислот и оснований с образованием соли и воды и разложение продуктов этого взаимодействия водой. Это утверждение справедливо для всех обратимых реакций: единство прямого и обратного химических процессов. Окислительно-восстановительные реакции — ещё один пример действия этого философского закона.
В пробирку налейте 4—5 мл раствора сульфата меди(II) и опустите в неё стальную канцелярскую скрепку. Оставьте пробирку в штативе на 1—2 мин. При наблюдении легко заметить, что в результате реакции стальная скрепка покрылась красноватым налётом свободной меди:
CuSO4 + Fe = FeSO4 + Сu
Для того чтобы выполнить задание, сформулированное в условии эксперимента, вам необходимо записать степени окисления элементов, образующих реагенты и продукты данной реакции.
Степень окисления атома обозначают знаком заряда и цифрой над символом химического элемента в формуле вещества, например: 
Рассмотрим пример расстановки степеней окисления атомов в перманганате калия КМnO4:
Следовательно,
Вернёмся к выполнению задания, указанного в лабораторном опыте:
Как видите, степени окисления в данной реакции изменили атомы железа и меди. Следовательно, эта реакция является окислительно-восстановительной.
Атомы железа в степени окисления 0 отдали два электрона, превратившись при этом в ион с зарядом +2: 
Ионы меди в исходном веществе имели степень окисления +2, а в продукте реакции — степень окисления 0, т. е. каждый из них принял по два электрона: 
Итак, на схеме показано, что железо в этой реакции окисляется, являясь восстановителем; сульфат меди(II), а точнее, ионы 
Окислительно–восстановительные реакции играют важную роль и в органической химии. Рассмотрим, например, реакцию горения метана и повторим, как рассчитываются коэффициенты и составляются уравнения окислительно–восстановительных реакций с использованием метода электронного баланса, т. е. равенства числа отданных и принятых электронов.
Убедиться, что атомы углерода в этой реакции теряют именно 8 электронов, поможет схема, где на числовом луче показаны степени окисления атомов, а также изменение этой величины в процессах окисления и восстановления.
Одно вещество в реакциях может выступать и в роли окислителя, и в роли восстановителя.
Во-первых, в состав вещества могут входить атомы элементов, один из которых проявляет свойства окислителя, а другой — восстановителя. Например, хлороводород (и его водный раствор — соляная кислота) проявляет окислительные свойства при взаимодействии с металлами за счёт катиона водорода 

Во-вторых, вещество может содержать атомы элемента в промежуточной степени окисления и выступать в качестве окислителя, принимая чужие электроны, или в качестве восстановителя, отдавая электроны другим атомам. Так, оксид серы(IV) в реакции с кислородом выступает в роли восстановителя, а в реакции с углеродом — окислителя:
Окислительно-восстановительные реакции используются на производстве (все металлургические процессы, синтез аммиака, производство кислот) и играют важную роль в процессах жизнедеятельности (процессы дыхания, горения и фотосинтеза).
В заключение подчеркнём единство окислительно–восстановительных процессов. Ведь если какой-то элемент или вещество окисляется (отдаёт электроны), то другое вещество обязательно восстанавливается (принимает эти электроны) с соблюдением электронного баланса. Эти процессы неразрывно связаны между собой.
Без изменения степеней окисления элементов протекают, например, реакции ионного обмена.
Окислительно-восстановительные реакции.
Шпаргалка по всей теме курса.
Конспект урока по химии «Окислительно-восстановительные реакции». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Окислительно-восстановительные реакции.
v Окислительно-восстановительные реакции – это реакции, в результате которых изменяется степень окисления элементов.
Окислительно— восстановительные реакции самые распространенные и играют большую роль в природе. Они являются основой жизни на Земле, так как с ними связаны дыхание и обмен веществ в живых организмах, гниение и брожение, фотосинтез в зеленых частях растений и нервная деятельность человека и животных.
Фотосинтез, дыхание, брожение, накопление энергии в клетках сопровождаются переносом электронов.
Разделяя процессы окисления и восстановления, удается превращать энергию химических реакций в электрическую. Этот принцип лежит в основе работы гальванических элементов и аккумуляторов.
К числу ОВР принадлежат все реакции между простыми и сложными веществами, между двумя простыми веществами, а также некоторые случаи взаимодействия сложных веществ.
При окислительно-восстановительных реакциях происходит переход электронов от одних атомов к другим.
v Валентность – это число связей у элемента в соединении.
v Степень окисления – это условный заряд, который возникает на элементе, когда он оттягивает на себя электроны со связей в соединении (или отдает их).
v Электроотрицательность – это способность элемента оттягивать на себя электроны со связей в соединении.
Атом, отдающий электрон, то есть повышающий свою степень окисления, называют восстановителем, а атом, принимающий электрон (его степень окисления понижается) – окислителем.
· Процесс отдачи электронов– это процесс окисления.
· Процесс принятия электронов– это процесс восстановления.
v Есть ряд мнемонических правил, которые позволяют лучше запомнить разницу между этими понятиями:
1. По первым буквам слов можно составить следующие сокращения:
2. Или использовать словосочетание «окислитель-грабитель».
3. Запомнить стихотворение:
Восстановитель — это тот, кто электроны отдает.
Сам отдает грабителю, злодею-окислителю.
Отдает — окисляется, сам восстановителем является.
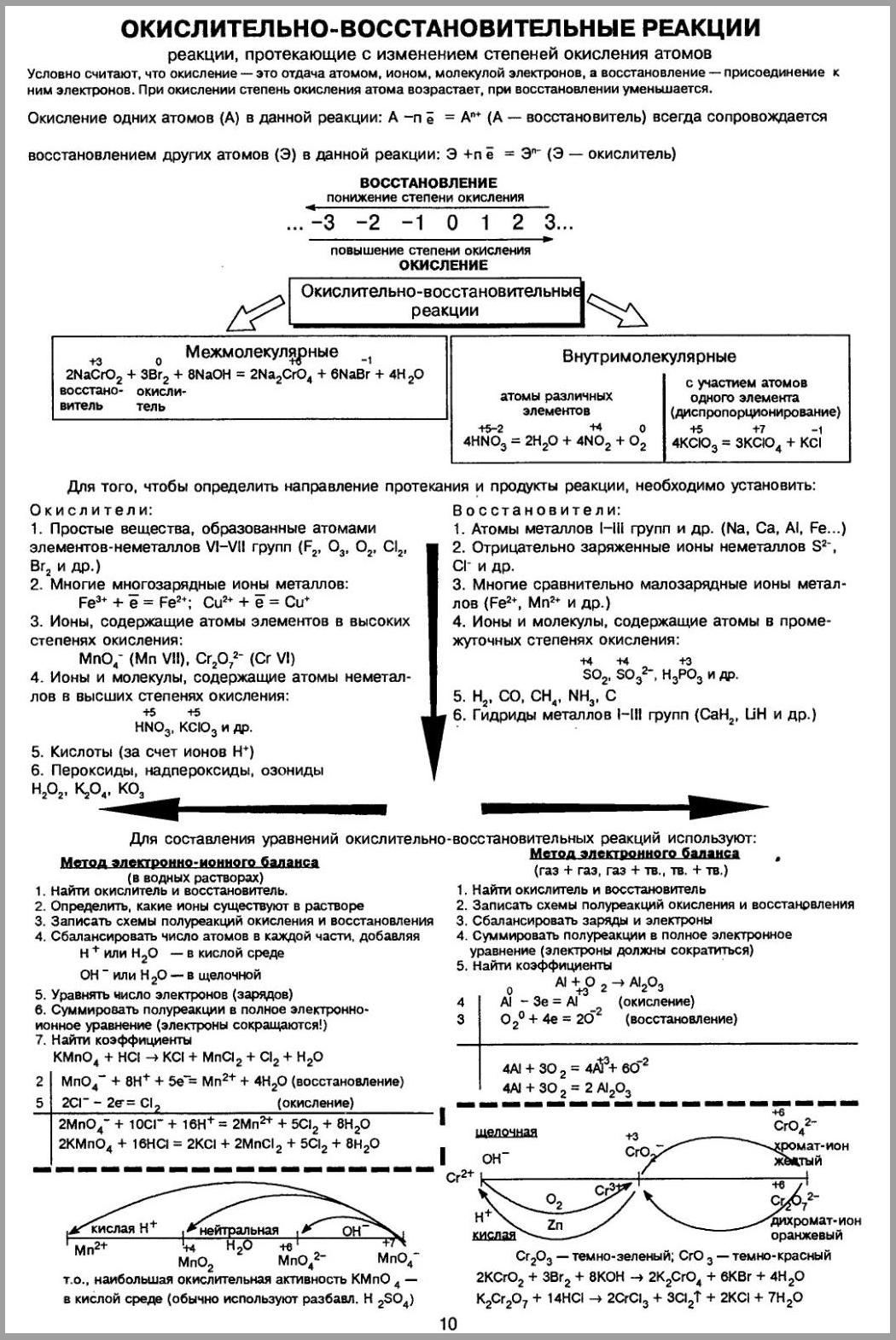
Уравнивание окислительно-восстановительных реакций, как правило, требует больше времени и усилий, чем расстановка коэффициентов в других реакциях. Для облегчения этой задачи существует два метода расстановки коэффициентов: метод электронного баланса и электронного-ионного баланса.
МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Расстановка коэффициентов в уравнении окислительно-восстановительной реакции основана на том, что число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
Алгоритм расстановки коэффициентов в окислительно-восстановительной реакции методом электронного баланса:
1. Записать схему реакции
2. Определить какие элементы изменили степень окисления в ходе реакции
3. Составить полуреакции для этих элементов и определить их роль в процессе (окислитель или восстановитель)
4. Подобрать дополнительные множители для этих элементов так, чтобы закон сохранения заряда выполнялся для реакции в целом, для чего число принятых электронов в полуреакциях восстановления делают равным числу отданных электронов в полуреакции окисления
5. Перенести подобраные коэффициенты в схему реакции
6. Уравнять числа атомов элементов, не изменивших степень окисления в ходе реакции
7. Проверить числа атомов всех элементов (чаще всего проводят проверку по кислороду)
1. Чтобы составить схему электронного баланса для данного уравнения, нужно расставить степени окисления всех элементов во всех веществах.
2. Затем найти и подчеркнуть те элементы, которые изменили свою степень окисления в результате реакции:
3. Слева направо выписать только те элементы, которые изменили свою степень окисления.
| 0 +3 Al → Al |
| +1 0 H → H |
4. Подсчитать, сколько элемент при этом отдает или принимает электронов:
| 0 +3 Al— 3e → Al |
| +1 0 H + 1e → H |
5. В схеме электронного баланса необходимо учитывать индексы
а) у простых веществ;
Необходимо умножить на индекс всю строчку этого элемента в схеме электронного баланса.
| 0 +3 Al — 3e → Al |
| +1 0 2 H + 2 × 1e → 2 H |
6. Для числа отданных электронов (3) и для числа принятых электронов (2) найти наименьшее общее кратное (6). Найти дополнительные множители.
7. Указать окислитель, восстановитель; процессы окисления и восстановления.
| восстановитель | 0 — +3 Al — 3e → Al | 6 (наименьшее общее кратное) | окисление |
| окислитель | +1 — 0 2 H + 2 × 1e → 2 H | 3 (дополнит. множители) | восстановление |
8. Расставить коэффициенты в уравнении реакции.
*Ответ: 2Al + 6 H Cl → 2 AlCl3 + 3 H2
| восстановитель | 0 — +3 Al — 3e → Al | окисление |
| окислитель | +1 — 0 2 H + 2 e → 2 H | восстановление |
Если несколько элементов в О.В.Р. отдают (или берут) электроны, то в схеме электронного баланса считают сумму отданных (или принятых) электронов. И ищут наименьшее общее кратное для этой суммы.
Примеры: 1) 2Al + 3 S → Al2 S3 сульфид алюминия
| сумма 2е | ||
| окислитель | +1 — 0 Ag + 1e → Ag | восстановление |
| окислитель | +5 — +4 N + 1e → N | восстановление |
| восстановитель | -2 — 0 2O — 2×2e → 2O | окисление |
1) Какие реакции называются окислительно-восстановительными?
2) Что такое окислитель?
3) Что такое восстановитель?
4) Какой процесс называется процессом восстановления?
5) Какой процесс называется процессом окисления?
6) Приведите примеры природных явлений, в основе которых лежат процессы окисления и восстановления.
Урок по химии в 9 классе «Окислительно-восстановительные реакции»
Пахомова Ирина Валерьевна
учитель биологии и химии МБОУ СОШ № 7
им. Ф.М. Школьного пос. Октябрьского Курганинского района Краснодарского края
ТЕХНОЛОГИЧЕСКАЯ КАРТА УРОКА
по учебному предмету «ХИМИЯ» в 9 классе на тему «Окислительно-восстановительные реакции»
Изучение нового материала
В.В. Еремин, Н.Е. Кузьменко, А.А. Дроздов, В.В. Лунин
урок-дискуссия с элементами проблемного обучения.
Познакомить учащихся с новой классификацией химических реакций по признаку изменения степеней окислений элементов – окислительно-восстановительными реакциями, охарактеризовать единство и непрерывность процессов окисления и восстановления, систематизировать знания о типах химических реакций, о степени окисления химических элементов. С оздать условия для осознания и осмысления новой учебной информации.
Планируемые образовательные результаты
(личностные, метапредметные, предметные)
· Познавательные : Систематизация знаний о химических реакциях, о степенях окисления химических элементов. Умение находить среди уравнений реакций уравнения ОВР, определять элементы, изменившие степень окисления, определять окислитель и восстановитель, процессы окисления и восстановления.
· Регулятивные: умение самостоятельно планировать свою деятельность, логически выстраивать алгоритм действий, анализировать проделанную работу, оценивать, находить положительные моменты и ошибки. Продолжить формирование умений составлять уравнения химических реакций.
· Личностные: умение доказывать свою точку зрения, приводить примеры из личной практики.
· Межпредметные : умение применять полученные знания в различных видах деятельности.
· Коммуникативные : умение работать в парах, в коллективе.
Реактивы: растворы хлорида меди (II), гидроксида натрия, алюминиевая проволока, лабораторное оборудование,
Презентация, таблица растворимости кислот, солей, оснований в воде, электрохимический ряд напряжений металлов, учебники, рабочие листы.
1. Организационный момент. Мотивация.
2. Актуализация знаний. Повторение опорных знаний.
3. Новая тема: Окислительно – восстановительные реакции. Окислители. Восстановители. Процессы окисления и восстановления.
4. Закрепление. Осознание и осмысление учебного материала.
5. Домашнее задание.
Название и цели каждого этапа в структуре урока
I. Организационный момент. Мотивация.
Организация учащихся на усвоение новых знаний. Основы ТБ.
Постановка цели урока, определение задания для учащихся.
Знакомятся с заданием, повторяют основы техники безопасности при работе с реактивами и лабораторным оборудованием.
II . Актуализация знаний. Повторение опорных знаний.
1. Химическая разминка.
Повторить классы неорганических соединений, понятие «Степень окисления», типы химических реакций по числу и составу исходных веществ и продуктов реакции.
2. В ходе химического эксперимента повторить признаки протекания химических реакций, записать уравнения проводимых реакций, определить их типы, определить степени окисления атомов в уравнениях проводимых реакций. Привести учащихся к выводу, что реакции могут отличаться еще по одному признаку: изменение степени окисления атомов в ходе реакции.
Координирует деятельность учащихся.
1. Определить, к какому классу неорганических соединений относятся вещества.
2. Постановка проблемы:
— Что такое степень окисления?
— Какие бывают степени окисления?
Определить степени окисления атомов в веществах.
— Почему в простых веществах у атомов нулевая степень окисления?
3. Определить типы химических реакций
В ходе химического эксперимента необходимо:
— определить признаки, которые свидетельствуют о превращениях одних веществ в другие;
— записать уравнения протекающих химических реакций;
— определить типы реакций;
— определите степени окисления атомов в уравнениях химических реакций.
Учитель следит за соблюдением ТБ, проведением эксперимента, выполнением заданий учащимися.
Делают записи в рабочих листах
1. Определение принадлежности вещества к определенному классу:
СаСl2 – средняя соль;
Н3РО4 – (кислородсодержащая) кислота;
СаОНСl – основная соль;
КНSО4 – кислая соль.
— Положительные и отрицательные.
Определение степеней окисления атомов:
— Т.к. в простых веществах нет полярных связей, степень окисления атомов равна нулю.
3. Определение типов химических реакций:
а) реакция разложения;
б) реакция соединения;
в) реакция замещения;
Проводят химический эксперимент (ТБ!):
СuСl2 + 2NаОН = Сu(ОН)2↓+ 2NаСl – образовался синий осадок, р. обмена, степени окисления атомов не изменились.
3СuСl2 + 2Аl = 2АlСl3 + 3Сu – на проволоке появился темный налет, в растворе «хлопья» металла, р. замещения, атомы меди и алюминия изменили степени окисления.