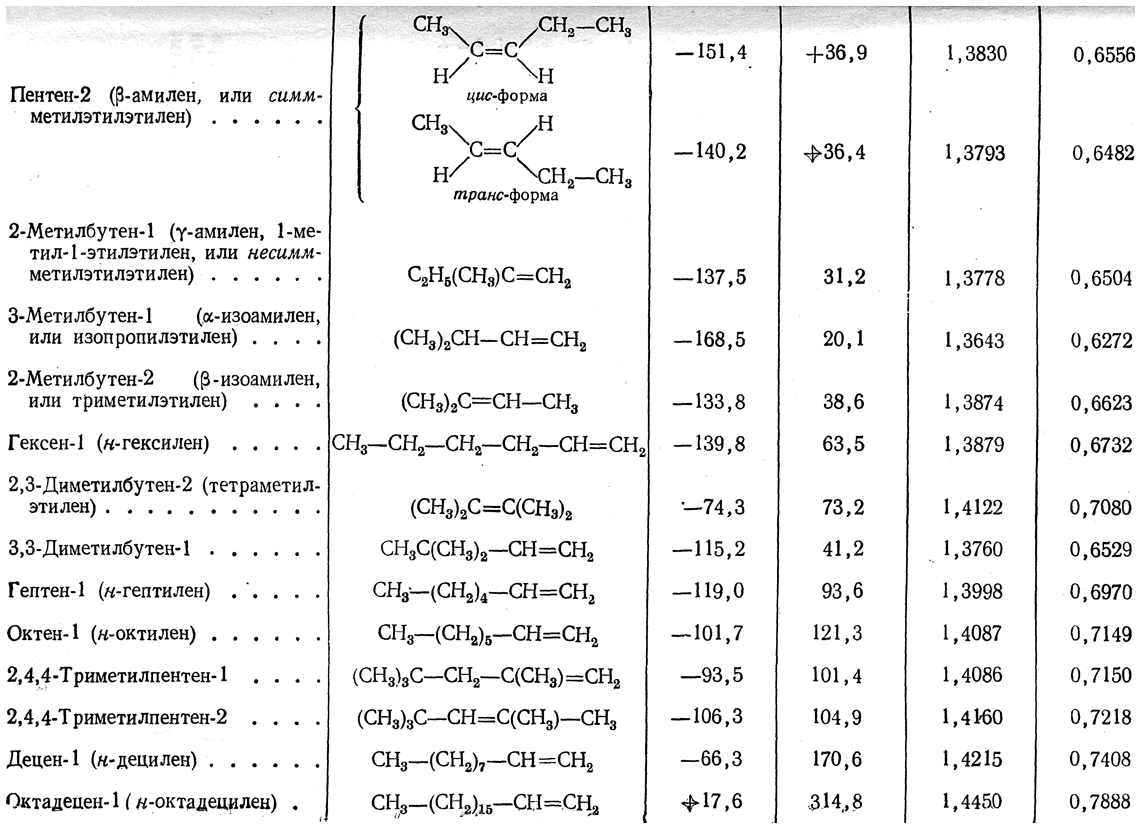
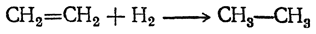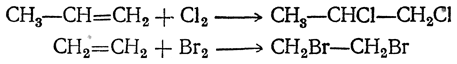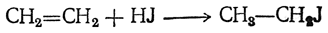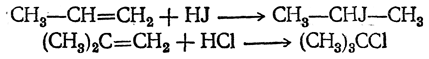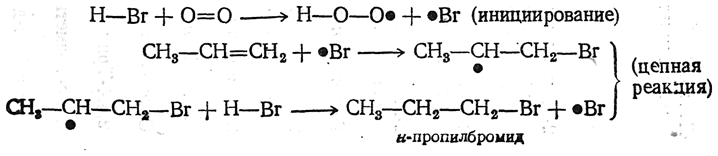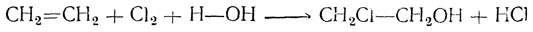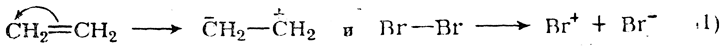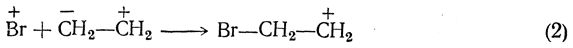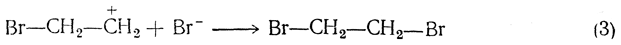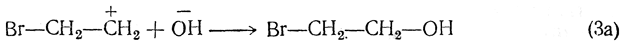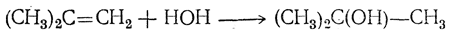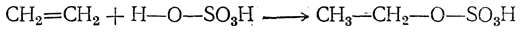Как называется реакция присоединения водорода
Гидрогенизация
Литература : Лозовой А. В., Дьякова М. К., Гидрогенизация топлива в СССР, М.-Л., 1940; Рапопорт И. Б., Искусственное жидкое топливо, ч. 1, М.-Л., 1949; Аронов С. Г., Скляр М. Г., Тютюнников Ю. Б., Комплексная химико-технологическая переработка углей, (К., 1968); Кричко A. A., Лебедев В. В., Фарберов И. Л., Нетопливное использование углей, М., 1978.
Е. А. Дембовская, М. А. Меньковский.
Полезное
Смотреть что такое «Гидрогенизация» в других словарях:
гидрогенизация — гидрогенизация … Орфографический словарь-справочник
Гидрогенизация — (гидрирование) реакция присоединения водорода по кратной связи, обычно в присутствии катализаторов: Отщепление водорода от соединений называется дегидрогенизацией. Гидрогенизация и дегидрогенизация связаны динамическим равновесием. Наиболее … Википедия
ГИДРОГЕНИЗАЦИЯ — ГИДРОГЕНИЗАЦИЯ, химическая реакция между водородом и другим элементом или соединением, иногда под давлением, в присутствии металлического катализатора, например, никеля, платины или палладия. Ненасыщенные соединения, например, бензол, могут… … Научно-технический энциклопедический словарь
гидрогенизация — гидрирование Словарь русских синонимов. гидрогенизация сущ., кол во синонимов: 1 • гидрирование (3) Словарь синонимов ASIS. В.Н. Тр … Словарь синонимов
ГИДРОГЕНИЗАЦИЯ — то же, что гидрирование … Большой Энциклопедический словарь
Гидрогенизация — 4) гидрогенизация процесс частичного или полного насыщения водородом непредельных связей ненасыщенных жирных кислот триацилглицеридов, входящих в состав растительных масел и (или) жиров;. Источник: Федеральный закон от 24.06.2008 N 90 ФЗ… … Официальная терминология
Гидрогенизация — (от лат. hydrogenium водород) гидрирование, каталитическая реакция присоединения водорода к простым веществам (элементам) или химическим соединениям. Обратная реакция отщепление водорода от химических соединений называется… … Большая советская энциклопедия
гидрогенизация — и; ж. = Гидрирование. Г. веществ. * * * гидрогенизация то же, что гидрирование. * * * ГИДРОГЕНИЗАЦИЯ ГИДРОГЕНИЗАЦИЯ, то же, что гидрирование (см. ГИДРИРОВАНИЕ) … Энциклопедический словарь
гидрогенизация — riebalų hidrinimas statusas Aprobuotas sritis pašarai apibrėžtis Aliejaus ir taukų neprisotintųjų glicerolių pakeitimas prisotintaisiais gliceroliais. atitikmenys: angl. hydrogenation vok. Fetthärtung rus. гидрирование; гидрогенизация pranc.… … Lithuanian dictionary (lietuvių žodynas)
Гидрирование
Гидрогенизация (гидрирование) — реакция присоединения водорода по кратной связи, обычно в присутствии катализаторов:

Отщепление водорода от соединений называется дегидрогенизацией. Гидрогенизация и дегидрогенизация связаны динамическим равновесием. Наиболее важные промышленные процессы гидрогенизация — синтез циклогексана из бензола, синтез метилового спирта из СО и Н2, синтез насыщенных жиров из ненасыщенных (получение маргарина), синтез искусственного жидкого топлива. В качестве катализаторов применяют Ni, Pt, Co, Fe, Pd, Cu, V и др. Реакция, как правило, проходит при повышенной температуре и/или повышенном давлении. Для проведения реакции в таких условиях необходим взрывобезопасный химический реактор. Также известны гомогенные катализаторы (в основном комплексы переходных металлов), например катализатор Уилкинсона RhCl•(PPh3)3. Гидрирование с применением гетерогенных катализаторов приводит к продуктам цис-присоединения водорода.
Также для гидрирования алкинов до алкенов может быть использован натрий в жидком аммиаке:
Присоединение происходит стереоселективно как транс.
Алкадиены могут быть гидрированы до алкенов с помощью натрия в этиловом спирте:
Всегда происходит как 1,4-присоединение.
См. также
Полезное
Смотреть что такое «Гидрирование» в других словарях:
ГИДРИРОВАНИЕ — (гидрогенизация) присоединение водорода к органическим соединениям. Осуществляют действием молекулярного водорода в присутствии катализаторов или доноров водорода (напр., алюмогидрида лития). В промышленности каталитическое гидрирование… … Большой Энциклопедический словарь
гидрирование — сущ., кол во синонимов: 3 • гидрогенизация (1) • реакция (33) • самогидрирование … Словарь синонимов
ГИДРИРОВАНИЕ — ГИДРИРОВАНИЕ, гидрогенизация, присоединение водорода к простым и сложным хим. телам. Только немногие из элементов обладают свойством непосредственно присоединять водород. Бблыная же часть как простых, так и сложных хим. тел (из последних особенно … Большая медицинская энциклопедия
гидрирование — Взаимодействие водорода с металлами или менее электроотрицат., чем водород, неметаллами. Г. приводит к образованию гидридов или фаз перемен. состава, включающих водород. В завис ти от природы связи элемента с водородом при г. образуются: 1)… … Справочник технического переводчика
гидрирование — я; ср. к Гидрировать и Гидрироваться. Процесс гидрирования. * * * гидрирование (гидрогенизация), присоединение водорода к органическим соединениям. Осуществляют действием молекулярного водорода в присутствии катализаторов или доноров водорода… … Энциклопедический словарь
Гидрирование — [hyd rogenation] взаимодействие водорода с металлами или менее электроотрицательными, чем водород, неметаллами. Гидрирование приводит к образованию гидридов или фаз переменного состава, включающих водород. В зависимости от природы связи элемента… … Энциклопедический словарь по металлургии
гидрирование — riebalų hidrinimas statusas Aprobuotas sritis pašarai apibrėžtis Aliejaus ir taukų neprisotintųjų glicerolių pakeitimas prisotintaisiais gliceroliais. atitikmenys: angl. hydrogenation vok. Fetthärtung rus. гидрирование; гидрогенизация pranc.… … Lithuanian dictionary (lietuvių žodynas)
гидрирование — hidrinimas statusas T sritis chemija apibrėžtis Vandenilio prijungimas. atitikmenys: angl. hydrogenation rus. гидрирование; гидрогенизация … Chemijos terminų aiškinamasis žodynas
Гидрирование — ср. то же, что гидрогенизация Толковый словарь Ефремовой. Т. Ф. Ефремова. 2000 … Современный толковый словарь русского языка Ефремовой
Как называется реакция присоединения водорода
Алена Игоревна Титаренко
Шпаргалка по органической химии
1. Предмет органической химии
Органические вещества в своем составе наряду с другими элементами всегда содержат углерод. Изучение соединений углерода – их строения, химических превращений – и составляет предмет органической химии.
Вещества органические и неорганические.
Наряду с углеродом в состав органических веществ чаще всего входят водород, кислород и азот, сравнительно реже – сера, фосфор, галогены и другие элементы. Известно несколько миллионов органических соединений, неорганических же веществ значительно меньше. Из всех химических элементов только углерод образует такое большое число органических соединений.
С органическими веществами мы встречаемся на каждом шагу. Они содержатся во всех растительных и животных организмах, входят в состав нашей пищи, служат материалом для изготовления одежды, образуют различные виды топлива, используются нами в качестве лекарств, красителей, средств защиты урожая и т. д.
Резкой грани между органическими и неорганическими веществами не существует. Оксиды углерода, угольная кислота, ее соли и некоторые другие вещества по наличию в них углерода должны считаться органическими, но по свойствам они близки к неорганическим соединениям подобного типа и изучаются обычно в неорганической химии.
С органическими веществами человек знаком с давних времен. Наши далекие предки применяли природные красители для окраски тканей, использовали в качестве продуктов питания растительные масла, животные жиры, тростниковый сахар, получали уксус брожением спиртовых жидкостей.
В настоящее время синтезированы многие органические вещества, не только имеющиеся в природе, но и не встречающиеся в ней: многочисленные пластмассы, различные виды каучуков, всевозможные красители, взрывчатые вещества, лекарственные препараты.
Синтетически полученных веществ сейчас известно даже больше, чем найденных в природе, и число их быстро растет. Осуществляются синтезы самых сложных органических веществ – белков.
Название науки «органическая химия», утратив первоначальный смысл, приобрело в связи с этим более широкое толкование.
Можно сказать, что такое название получило и новое подтверждение, так как ведущей познавательной задачей современной органической химии является глубокое изучение процессов, происходящих в клетках организмов на молекулярном уровне, выяснение тех тонких механизмов, которые составляют материальную основу явлений жизни.
Изучение химии органических веществ, таким образом, расширяет наши знания о природе.
2. Предпосылки теории строения
Подобно тому как в неорганической химии при изучении элементов и их соединений необходимо постоянно руководствоваться периодическим законом и Периодической системой химических элементов Д.И. Менделеева, в органической химии при изучении веществ необходимо опираться на теорию химического строения.
Основные особенности предпосылок химического строения:
1) теория химического строения в своей основе была создана в 60-е гг. XIX в.;
2) основная задача органической химии того времени состояла в изучении состава и свойств природных соединений;
3) также основная задача состояла в разработке способов рационального использования состава и свойств природных соединений для практических нужд;
4) в связи с развитием промышленности, торговли, ростом городов к органической химии стали предъявляться большие требования;
5) текстильная промышленность нуждалась в разнообразных красителях;
6) для развития пищевой промышленности требовались более совершенные методы переработки сельскохозяйственных продуктов;
7) необходимо было решить проблему освещения растущих городов на основе использования природных материалов;
8) нужно было также удовлетворить потребность населения в лекарственных веществах и т. д.
Дальнейшее развитие органической химии стало замедляться из-за отставания в ней теоретических представлений.
Новые теоретические воззрения:
1) открывшиеся в процессе исследования веществ новые явления требовали систематизации и объяснения их с единой точки зрения, но теория того времени оказывалась для этого недостаточной;
2) органическая химия должна была создавать новые вещества, но теоретические знания не могли указать пути их целенаправленного синтеза;
3) необходимость новых теоретических воззрений в органической химии становится более понятной, если знать некоторые известные факторы.
При изучении курса неорганической химии становится известно, что:
а) углерод образует с водородом большое число соединений, так называемых углеводородов;
б) в состав горючего природного газа, например, наряду с простейшим углеводородом метаном СН4, входят этан С2Н6, пропан С3Н8, бутан С4H10 и др.;
в) при термическом разложении каменного угля образуется бензол С6Н6, толуол С7Н8 и т. д.;
г) много различных углеводородов содержится в нефти;
4) углерод, который содержится в природном газе, является четырехвалентным элементом, но только в метане он сохраняет эту валентность;
5) в этане С2Н6 углерод должен быть трехвалентным, а в пропане С3Н8 иметь даже дробную валентность.
3. Особенности органических соединений
В отличие от неорганических веществ органические вещества имеют ряд характерных особенностей:
1) атомы углерода способны соединяться друг с другом;
2) образуют цепи и кольца, что не так типично для неорганических соединений. Это одна из причин многообразия органических соединений;
3) одной из важных особенностей органических соединений, которая накладывает отпечаток на все их химические свойства, является характер связей между атомами в их молекулах.
Эти связи имеют ярко выраженный ковалентный характер. Органические вещества в большинстве неэлектролиты, не диссоциируют в растворах на ионы и сравнительно медленно взаимодействуют друг с другом.
Время, необходимое для завершения реакций между органическими веществами, измеряется часами, а иногда и днями.
Если ионные (неорганические) соединения легко диссоциируют в воде на ионы и реакции между ними протекают весьма быстро, то органические вещества, содержащие простые (одинарные) С – С и С – Н связи, взаимодействуют между собой с большим трудом.
При нагревании в пределах 400–600 °C органические соединения полностью разлагаются и обугливаются, а в присутствии кислорода сгорают. Это объясняется сравнительно небольшой прочностью связи между атомами углерода (355,6 кДж/моль);
4) важной особенностью органических соединений является и то, что среди них широко распространено явление изомерии;
5) имеется множество соединений углерода, которые обладают одинаковым качественным и количественным составом и одинаковой молекулярной массой, но совершенно различными физическими и даже химическими свойствами;
6) многие органические соединения являются непосредственными носителями, участниками или продуктами процессов, которые протекают в живых организмах, – ферменты, гормоны, витамины.
Особенности атома углерода объясняются его строением:
1) он имеет четыре валентных электрона;
2) атомы углерода образуют с другими атомами, а также друг с другом общие электронные пары. При этом на внешнем уровне каждого атома углерода будет восемь электронов (октет), четыре из которых одновременно принадлежат другим атомам.
В органической химии обычно пользуются структурными формулами, поскольку атомы имеют пространственное расположение в молекуле.
I. Реакции присоединения
Присоединение элементарного водорода к этиленовым соединениям в отсутствие катализаторов происходит лишь при высоких температурах, при которых часто уже наблюдается разложение молекул органических веществ (реакция с самим этиленом является при этом обратимой). Значительно легче можно достигнуть присоединения водорода действием восстановителей, например иодистого водорода.
Самым удобным способом является присоединение водорода в присутствии катализаторов. Такими катализаторами служат металлы платиновой группы в мелко раздробленном виде, сама платина и особенно палладий — уже при обыкновенной температуре (С. А. Фокин, Вильштеттер). Большое практическое значение имело открытие Сабатье, применившего для этой цели мелко раздробленный никель при температуре 150—300° С и в многочисленных работах показавшего универсальность этого катализатора для целого ряда реакций восстановления.
2. Присоединение галоидов. Присоединением галоидов получаются дигалоидные соединения, содержащие галоиды при соседних атомах углерода:
Наиболее энергично присоединяется хлор, труднее всего — иод. Реакцией присоединения брома часто пользуются как качественной реакцией на двойную и тройную связи. Признаком наличия двойной связи является моментальное обесцвечивание капли брома без выделения газообразного бромистого водорода.
3. Присоединение галоидоводородов. Легко присоединяются к двойной связи также и галоидоводороды, причем легче всего присоединяется иодистый водород и труднее всего — хлористый.
Первичный галоидный алкил получается лишь при присоединении галоидоводорода к самому этилену:
В других случаях присоединение идет главным образом так, что атом водорода направляется к тому атому углерода, где атомов водорода было больше (к наиболее «гидрогенизированному» атому углерода), а атом галоида — туда, где водорода было меньше, так что преимущественно получаются вторичные и третичные галоидные алкилы (см. правило Марковникова):
Особенно легко происходит присоединение (даже хлористого водорода) в тех случаях, когда может образоваться третичный галоидный алкил.
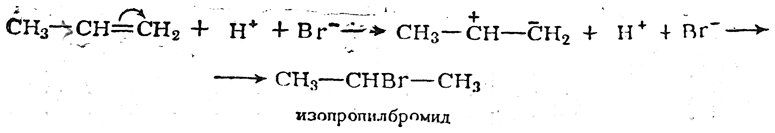
Присоединение других несимметричных реагентов типа Н—X к олефинам также обычно происходит в соответствии с правилом Марковникова.
Присоединение Н—Cl и Н—J протекает нормально, согласно правилу Марковникова. В случае же присоединения Н—Br соблюдение правила Марковникова в значительной степени зависит от условий реакции, в первую очередь от присутствия или отсутствия кислорода или перекисных соединений («перекисный эффект»). Реакции присоединения несимметричных реагентов к олефинам подробно изучались с учетом влияния перекисей (Хараш).
Различному поведению Н—Br в зависимости от условий реакции дается следующее объяснение:
а) В отсутствие перекисей реакция идет по ионному механизму с поляризацией двойной связи (иногда для этого достаточно устранить кислород; в других случаях приходится добавлять антиоксиданты, например гидрохинон); при этом реакция протекает нормально в согласии с правилом Марковникова, т. е. анион реагента X – направляется к атому углерода с наименьшей плотностью электронного облака (к наименее гидрогенизированному атому), например:
б) В присутствии перекисей (в атмосфере, содержащей кислород, или при добавлении готовых перекисей) протекает возбуждаемая этими веществами свободнорадикальная цепная реакция, приводящая к аномальным продуктам:
Под действием фтористого водорода олефины обычно полимеризуются; фтористый водород присоединяется сравнительно гладко лишь к галоидзамещенным олефинам.
4. Образование галоидгидринов. При взаимодействии с водными растворами хлора или брома олефины присоединяют элементы хлорноватистой (бромноватистой) кислоты, в результате чего образуются галоидгидрины, важные промежуточные продукты в современной технологии органического синтеза:
Если при атомах углерода содержится различнее число атомов водорода, то обычно гидроксил присоединяется преимущественно к менее гидрогенизированному атому углерода.
Приведенные схемы реакций отражают лишь конечные результаты процессов. В действительности присоединение галоидов к двойной связи совершается гораздо сложнее. Вероятный механизм процесса таков. Сначала происходит активация реагентов:
Далее олефин реагирует с положительным ионом брома:
Затем присоединяется второй (отрицательный) ион брома:
Если процесс протекает в водном растворе, то третьей стадией является реакция с участием ионов воды, приводящая к образованию галоидгидрина (и галоидоводородной кислоты):
В пользу такого механизма процесса свидетельствуют следующие факты: а) В газовой фазе реакция между этиленом и галоидом практически не идет. Реакция происходит на внутренней поверхности реакционного сосуда, на стекле; если стекло покрыть слоем парафина, то скорость реакции делается ничтожной. Значит, чтобы процесс начался, нужны полярные катализаторы, и процесс, следовательно, имеет ионный характер.
б) Кинетический порядок реакции зависит от условий, существующих на поверхности сосуда, но скорость реакции всегда убывает с повышением температуры. Отрицательный температурный коэффициент свидетельствует о том, что реакция идет через образование малостойкого при повышенной температуре промежуточного продукта, а не путем непосредственного соединения компонентов.
в) При протекании процесса в водных растворах имеются две конкурирующие реакции (3 и За). Следовательно, относительный выход дибромэтана должен быть тем выше, чем больше концентрация анионов брома в растворе; действительно, при добавлении бромистого калия (т. е. К + и Вr – ) к раствору увеличивается выход BrСН2—СН2Br и уменьшается выход BrСН2—СН2ОН
5. Присоединение элементов воды. Присоединение элементов воды приводит к образованию спиртов, причем и в этом случае атом водорода направляется к наиболее гидрогенизированному, а гидроксил — к менее гидрогенизированному атому углерода, например
так что получаются вторичные или третичные спирты.
Присоединение воды может происходить под влиянием серной кислоты, хлористого цинка и тому подобных катализаторов. В случае серной кислоты сначала образуется алкилсерная кислота
которая при последующем омылении дает спирт.
Эти реакции дают возможность превращать первичные соединения во вторичные или третичные. Так, отнимая воду от первичного пропилового спирта, можно получить пропилен СН3—СН=СН2, а присоединением молекулы воды к пропилену— вторичный (изопропиловый) спирт. Аналогичные превращения возможны при отщеплении и присоединении галоидоводородов.
6. Присоединение окислов азота и хлористогонитрозила. Этиленовые углеводороды способны присоединять высшие окислы азота, а также хлористый нитрозил NOCl. При этом часто получаются кристаллические продукты состава CnH2nN2O3, СnН2nN2O4 и СnН2nNОСl. В соединениях первых двух типов атомы азота присоединены частью непосредственно к углероду, частью через посредство кислорода (эфиры азотной или азотистой кислоты); в соединениях третьего типа атом азота присоединен непосредственно к углероду. Так, например, триметилэтилен с N2O4 и NOCl дает вещества следующего строения:
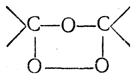
7. Присоединение озона. Озон присоединяется к этиленовым углеводородам с образованием озонидов строения
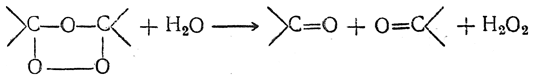
Озониды — обычно сильно взрывчатые вещества — при разложении водой распадаются по месту прежней двойной связи и дают альдегиды и кетоны:
Строение образовавшихся альдегидов и кетонов дает возможность судить о строении этиленовых соединений; для этой цели реакция озонирования применяется очень часто.
Водород: химия водорода и его соединений
Водород
Положение в периодической системе химических элементов
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии :
+1H 1s 1 1s
Атом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Соединения водорода
Типичные соединения водорода:
| Степень окисления | Типичные соединения |
| +1 | кислоты H2SO4, H2S, HCl и др. вода H2O и др. летучие водородные соединения (HCl, HBr) кислые соли (NaHCO3 и др.) основания NaOH, Cu(OH)2 основные соли (CuOH)2CO3 |
| -1 | гидриды металлов NaH, CaH2 и др. |
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов :
2Na + H2 → 2NaH
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
2. Водород взаимодействует со сложными веществами:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
Водородные соединения металлов
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Способы получения
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
2Na + H2 → 2NaH
Гидрид кальция можно получить из кальция и водорода:
Химические свойства
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором :
NaH + Cl2 = NaCl + HCl
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
Соли фосфония неустойчивые, легко гидролизуются.
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
Ag + Н2O ≠
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
6. Бинарные соединения неметаллов также гидролизуются водой.
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).