Как называется соли уксусной кислоты
Соли уксусной кислоты
Уксуснокислый натрий CH3COONa кристаллизуется с тремя молекулами воды; он чрезвычайно хорошо растворим в воде и легко дает пересыщенные растворы. Из спиртовых растворов уксуснокислых солей щелочных металлов углекислота осаждает углекислые соли, вытесняя уксусную кислоту.
Уксуснокислая соль трехвалентного железа (CH3COO)3Fe, как и средние железные соли других жирных кислот, дает темно-красные водные растворы. При кипячении с водой уксуснокислого железа, а также уксуснокислого алюминия осаждаются аморфные хлопьевидные осадки основных солей. Эта реакция применяется в анализе для отделения алюминия и железа от остальных металлов III группы, а также в технике крашения для нанесения «протрав» (осаждение на волокнах окислов металлов).
Средняя уксуснокислая соль свинца (СН3СОО)3Рb · 3H2O называется свинцовым сахаром. Она растворима в воде, имеет сладкий вкус, ядовита. Основная уксуснокислая соль свинца (СН3СОО)2Рb · Рb(ОН)2, называемая свинцовым уксусом, применяется в медицине, а также для производства свинцовых белил.
Средняя уксуснокислая соль меди Cu(СН3СОО)2 · Н2О — сине-зеленые кристаллы, растворимые в воде. Смесь основных медных солей, получающаяся при действии кислорода воздуха на смоченную уксусной кислотой медь, называется медной зеленью и ярь-медянкой. Соединение уксуснокислой меди и мышьяковистокислой меди называется парижской, или швейнфуртской, зеленью и применяется как средство борьбы с вредителями растений.
Уксусная кислота
| Уксусная кислота | |
 | |
 | |
| Общие | |
|---|---|
| Химическая формула | CH3COOH |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветная жидкость |
| Молярная масса | 60,05 г/моль |
| Плотность | 1,0492 г/см³ |
| Термические свойства | |
| Температура плавления | 16,75 °C |
| Температура кипения | 118,1 °C |
| Критическая точка | 321,6 °C, 5,79 МПа |
| Молярная теплоёмкость (ст. усл.) | 123,4 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | −487 кДж/моль |
| Химические свойства | |
| pKa | 4,76 (Ka=1,75*10-5) |
| Оптические свойства | |
| Показатель преломления | 1,372 |
| Структура | |
| Дипольный момент | 1,74 Д |
| Классификация | |
| Рег. номер CAS | 64-19-7 |
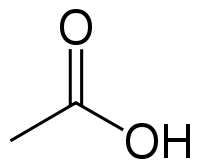
У́ксусная кислота (эта́новая кислота) — органическое вещество с формулой CH3COOH. Слабая, предельная одноосно́вная карбоновая кислота. Производные уксусной кислоты носят название «ацетаты».
Содержание
История
Уксус является продуктом брожения вина и известен человеку с давних времен.
Первое упоминание о практическом применении уксусной кислоты относится к третьему веку до н. э. Греческий ученый Теофраст впервые описал действие уксуса на металлы, приводящее к образованию некоторых используемых в искусстве пигментов. Уксус применялся для получения «свинцовых белил», а также ярь-медянки (зелёной смеси солей меди, содержащей помимо всего ацетат меди).
В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа». «Сапа» содержала большое количество ацетата свинца — очень сладкого вещества, которое также называют «свинцовым сахаром» или «сахаром Сатурна». Высокая популярность «сапы» была причиной хронического отравления свинцом, распространенного среди римской аристократии. [1]
В VIII веке арабский алхимик Джабир ибн Хайян впервые получил концентрированную уксусную кислоту путем перегонки.
Во времена Эпохи Возрождения уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)) (при сухой перегонке ацетатов металлов получается ацетон, вполне промышленный способ до середины 20 века).
В 1847 году немецкий химик Адольф Кольбе впервые синтезировал уксусную кислоту из неорганических материалов. Последовательность превращений включала в себя хлорирование сероуглерода до тетрахлорметана с последующим пиролизом до тетрахлорэтилена. Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту. [2]
В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины. Основным производителем уксусной кислоты являлась Германия. В 1910 году ею было произведено более 10 тыс. тонн кислоты, причем около 30 % этого количества было израсходовано на производство красителя индиго. [1] [3]
Физические свойства
Абсолютная уксусная кислота называется ледяной, ибо при замерзании образует льдовидную массу (см. изображение справа).
Уксусная кислота образует двойные азеотропные смеси со следующими веществами.
Получение
В промышленности
Окислительные методы
Ацетальдегид окислялся в присутствии ацетата марганца (II) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 %.
Окисление н-бутана проводилось при температуре 150—200 °C и давлении 150 атм. Катализатором этого процесса являлся ацетат кобальта.
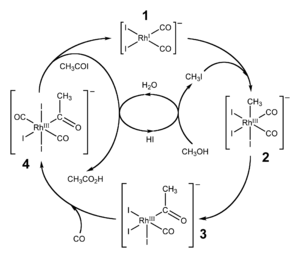
Каталитическое карбонилирование метанола
Реакция карбонилирования метанола была открыта учеными фирмы BASF в 1913 году. В 1960 году эта компания запустила первый завод, производящий уксусную кислоту этим методом. [7] Катализатором превращения служил йодид кобальта.
Усовершенствованная реакция синтеза уксусной кислоты карбонилированием метанола была внедрена исследователями фирмы Monsanto в 1970 году. [8] [9] Это гомогенный процесс, в котором используются соли родия в качестве катализаторов, а также йодид-ионы в качестве промоторов. Важной особенностью метода является большая скорость, а также высокая селективность (99 % по метанолу и 90 % по CO). [5]
Этим способом получают чуть более 50 % всей промышленной уксусной кислоты. [10]
В процессе фирмы BP в качестве катализаторов используются соединения иридия.
Биохимический способ производства
Реакция окисления этанола до уксусной кислоты протекает при участии фермента алкогольоксидазы. Это сложный многоступенчатый процесс, который описывается формальным уравнением [12] :
Химические свойства
Уксусная кислота обладает всеми свойствами карбоновых кислот. Связь между водородом и кислородом карбоксильной группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства.
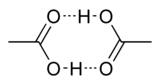
Исследования показывают, что в кристаллическом состоянии молекулы образуют димеры, связанные водородными связями. [13]
Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород и образуются соли — ацетаты.
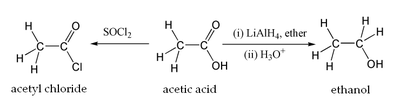
Уксусная кислота может хлорироваться действием газообразного хлора. При этом образуется хлоруксусная кислота.
Этим путем могут быть получены также дихлоруксусная (CHCl2COOH) и трихлоруксусная (CCl3COOH) кислоты.
Уксусная кислота вступает во все реакции, характерные для карбоновых кислот. Она может быть восстановлена до этанола действием алюмогидрида лития. Уксусная кислота также может быть превращена в хлорангидрид действием тионилхлорида. Натриевая соль уксусный кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана.
Применение
Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении.
Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту.
Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния.
Безопасность
Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. Порог восприятия запаха уксусной кислоты в воздухе находится в районе 0,4 мг/л. ПДК в атмосферном воздухе составляет 0,06 мг/м³, в воздухе рабочих помещений — 5 мг/м³. [4]
Последствиями приёма концентрированной уксусной кислоты являются тяжёлый ожог слизистой оболочки полости рта, глотки, пищевода и желудка; последствия всасывания уксусной эссенции — ацидоз, гемолиз, гемоглобинурия, нарушение свёртываемости крови, сопровождающееся тяжёлыми желудочно-кишечными кровотечениями. Характерно значительное сгущение крови из-за потери плазмы через обожжённую слизистую оболочку, что может вызвать шок. К опасным осложнениям отравления уксусной эссенцией относятся острая почечная недостаточность и токсическая дистрофия печени.
При приёме уксусной кислоты внутрь следует выпить большое количество жидкости. Вызов рвоты является крайне опасным, так как вторичное прохождение кислоты по пищеводу усугубит ожог. Показано промывание желудка через зонд. Необходима немедленная госпитализация.
Характеристика и свойства уксусной кислоты
Уксусная кислота (или этановая) – органическое химическое соединение, относящееся к карбоновым кислотам (в состав их формулы входит карбоксильная группа – COOH). Это вещество известно человечеству с древних времен. Без нее невозможно производство многих пищевых продуктов и получение органических веществ.
Общая характеристика, формула
Химическая формула вещества СН3СООН. При нормальных условиях это бесцветная жидкость, обладающая резким характерным запахом и кислым вкусом. Попадание концентрированного вещества на слизистые оболочки вызывает химический ожог. «Ледяная» уксусная кислота 99 процентов обладает высокой гигроскопичностью, т.е. она способна поглощать водяной пар из атмосферного воздуха.
В уксусе могут растворяться не только жидкости, но и газы. Например, в нем растворяются фтороводород HF, хлористый водород HCl и бромистый водород HBr.
Соли рассматриваемого химического вещества называются ацетатами. Такое же наименование имеют и сложные эфиры. В качестве пищевой добавки применяется раствор уксусной кислоты с концентрацией 3 – 9%. В составе уксусной кислоты не может быть никаких примесей.
История открытия уксусной кислоты
Рассматриваемое вещество известно человеку с первобытных времен. СН3СООН образуется при скисании вина (отсюда и другое название – винный уксус). Впервые химические свойства уксуса описано в Древней Греции в 3 веке до н.э. В то время это вещество применялось для получения красителей. В Древнем Риме большой популярностью пользовался так называемый свинцовый сахар – ацетат свинца. Эта соль была причиной хронических отравлений и болезней римской аристократии.
Химическое строение уксуса впервые начал исследовать французский химик Дюма: он опубликовал труд о замещении атома водорода в органических соединениях атомом хлора. Так он получил хлоруксусную кислоту.
В середине 19 века немецкий химик А. Кольбе синтезировал уксус путем хлорирования сероуглерода CS2 до тетрахлометана CCl4, который путем пиролиза превращался в тетрахлорэтилен C2Cl4. Дальнейшее воздействие хлором водного раствора тетрахлорэтилена дало возможность получить трихлоруксусную кислоту. После электролитического восстановления ученый получил СН3СООН.
Еще в начале ХХ века значительное количество уксуса проводилось путем перегонки древесины.
Получение и производство
На ранних этапах развития индустрии вещество уксусная кислота получали путем окисления бутана и ацетатальдегида. Этот альдегид окислялся в присутствии катализатора ацетата марганца при высоком давлении и температуре. Реакция имела такой вид: 2СН3СНО + О2→2СН3СООН.
Окисление же бутана проходило при высоком давлении и в присутствии катализатора ацетата кобальта. Реакция имела такой вид: 2С4Н10 + 5О2→ 2СН3СООН.
В результате подорожания нефти (а рассмотренные способы базировались на окислении продуктов ее крекинга) сделали такие химические реакции экономически невыгодными. Более совершенный способ получения уксусной кислоты – это каталитическое карбонилирование метанола (древесного спирта) путем воздействия на него окисью углерода. Реакция имеет такой вид: СН3СОН + СО → СН3СООН. Катализатором служит йодистая соль кобальта.
С 1970 г. компания Монсанто предложила использовать в качестве катализатора родиевые соли. В результате производство уксусной кислоты заметно возросло.
В процессе биохимического производства применяется окисление этилового спирта микроорганизмами. Реакция проходит при участии фермента алькогольдегидрогеназы.
Также пищевую добавку уксусную кислоту можно получить путем окисления этилового спирта: С2Н5ОН + О2→ СН3СООН + Н2О.
Химические и физические свойства
Физические свойства уксусной кислоты следующие:
В следующих примерах показаны кислотные свойства уксусной кислоты.
Качественной реакцией на наличие ацетатов является их взаимодействие с сильными кислотами. Уксус вытесняется из водных растворов солей. При этом появляется характерный запах.
Хранение и транспортировка
Промышленная уксусная кислота наливается в транспортную тару (оцинкованные металлические бочки или канистры из полимерных материалов). В магазины раствор поступает в стеклянных или пластиковых бутылках с навинчивающимися крышками или пробками.
Хранить это вещество нужно в плотно закрытой таре в помещениях, которые специально приспособленные для хранения воспламеняющихся веществ. Места хранения уксусной кислоты должны быть защищенными от попадания прямых солнечных лучей и осадков.
Класс опасности уксусной кислоты – 8: едкие и коррозийные вещества.
Перевозку нужно осуществлять в цистернах из нержавеющей стали. Они не должны иметь нижнего слива. Наливные отверстия, люки оборудуются герметичными резиновыми, полиэтиленовыми прокладками, которые предотвращают расплескивание жидкости в процессе перевозки.
ООО «Эверест» осуществляет оптовые поставки уксусной ледяной (этановой) кислоты по выгодным ценам. Подробнее по телефону: +7 (812) 448-47-55.
Уксусная кислота – химические свойства
Уксусная кислота представляет собой одноосновную кислоту. Химический характер данной кислоты определяется наличием в ней карбоксила – СООН.
По показателям химических свойств, уксусная кислота считается слабой кислотой, ее константа электролитической диссоциации составляет 1,82*10 5 мол/л при температуре 18°С. Высококонцентрированная уксусная кислота, точно также, как и минеральные кислоты, способна нейтрализовать гидраты и основные окислы, а также эффективно вытеснять из углекислых солей углекислоту. При этом она дает соответствующие средние соли которые называются ацетатами. Именно на этом свойства уксусной кислота основано получения уксуснокислых солей в технике.
В ходе нейтрализации гидроокисей уксусной кислотой, таких как КОН, NaOH, Ca(OH)2, интенсивно выделяется почти 56 кДж/г*экв. В случае нейтрализации гидроокиси аммония будет выделяться 50,3 кДж/г*экв.
Никак не воздействует на углекислые соли безводная уксусная кислота или же ее спиртовой раствор. Все наоборот, углекислота активно вытесняет уксусную кислоту из водно-спиртового раствора уксуснокислых солей, при этом углекислые соли, выпадают в осадок (будучи вовсе нерастворимыми в спирте).
Уксуснокислые средние соли тяжелых металлов также можно получить при помощи обменного разложения ацетатов щелочноземельных или щелочных металлов с хлоридами или сульфатами соответствующих тяжелых металлов. Свинец, медь, железо (свободные металлы) способны заместить водород уксусной кислоты, при этом образуя соответствующие соли:
Последняя реакция, в которой часть кислоты восстанавливается до ацетальдегида из-за слабоактивной меди протекает, но очень медленно. По этой причине медь считается одним из самых важных материалов для производства оборудования, необходимого в ходе производства уксусной кислоты.
В присутствии кислорода (воздуха) реакция уксусной кислоты с металлами протекает намного быстрее, особенно если используется свинец или железо. Реакция уксусной кислоты с магнием и цинком даже на холоде протекает достаточно энергично, особенно если в кислоте концентрация ионов водорода будет максимальной. Практически все средние соли уксусной кислоты растворяются в воде и отлично кристаллизуются. Только одновалентная уксуснокислая ртуть и уксуснокислое серебро являются исключением.
Хорошо растворимы в воде ацетаты щелочноземельных металлов, выделяющиеся из растворов в виде кристаллогидратов. Например, в 100г воды при 20°С растворяется безводной соли 35г Ca(CH3COO)2, 41г Sr(CH3C00)2 и 72г Ва(СН3С00)2. Константы диссоциации ионов 3CH3COO этих солей равны соответственно 0,17(Са), 0,36 (Sr) и 0,39 (Ba).
Карбоновые кислоты
Классификация карбоновых кислот
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.
Получение карбоновых кислот
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты.
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.
Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.
При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
Сложные эфиры
Ангидриды
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.
Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.