Как заряжены протоны электроны нейтроны
Атомы
Атом — это мельчайшая химически неделимая частица вещества, а также наименьшая часть химического элемента, являющаяся носителем его свойств. Химически неделимая означает, что атом в ходе химических реакций не делится на более мелкие части.
Атомы очень маленькие частицы, их размер находится в диапазоне от одного до пяти ангстрем (обозначается — Å.). Один ангстрем — это 10 –10 метра.
Состав и строение атомов
Атомы состоят из ещё более мелких частиц.
Пример. Атом гелия состоит из ядра, в котором находятся два протона и два нейтрона, и двух электронов:
Ядро атома — это центральная часть атома, в которой сосредоточена основная его масса и весь положительный электрический заряд. Ядро атома состоит из протонов и нейтронов.
Протоны и нейтроны имеют общее название — нуклоны.
Ядра атомов имеют положительный заряд, так как состоят из протонов с положительным зарядом и нейтронов. По величине заряд равен количеству протонов в ядре и совпадает с порядковым номером элемента в периодической системе.
Протоны, нейтроны и электроны имеют общее название — элементарные частицы или субатомные частицы.
| Название | Символ | Заряд |
|---|---|---|
| Протон | p + | +1 |
| Нейтрон | n 0 | 0 |
| Электрон | e | -1 |
Заряд протона и электрона одинаковы по величине, но противоположны по знаку. Любой атом содержит равное число протонов и электронов, значит заряд ядра и суммарный заряд всех электронов атома одинаковы по величине, но противоположны по знаку. Следовательно, атомы являются электронейтральными частицами.
Число протонов, нейтронов и определение заряда ядра: список примеров
Содержание:
Атом – частица, которая включает протоны, нейтроны и электроны. Совокупность протонов и нейтронов атома формирует ядро, вокруг которого движутся электроны. Все элементы, содержащиеся в атоме, имеют свои особенности.
Строение атомного ядра
У протонов и нейтронов масса примерно одинакова и равна 1. Они схожи по строению, но различны по заряду. Протоны обладают положительным зарядом, а нейтроны – нулевым. Сумма протонов и нейтронов в одном атоме называется массовым числом.
Порядковый номер атома кремния равен 14. Таким образом, заряд ядра атома кремния равен 14. Ядро составляют 14 протонов и 14 нейтронов. Массовое число кремния равно 28.
Электроны
Электроны, главное число которых равно одному (n=1), размещаются на первом энергетическом уровне. Изменение главного квантового числа связано со скачкообразным изменением энергии. При этом электроны могут переходить на следующий уровень. Максимальное число электронов на энергетическом уровне определяется по формуле:
Например, на первом энергетическом уровне согласно формуле может располагаться только два электрона, а на втором – восемь электронов.
Электроны, находящиеся на внешнем уровне, слабо связаны с атомным ядром, поэтому при химических взаимодействиях эти электроны легко отсоединяются. В электронейтральных атомах число электронов соответствует его порядковому номеру.
Сколько электронов в электронейтральном атоме кремния, можно узнать по порядковому номеру элемента. Таким образом, у кремния 14 электронов.
Как в одном атоме умещается вся физика
Большинство людей, представляя себе атом, рисуют в воображении небольшое ядро, состоящее из протонов и нейтронов, вокруг которого двигаются один или несколько электронов. Это представление основано на интерпретации квантовой механики, основанной на частицах. Но для описания атомов в стандартных условиях его недостаточно.
Если вы хотите раскрыть секреты Вселенной, вам только и нужно, что допрашивать её, пока она не выдаст ответы в такой форме, в какой вы сможете их понять. При взаимодействии двух квантов энергии – будь то частицы или античастицы, массивные они или безмассовые, фермионы или бозоны – его результат в принципе может рассказать вам о правилах и законах, которым подчиняется эта система. Если мы будем знать о всех возможных вариантах результатов любого взаимодействия, включая их относительные вероятности – только тогда мы сможем говорить о том, что понимаем, что происходит.
Удивительно, но всё, что мы знаем о Вселенной, можно так или иначе привязать к самой скромной из всех известных нам сущностей: к атому. Атом – это мельчайшая единица материи, всё ещё сохраняющая уникальные характеристики макроскопического мира, такие, как физические и химические свойства. И при этом это фундаментально квантовая сущность, со своими уровнями энергии, свойствами и законами сохранения. Более того, этот непримечательный атом связан со всеми четырьмя известными фундаментальными взаимодействиями. В единственном атоме на самом деле можно увидеть всю физику. И вот, что она может рассказать нам о Вселенной.
От макроскопических до субатомных масштабов, размеры фундаментальных частиц играют небольшую роль в определении размеров композитных структур. Пока неизвестно, являются ли эти строительные кирпичики по-настоящему фундаментальными и точечными частицами, но мы понимаем, как устроена Вселенная от больших, космических масштабов до мелких, субатомных. В человеческом теле содержится порядка 10 28 атомов.
Здесь на Земле существует около 90 элементов, появившихся естественным путём – в результате протекания создавших их космических процессов. По сути, элемент – это атом, чьё ядро состоит из протонов, (и возможно) нейтронов. Вокруг ядра находятся несколько электронов, чьё количество равно количеству протонов. У каждого элемента есть свой набор свойств, среди которых:
Разнообразие атомов и управляющие движущимися по орбите вокруг ядер электронами – идентичными частицами — квантовые правила позволяют без преувеличения сказать, что всё под Солнцем состоит из атомов – в том или ином виде.
Атомным и молекулярным комбинациям несть числа. Но конкретные комбинации этих составляющих, присущие определённому материалу, определяют его свойства. Принято считать, что алмазы – это самое твёрдое вещество на Земле, но на самом деле это и не самый прочный материал в принципе, и не самый прочный из природных материалов. На сегодня известно уже шесть более прочных материалов, и ожидается, что их количество будет только расти.
Каждый атом с уникальным набором протонов в ядре формирует уникальные связи с другими атомами, благодаря чему типов молекул, ионов, солей и более крупных структур может быть почти бесконечное количество. Друг на друга субатомные частицы воздействуют в основном при помощи электромагнитных сил. В итоге со временем формируются макроскопические структуры, которые мы наблюдаем не только на Земле, но и по всей Вселенной.
Общим свойством всех атомов является наличие у них массы. И чем больше протонов и нейтронов в ядре, тем больше масса атома. И хотя это квантовые сущности, а диаметр одного атома не превышает одного ангстрема, дальность действия гравитации ничем не ограничена. Любой объект, обладающий энергией– включая и энергию покоя, придающую частицам массу – будет искривлять ткань пространства-времени согласно общей теории относительности Эйнштейна. Какой бы малой масса не была, каким бы ни было малым расстояние, кривизна пространства-времени, вызванная любым количеством атомов — будь то 10 57 атомов в звезде, 10 28 атомов в человеческом теле, или один атом гелия – будет происходить точно в соответствии с ОТО.
Появление массы в пустой трёхмерной решётке заставляет её линии искривляться определённым образом. Они как бы вытягиваются в сторону массы. Искривление пространства из-за гравитационного воздействия Земли – это один из способов визуализации гравитации, и фундаментальное отличие общей теории относительности от специальной.
Это примечательно по двум причинам. Во-первых, когда один атом приближается к другому (или к группе атомов), они могут взаимодействовать. На квантовом уровне их волновые функции могут накладываться, и атомы связываются вместе в молекулы, ионы и соли. У этих связных структур есть свои уникальные формы и конфигурации электронных облаков. Соответственно, у них есть свои уникальные уровни энергии, поглощающие и испускающие фотоны только с определёнными длинами волн.
Атомные электронные переходы в атоме водорода и длины волн возникающих фотонов демонстрируют энергию связей и взаимоотношение электрона и протона в квантовой физике.
Эти электронные переходы в атоме или группе атомов уникальны: они свои для каждого атома или конфигурации из группы атомов. Обнаружив спектральные линии атома или молекулы – неважно, поглощения или испускания – можно сразу же сказать, что это за атом или молекула. Внутренние электронные переходы согласуются с уникальным набором энергетических уровней, и переходы электронов недвусмысленно свидетельствуют о типе и конфигурации атома/атомов.
По всей Вселенной атомы и молекулы подчиняются одним и тем же правилам: законам классической и квантовой электродинамики, управляющими всеми заряженными частицами. Даже внутри самого атомного ядра, состоящего из обладающих зарядом кварков и глюонов без электрического заряда, электромагнитные связи играют важнейшую роль. Эта внутренняя структура объясняет, почему магнитный момент протона почти в три раза сильнее магнитного момента электрона (и имеет противоположный знак), а у нейтрона магнитный момент почти в два раза больше, чем у электрона, и имеет тот же знак.
У самого низкого энергетического уровня водорода (1S) слева вверху очень плотное вероятностное электронное облако. У более высоких энергетических уровней облака похожи, но имеют более сложную структуру. Для первого возбужденного состояния есть две независимых конфигурации: 2S и 2P, у которых из-за почти неуловимого эффекта получаются разные энергетические уровни.
Хотя электрическое взаимодействие работает на довольно больших расстояниях – на самом деле, как и у гравитации, у него тоже нет никаких ограничений – электрическая нейтральность атома в целом играет невероятно важную роль в понимании поведения всей Вселенной. Электромагнитное взаимодействие невероятно сильно – два протона отталкиваются с силой, в 10 36 раз превышающей их гравитационное притяжение!
Но поскольку привычные нам макроскопические объекты состоят из такого количества атомов, и поскольку атомы сами по себе электрически нейтральны, мы что-то замечаем, только если:
Если потереть два разных материала, к примеру, ткань и пластик, можно перенести заряды с одного на другой, в результате чего оба объекта окажутся заряженными.
На классическом и квантовом уровнях в атоме закодировано огромное количество информации, связанное с электромагнитными взаимодействиями, при этом «классической» (не квантовой) ОТО достаточно для объяснения когда-либо встреченных нами атомных и субатомных взаимодействий. Если забраться в атом ещё глубже, вовнутрь протонов и нейтронов, можно раскрыть природу и свойства оставшихся фундаментальных взаимодействий: слабого и сильного.
Опускаясь на фемтометровые масштабы, сначала вы начнёте замечать влияние сильного взаимодействия. Впервые оно проявляется между разными нуклонами – протонами и нейтронами, из которых состоит любое ядро. Электрическое взаимодействие между двумя нуклонами либо отталкивает их (заряды протонов одинаковые), либо не возникает (зарядов у нейтронов нет). Но на малых расстояниях работает взаимодействие, ещё более сильное, чем электромагнитное: сильное взаимодействие, работающее между кварками через обмен глюонами. Разные протоны и нейтроны могут обмениваться парами кварков-антикварков – мезонами – это связывает их в ядре, и при подходящей конфигурации преодолевает силу электромагнитного отталкивания.
Отдельные фотоны и нейтроны не обладают «цветом», а содержащиеся внутри них кварки – обладают. Обмен глюонами может происходить не только внутри протона или нейтрона, но и между протонами и нейтронами, благодаря чему возникают связи внутри ядра.
В глубине атомного ядра сильное взаимодействие проявляет себя по-другому: отдельные кварки постоянно обмениваются глюонами. Кроме гравитационного заряда (массы) и электромагнитного заряда, присущего материи, есть ещё и заряд, характерный для кварков и глюонов: цветной. Они не просто всегда притягиваются, как гравитация, или обладают двумя зарядами, которые могут отталкиваться или притягиваться, как электрические. У них есть три независимых цвета – красный, зелёный и синий – и три антицвета. Встречаются они только в «бесцветной» комбинации, в которой комбинируются все три цвета (или антицвета), или же сочетаются комбинации цвет-антицвет.
Удерживает протоны и нейтроны в целости обмен глюонами – в особенности, когда кварки отдаляются, и сильное взаимодействие увеличивается. Чем больше энергии вы можете передать через столкновение с субатомными частицами, тем больше кварков, антикварков и глюонов сможете увидеть. Похоже на то, будто бы внутренности протона заполнены целым морем частиц, и чем сильнее его бить, тем более липкими они становятся. Углубляясь на величину максимальной доступной нам энергии, мы всё равно не видим ограничения на плотность этих субатомных частиц внутри атомных ядер.
Протон – это не просто три кварка с глюонами. Это целое море плотных частиц и античастиц. Чем подробнее мы изучаем протон, чем больше энергии тратим на неупругие столкновения, тем больше внутренней структуры мы в нём находим.
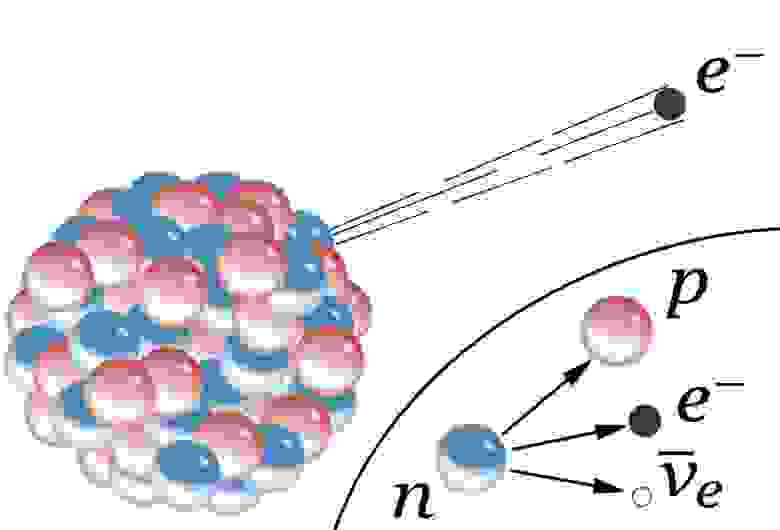
Но не всякий атом способен вечно жить в стабильной конфигурации. Многие атомы испытывают радиоактивный распад – рано или поздно испускают на одну или несколько частиц, что фундаментально меняет их свойства. Самый распространённый вид распада – альфа-распад, при котором нестабильный атом выплёвывает ядро гелия с двумя протонами и двумя нейтронами. Второй по распространённости тип – бета-распад, при котором атом выплёвывает электрон и антиэлектронное нейтрино, а один из нейтронов ядра превращается в протон.
Схематичное изображение бета-распада массивного атомного ядра. Нейтрон превращается в протон, электрон и антиэлектронное нейтрино. До открытия нейтрино казалось, что в бета-распадах не сохраняются энергия и импульс.
Из этого следует нечто примечательное: если взять любую частицу Вселенной, даже пока не открытую, но подверженную одному из этих взаимодействий, она также будет взаимодействовать и с атомами. Через взаимодействия с частицами, находящимися внутри ничем не примечательного атома, мы открыли огромное количество частиц – в том числе, всяческие типы нейтрино и антинейтрино. Атом – это и то, из чего мы состоим, и окно в истинную природу материю.
Чем глубже мы заглядываем в строительные кирпичики материи, тем лучше мы понимаем и природу самой Вселенной. Только допрашивая Вселенную на предмет того, каким правилам подчиняются все частицы и античастицы, и как они связываются друг с другом, мы можем разобраться в её устройстве. И пока наука и технология, подвластные нам, позволяют зарываться всё глубже, обидно было бы отказываться от исследований только потому, что они не могут гарантировать нам какое-нибудь новое революционное открытие. Единственное, что известно точно: если мы не будем зарываться глубже, мы так ничего и не найдём.

Сложными веществами называются такие вещества, которые путем химических реакций могут быть разложены на другие, более простые вещества. В отличие от сложных простыми веществами называются такие, которые химическим путем не могут быть разложены на еще более простые вещества.
Примером сложного вещества может служить вода, которая путем химической реакции может быть разложена на два других, более простых вещества — водород и кислород. Что же касается последних двух, то они химическим путем уже не могут быть разложены на более простые вещества, а поэтому являются простыми веществами, или, иначе, химическими элементами.
Изучая свойства химических элементов, Д. И. Менделеев подметил, что свойства их периодически повторяются в зависимости от их атомного веса. Эту периодичность он отобразил в форме таблицы, вошедшей в науку под названием «Периодическая система элементов Менделеева».
Ниже приведена современная периодическая таблица химических элементов Менделеева.
Согласно современным представлениям науки каждый химический элемент состоит из совокупности мельчайших материальных (вещественных) частиц, называемых атомами.
Атомом называется самая малая доля химического элемента, которая уже не может быть разложена химическим путем на другие, более мелкие и простые материальные частицы.
Атомы различных по своей природе химических элементов отличаются друг от друга своими физико-химическими свойствами, структурой, размерами, массой, атомным весом, собственной энергией и некоторыми иными свойствами. Например, атом водорода резко отличается по своим свойствам и структуре от атома кислорода, а последний — от атома урана и т. д.
За условную единицу измерения атомных весов химических элементов принята 1/16 часть веса атома кислорода, В соответствии с этим атомным весом химического элемента называют отвлеченное число, показывающее, во сколько раз вес данного химического элемента больше 1/16 части веса атома кислорода.
В периодической таблице элементов Д. И. Менделеева приведены атомные веса всех химических элементов (см. число, помещенное под названием элемента). Из этой таблицы мы видим, что наиболее легким атомом является атом водорода, имеющий атомный вес 1,008. Атомный вес углерода равен 12, кислорода — 16 и т. д.
Что же касается более тяжелых химических элементов, то их атомный вес превышает атомный вес водорода более чем в двести раз. Так, атомный вер ртути равен 200,6, радия — 226 и т.д.Чем выше порядок номера, занимаемого химическим элементом в периодической системе элементов, тем больше атомный вес.
Большая часть атомных весов химических элементов выражается дробными числами. Это в известной мере объясняется тем, что такие химические элементы состоят из совокупности скольких сортов атомов, обладающих различными атом весами, но одинаковыми химическими свойствами.
Химические элементы, занимающие один вый номер в периодической системе элементов, а следовательно, обладающие одинаковыми химическими свойствами, но различными атомными весами, называются изотопами.
Элементарные частицы вещества
Долгое время считалось, что атомы химических элем являются пределом делимости вещества, т. е. как бы элементарными «кирпичиками» мироздания. Современная наука отвергла эту гипотезу, установив, что атом любого химического эле представляет собой совокупность еще более мелких материальных частиц, чем сам атом.
Чтобы понять строение атомов и физико-химические процессы в них, необходимо хотя бы вкратце ознакомиться с основными характеристиками элементарных частиц, входящих в состав атомов.
Исключительно малая «масса покоя» электрона свидетельствует о том, что инертные свойства электрона проявляются исключительно слабо, а это значит, что электрон под влиянием переменной электрической силы может колебаться в пространстве с частотой во много миллиардов периодов в секунду.
Масса электрона настолько мала, что для получения одного грамма электронов их потребовалось бы взять 1027 единиц. Чтобы иметь хотя бы некоторое физическое представление об этом колоссально большом числе, приведем такой пример. Если бы можно было один грамм электронов расположить на прямой линии вплотную друг к другу, то они образовали бы цепочку длиной в четыре миллиарда километров.
Масса электрона, как и всякой иной вещественной микрочастицы, зависит от скорости его движения. Электрон, находясь в состоянии относительного покоя, обладает «массой покоя», имеющей механическую природу, как и масса всякого физического тела. Что же касается «массы движения» электрона, увеличивающейся с ростом скорости его движения, то она электромагнитного происхождения. Она обусловлена наличием у движущегося электрона электромагнитного поля как некоторого вида материи, обладающего массой и электромагнитной энергией.
Чем быстрее движется электрон, тем больше проявляются инерционные свойства его электромагнитного поля, тем, следовательно, больше масса последнего и соответственно электромагнитная энергия его. Так как электрон со своим электромагнитным полем составляет единую, органически связанную материальную систему, то естественно, что массу движения электромагнитного поля электрона можно непосредственно приписать самому электрону.
Электрон, помимо свойств частицы, обладает и волновыми свойствами. Опытом установлено, что поток электронов, подобно световому потоку, распространяется в форме волнообразного движения. Характер волнового движения электронного потока в пространстве подтверждается явлениями интерференции и дифракции электронных волн.
Интерференция электронов — это явление наложения электронных воли друг на друга, а дифракция электронов — это явление огибания электронными волнами краев узкой щели, сквозь которую проходит электронный поток. Следовательно, электрон — это не просто частица, а «частица-волна», длина которой зависит от массы и скорости движения электрона.
Установлено, что электрон, помимо своего поступательного движения, совершает еще и вращательное движение вокруг своей оси. Этот вид движения электрона получил название «спина» (от английского слова «спин» — веретено). В результате такого движения электрон, кроме электрических свойств, обусловленных электрическим зарядом, приобретает еще и магнитные свойства, напоминая в этом отношении элементарный магнитик.
Протон — это вещественная частица, обладающая положительным электрическим зарядом, равным по абсолютной величине электрическому заряду электрона.
В отличие от электрона и протона, нейтрон не обладает электрическим зарядом, т. е. он является электронейтральной «элементарной» частицей вещества. Масса нейтрона практически равна массе протона.
Электроны, протоны и нейтроны, находясь в составе атомов, взаимодействуют друг с другом. В частности, электроны и протоны взаимно притягиваются друг к другу как частицы, обладающие разноименными электрическими зарядами. Одновременно с этим электрон от электрона и протон от протона отталкиваются как частицы, обладающие одноименными электрическими зарядами.
Взаимодействие всех этих электрически заряженных частиц происходит через их электрические поля. Эти поля представляют собой особый вид материи, состоящей из совокупности элементарных материальных частиц, называемых фотонами. Каждый фотон обладает строго определенным присущим ему количеством энергии (квантом энергии).
Ядерные силы значительно превосходят по своей величине электрические силы взаимного отталкивания протонов в ядре атома. Это приводит к тому, что они в состоянии не только преодолеть внутри ядер атомов силы взаимного отталкивания протонов, но и создать из совокупности протонов и нейтронов весьма прочные системы ядер.
Устойчивость ядра каждого атома зависит от соотношения двух противоречивых сил — ядерных (взаимное притяжение протонов и нейтронов) и электрических (взаимное отталкивание протонов).
Мощные ядерные силы, действующие в ядрах атомов, способствуют превращению нейтронов и протонов друг в друга. Эти взаимопревращения нейтронов и протонов осуществляются в результате выделения или поглощения ими более легких элементарных частиц, например мезонов.
Рассмотренные нами частицы названы элементарными потому, что они не состоят из совокупности других, более простых частиц материи. Но в то же время не надо забывать, что они способны превращаться друг в друга, возникать за счет друг друга. Таким образом, эти частицы являются некоторыми сложными образованиями, т. е. их элементарность условна.
Химическое строение атомов
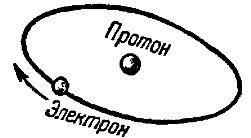
Простейшим по своему устройству атомом является атом водорода. Он состоит из совокупности только двух элементарных частиц — протона и электрона. Протон в системе атома водорода играет роль центрального ядра, вокруг которого по некоторой орбите вращается электрон. На рис. 1 схематически показана модель атома водорода.
Рис. 1. Схема строения атома водорода
Эта модель — только грубое приближение к действительности. Дело в том, что электрон как «частица-волна» не обладает резко отграниченным от внешней среды объемом. А это значит, что следует говорить не о некоторой точной линейной орбите электрона, а о своеобразном электронном облачке. При этом электрон чаще всего занимает некоторую среднюю линию облачке, являющуюся одной из возможных орбит его в атоме.
Надо сказать, что и сама орбита электрона не является строга неизменной и неподвижной в атоме — она тоже в силу изменения массы электрона совершает некоторое вращательное движение. Следовательно, движение электрона в атоме носит относительно сложный характер. Так как ядро атома водорода (протон) и вращающийся вокруг него электрон обладают разноименными электрическими зарядами, то они взаимно притягиваются.
Одновременно с этим стой энергии электрон, вращаясь вокруг ядра атома, развивает центробежную силу, стремящуюся удалить его от ядра. Следовательно, электрическая сила взаимного притяжения ядра атома и электрона и центробежная сила, действующая на электрон, — силы противоречивые.
При равновесии их электрон занимает относительно устойчивое положение на некоторой орбите в атоме. Так как масса электрона очень мала, то для уравновешивания силы притяжения к ядру атома он должен вращаться с громадной скоростью, равной примерно 6 · 10 15 оборотам в секунду. Это значит, что электрон в системе атома водорода, как и всяком ином атоме, движется по своей орбите с линейной скоростью, превышающей тысячу километров в секунду.
В нормальных условиях электрон вращается в атоме рода по наиболее близко расположенной к ядру орбите. При этом он обладает минимальным возможным количеством энергии. Если же по тем или иным причинам, например под воздействием каких-либо иных материальных частиц, вторгнувшихся систему атома, электрон перейдет на более удаленную от атома орбиту, то он уже будет обладать несколько большим количеством энергии.
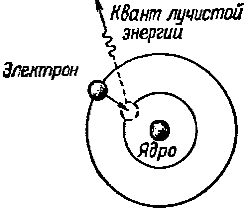
Однако на этой новой орбите электрон но пребывает ничтожно малое время, после чего он снова вращается на ближайшую к ядру атома орбиту. При этом ходе он отдает излишек своей энергии в виде кванта эле магнитного излучения — лучистой энергии (рис. 2).
Рис. 2. Электрон при переходе с далекой орбиты на более близкую к ядру атома излучает квант лучистой энергии
Чем больше получает извне энергии электрон, тем на удаленную от ядра атома орбиту он переходит и тем большее количество электромагнитной энергии он излучает, когда вращается на ближайшую к ядру орбиту.
Измеряя количество энергии, излучаемой электроном при переходе с различных орбит на ближайшую к ядру атома, удалось установить, что электрон в системе атома водорода, как и в системе любого иного атома, может переходить не на любую произвольную орбиту, на строго определенную в соответствии с той энергией, которую он получает под действием внешней силы. Орбиты, которые может занимать электрон в атоме, называются дозволенными орбитами.
Так как положительный заряд ядра атома водорода (заряд протона) и отрицательный заряд электрона численно равны, то суммарный их заряд равен нулю. Это значит, что атом водорода, находясь в нормальном состоянии, является электронейтральной частицей.
Это справедливо для атомов всех химических элементов: атом любого химического элемента, находящийся в нормальном со стоянии, является электронейтральной частицей из-за численного равенства его положи тельных и отрицательных зарядов.
Поскольку в состав ядра атома водорода входит только одна «элементарная» частица — протон, то так называемое массовое число этого ядра равно единице. Массовым числом ядра атома любого химического элемента называется общее число протонов и нейтронов входящих в состав этого ядра.
Природный водород в основном состоит из совокупности атомов с массовым числом, равным единице. Однако в составе его имеется и другой сорт атомов водорода, с массовым числом равным двум. Ядра атомов этого тяжелого водорода называемые дейтонами, состоят из двух частиц — протона и нейтрона. Этот изотоп водорода называется дейтерием.
В природном водороде дейтерия содержится весьма незначительное количество. На каждые шесть тысяч атомов легкого водорода (массовое число равно единице) приходится только один атом дейтерия (тяжелого водорода). Существует еще один изотоп водорода — сверхтяжелый водород получивший название тритий. В ядрах атома этого изотопе водорода имеются три частицы: протон и два нейтрона, связанных друг с другом ядерными силами. Массовое число ядра атома трития равно трем, т. е. атом трития в три раза тяжелей атома легкого водорода.
Хотя атомы изотопов водорода и имеют различные массы но все же они обладают одинаковыми химическими свойствами, Например, легкий водород, вступая в химическое взаимодействие с кислородом, образует с ним сложное вещество — воду. Аналогично этому изотоп водорода — дейтерий, соединяясь с кислородом, образует воду, которая в отличие от обычной воды называется тяжелой водой. Тяжелая вода находит большое применение в процессе производства ядерной (атомной) энергии.
Следовательно, химические свойства атомов зависят не от массы их ядер, а только от строения электронной оболочки атома. Поскольку в атомах легкого водорода, дейтерия и трития имеется одинаковое количество электронов (по одному на каждый атом), эти изотопы имеют одинаковые химические свойства.
Химический элемент водород не случайно занимает первый номер в периодической системе элементов. Дело в том, что между номером любого элемента в периодической системе элементов и величиной заряда ядра атома этого элемента существует некоторая связь. Ее можно сформулировать так: порядковый номер всякого химического элемента в периодической системе элементов численно равен положительному заряду ядра этого элемента, а следовательно, и числу вращающихся вокруг него электронов.
Так как водород занимает первый номер в периодической системе элементов, то это значит, что положительный заряд ядра его атома равен единице и что вокруг ядра вращается один электрон.
Химический элемент гелий занимает второй номер в периодической системе элементов. Это значит, что он имеет положительный электрический заряд ядра, равный двум единицам, т. е. в составе его ядра должно быть два протона, а в электронной оболочке атома — два электрода.
Природный гелий состоит из двух изотопов — тяжелого и легкого гелия. Массовое число тяжелого гелия равно четырем. Это значит, что в состав ядра атома тяжелого гелия, помимо вышеупомянутых двух протонов, должны входить еще два нейтрона. Что же касается легкого гелия, то его массовое число равно трем, т. е. в состав его ядра, помимо двух протонов, должен входить еще один нейтрон.
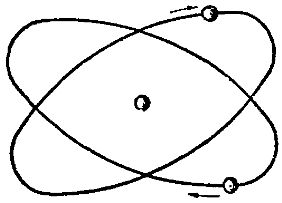
Установлено, что в природном гелии число атомов легкого гелия составляет примерно одну миллионную долю атомов тяжелого гения. На рис. 3 показана схематически модель атома гелия.
Рис. 3. Схема строения атома гелия
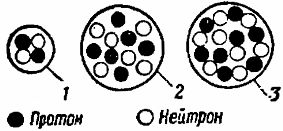
Дальнейшее усложнение строения атомов химических элементов идет за счет увеличения количества протонов и нейтронов в ядрах этих атомов и одновременно за счет увеличения количества электронов, вращающихся вокруг ядер (рис. 4). Пользуясь периодической системой элементов, легко определить число электронов, протонов и нейтронов входящих в состав различных атомов.
Порядковый номер химического элемента равен числу протонов, находящихся в ядре атома, а одновременно с этим числу электронов, вращающихся вокруг ядра. Что же касается атомного веса, то он приближенно равен массовому числу атома, т. е. числу вместе взятых протонов и нейтронов в ядре. Следовательно, вычитая из атомного веса элемента число, равное порядковому номеру элемента, можно определить, какое количество нейтронов содержится в данном ядре.
Установлено, что ядра легких химических элементов, имеющих в своем составе поровну протонов и нейтронов, отличаются весьма большой прочностью, так как ядерные силы в них относительно велики. Например, ядро атома тяжелого гелия отличается исключительно большой прочностью, так как оно составлено из двух протонов и двух нейтронов, связанных друг с другом мощными ядерными силами.
Ядра атомов более тяжелых химических элементов содержат в своем составе уже неодинаковое количество протонов и нейтронов, поэтому их связь в ядре слабее, чем в ядрах легких химических элементов. Ядра этих элементов могут быть относительно легко расщеплены при бомбардировке их атомными «снарядами» (нейтронами, ядрами атома гелия и т. д.).
Что же касается наиболее тяжелых химических элементов, в частности радиоактивных, то их ядра отличаются настолько малой прочностью, что они самопроизвольно распадаются на составные части. К примеру, атомы радиоактивного элемента радия, состоящего из совокупности 88 протонов и 138 нейтронов, самопроизвольно распадаются, превращаясь в атомы радиоактивного элемента радона. Атомы же последнего в свою очередь распадаются на составные части, переходя в атомы других элементов.
Ознакомившись вкратце с составными частями ядер атомов химических элементов, рассмотрим строение электронных оболочек атомов. Как известно, электроны могут вращаться вокруг ядер атомов только по строго определенным орбитам. При этом они так сгруппированы в электронной оболочке каждого атома, что можно различить отдельные слои электронов.
В каждом слое может находиться количество электронов, не превышающее строго определенного числа. Так, например, в первом, ближайшем к ядру атома электронном слое может находиться максимум два электрона, во втором — не более восьми электронов и т. д.
Те атомы, у которых внешние электронные слои целиком заполнены, имеют наиболее устойчивую электронную оболочку. Это значит, что данный атом прочно держит все свои электроны и не нуждается в получении извне добавочного количества их. Например, атом гелия имеет два электрона, целиком заполняющих первый электронный слой, а атом неона имеет десять электронов, из которых первые два целиком заполняют первый электронный слой, а остальные — второй (рис. 5).
Рис. 5. Схема строения атома неона
Следовательно, атомы гелия и неона имеют вполне устойчивые электронные оболочки, не стремятся их как-нибудь видоизменить количественно. Такие элементы химически инертны, т. е. не вступают в химическое взаимодействие с другими элементами.
Или, например, атом кислорода имеет восемь электронов, из которых два целиком заполняют первый слой, а остальные шесть размещены во втором слое. Таким образом, для полного завершения построения второго электронного слоя в атоме кислорода ему не хватает только двух электронов. Поэтому атом кислорода не только прочно удерживает свои шесть электронов во втором слое, но и обладает возможностью притянуть к себе два недостающих ему электрона для заполнения своего второго электронного слоя. Этого он достигает путем химического соединения с атомами таких элементов, у которых внешние электроны слабо связаны со своими ядрами.
Химические элементы, атомы которых не имеют целиком заполненных электронами внешних электронных слоев, как правило, химически активны, т. е. охотно вступают в химическое взаимодействие.
Итак, электроны в атомах химических элементов располагаются в строго определенном порядке и всякое изменение их пространственного расположения или количества в электронной оболочке атома приводит к изменению физико-химических свойств последнего.
Равенство числа электронов и протонов в системе атома является причиной того, что суммарный электрический заряд его равен нулю. Если равенство числа электронов и протонов в системе атома нарушается, то атом становится электрически заряженной системой.
Атом, в системе которого нарушено равновесие разноименных электрических зарядов вследствие того, что он потерял часть своих электронов или, наоборот, приобрел лишнее количество их, называется ионом.
Способность разноименных ионов взаимно притягиваться друг к другу является причиной того, что они химически соединяются, образуя более сложные частицы вещества — молекулы.
В заключение следует отметить, что размеры атома очень велики по сравнению с размерами тех вещественных частиц, из которых они состоят. Ядро самого сложного атома вместе со всеми электронами занимает миллиардную долю объема атома. Простой подсчет показывает, что если бы удалось один кубический метр платины сжать так крепко, чтобы исчезли внутриатомные и междуатомные пространства, то получился бы объем, равный примерно одному кубическому миллиметру.
Если Вам понравилась эта статья, поделитесь ссылкой на неё в социальных сетях. Это сильно поможет развитию нашего сайта!
Подписывайтесь на наш канал в Telegram!
Просто пройдите по ссылке и подключитесь к каналу.
Не пропустите обновления, подпишитесь на наши соцсети: