Как заставить работать костный мозг
Физическая нагрузка стимулирует иммунные клетки костного мозга
В костном мозге был обнаружен особый тип предшественников остеоцитов, который, как выяснилось, помогает поддерживать образование иммунных клеток лимфоцитов в ответ на физические упражнения.
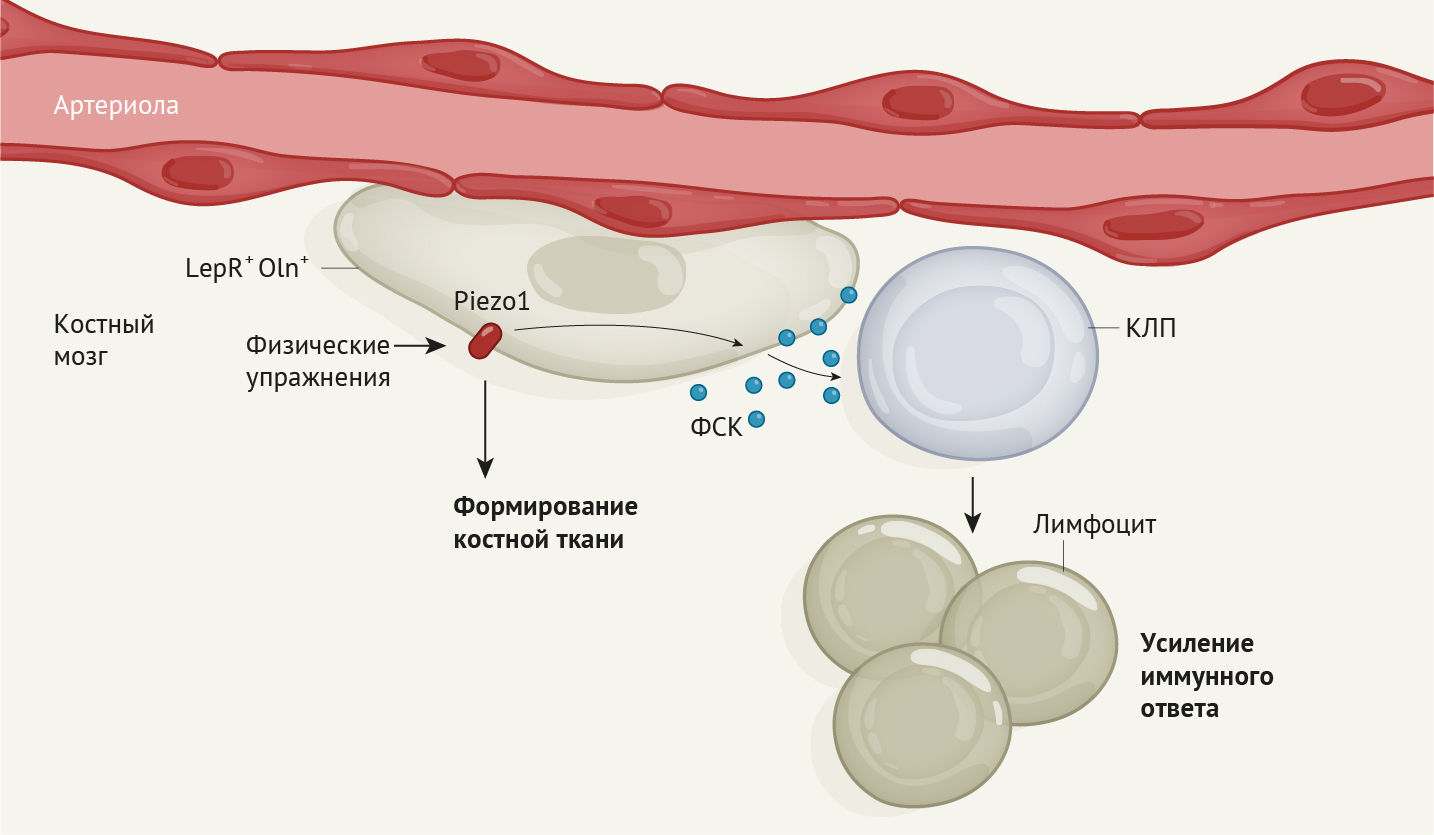
В костном мозге по-настоящему тесно от клеток. Бок о бок сосуществует много типов стволовых клеток [1, 2] и клеток-предшественников (например, предшественников иммунокомпетентных клеток). Их жизнедеятельность поддерживается за счет соседей, которые создают специальную защитную среду для стволовых клеток, называемую нишей. Взаимодействие между клетками ниши, также известными как стромальные клетки, и ранними предшественниками иммунных клеток в костном мозге изучено плохо. Понимание того, как координируется это взаимодействие, поможет лучше понять, как образуются предшественники иммунных клеток. В своей статье в «Nature» Shen с соавт. [3] решили часть этой загадки, определив роль физической нагрузки в процессе стимулирования связи между одним типом стромальных клеток и предшественниками иммунокомпетентных клеток у мышей, что в итоге помогло организму животных бороться с инфекцией.
Затем Shen с соавт. вывели генетически мутантных мышей, у которых Oln + клетки были лишены способности кодировать ФСК. Отсутствие этого фактора у Oln + клеток в итоге не влияло на гемопоэтические стволовые клетки или большинство иных типов гемопоэтических клеток-предшественников в костном мозге. Тем не менее, это привело к значительному уменьшению численности одного специфического типа гемопоэтических клеток — клеток-предшественников лимфопоэза (КПЛ), из которых развиваются лимфоциты. В поддержку гипотезы о том, что Oln + клетки способствуют образованию и поддержанию пула КПЛ, авторы исследования продемонстрировали, что Oln + клетки и КПЛ располагаются близко друг к другу в костном мозге. Затем ученые заразили мутантных мышей болезнетворной бактерией Listeria monocytogenes, от которой обычно организм очищают лимфоциты. Уничтожение патогенов в организме животных-мутантов происходило гораздо менее эффективно, чем у животных из группы контроля. Вследствие снижения численности КПЛ в организме животных не производились в достаточном количестве лимфоциты.
Известно, что механическая стимуляция костей во время выполнения упражнений способствует их формированию [6]. В заключительной серии экспериментов Shen с соавт. поместили мышей в клетки с беговыми колесами и обнаружили, что бег приводит к увеличению количества как Oln + клеток, так и КПЛ в костном мозге. Ученые выявили экспрессию белка механочувствительного ионного канала Piezo1 клетками Oln + и обнаружили, что у генетической линии мышей, у которых отсутствует этот белок, количество КПЛ аномально низкое. Таким образом, ученые открыли ранее неизвестный путь, с помощью которого физическая нагрузка, воспринимаемая через механочувствительный белок Piezo1, запускает экспрессию ФСК в клетках-предшественниках остеогенеза для поддержки функционирования КПЛ. В конечном счете, так контролируется часть функций иммунной системы (рис. 1).
Открытие того, что механочувствительные клетки-предшественники остеогенеза участвуют в борьбе с бактериальными инфекциями, впечатляет. Известно, что физические нагрузки могут стимулировать иммунную систему [7], однако успех работы Shen с соавт. показывает, почему это так. У результатов данной работы есть прямое клиническое применение. К примеру, существование механизма, раскрытого учеными в текущем исследовании, может быть использовано для разработки более эффективных методов усиления иммунного клеточного ответа (его запуск с помощью физических упражнений). Логичным следующим шагом станет проверка, действительно ли бег может улучшить элиминацию бактериальных патогенов у мышей. Еще один ключевой вопрос, который необходимо разрешить, заключается в том, поможет ли увеличение количества Oln + клеток и КПЛ в костном мозге обеспечить защиту от иных болезнетворных бактерий или даже вирусов, и может ли это усилить ответ на действие вакцинации.
Авторы также обнаружили, что количество ниш Oln + и количество КПЛ ниже в костном мозге 18-месячных мышей, чем их 2-месячных собратьев. Пожилые животные также активны [8], поэтому на снижение количества ниш и КПЛ, связанное со старением, влияют другие факторы, помимо снижения двигательной активности.
Крайне важно исследовать, к примеру, изменяется ли способ, с помощью которого ниши Oln + воспринимают механическую стимуляцию с течением времени. Или какие эпигенетические изменения (модификации ДНК, которые могут изменять экспрессию гена без изменения самой последовательности нуклеотидов ДНК) в старых Oln + клетках способствуют снижению эффективности восприятия механической стимуляции для генерации сигнальных молекул, таких как ФСК.
Хорошо известно, что механочувствительность играет важную роль в физиологии костной ткани, но ключевое значение механических сигналов было также описано для иных типов клеток, например, клеток-предшественников ткани поджелудочной железы, стволовых клеток кишечника и эндотелиальных клеток, образующих выстилку кровеносных сосудов. Хотя о клеточных нишах, которые поддерживают функционирование стволовых клеток вне костного мозга, известно меньше, мелкие сосуды и, следовательно, эндотелиальные клетки являются главными кандидатами на роль структурных элементов таких ниш. Тогда, возможно, что механочувствительность в формирующих ниши эндотелиальных клетках может способствовать поддержанию других типов стволовых клеток и клеток-предшественников. В таком случае работа Shen с соавт. может иметь большое значение для биологии стволовых клеток.
АПЛАСТИЧЕСКАЯ АНЕМИЯ (НЕДОСТАТОЧНОСТЬ КОСТНОГО МОЗГА)
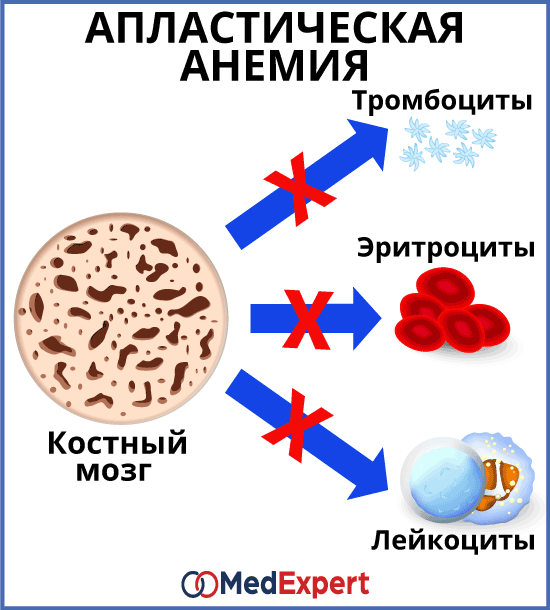
Апластическая анемия – это заболевание, при котором костный мозг перестает производить клетки крови в достаточном количестве. Апластическая анемия сопровождается слабостью, повышает риск развития инфекционных заболеваний и неконтролируемых кровотечений.
Апластическая анемия – редкое, но очень тяжелое заболевание, которое может развиться в любом возрасте. Она может появиться внезапно или прогрессировать медленно в течение длительного времени, ухудшая состояние пациента.
Различают два вида заболевания:
СИМПТОМЫ АПЛАСТИЧЕСКОЙ АНЕМИИ
Каждый вид кровяных клеток выполняет свои функции:
Симптомы болезни зависят от того, каких кровяных клеток недостаточно, однако в некоторых случаях, может присутствовать дефицит всех трех видов клеток одновременно. Характерными симптомами являются:
При низком количестве эритроцитов:
При низком количестве лейкоцитов:
При низком количестве тромбоцитов:
Почему апластическую анемию можно спутать с миелодиспластическим синдромом?
Апластическую анемию можно спутать с заболеванием, которое называется миелодиспластическим синдромом. Миелодиспластический синдром – это группа заболеваний, при которых костный мозг вырабатывает новые кровяные клетки, но они деформированы или недоразвиты. При этом синдроме костный мозг иногда характеризуют как «гиперпластический», имея в виду, что в нем содержится много кровяных клеток. Но у некоторых пациентов с этим синдромом костный мозг почти пуст, поэтому заболевание может быть ошибочно диагностировано как апластическая анемия.
Взаимосвязь с другими редкими заболеваниями
У части больных с апластической анемией может наблюдаться такая редкая аномалия, как пароксизмальная ночная гемоглобинурия, при которой происходит слишком быстрое разрушение эритроцитов. Пароксизмальная ночная гемоглобинурия может привести к развитию апластической анемии, а также апластическая анемия может развиться в пароксизмальную ночную гемоглобинурию.
Анемия Фанкони – это редкое, наследственное заболевание, которое приводит к развитию апластической анемии. Дети, рожденные с болезнью Фанкони, обычно, отстают в развитии и могут иметь различные врожденные дефекты, такие как недоразвитость конечностей. Болезнь диагностируется при помощи лабораторных исследований крови.
ЛЕЧЕНИЕ АПЛАСТИЧЕСКОЙ АНЕМИИ
Лечение апластической анемии может заключаться в наблюдении и контроле состояния пациента при легкой степени тяжести заболевания, переливании крови и медикаментозном лечении в более тяжелых случаях, и в необходимости проведения трансплантации костного мозга в тяжелых случаях. Тяжелая форма апластической анемии, при которой количество кровяных клеток слишком низкое, представляет угрозу жизни и требует немедленной госпитализации и лечения.
Переливание крови
Лечение апластической анемии, обычно, включает переливание крови для того, чтобы контролировать кровотечения и уменьшить интенсивность симптомов. Переливание крови не может излечить от болезни, но будет способствовать уменьшению признаков и симптомов, восполняя кровяные клетки, которые костный мозг не в состоянии производить. Переливание крови может включать:
И хотя официально нет ограничений для количества переливания крови, все же многоразовые процедуры могут привести к осложнениям. Переливаемые эритроциты содержат железо, которое, накапливаясь в организме, может нанести ущерб жизненно важным органам при отсутствии необходимой терапии, способствующей его выведению из организма. Применение специальных препаратов поможет организму избавиться от избытка железа. Другое возможное осложнение может развиться со временем в связи с тем, что организм начнет вырабатывать антитела к переливаемым кровяным клеткам, что сделает лечение менее эффективным. Для снижения вероятности развития этого осложнения назначается иммуносупрессивная терапия.
Пересадка стволовых клеток
Пересадка стволовых клеток для восстановления здоровья костного мозга с помощью донорских стволовых клеток может быть единственным выбором для лечения тяжелой апластической анемии. Трансплантация стволовых клеток, иногда называемая пересадкой костного мозга, является предпочтительным методом лечения для пациентов молодого возраста, имеющих подходящего донора – чаще всего таковым является брат или сестра.
Если донор найден, то перед трансплантацией стволовых клеток пациент подвергается воздействию лучевой и химиотерапии, которые разрушают его собственный костный мозг, а вместе с ним злокачественные клетки, и освобождают место для нового костного мозга. Далее у донора производится забор стволовых клеток. Здоровые стволовые клетки вводят внутривенно, и по кровеносной системе они транспортируются в полости костей, где начинают производить новые клетки крови. Эта процедура требует длительной госпитализации. С целью предотвращения отторжения донорских стволовых клеток, после трансплантации назначаются специально действующие препараты.
Трансплантация стволовых клеток сопряжена с риском. Есть вероятность, что организм начнет отторгать трансплантат, что может привести к угрожающим жизни осложнениям. Кроме того, пересадка костного мозга показана не каждому пациенту, а также не всегда удается найти подходящего донора.
Иммуносупрессивная терапия
В случаях, когда пациенту невозможно провести пересадку костного мозга, или апластическая анемия является результатом аутоиммунных нарушений, для лечения заболевания назначают препараты, которые изменяют или подавляют иммунную систему (иммуносупрессанты).
К таким препаратам относятся циклоспорин (Gengraf, неорал, сандиммун) и антитимоцитарный глобулин (Тимоглобулин). Эти лекарственные везества подавляют деятельность иммунных клеток, которые повреждают костный мозг. Лечение помогает восстановить костный мозг и повысить содержание кровяных телец в крови. Циклоспорин и антитимоцитарный глобулин часто используются комбинировано.
В комплексе с этими препаратами часто назначаются кортикостероидные лекарства, такие как метилпреднизолон (медрол, солу-медрол).
Иммуносупрессоры могут быть очень эффективными для лечения апластической анемии. Отрицательным моментом является то, что эти препараты ослабляют иммунную систему. Кроме того, существует вероятность, что после отмены лекарств апластическая анемия может возвратиться.
Стимуляторы кроветворения в костном мозге
Некоторые препараты, включая колониестимулирующие факторы, такие как сарграмостим (лейкин), филграстим (нейпоген), пегфилграстим (нейласта) и эпоэтин альфа (эпоген, прокрит), могут стимулировать кроветворение в костном мозге. Препараты, стимулирующие кроветворение, могут применяться в комбинации с иммуносупрессорами.
Антибактериальное и противовирусное лечение
Апластическая анемия ослабляет иммунную систему в связи с тем, что в крови снижен уровень лейкоцитов, которые защищают организм от инфекций. Это делает больного восприимчивым к различным инфекционным заболеваниям.
При первых признаках инфекционного заболевания, таких как повышенная температура, жар, ломота во всем теле необходимо обратиться к врачу. Развитие инфекционного заболевания может быть опасным для жизни больного с апластической анемией. Для лечения и профилактики инфекционных заболеваний назначают антибактериальные и противовирусные препараты.
МЕТОДЫ ДИАГНОСТИКИ АПЛАСТИЧЕСКОЙ АНЕМИИ
Для диагностики апластической анемии рекомендуются следующие методы:
«. Сообразно с моими силами и моим разумением» — донорство костного мозга — вклад в здоровое будущее
«. Сообразно с моими силами и моим разумением» — донорство костного мозга — вклад в здоровое будущее
Авторы
Редакторы
Статья на конкурс «Био/Мол/Текст»: Представленная статья посвящена трансплантации костного мозга. В результате проведенного опроса (около 150 респондентов) мы выявили среднюю осведомленность по данному вопросу и решили осветить тонкости процесса, разобрать биологические механизмы, лежащие в его основе, и продемонстрировать некоторые современные тенденции.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Что собой представляет костный мозг?
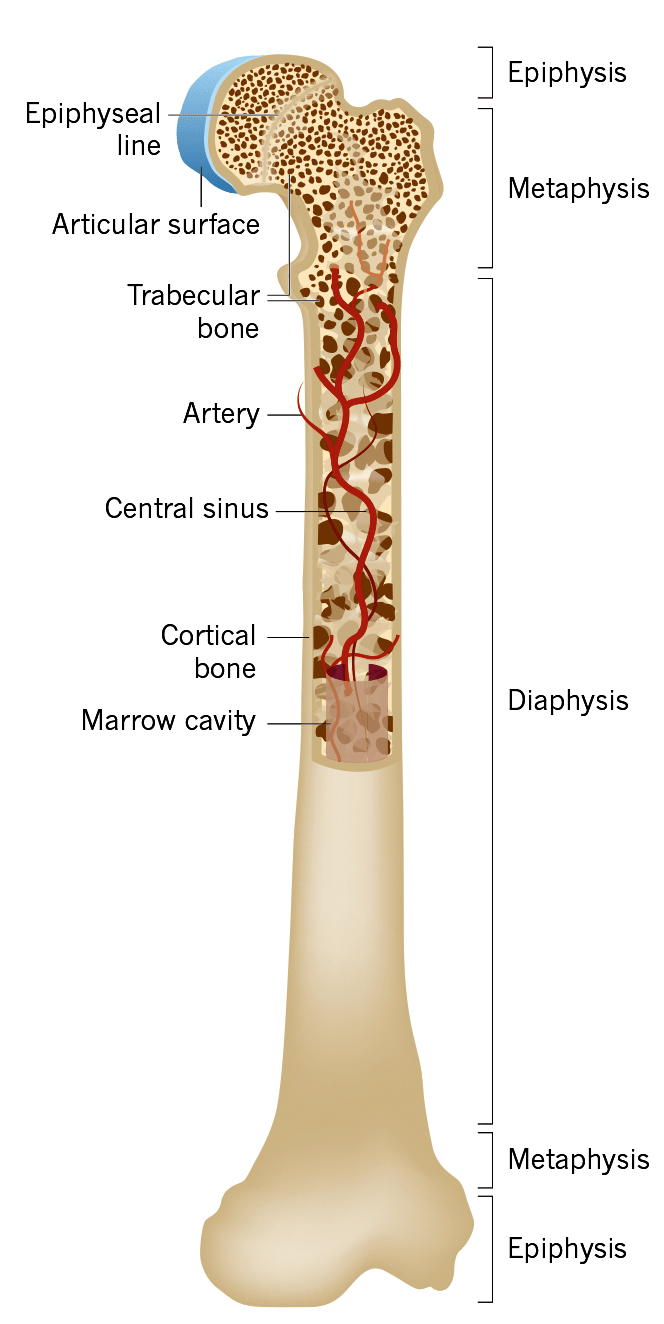
Рисунок 1. Общая анатомия кости
Сочетание слов «костный» и «мозг» может сбивать с толку и навевать стереотипные образы. Под мозгом мы привыкли представлять «рыхлую массу» в форме грецкого ореха, располагающуюся в голове. Костный мозг интуитивно можем путать со спинным, ошибочно предполагая, что он располагается в позвоночном столбе.
На самом же деле, костный мозг (КМ) — это гемо- и лимфопоэтический орган, располагающийся в полостях губчатой части и костномозговых каналах костей (рис. 1).
Выделяют две разновидности КМ — красный, цвет которого обусловлен обилием крови и гемопоэтичеких клеток, и желтый, окраска которого связана с наличием большого количества жировых клеток (адипоцитов), замещающих большинство кроветворных клеток [1].
Первоначально у человека имеется только красная разновидность, которая по мере взросления частично переходит в желтую.
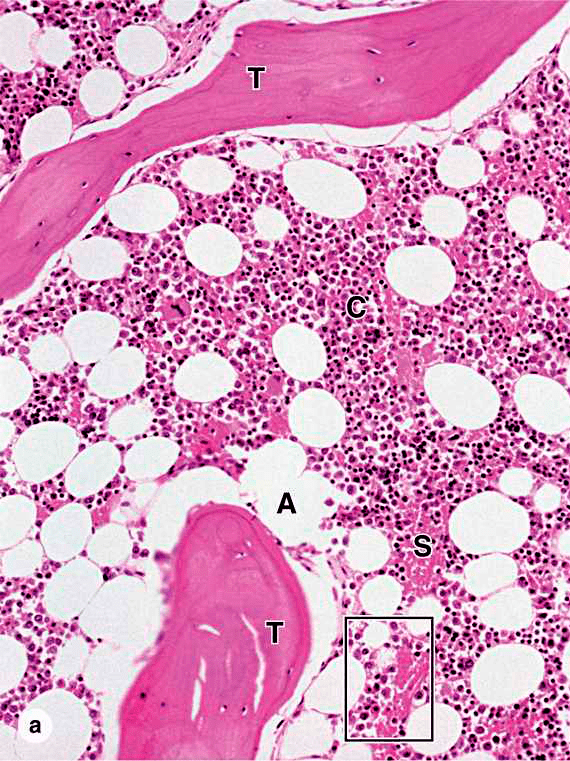
Красный костный мозг (рис. 2) состоит из ретикулярной стромы соединительной ткани, кровяных тяжей или островков клеток и синусоидальных капилляров. Строма представлена фибробластическими (стромальными = ретикулярными = адвентициальными) клетками, макрофагами и тонкими ретикулярными волокнами, состоящими из коллагена I типа, протеогликанов, фибронектинов и ламинина. Желтый костный мозг представляет собой подобную структуру, отличающуюся большим числом адипоцитов и меньшим количеством сосудов, гемопоэтических клеток [2].
Рисунок 2. Гистологический срез красного костного мозга. Т — трабекулы губчатой кости; А — адипоциты; S — синусоиды, заполненные кровью; C — кроветворные тяжи.
Какие функции выполняет кровеносная система?
Стабильное кровообращение необходимо каждому организму. Кровь выполняет множество разнообразных функций:
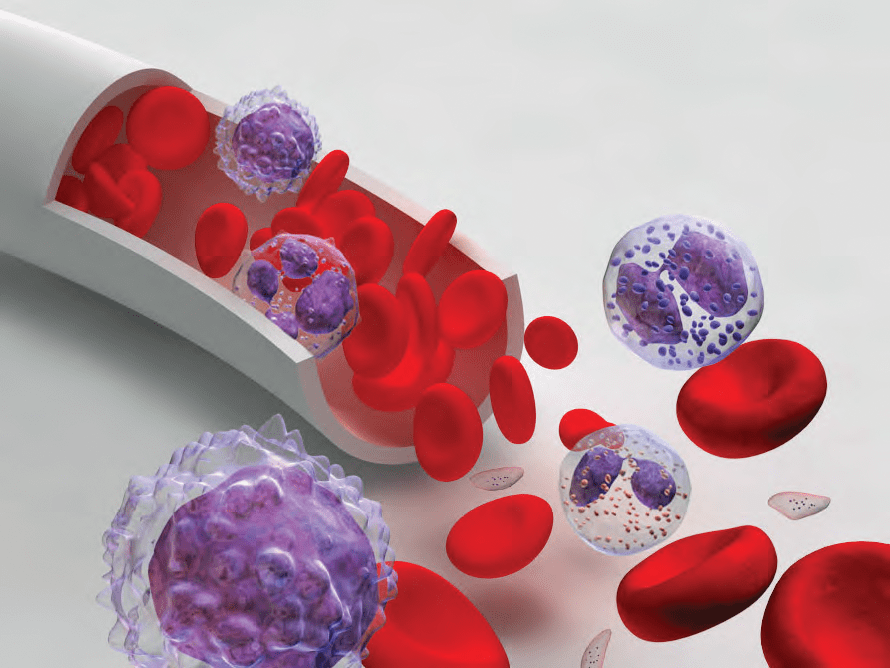
Столь большое разнообразие функций кровь может выполнять благодаря необычности своего гистологического строения: (1) форменные элементы (эритроциты, лейкоциты и тромбоциты) и (2) плазма (рис. 3). Источником форменных элементов является костный мозг. Бóльшая часть пула клеток формируется красным костным мозгом, остальная — желтым. [4].
Рисунок 3. Схема кровеносного сосуда с форменными элементами
Почему люди нуждаются в костном мозге?
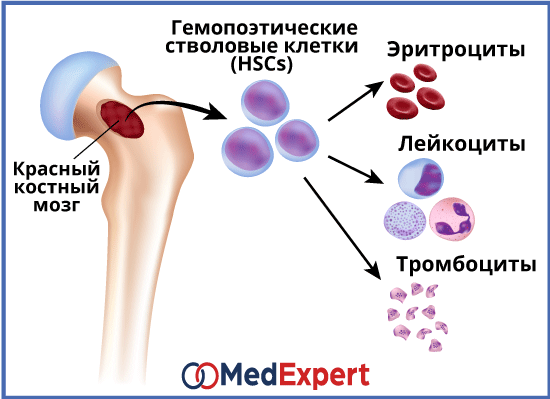
Костный мозг является одним из центральных органов как кровеносной, так и иммунной систем [5]. Как отмечалось ранее, в нем находятся гемопоэтических стволовые клетки, способные дифференцироваться в различные клетки крови, например, в эритроциты, макрофаги или Т-лимфоциты.
Возникновение патологий этого органа приводит к снижению эффективности его деятельности, что ведет к ухудшению работоспособности иммунной и кровеносной систем. Организм человека становится более уязвимым. Возникает потребность в трансплантации донорского материала.
Нарушение целостности костного мозга может, произойти, например, при лечении онкозаболеваний. Вследствие применения химио- и лучевой терапии уничтожаются раковые, но вместе с ними и другие активно делящиеся клетки организма, в том числе, компоненты костного мозга. Организм теряет возможность производить форменные элементы крови.
Без трансплантации костного мозга подобное лечение нередко может принести больше вреда, нежели пользы, поскольку в итоге приводит к серьезным нарушениям в работе всего организма. В трансплантации нуждаются люди, больные лейкозом, апластической анемией, злокачественными лимфомами, аутоиммунными заболеваниями и пр.
Информированность о трансплантации костного мозга
Мы провели опрос группы потенциальных доноров (141 человека) из разных городов России (Санкт-Петербург, Москва, Орел, Казань и др.). Опросник состоял из 17 вопросов, 7 из которых были построены по методу семантического потенциала Ч. Осгуда.
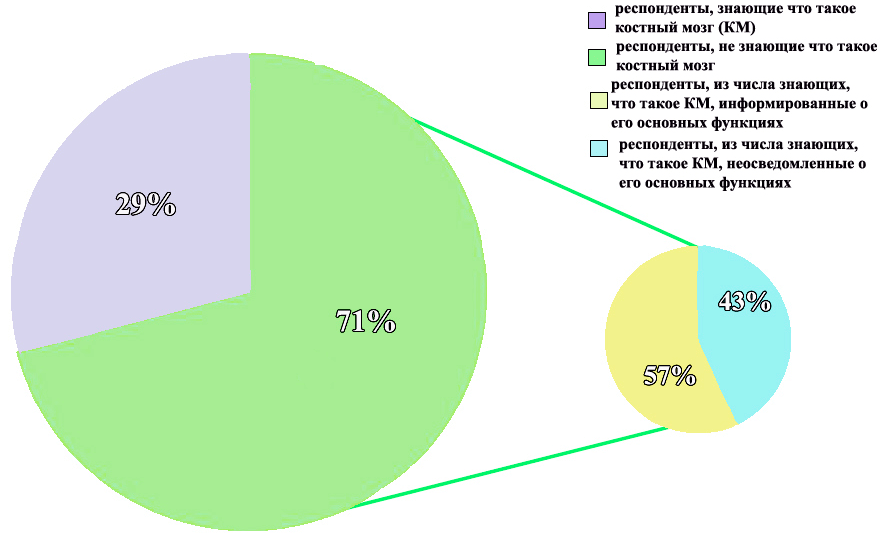
В результате проведения опроса была установлена средняя осведомленность граждан по вопросу устройства костного мозга и его функций: более половины опрошенных (71%, то есть 100 человек) дали верное определение костному мозгу, из них наиболее полно и верно перечислили его функции 43% респондентов (рис. 4).
Рисунок 4. Диаграмма анализа информированности о костном мозге и его функциях
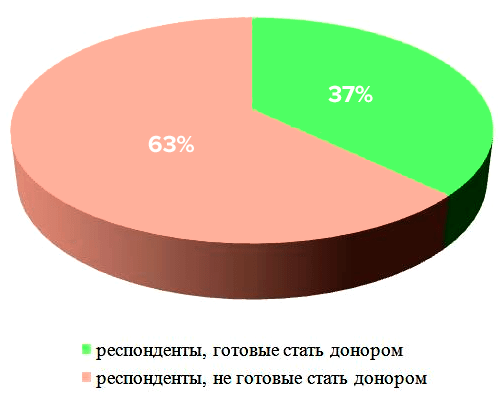
Большинство опрошенных (95,3%) знают о наличии донорства костного мозга в разной степени (от информированности о самом факте подобной операции, до сведений о многих деталях процесса). Люди осведомлены о проблеме благодаря СМИ (43,4% опрошенных), социальным сетям (50,4%) и близкому кругу (друзьям, родственникам) — 24%. Меньше половины респондентов задумывалось о том, что, став донором, смогли бы спасти жизнь (48,3%). Больше половины опрошенных (62,4%) (рис. 5) не стали бы совершать донацию костного мозга и не знают о наличии регистра доноров (65,4%). Респонденты в большинстве случаев не согласились бы сдавать костный мозг в связи со страхом получить болевые ощущения (47%) и необратимые травматичные изменения собственного здоровья (56,7%).
Рисунок 5. Диаграмма анализа количества потенциальных доноров костного мозга
Трансплантация
Трансплантация КМ состоит из четырех этапов:
Трансплантация гемопоэтических клеток костного мозга бывает двух видов: аутологичная и аллогенная.
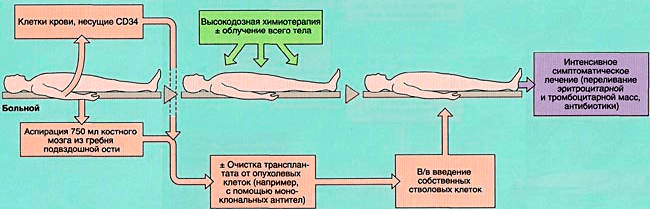
При аутологичной пересадке (рис. 6а) используются собственные стволовые клетки пациента. До жесткой химиотерапии отбираются и замораживаются клетки костного мозга. Далее, после проведения процедуры, они вводятся обратно в организм.
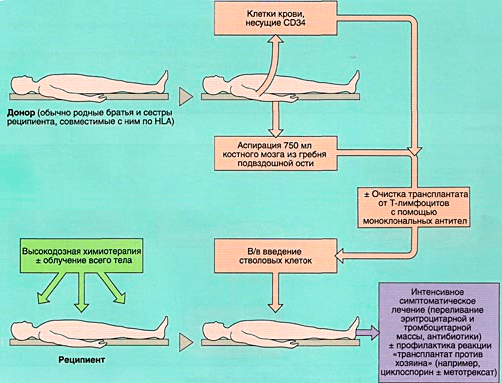
Аллогенная трансплантация (рис. 6б) представляет собой пересадку гемопоэтической ткани от здорового подходящего донора. Выделяют три вида подобной трансплантации (в зависимости от источника материала): совместимого родственного, совместимого неродственного и не полностью совместимого родственного происхождения.
Рисунок 6а. Схема аутологичной трансплантации костного мозга
Рисунок 6б. Схема аллогенной трансплантации костного мозга
Выделение нескольких типов обусловлено различием главного комплекса гистосовместимости (МНС) у разных людей и разной вероятностью возникновения осложнений при трансплантации.
Прежде чем обсудить непосредственно аллогенную трансплантацию, разберемся в том, что же такое МНС, откуда он берется и зачем нужен.
Главный комплекс гистосовместимости (МНС) — это несколько групп генов, кодирующих специфический мембранный белок — лейкоцитарный антиген человека (HLA), который осуществляет презентацию антигенов. Благодаря этому процессу происходит распознавание чужеродных антигенов и формирование адаптивного иммунного ответа. Основа последнего заключается в активации В-лимфоцитов, ответственных за формирование антител, и Т-лимфоцитов с макрофагами, обеспечивающих клеточный иммунитет (физическое удаление инородного агента). Поскольку комплекс гистосовместимости является тонкой структурой и направлен на защиту собственного организма, то у разных людей данный фактор может быть различен, следовательно, при смешивании биологических тканей, будь то кровь или костный мозг, есть шанс возникновения реакции «трансплантат против хозяина» (РТПХ). Проявление такой реакции может привести к полному неприживлению материала (иммунный ответ реципиента на клетки донора). Во избежание возникновения РТПХ до пересадки у донора и рецепиента определяют степень гистосовместимости путем HLA-типирования. По тому, насколько высока совместимость, и выделяют типы аллогенной трансплантации:
Как происходит процедура типирования и донации стволовых клеток?
Для типирования и определения HLA-генотипа у потенциального донора берут образец крови до 10 мл [9]. Проводят лабораторные исследования и вносят полученную информацию в общероссийскую базу — Национальный регистр доноров.
Если потенциальный донор подходит больному, начинается процесс изъятия стволовых клеток. Его возможно осуществить двумя путями: шприцом из тазовой кости, или с помощью препаратов, которые способствуют выходу недифференцированных стволовых клеток в кровь. В первом случае, донора госпитализируют в больницу и под общим наркозом производят забор. В тазовой кости делают несколько маленьких разрезов, через которые специальными иглами извлекают около литра жидкого костного мозга (такой объем составляет не более 5% от общего количества и компенсируется организмом в течение двух недель).
Побочные эффекты для донора при данном способе забора могут быть следующими: болевые ощущения в тазовых костях, снижение уровня гемоглобина, тошнота, сонливость, слабость (последствия наркоза).
Во втором случае донор проходит подготовительный период (около пяти дней). В течение этого времени человеку подкожно вводится препарат (рекомбинантные факторы роста = гранулоцит-колониестимулирующий фактор = гранулоцит-макрофаг-колониестимулирующий фактор) для стимуляции пролиферации и мобилизации стволовых клеток. На пятый день донору проводят процедуру афереза (получение отдельных компонентов костного мозга путем центрифугирования) длительностью 3–5 часов. Кровь забирается из вены, проходит клеточный сепаратор (установку с несколькими камерами и системой подвода/вывода жидкости и клеточной культуры, предназначенную для разделения пула на группы по размеру, удельному весу и другим характеристикам) и возвращается донору. После прохождения через аппарат, из крови выделяют небольшое количество стволовых клеток. Процедура повторяется несколько раз для отбора необходимого количества материала. Суммарно через аппарат может проходить до 15 литров крови, из которых в сепараторе остается до 200 мл (остальное отправляется обратно донору).
Побочные эффекты для донора могут быть различны: ломота в костях, связанная с активным делением клеток костного мозга; обострение аутоиммунных заболеваний (например, артрита, красной волчанки).
Риски, связанные с серьезными последствиями для организма донора в обоих случая минимален, однако при применении перфузионного катетера есть шанс возникновения кровотечения, появления абсцесса или иной местной инфекции [6]. Как правило, спустя 2–3 недели все неприятные ощущения и последствия донации проходят.
В мировой практике существует регламент, по которому донор и реципиент не должны знать друг о друге. Максимум предоставляемой информации — возраст и пол. Знакомство может произойти лишь спустя два года после трансплантации. Донорам также не сообщают: помог ли их костный мозг вылечить больного. Это не тайна, а вынужденная анонимность. Регламент соблюдается в целях предосторожности и в силу психологических и этических причин.
История от реального донора костного мозга
«Я заключила некую сделку с небесами», — говорит Алла Багирянц, которая стала реальным донором костного мозга. В 2015 году маме девушки поставили диагноз: множественная миелома (рак плазматических клеток крови). Это подвигло девушку изучить данную тему. Так она узнала, что при этом типе заболеваний может понадобиться пересадка костного мозга. Лечение миеломы проходило с помощью трансплантации аутологичных стволовых клеток. Это помогло матери Аллы, теперь она в ремиссии. Болезнь близкого человека послужила толчком, и девушка вступила в регистр доноров костного мозга в Центре гематологии.
В 2019 году Алла узнала, что есть совпадение со сторонним реципиентом и необходимо приехать в клинику для расширенного типирования. Следовало провести дополнительные анализы, чтобы удостовериться, что ни одно заболевание не осталось незамеченным. Пересаживать стволовые клетки от не совсем здорового человека может быть опасно для реципиента, ведь на момент трансплантации иммунитет пациента полностью подавлен.
«Когда наступил непосредственный момент донации, — говорит Алла, — меня проконсультировали о двух способах извлечения стволовых клеток: из тазобедренной кости и из периферической крови. Я выбрала второй вариант, доверясь врачам. Мне сделали укол лейкостима. Он стимулирует выход гемопоэтических клеток в кровь. Затем в обе руки вставили катетеры. Из одной забирали кровь, которая проходила через центрифугу, в которой сепарировались гемопоэтические клетки. А во вторую возвращали оставшуюся кровь, не содержащую стволовых клеток. По прошествии некоторого времени после начала донации у меня стали неметь конечности и лицо, но я быстро сообщила медсестрам, и они сделали мне укол, который помог. Весь процесс занял около четырех часов. После процедуры я чувствовала себя хорошо, единственной проблемой была небольшая ломота в костях. Стволовые клетки сдавала в два захода, так как с первого раза не получилось взять нужное количество. Вся донация не страшнее, чем обычная сдача крови».
Расширение базы регистра позволит быстрее находить «генетического близнеца» нуждающемуся, тем самым увеличивая его шанс на выздоровление.
Что происходит при трансплантации с больным?
Перед тем как приступить к введению гемопоэтических клеток, врачи проводят процедуру кондиционирования (химиотерапию или лучевую терапию). Это делается с целью уничтожения раковых клеток (если лечение касается онкозаболеваний) или подавления иммунной системы, чтобы увеличить шанс приживления донорских клеток. Такой процесс имеет свои негативные последствия: тошнота и рвота, выпадение волос, кровотечения, сердечная и почечная недостаточности.
Затем наступает следующий этап. После того как врачи сделали пункцию (прокол стенки сосуда, полости или какого-либо органа с лечебной или диагностической целью) у донора, начинается непосредственное переливание реципиенту. Стволовые клетки попадают в организм больного и начинают свою работу. Донорские клетки с течением времени компенсируют недостаток клеток костного мозга реципиента, налаживая кроветворение и иммунную систему. Процесс приживления обычно требует нескольких недель, после чего показатели крови начинают нормализовываться.
Риск развития патологических реакций существует на всех стадиях адаптации организма после трансплантации. Реакция может начаться в течение первых месяцев после пересадки или развиться куда позже. Это происходит вследствие того, что донорские клетки подвергаются иммунному ответу организма реципиента.
Лечение спинного мозга с применением костного
Центральная нервная система имеет ограниченные способности к восстановлению, на которые негативно влияют различные факторы, в том числе связанные с повреждениями спинного мозга. Нарушения нервных структур и воспалительные процессы в них могут привести к инвалидности.
Однако исследования в области восстановления нейронов ЦНС дали почву для развития регенеративных методов лечения. Одним из многообещающих направлений в исследовании является метод введения стволовых клеток костного мозга совместно с плазмой крови, обогащенной тромбоцитами. Такой метод стимулирует регенерацию нейронов, поддерживая рост аксонов. Предполагалось, что данный вид лечения, с использованием концентрата клеток костного мозга, предпочтительнее из-за низкой способности на иммунный ответ и их большой распространенности.
На базе института Cedar Stem Cell Institute (штат Огайо, США) проводились процедуры ввода PRP (плазмы крови, обогащенной тромбоцитами) совместно с BMAC (концентратом стволовых клеток костного мозга) пациентам, имеющим повреждения в спинном мозге. Целью исследования было оценить изменения в состоянии пациентов, имеющих любой тип SCI (повреждение спинного мозга), а также отследить изменения индекса инвалидности ODI (показателя инвалидности, где более высокие значения эквивалентны более высокой инвалидности: от 0% до 100%).
Первый этап — выделение PRP и BMAC
Для получения PRP у пациентов отбирают по 60 мл периферической крови, добавляют 10 мл антикоагулянта цитратдекстрозы и центрифугируют полученную смесь с последующим концентрированием. В результате этого в среднем получается 7–8 мл плазмы, обогащенной тромбоцитами.
Получения BMAC проводят с помощью иглы для биопсии, которая через кожу и подкожные ткани вводится в правый гребень подвздошной кости. При помощи медленной аспирации отбирается 2 шприца по 25 мл, в которые добавляется по 1000 ед\мл гепарина. Полученную смесь фильтруют и центрифугируют в течение 10 минут, получая в итоге 17 мл BMAC.
После отбора PRP и BMAC смешивают в соотношении 1:2. Последним этапом данного метода является введение полученного препарата пациенту.
В эксперименте принимали участие семь человек с различными повреждениями спинного мозга, средний возраст пациентов составил 43,7 ± 2,33 года. После получения травмы пациенты перенесли минимум два вмешательства (физиотерапию и хирургическое вмешательство), а в период от 2,4 месяцев до 6,2 лет после травмы получили лечение смесью PRP и BMAC.
Показатели ODI отслеживали с помощью опроса по категориям: интенсивность боли, уход за собой, подъем, ходьба, положения сидя и стоя, сон, сексуальная жизнь, социальная жизнь и путешествия. Пациенты должны были оценить свое состояние от 0 (нет дискомфорта из-за травмы) до 5 (максимальный дискомфорт) в каждой категории. Все оценки складывались и делились на 50, чтобы получить процент функциональной инвалидности.
У 6 из 7 пациентов на момент начала эксперимента имелась значительная функциональная инвалидность. Один пациент после процедуры прекратил свои наблюдения, а динамика остальных пяти была отображена в исследовании. У двух пациентов наблюдались изменения от «тяжелой инвалидности» до «минимальной инвалидности», они вернули способность выполнять все бытовые дела самостоятельно. Показатели третьего пациента улучшились на 40% за год, а у четвертого улучшилось состояние на 28% за два месяца наблюдения.
Побочные эффекты наблюдались у одного из семи подопечных. Он не мог получать внутривенное введение препарата. Пациент сообщил о головной боли и трудностях, связанных с памятью.
Данный метод лечения помогает избежать дополнительного травмирования, которое возникает при введении инъекций в пораженный участок спинного мозга. Он безопасен и эффективен для восстановления после травм. У пациентов наблюдается положительная динамика и минимальное количество побочных эффектов. Потенциал такого лечения велик, и оно претендует занять передовое место при борьбе с повреждениями спинного мозга.
Как сегодня ищут донора костного мозга?
Мировая практика показала, что данные о донорах, протипированных по HLA, лучше хранить в виде единой информационной базы. Регистр Всемирной ассоциации доноров костного мозга содержит данные 37 млн добровольцев из 55 стран.
Формирование РДКМ (регистр доноров костного мозга) в России только начинает набирать обороты. Например, Русфонд совместно с Первым Санкт-Петербургским государственным медицинским университетом им. академика Павлова создал базу доноров костного мозга. Регистр был назван в честь Васи Перевощикова — больного, умершего от лейкоза в девять лет из-за отсутствия донора. Сегодня в регистре числится 40 258 потенциальных доноров. Однако регистра, объединяющего все города России, — нет, что усложняет поиск донора по всей стране. База разрознена по городам и учреждениям, поэтому шанс встретить генетически подходящего донора составляет 1:10 000.
Обращение к зарубежным регистрам возможно не всегда, поскольку процедура донации от иностранного гражданина может стоить порядка 20–50 тысяч долларов. Помимо этого, из-за многовариантности генотипов (связанной, например, с многонациональностью России) поиски донора могут закончиться провалом, т.к. не будет обнаружен подходящий по HLA-типу человека.
Вследствие этого в 20–40% случаев поиск в европейских регистрах заканчивается неудачей.
«В России нет обобщенной базы доноров костного мозга, — комментирует Виктор Андронов, заслуженный донор России, основатель движения “Энергия жизни”. — Они сообщаются между собой, обмениваясь данными, но дружат не все. Проблема заключается в том, что у нас до сих пор отсутствует законодательная база — нет закона о донорстве костного мозга. Организация Русфонд создала большую базу доноров, которая сейчас является самой перспективной в стране.
Помимо отсутствия общероссийского регистра проблемой является недостаточная информированность людей. Многие путают костный со спинным мозгом, считают, что процедура является болезненной, а иногда и вовсе не знают о донорстве.
В идеале, в регистре должен быть каждый. Нам стоило бы жить под лозунгом: “Все помогают всем”. В условиях коронавируса это крайне важно, т.к. нам с иностранными донорами очень сложно в этот период.
Количество доноров в регистре — вопрос национальной безопасности и индекса человеческой отзывчивости».
Создание единого регистра является решением проблем с трансплантацией, поскольку это снизит затраты на поиск и активацию донора, что увеличит шансы на жизнь нуждающихся в пересадке.
Людей спасет отзывчивость и причастность к общему делу. Донорство способно объединять против общей проблемы, связанной с серьезными заболеваниями. Трансплантация костного мозга — шанс на жизнь.