Proteus mirabilis в мазке у женщин что это значит
Proteus spp. (качественный метод)
Описание исследования
Proteus spp. – это род грамотрицательный факультативных анаэробных не образующих спор бактерий, представляющих нормальную, условно-патогенную флору кишечника. Патогенными для человека являются три вида протей – Proteus mirabilis, Proteus vulgaris и Proteus penneri, причем наиболее часто заболевания вызывает Proteus mirabilis.
Протеи похожи на мелкие нитевидные палочки, которые очень активно двигаются. Патогенное действие бактерий объясняется способностью вырабатывать эндотоксин и разрушать красные клетки крови (эритроциты). Кроме того, протеи обладают способностью вырабатывать уреазу – фермент, разлагающий мочевину (уреаза продуцируется также Хеликобактер пилори, что, при заселении протеями верхних отделов желудочно-кишечного тракта, может стать причиной ложноположительного результата при обследовании на инфицирование Helicobacter pylori). В результате реакции выделяется аммиак, способствующий образованию в почках фосфатных камней, микрогнойников, вызывающий некроз (отмирание) почечных тканей, снижение местного иммунитета. Поражение протеями происходит только в случае выхода бактерий за пределы нормальной среды обитания (желудочно-кишечного тракта). Они провоцируют развитие острых кишечных инфекций, которые протекают в форме:
Характерными признаками кишечных инфекций являются следующие симптомы:
Чаще всего кишечные инфекции развиваются у маленьких детей с пониженным иммунитетом. Также заболевание может возникнуть при бесконтрольном приеме антибиотиков.
Поражение протеем урогенитальных путей и почек может привести к развитию:
Кроме вышеперечисленного, Proteus spp. может стать причиной:
Заражение инфекцией может произойти:
Количество протей является показателем санитарного состояния среды. Наличие Proteus mirabilis рассматривают как показатель фекального загрязнения, а Proteus vulgaris —загрязнения объекта органическими веществами.
Данное исследование проводится методом полимеразной цепной реакции в режиме реального времени. В рамках теста исследуется соскоб эпителиальных клеток урогенитального тракта, задней стенки глотки, сперма, моча.
Подготовка к исследованию
Соскоб урогенитальный (цервикальный канал, влагалище, уретра)
Соскобы у женщин отбираются не ранее пятого дня от начала менструального цикла и не позже пятого дня до предполагаемой даты следующей менструации. Если наблюдаются явные признаки заболевания, отбор пробы проводится непосредственно в день обращения.
Требования по подготовке к тестированию:
Проба не отбирается:
Мочеиспускательный канал (уретра)
У лиц обоего пола проба отбирается не ранее чем через 14 дней после применения антибиотиков местного действия и 30 дней после перорального приема противобактериальных средств.
За неделю до манипуляции рекомендуется прекратить прием всех медицинских препаратов. Если отказ от лечения невозможен, то пациенту необходимо поставить об этом в известность специалиста, направляющего его на обследование.
При отборе эпителиальных клеток из мочеиспускательного канала, манипуляция проводится перед мочеиспусканием или через 2-3 часа после него (при обильных выделениях из уретры у мужчин – через 1 час).
Соскоб с задней стенки глотки
Перед отбором биологического материала необходимо учесть следующее:
При подготовке к взятию соскоба:
Перед проведением соскоба необходимо прополоскать рот, используя для этого воду комнатной температуры.
Для получения корректного результата тестирования все эти условия необходимо соблюсти в точности. Лечащий врач может рекомендовать иные условия проведения обследования.
Сперма
Отбор материала с целью диагностики проводится до начала противобактериального, антивирусного и противопаразитарного лечения, химиотерапии, а также до лечебных или диагностических мероприятий в месте предполагаемой локализации агента инфекции. После курса лечения проба отбирается не ранее, чем через 10-14 дней при проведении локальной терапии и через 30 дней после перорального приема антибиотиков.
На анализ собирается порция первой утренней мочи, выделенной не ранее, чем через 2-3 часа после предыдущего (ночного) мочеиспускания. Ее объем должен составлять порядка 20-30 мл. Емкость, используемая для сбора биоматериала – стерильный медицинский контейнер.
Моча собирается либо до проведения химиотерапии или лечения антибиотиками, либо через месяц после окончания курса лечения.
Перед началом манипуляции необходимо тщательно обмыть гениталии. Женщинам желательно воспользоваться гигиеническим тампоном во избежание попадания в пробу слизи из влагалища. Во время менструации материал не собирается.
После наполнения контейнера на треть-половину объема, емкость с мочой плотно закрывается крышкой, дабы избежать ее вытекания.
Доставка биоматериала должна быть организована в течение максимум 6 часов. До отправки в лабораторию моча может храниться как в холодильнике (при t⁰ от +2⁰С – замораживать ее нельзя), так и в комнате, но при этом температура не должна быть выше +25⁰С.
Показания к исследованию
Интерпретация исследования
Данный тест – качественный, результат выдается в формулировках «обнаружено» или «не обнаружено».
Нормой является отсутствие в исследуемой пробе специфических фрагментов ДНК Proteus spp.
Результат анализа выдается на бланке лаборатории медицинской компании «Наука». Пример результата по данному анализу представлен ниже:
Ф.И.О.: Иванов Иван Иванович Пол: м Год рождения: 01.01.0000
Дата исследования: 12.12.0000
Proteus (протей): особенности бактерии, в чем опасность
Proteus: описание рода бактерий
Протей – это условно патогенная бактерия, которая длительное время не представляла никакого интереса для медицины. С развитием современной диагностики наличие Proteus в организме начали связывать с различными воспалительными заболеваниями инфекционной породы. Возбудитель представляет собой палочку с округлыми концами размером не более 2,5 мкм. Бактерии образовывают спор, который провоцирует возникновение гнойных очагов, воспалительных процессов в организме. Для поддержания их жизнеспособности оптимальная температура становит 38 градусов по Цельсию. Бактерии устойчивы к различным внешним и внутренним воздействиям. Наиболее часто заражению подвержены маленькие дети, люди со сниженным иммунитетом, которые на протяжении длительного времени принимали антибактериальные и другие медикаментозные препараты. Протей во взаимодействии с другими бактериями быстро поражает мочеполовую систему, становится причиной развития цистита, простатита, других недугов.
Важные моменты
В природе Proteus можно обнаружить в навозе, грязных водоемах, почве. Заражение происходит после контакта с носителем, бытовым путем (грязные руки, немытые овощи и так далее). Как уже было сказано выше, бактерия является практически неуязвимой к различным воздействиям, поэтому может свободно жить на земле. Как только она попадает в организм, активизируется, способствует возникновению воспалительных процессов. Наиболее уязвимыми считаются уши, носовые пазухи. Если вовремя не будут предприняты медикаментозные меры, Proteus может спровоцировать целый ряд осложнений: почечную недостаточность, анемический синдром и так далее. Инкубационный период составляет не более суток, бактерия часто дает о себе знать уже через пару часов после заражения. При этом конкретные симптомы отсутствуют, все зависит от места локализации. Если «Протей» попадает в кишечник, то пациент жалуется на сильную рвоту, повышенную температуру тела, диарею. Данная бактерия часто провоцирует развитие атопического дерматита. Данный недуг является достаточно опасным. Он сопровождается ярко-выраженными симптомами. Пациенты жалуются на сильный зуд в пораженной области, сухость и покраснение кожи. У них на теле появляются бляшки округлой формы, которые быстро увеличиваются в размерах.
Каждый согласится с тем, что любое заболевание легче предупредить, чем вылечить. И это действительно так. Профилактические мероприятия против Proteus заключаются в следующем:
Чтобы избежать заражения, рекомендуется пить только чистую и качественную воду, тщательно помытые овощи и фрукты, исключить контакт с бездомными животными, не купаться в неизвестных водоемах. Соблюдение выше описанных рекомендаций не дает полную уверенность в том, что заражение не произойдет. Однако, профилактика позволит свести риск к минимуму.
Инфекции, вызываемые возбудителями рода PROTEUS (Протей)
В последние годы инфекционисты отмечают рост заболеваний, обусловленных нетрадиционными микроорганизмами. Особое место занимает протейная инфекция. Ее кишечная форма, вызванная бакетриями рода Протей — P. vulgaris протекает тяжелее у детей раннего возраста. Не менее опасны гнойно-воспалительные заболевания мочевыводящей системы, вызываемые P. mirabilis, P. rettgeri и P. morganii.
В греческой мифологии Протей – божество, способное менять облик. Отсюда название полиморфных, мелких, нитевидных палочек, отличающихся активной подвижностью. Размеры клеток составляют 0,5 — 3 мкм. P. morganii, P. rettgeri — менее полиморфны и малоподвижны.
Протейная инфекция: причины, развитие, опасность для организма
Возбудителями протейной инфекции являются грамотрицательные условно-патогенные микроорганизмы семейства энтеробактерий, которые присутствуют в нормальной микрофлоре кишечника, а также повсеместно распространены в воздухе, почве и воде. Бактерии рода Proteus в течение долгого времени не причислялись к возбудителям серьезных инфекционно-воспалительных заболеваний. Однако в связи с последними достижениями в области диагностики было обнаружено, что эти микроорганизмы способны вызывать трудно поддающиеся лечению патологии (протеозы), поражающие преимущественно ЖКТ и мочеполовую систему.
Протей – факультативный анаэроб, палочковидная, неспороносная, подвижная, грамотрицательная бактерия. В микробиологическом анализе кала протей встречается в комплексе с другими условно-патогенными бактериями семейства энтеробактерий. Кроме протея, в составе нормальной микрофлоры кишечника человека определяются: клебсиелла, энтеробактер, гафния, серратия, морганелла, провиденция, цитробактер. В 1 г кала должно быть меньше 10 4 общего количества этих бактерий. Большее количество перечисленных бактерий является признаком дисбактериоза.
В природе бактерии рода Proteus обнаруживаются: в сточных водах, в земле, в водоемах, на овощах, в разлагающихся органических веществах. Эти микроорганизмы — сапрофиты, они живут на слизистых оболочках, на коже, в кишечнике человека и животных. Протеи устойчивы во внешней среде и сохраняют жизнедеятельность в слабых растворах фенола и других средств. Выявлена также резистентность ко многим антибиотикам.
Причины протейной инфекции
Протейная палочка, присутствующая в кишечной микрофлоре в небольших количествах, не причиняет организму никакого вреда. При определенных обстоятельствах (снижение иммунитета, неправильное питание, длительный прием антибиотиков) она может активизироваться и начать интенсивно размножаться. Также инфицирующее количество этих бактерий способно проникнуть в организм из внешней среды.
Основными путями передачи инфекции являются пищевой и контактно-бытовой. Чаще всего заражение происходит при употреблении белковых продуктов (мяса, рыбы, молока, колбасы), которые хранились с нарушением надлежащих сроков и условий. Значительно реже инфицирование осуществляется через немытые руки, во время купания или при употреблении зараженной воды.
Инфицирование протеем может произойти через полуфабрикаты, сырые продукты или готовые блюда из мяса, рыбы, молока, колбасы, студня. В них происходит быстрое размножение бактерий с образованием токсинов. Реже отмечают водный путь передачи: при купании в загрязненных водоемах или употреблении инфицированной воды. Возможен и контактный путь передачи на инфицированных руках зараженного человека.
Развитие патологии
При непосредственном попадании протея в ЖКТ вместе с продуктами питания инфекционное заболевание развивается очень стремительно. Первые симптомы ярко выражены, а общая клиническая картина совпадает с проявлениями сильного пищевого отравления. При контактно-бытовом способе заражения развитие признаков инфекции обычно происходит медленнее.
Если инфекционный процесс протекает в легкой форме, больной испытывает слабость, у него отмечаются повышение температуры, рвота, боль в животе, частый водянистый стул, в котором могут обнаруживаться слизь и зеленые включения. При тяжелом течении заболевания приступы рвоты случаются около 10 раз за сутки и более, а температура обычно поднимается до 40°С.
При условии своевременного и адекватного лечения вся острая симптоматика протеоза легкой или средней степени тяжести исчезает спустя несколько дней, после чего больной быстро идет на поправку.
Протеи выделяют токсические вещества — эндотоксины с гемолитическими свойствами и с различной степенью биохимической активности. У штаммов P. vulgaris обнаружена лецитиназная активность. Протеи обладают способностью адгезии к уротелию при помощи ресничек. Отмечают, что резистентность к антибиотикам связана с адгезивной способностью уропатогенных протеев.
Острой кишечной протейной инфекцией, протекающей по типу гастроэнтерита, гастрита и колиэнтерита часто болеют дети раннего возраста с пониженным иммунитетом и после бесконтрольного назначения антибиотиков. Заболевание сопровождается симптомами токсикоза — повышением температуры, рвотой, метеоризмом, схваткообразными болями в животе, нарушением аппетита, кратковременными судорогами, появлением водянистого, зловонного, учащенного стула.
В тяжелых случаях могут развиться осложнения: гемолитико-уремический синдром, а также симптомы острой гемолитической тромбопении, анемии или острой почечной недостаточности.
Клинические проявления внутрибольничной инфекции протейной этиологии весьма разнообразны: поражения мочевыводящей системы, отиты, холециститы, нагноения ран и септические состояния. Попадание протеев в пупочную ранку новорожденного может привести к бактериемии или развитию менингита.
Данные заболевания могут развиться: при передаче возбудителя контактно-бытовым или воздушно-капельным путями, при заносе с катетером, другими урологическими инструментами.
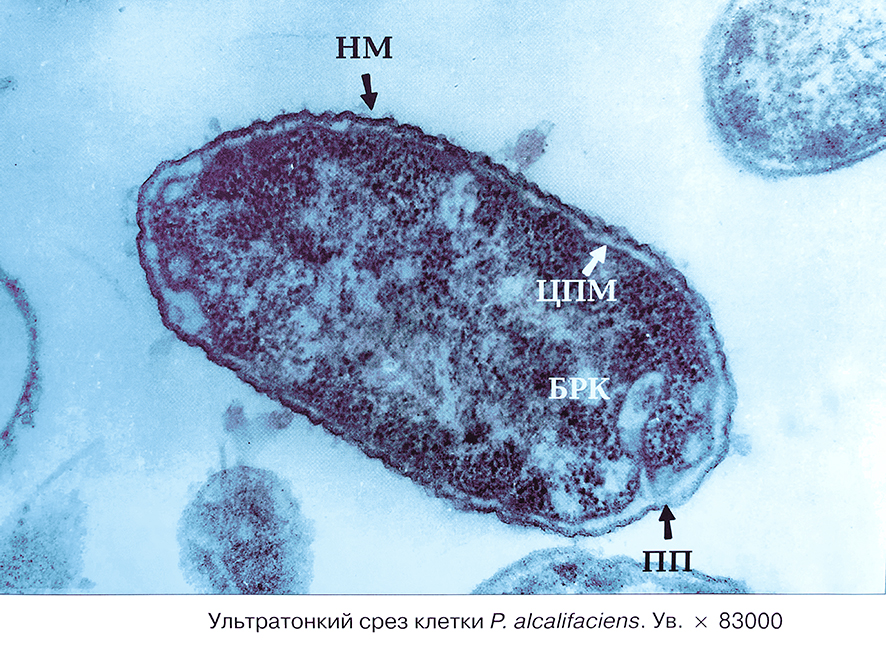
Если в мазках исследуемого материала (участки ожоговой ткани, гной, раневое отделяемое, испражнения) обнаруживаются грамотрицательные палочки, то бактериоскопический метод позволяет сделать предварительное заключение. Бактериологическим методом на средах определяют колонии протея в виде тонкого стелющегося налета. Активно размножаются протеи на белковой питательной среде вызывают гниение мяса, рыбы, других белковых продуктов.
Важнейшие профилактические меры — это соблюдение санитарного режима в детских учреждениях и стационарах, проведение общесанитарных мероприятий. Для профилактики протея каждому необходимо соблюдать правила личной гигиены, исключить потребление подозрительных продуктов в питании, избегать контактов с больными детьми и взрослыми.
При лечении протейной инфекции следует придерживаться лечебной щадящей диеты с исключением жареных, острых блюд, белковых продуктов. В острый период протейного инфицирования, при поражении желудочно-кишечного тракта — необходимо обеспечить восполнение потерянной жидкости. Полезно употреблять отвары трав – тысячелистника, алтея, зверобоя, ромашки, календулы; морсы, компоты с клюквой, черной смородиной, абрикосами, черникой, яблоками. Применять антибиотики можно только по назначению врача, в соответствии с данными анализов чувствительности бактерии протея к ним.
Обязательно нужно принимать препараты – пробиотики, пребиотики, синбиотики для восстановления нормальной флоры кишечника.
Синбиотические комплексы Нормофлорины, содержащий живые активные лакто- и бифидобактерии, секретирующие молочную, уксусную, масляную, пропионовую кислоты, оказывающие защитное, антисептическое, противовоспалительное, сорбционное действие – уменьшает интоксикацию, улучшает моторику кишечника, функцию печени, повышает иммунную реактивность. Это помогает в борьбе с протейной инфекцией, восстанавливает работу желудочно-кишечного тракта, общее самочувствие, повышает иммунитет.
Схема (возрастные дозировки для детей или взрослых): (взрослый) нормофлорин Л – 20 мл (при диарее) – 40 (при запорах) мл утром перед едой, Д — 40 мл вечером за 20 мин до еды, Б – 20-30 мл на ночь в клизме. При диарее в обед можно добавить Д – 30-40 мл, при запорах в обед + Л – 30-40 мл.
Курс приема нормофлоринов — 1 — 1,5 месяца, для выведения токсинов, патогенной микрофлоры, восстановления полезных собственных бактерий. Уникальный состав нормофлоринов, не содержащих белков коровьего молока, молочного сахара, консервантов позволяет при протейной инфекции успешно применять его у детей с первых дней жизни, беременных, кормящих, больных сахарным диабетом, аллергическими заболеваниями, т.е. у взрослых при любой сопутствующей патологии.
Опасность протейной инфекции

Тяжелые формы патологии могут осложняться состояниями, требующими срочной госпитализации больного, такими как сильное обезвоживание, судороги, инфекционно-токсический шок.
protey_mirabilis
Помимо острых инфекций пищеварительной системы бактерии Proteus способны поражать другие органы, распространяясь через кровь или по лимфатическим сосудам. Очаг воспаления может локализоваться в мочеполовой системе, глазах, ушах, легких и даже в костной ткани или мозговых оболочках. Данные патологии достаточно часто переходят в хроническую форму с упорным рецидивирующим течением, которая тяжело поддается терапии.
Если протейная инфекция заносится на незажившие поверхности кожи и слизистых оболочек (послеоперационные раны, ожоги), вызванный ею воспалительный процесс значительно замедляет регенерацию тканей и снижает эффективность лечебных мероприятий.
Следует отметить, что даже незначительное превышение нормального количества протейной палочки в кишечной микрофлоре может негативно отразиться на состоянии здоровья. Так, если у человека имеются аутоиммунные болезни, существует высокий риск их обострения из-за возросшей активности протейной палочки. Атопический дерматит, астма, аллергические заболевания и другие иммунозависимые патологии могут впервые развиться или обостриться под воздействием бактерий Proteus.
Вагиниты, вызванные условно-патогенной микрофлорой: рекомендации для практикующих врачей
Сведения об авторе:
Пустотина Ольга Анатольевна, доктор медицинских наук, профессор кафедры акушерства, гинекологии и репродуктивной медицины ФПК МР РУДН Адрес: 117198 Москва, ул. Миклухо-Маклая д. 6, телефон 8 (495) 787-38-27, email: rudn@rudn.ru Pustotina Olga Anatolievna, Doctor of Medicine, Professor of The department of Obstetrics, Gynecology and Reproductive Health, Peoples’ Friendship University of Russia. Address: 117198 Moscow, Mikluho-Maklaya str, 6. Phone 8(495)7873827
Нормальная микрофлора женских половых органов
Таким образом, во влагалище здоровых женщин репродуктивного возраста общая численность бактерий составляет 105-106 КОЕ/мл выделений, 95% которых представлены лактобактериями и только 5% формируется представителями других видов аэробных и анаэробных УПМ.
Вагиниты, вызванные УПМ
Вагиниты бывают воспалительного и невоспалительного характера. Воспалительные вагиниты в зависимости от вида возбудителя разделяют на неспецифические и специфические. К специфическим относятся трихомонадный, хламидийный, гонококковый и грибковый вагинит (вагинальный кандидоз), при обнаружении любых других УПМ вагинит является неспецифическим. Невоспалительный вагинит называется бактериальным вагинозом. Бактериальный ваги- ноз, неспецифический вагинит и вагинальный кандидоз объединяют вагиниты, вызванные УПМ.
Бактериальный вагиноз не относится к инфекциям, передаваемым половым путем (ИППП), но связан с сексуальной активностью женщины и может вызывать симптомы уретрита у мужчин. Происходящие во влагалищном биотопе изменения облегчают восходящее инфицирование ИППП: гонококками, хламидиями, трихо- монадами, ВИЧ-инфекцией и др. Кроме того, накапливаясь в большом количестве, УПМ проникают в полость матки, вызывая хроническую воспалительную реакцию, приводя к бесплодию, невынашиванию беременности и снижению эффективности программ ЭКО [7, 8].
Вагинальный кандидоз-это воспаление слизистой оболочки влагалища, вызванное дрожжевыми грибами рода СапсНс1а, которое встречается у 5-10% женщин репродуктивного периода. Развитие кандидоза в основном расценивают как вторичную эндогенную инфекцию, резервуаром которой является желудочно-кишечный тракт. Основными причинами, способствующими проникновению грибов из аногенитальной области во влагалище и их интенсивному размножению, является прием антибиотиков, глюкокортикоидов, потребление пищи с большим количеством углеводов. Предрасполагающими к заболеванию факторами служат ожирение, сахарный диабет и нарушение правил личной гигиены 10.
Факторы риска вагинитов, вызванных УПМ
Устойчивость экосистемы влагалища определяется факторами эндогенного и экзогенного происхождения. К развитию дисбиотических процессов в вагинальном микроценозе наиболее часто приводят: стресс, лечение антибиотиками, гормональная терапия, эндокринные и аллергические заболевания, снижение иммунной защиты организма, хронические запоры, инфекция мочевых путей. Уменьшение доли лактобацилл и повышение рН в содержимом влагалища происходит при повреждениях эпителиального покрова в результате полового акта, трещин, расчесов, при чрезмерной гигиене наружных половых органов. Нередко женщины при появлении неприятного запаха из половых путей прибегают к спринцеванию. Спринцевание не имеет ни гигиенического, ни профилактического, ни лечебного эффекта, а усугубляет дис- биоз и является фактором риска воспалительных заболеваний органов малого таза. Нарушение экосистемы влагалища может возникать после полового акта вследствие действия спермы с высоким уровнем рН, при частой смене половых партнеров, во время аногенитальных контактов, при использовании некоторых спермицидов. Длительное маточное кровотечение, инородные тела во влагалище (тампоны, пессарии, швы при истмико-цервикальной недостаточности) нередко также сопровождаются патологическими выделениями из половых путей [4, 6, 7, 9].
Клиника и диагностика вагинитов, вызванных УПМ
В основе вагинитов, вызванных УПМ, лежит уменьшение колоний лактобактерий, в результате которого изменяется рН вагинальной среды с кислой на щелочную и создаются условия для разрастания УПМ и их адгезии на освобождающийся эпителий слизистой оболочки влагалища.
Все происходящие изменения вагинального биотопа объединяются диагностическими критериями Амселя: появление специфических белей из половых путей, увеличение рН вагинального отделяемого, «рыбный» запах и наличие «ключевых клеток», представляющих собой эпителиальные клетки, порытые сплошным слоем различных микроорганизмов. По последним данным, даже наличие двух критериев из четырех позволяет установить нарушение вагинального микробиоценоза [5].
Кроме того, возбудители ИППП, такие как хламидии, трихомонады, гонококк и Мусор1а5та депйаПит, также могут колонизировать генитальный тракт, не нарушая нормальный рост лактобактерий и не изменяя рН влагалищного содержимого, в следствие чего до 90% случаев инфицирования ИППП протекают бессимптомно. Поэтому международные и отечественные эксперты 14 рекомендуют дополнительно к микроскопическому исследованию, обладающему низкими диагностическими возможностями в отношении облигатных патогенов, использовать метод полимеразной цепной реакции (ПЦР) для выявления антигенов хламидий, трихо- монад, гонококка и Мусор1а5та депИаИит в отделяемом половых путей.
Таким образом, окончательный диагноз вагинитов, вызванных УПМ, устанавливается при наличии у женщины жалоб на патологические вагинальных выделения и данных микроскопического исследования, и только после исключения ИППП методом ПЦР.
Лечение вагинитов, вызванных УПМ
Первый этап: Противомикробная терапия.
Препаратами выбора для лечения бактериального вагиноза являются производные нитроимидазола и линкозамиды, которые наиболее активно подавляют размножение анаэробной микрофлоры:
Исследования показали, что ни у одной из схем нет преимуществ в эффективности терапии [7], однако при местном использовании значительно реже возникают побочные эффекты [16].
Для лечения неспецифического вагинита рекомендуется использовать клин- дамицин (300 мг 2 р/сут 7 дней, вагинальный крем 2% 5г 7 дней, свечи 100 мг вагинально 3 дня). В сравнении с производными нитроимидазола (метронидазол, тинидазол, орнидазол), он имеет более широкий спектр действия, включающий не только анаэробные, но и аэробные грамположительные и грамотрицательные бактерии [3, 12, 13, 17, 18].
В последние годы опубликованы результаты крупных рандомизированных контролируемых исследований, показавших высокую эффективность лечения нарушений вагинального микробиоценоза еще двумя антибиотиками широкого спектра действия: рифаксимина (250 мг вагинально 5 сут) [19] и нифуратела (250 мг вагинально 10 сут) [20].
Следует отметить, что все выше представленные антибактериальные средства, обладая выраженной подавляющей активностью в отношении УПМ, не влияют на жизнедеятельность полезных молочно-кислых бактерий [15, 19, 20].
Терапия вагинального кандидоза проводится антимикотиками, среди которых препаратами первой линии являются азолы для интравагинального применения (имидазолы):
и азолы для приема внутрь (триазолы):
При остром неосложненном вагинальном кандидозе, вызванном СапсМс1а а1Ысап5, все препараты местного и системного действия одинаково эффективны.
В случаях рецидивирования процесса длительность и количество курсов увеличивается, при этом необходимо идентифицировать вид кандидозной инфекции и исключить возможные факторы риска [10,12-14].
Антисептики:
В настоящее время получено множество доказательств эффективности терапии вагинитов, вызванных УПМ, различными антисептическими средствами, такими как:
Все антисептики обладают широким неспецифическим спектром действия и подавляют рост аэробных и анаэробных микроорганизмов, а также грибов рода СапсМс1а, при этом не влияя на жизнедеятельность колонии лактобактерий [15].
Наибольшая доказательная база (уровень доказательности 1А) продемонстрирована для деквалиния хлорида (флуомизина). В крупномасштабных многоцентровых рандомизированных зарубежных [21 ] и отечественных исследованиях (БИОС-1/М) [18, 22, 24] с участием 321 и 640 пациенток, соответственно, деквалиния хлорид показал сопоставимую эффективность с действием клиндамицина при лечении вагинитов, вызванный УПМ, при значительно лучшей переносимости и меньшей частоте развития кандидоза. Кроме того, вагинальные таблетки деквалиния хлорида обладают хорошей всасываемостью и меньшей текучестью в сравнении с хлоргексидином, поэтому назначаются один раз в сутки, не вызывая аллергических и других побочных эффектов, характерных для повидон-йода, при этом более эффективно уменьшая количество «ключевых клеток» и ПЯЛ в вагинальном мазке [18, 22].
Второй этап: восстановление микробиоценоза
Одной из причин хронизации процесса являются бактериальные пленки, формирующие невосприимчивость микроорганизмов к действию антибактериальных и антисептических средств [23]. В результате уровень излеченности через 3 мес составляет 60-70% и еще ниже через 6 мес [6]. Значительное повышение эффективности терапии вагинитов происходит после проведения второго этапа, направленного на восстановление нормального микробиоценоза [22, 23, 25].
Наилучшие результаты продемонстрировало применение пробиотиков, содержащих живые лактобактерии. Они не только подавляют рост УПМ, ассоциированных с бактериальным вагинозом и неспецифическим вагинитом, за счет образования молочной кислоты, перекиси водорода и бактериоцинов, но и способны разрушать образованные ими биопленки, а также модулируют иммунный ответ и способствуют размножению колоний эндогенных лактобактерий [4, 12, 19, 24, 26, 27].
В качестве дополнительного фактора, улучшающего состояние вагинального микробиоценоза после антимикробной терапии, является применение вагинальных таблеток аскорбиновой кислоты. [28]. В то же время, применение исключительно пробиотиков и/или закисления вагинальной среды без предшествующей антимикробной терапии для лечения вагинитов, вызванных УПМ, недостаточно [7].
Лечение вагинитов, вызванных УПМ, у беременных
Нарушение вагинального микробиоценоза у беременных достоверно сопряжено с повышенным риском преждевременных родов, восходящего инфицирования плода и послеродовых гнойно-септических осложнений [1,8, 29-31 ].
Согласно зарубежным рекомендациям [12, 13] терапия бактериального вагино- за и неспецифического вагинита у беременных женщин не отличается от таковой у небеременных. Препаратом первой линии считается метронидазол для системного и местного применения. При осложненном течении беременности и высоком риске преждевременных родов более эффективным считается назначение клиндамицина, обладающего более широким спектром активности 34. При этом терапию нарушений биоценоза влагалища необходимо проводить с самых ранних сроков беременности [36].
В отечественных рекомендациях [14] антибиотики из группы нитроимидазола и линкозамидов противопоказаны в первом триместре, их применение возможно только местно после 12 нед беременности. Поэтому препаратами выбора для беременных являются вагинальные антисептики широкого спектра действия. Среди антисептических средств только у деквалиния хлорида безопасность применения на любом сроке беременности и в период грудного вскармливания подтверждена в масштабных многоцентровых исследованиях [18, 21, 22, 24]. Беременным с вагинальным кандидозом показано местное применение азолов (клотримазол, миконазол, терканозол и др.) 12. В случаях неэффективности терапии предусмотрено интравагинальное назначение полиенов (натамицин, нистатин) 15. В дальнейшем для профилактики рецидивов вагинальных выделений беременным назначаются пробиотики и средства, подкисляющие вагинальную среду [28, 36].
В заключение хочется отметить, что вагинальный микробиоценоз напрямую связан с состоянием здоровья женщины. Любые нарушения гомеостаза могут сопровождаться патологическими выделениями из половых путей, которые нередко бывают кратковременными, и после нормализации общего состояния самостоятельно проходят. В случаях рецидивирования процесса основной задачей врача является не поиск и идентификация возможных возбудителей, которых при вагинитах, вызванных УПМ, как правило множество, а выяснение причин, приведших к длительному течению заболевания. Для постановки правильного диагноза достаточно простой микроскопии вагинального мазка и метода ПЦР для исключения строгих патогенов. При рецидивирующих патологических вагинальных выделениях необходим также тщательный сбор анамнеза для выявления всех возможных факторов риска, только после устранения которых достигается полноценное восстановление вагинального микробиоценоза.
Список использованной литературы
1. Гуртовой Б.Л., Кулаков В.И., Воропаева С.Д. Применение антибиотиков в акушерстве и гинекологии. – М.: Триада-Х, 2004. – 176с.
2. Sweet RL, Gibbs RS. Infectious diseases of the female genital tract. – 5th ed. Lippincott Williams Wilkins, 2009. 469p.
4. Радзинский В.Е. Бактериальный вагиноз. В кн. Шейка матки, влагалище, вульва. Физиология, патология, кольпоскопия, эстетическая коррекция: руководство для практикующих врачей / Под ред. С.И. Роговской, Е.В. Липовой. – М.: Издат журнала StatusPraesens, 2014. – С.249-280.
5. Mittal V, Jain A, Pradeep Y. Development of modified diagnostic criteria for bacterial vaginosis at peripheral health centres in developing countries/ J Infect Dev Ctries. 2012; 6(5): 373-377.
6. Verstraelen H, Verhelst R. Bacterial vaginosis: an update on diagnosis and treatment/ Expert Rev Anti Infect Ther. 2009;7:1109–1124.
7. Donders GG, Zodzika J, Rezeberga D. Treatment of bacterial vaginosis: what we have and what we miss/ Expert Opin Pharmacother. 2014;15(5): 645-657.
8. Leitich H, Bodner-Adler B, Brunbauer M. et al. Bacterial vaginosis as a risk factor for preterm delivery: a meta-analysis/ Am J Obstet Gynecol. 2003;189: 139–147.
9. Filler SG. Insights from human studies into the host defense against candidiasis/ Cytokine. 2012; 58(1): 129-132.
10. Байрамова Г.Р. Рецидивирующий вульвовагинальный кандидоз: автореф. дис. докт.мед.наук.– М., 2013.
11. Роговская С.И., Липова Е.В., Яковлева А.Б. Вульвовагинальные микозы. В кн. Шейка матки, влагалище, вульва. Физиология, патология, кольпоскопия, эстетическая коррекция: руководство для практикующих врачей / Под ред. С.И. Роговской, Е.В. Липовой. – М.: Изд-во журнала StatusPraesens, 2014. – С.281-308.
12. CDC. Sexually Transmitted Diseases Treatment Guidelines 2010. http://www.cdc.gov/std/treatment/2010/pid.htm
13. Sherrard J, Donders G, White D. European (IUSTI/WHO) Guideline on the management of vaginal discharge in women reproductive age. 2011.
14. Клинические рекомендации РОАГ. Акушерство и гинекология. – 4-е изд./ под ред. В.Н. Серова, Г.Т. Сухих. – М.: ГЭОТАР-Медиа, 2014. – 1024с.
15. Профилактика, диагностика и лечение инфекций, передаваемых половым путем: рук-во для дерматовенерологов, акушеров-гинекологов, урологов и семейных врачей. – М.:Институт здоровья семьи, 2008.
16. Mikamo H, Kawazoe K, Izumi K, et al. Comparative study on vaginal or oral treatment of bacterial vaginosis / Chemotherapy. 1997; 43:60-68.
17. Практическое руководство по антиинфекционной химиотерапии// Под ред. Л.С. Страчунского, Ю.А. Белоусова, С.Н. Козлова. – М., 2007. – 462с.
18. Подзолкова Н.М., Никитина Т.И. Сравнительная оценка различных схем лечения больных с бактериальным вагинозом и неспецифическим вульвовагинитом // Рос вестник акуш гинекол, 2012.- №4. – С.75-81.
19. Donders GG, Guaschino S, Peters K, et al. A multicenter, double-blind, randomized, placebocontroled study of rifaximin for the treatment of bacterial vaginosis/ Int J Gynaecol Obstet. 2013; 120:131-136.
21. Weissenbacher ER, Donders G, Unzeitig V. et al. Fluomizin Study Group. A comparison of dequalinium chloride vaginal tablets (Fluomizin®) and clindamycin vaginal cream in the treatment of bacterial vaginosis: a single-blind, randomized clinical trial of efficacy and safety. Gynecol Obstet Invest.
2012; 73: 8–15.
23. Swidsinski A, Verstraelen H, Loening-Baucke V. et al. Presence of a polymicrobial endometrial biofilm in patients with bacterial vaginosis/ PLoS One. 2013;8:e53997.
25. McMillan A, et al. Disruption of urogenital biofilms by lactobacilli / Colloids Surf B Biointerfase,2011; 86(1): 58-64.
26. Larsson PG, Stray-Pedersen B, Ryttig KR, Larsen S. Human lactobacilli as supplementation of clindamycin to patients with bacterial vaginosis reduce the recurrence rate; a 6-month, double-blind, randomized, placebo-controlled study./ BMC Women Health, 2008;15(8):3.
27. Ya W, Reifer C, Miller L E. Efficacy of vaginal probiotic capsules for recurrent bacterial vaginosis: a double blind, randomized, placebo-controlled study. Am J Obstet Gynecol. 2010; 203:1200–1208.
28. Zodzika J, Rezerberga D, Donders G. et al. Impact of vaginal ascorbic acid on abnormal vaginal microflora / Arch Gynecol Obstet 2013; 288: 1039-1044.
29. Bothuyne-Queste E, et al. Is the bacterial vaginosis risk factor of prematurity? Study of a cohort of 1336 patients in the hospital of Arras/ J Gynecol Obstet Biol Reprod. 2012; 41(3): 262-270.
30. Pustotina OA, Bubnova NI, Yezhova LS. Pathogenesis of hydramnios and oligohydramnios in placental infection and neonatal prognosis /J mat-fetal&neonat med. 2008; 21(1): 267-271.
31. Pustotina OA. Urogenital infection in pregnant women: clinical signs and outcome /J Perinat Med, 2013; 41:135.
32. Simcox R, Sin WT, Seed PT, et al. Prophylactic antibiotics for the prevention of preterm birth in women at rick: a meta-analysis/ Aust N-Z J Obstet Gynaecol. 2007; 47: 368-377.
33. McDonald HM, Brocklehurst P, Gordon A. Antibiotics for treating bacterial vaginosis in pregnancy/Cochr Database Syst Rev. 2007. N1.P.CD000262.
34. Lamont RF, Duncan SLB, Mandal D, et al. Intravaginal clindamycin to reduce preterm birth in women with abnormal genital tract flora/ Obstet Gynecol. 2003;101:516–522.


