Proteus mirabilis в моче что это
Что такое хронический пиелонефрит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Лычагин А. С., андролога со стажем в 15 лет.
Определение болезни. Причины заболевания
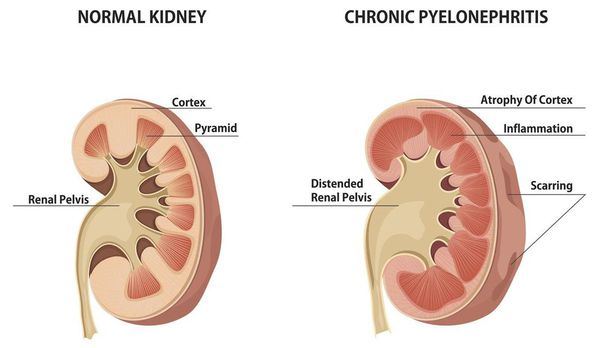
Хронический пиелонефрит — почечная патология, характеризующаяся длительно протекающим воспалительным процессом в почках. Вызывается воспаление разными видами бактерий, процесс затрагивает как чашечно-лоханочные структуры, так и интерстиций (соединительную ткань) почек. [1] [3]
Эпидемиология хронического пиелонефрита такова, что на его долю приходится до 65% всех воспалительных заболеваний мочеполового тракта. Примерно в трети случаев описываемому заболеванию предшествует острый пиелонефрит. Отчетливо отмечено гендерное различие в частоте заболеваемости — преимущественно болеет женский пол (в 3-5 раз чаще). Объясняется этот факт особенностями анатомии женской мочевыделительной системы: короткая уретра, которая облегчает инвазию микроорганизмов в мочевыводящую систему.
Средняя заболеваемость составляет 18 случаев на 1000 населения. [2] [3]
Ведущий этиологический фактор, провоцирующий развитие хронического пиелонефрита — бактериальная флора. Хронический пиелонефрит вызывается как одним видом микроорганизмов, так и микробными ассоциациями, когда при бактериологическом исследовании выделяется сразу несколько видов микроорганизмов. [4] [7] Среди возбудителей выделяют:
Особую роль в патогенезе хронического пиелонефрита играют так называемые L-формы возбудителей. Они отличаются высокой резистентностью к химиопрепаратам и возникают под действием нерациональной антибиотикотерапии. Именно их активизация в определённых условиях вызывает очередное обострение пиелонефрита. [4] [7]
Хронизации процесса в большинстве случаев предшествует острая атака пиелонефрита. Этому способствуют разнообразные факторы (большинство из них вызывают значимые нарушения уродинамики):
Вялотекущий воспалительный процесс любой другой локализации (тонзиллит, отит, абсцесс, стоматит, гастроэнтерит) способен длительное время поддерживать и провоцировать обострение хронического пиелонефрита. Хронические интоксикации (алкогольная, наркотическая и другие), иммунодефициты, соматические заболевания (сахарный диабет, метаболический синдром) также способствуют формированию хронического пиелонефрита.
У девушек в качестве провоцирующего фактора нередко выступает половая жизнь, а у женщин — беременность и роды.
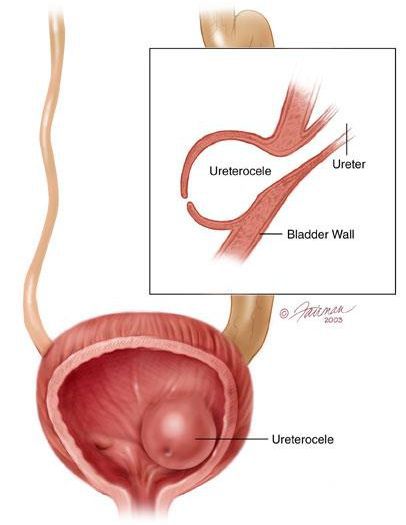
В детском возрасте развитие данной патологии связано с аномалиями развития мочеполовой системы, например, с уретероцеле.
Симптомы хронического пиелонефрита
Клинические проявления пиелонефрита зависят от активности воспалительного процесса.
Для латентной фазы характерна скудная симптоматика. Больных беспокоит незначительное повышение температуры, отмечается повышенная утомляемость, периодические головные боли. Патологические проявления со стороны почек и других органов отсутствуют либо выражены в минимальной форме. Часть пациентов жалуются на полиурию и повышение артериального давления. В анализе мочи выявляется незначительная протеинурия, бактериурия, периодически появляются лейкоциты. [1] [3] [7]
Фаза активного воспаления проявляется следующими симптомами:
При выраженном повышении артериального давления говорят о гипертоническом варианте хронического пиелонефрита, при этом гипертония носит злокачественный характер и с трудом поддаётся коррекции.
Хроническое поражение почек зачастую сопровождается гипохромной анемией. Это свидетельствует о развитии анемического варианта патологии.
В стадии стойкой ремиссии какие-либо значимые симптомы отсутствуют.
Для более наглядного восприятия симптомы разных фаз хронического пиелонефрита отображены в табличном виде. [4]
Протейная инфекция у детей
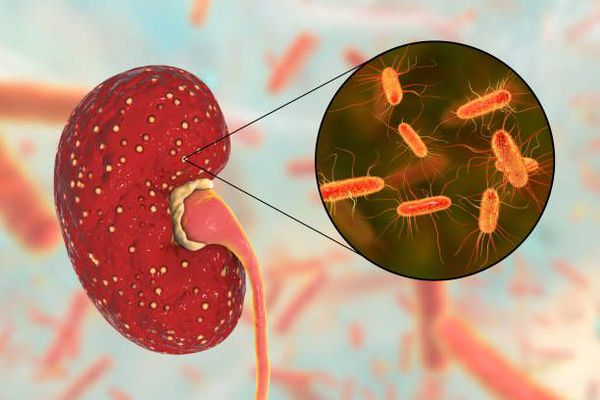
Протейные инфекции – большая группа заболеваний, называемых протеозами. Вызываются протеями (Proteus), которые существуют практически во всех странах мира. Могут существовать в почве, воде, атмосферном воздухе. В больницах и госпиталях протеи «селятся» на медаппаратуре, предметах ухода за больными, санитарно-гигиеническом оборудовании.
Бактерии широко распространяются, новые госпитальные штаммы регулярно формируются из-за широкого применения антибиотиков и высокой резистентности протея к большинству этих препаратов. Протеи в отделениях для грудничков могут вызвать экзогенную нозокомиальную инфекцию.
Инфекцию распространяют больные люди разных возрастов и бактериовыделители без ярко выраженной симптоматики. Самое большое количество возбудителей протеоза выделяют с испражнениями больные с кишечной протейной инфекцией. В 1 г фекалий содержится до 10 7 —10 8 бактерий. Также большое количество возбудителя попадает во внешнюю среду при гнойно-воспалительных процессах: нагноении ожоговых поверхностей, операционных ран, отите, остеомиелите, флегмонах и т. д. То же касается и болезней мочевых путей, вызванных Proteus.
Данному заболеванию подвержены в том числе новорожденные, груднички и дети дошкольного возраста, лица, имеющие аномалии и поражения мочевых путей, а также ослабленные хирургическими вмешательствами и/или разными болезнями.
Пути передачи протейной инфекции:
Заболевания протеозами фиксируют на протяжении всех пор года, в основном заболеваемость спорадическая (без эпидемических вспышек).
Что провоцирует / Причины Протейной инфекции у детей:
Существует пять видов рода протеев:
Разница между видами заключается в антигенной структуре. Протеи на данный момент считаются условно-патогенными микроорганизмами, возбудителями нозокомиапьных инфекций по типу пиелонефрита, острого гастроэнтерита, омфалита и т.д.
Патогенез (что происходит?) во время Протейной инфекции у детей:
Инфекция попадает в организм ребенка через ЖКТ, раневые и ожоговые поверхности, мочевые пути. В месте внедрения протеи подавляют «родную» флору, выделяют ряд токсически действующих факторов (бактериоцины и лейкоцидин). Последние угнетают барьерные функции клеточных систем макроорганизма. Микроорганизмы становятся устойчивыми к бактерицидной активности сыворотки крови.
Протеи вырабатывают уреазу – фермент, который расщепляет мочевину. Это грозит ощелачиванием мочи, нарушением целостности эпителия мочевых путей и снижением его резистентности. Таким образом возбудитель болезни колонизирует мочевые пути.
Протеи в тонком кишечнике приводят к развитию энтероколита, энтерита. Формирование того или иного симптома зависит от состояния макроорганизма, дозы и вирулентности штамма возбудителя. Почти сразу после заражения какая-то доза бактерий попадает в стенку кишки и в органы, где и сохраняется. Предположительно, там он и размножается несколько суток. Если есть соответствующие условия, появляются вторичные очаги, которые в условиях снижения резистентности организма ребенка могут приводить к локальным инфекционным процессам или вторичной бактериемии.
Таким образом, протеи при экзогенном заражении могут спровоцировать не только кишечную инфекцию, но и сделать кишечник источником потенциальной эндогенной инфекции различной локализации (месторасположения).
Симптомы Протейной инфекции у детей:
Среди основных симптомов протеозов:
В детском организме поражается прежде всего желудочно-кишечный тракт, а также мочевая система. При кишечной инфекции заражение происходит во время контакта с заболевшим диереей человеком или во время употребления зараженной протеем еды. От 2-3 часов до 2 суток колеблется инкубационный период. Болезнь имеет острое начало, проявляются общеинфекционные симптомы, нарушается функция ЖКТ.
В первые же сутки после начала заоболевания температура «прыгает» до уровня до 37,5—38,5 °С, повышенной она остается 5-7 суток или дольше. Фиксируют ухудшение аппетита, в тяжелых случаях может развиться анорексия. Часто появляются гастроэнтерит и энтерит, а в более редких случаях — гастроэнтероколит и энтероколит. Рвота обычно повторяется (известна в научной литературе как повторная рвота), в первые 2-3 дня количество приступов составляет от 3 до 5 раз в сутки.
Стул больного водянистый, желто-зеленый, имеет очень неприятный запах. В стуле можно заметить непереваренные комочки пищи, может быть присемь слизи. Дефекация происходит 5-10 раз в сутки. В 1/3 случаев среди симптомов – метеоризм и боли в животе. В ½ случаев фиксируют увеличение печени, а в 1/3 случаев – селезенка.
У детей до 12-ти месяцев при заражении протейной инфекцией начинается кишечный токсикоз с эксикозом I—II степени. Фиксируют потерю массы тела, сухость слизистых оболочек и кожи, снижение эластичности кожи и тургора мягких тканей. Происходят нарушения сердечно-сосудистой системы: относительная тахикардия, приглушение тонов сердца, в некоторых случаях – систолический шум.
Патологические изменения легких проявляются такими симптомами:
В пик болезни фиксируют олигурию с умеренным количеством белка в моче. Под олигурией понимают уменьшение количества отделяемой почками мочи. Анализ крови показывает у ½ больных детей нейтрофилез, лейкоцитоз, палочкоядерный сдвиг, умеренно повышенную СОЭ.
Кишечная инфекция длится 5-10 дней. Самый длительный симптом – дисфункция кишечника с вторичными нарушениями пищеварения. Морфологические изменения в кишечнике представляют собой острый серозный энтерит. Гистологические методы исследования показывают отек стенок кишок, полнокровие, поверхностные дефекты. Лимфогистиоцитарные инфильтратыобнаруживаются обнаруживают в слизистой оболочке и подслизистом слое кишки. Дистрофические процессы наблюдаются в других внутренних органах. Есть вероятность развития пневмонии. Затяжной энтероколит может привести к возникновению глубоких множественных язв, диаметр которых от 0,2 до 0,5 мм. Язвы имеют приподнятые края. Редко они находятся в области единичных лимфатических фолликулов.
У детей с аномалией развития почек и органов мочевой системы может быть поражение мочевых путей. Частое поражение мочевых путей объясняется выработкой протеями фермента уреазы, которая способствует нарушению целостности эпителия мочевых путей и внедрению возбудителя в эти ткани. После попадания в мочевую систему возбудитель закрепляется в паренхиме почек, что приводит к развитию пиелонефрита.
Симптоматика протейных пиелонефритов:
Анализ мочи показывает умеренное количество лейкоцитов, небольшое число эритроцитов и повышение уровня белка в 2-3 раза. Ренгтен позволяет обнаружить уменьшение тени почек, «изъеденность» паренхимы чашечек.
Особенности протейной инфекции у новорожденных и детей до 12-ти месяцев. Нередкими являются вспышки протеозов в отделениях для новорожденных. Заражение может произойти через аппаратуру. Протейная инфекция может локазалироваться по-разному у новорожденных. Протейная диарея имеет острое начало, температура тела поднимается до уровня 37,5—38 ˚С. Проявляются такие симптомы как рвота и жидкий стул со слизью и зеленью, болезненность живота, вздутие, урчание по ходу расположения кишечника.
На протяжении 2-3 первых дней развивается дегидратация на фоне общеинфекционного токсикоза. Дети начинают плохо питаться (отталкивают грудь), наблюдается вялость, появляется токсическая одышка.
Есть вероятность инфекции пупочной ранки — омфалита в сочетании с инфекцией пупочных сосудов в виде септического артериита и флебита, захватывающего пупочную и портальную вены.
Диагностика Протейной инфекции у детей:
Для постановки диагноза нужны бактериологические исследования такого биологического материала как испражнения, рвотные массы, моча, кровь, отделяемое из воспалительных очагов на коже. Иногда исследуют на присутствие бактерий воду, пищевые продукты, смывы с предметов, которые использовал больной, с медаппаратуры, а также лекарственные растворы.
В диагностике важны показания серологических исследований. Антитела к аутоштамму протея начинают выявляться в РА с 5— 6-го дня болезни в титрах 1:200 и 1:400 с максимумом к 9—15-му дню от начала заболевания (1:400— 1:1600). Применяют также РСК и РПГА.
Болезни мочевых путей с с протейной бактериурией сопровождаются появлением антипротейных антител в титрах от 1:160 до 1:640. При пиелонефритах и септических состояниях диагностическое значение придается титрам антипротейных антител 1:320 и выше.
Лечение Протейной инфекции у детей:
Терапия кишечных инфекций базируется на тех же принципах, что и лечение других кишечных инфекций бактериальной природы. Для лечения легких форм используется колипротейный бактериофаг. Для лечения тяжелых форм протейной инфекции у детей применяют антибактериальные препараты, например, защищенные пенипиллины, гентамицин, цефалоспорины III поколения.
Нормализацию микрофлоры кишечника в периоде реконвалесценции проводят с помощью полибактерина, бифидумбактерина, линекса, бификола, энтерола и пр.
Если произошло поражение мочевыводящих путей и почечной паренхимы, необходимо восстановить нормальный пассаж мочи. Антибактериальную терапию в данных случаях проводят при бактериурии и признаках пиелонефрита. Уроштаммы протея устойчивы к пенициллину, эритромицину, полимиксину и сохраняют высокую чувствительность к препаратам налидиксовой кислоты.
Чтобы усилить эффективность противопротейных препаратов, их сочетают с другими. К примеру, фурадонин сочетается с эритромицином, невиграмон с левомниетином, ампициллин с геитамицином.
Вялотекущие процессы лечатся комплексной терапией, с включением иммуномодуляторов, к примеру, нуклеината натрия, метилурацила, а также вакцины из бактерий рода Proteus или аутовакцины. При тяжелых формах болезни врачи иногда прописывают колипротейную плазму и антипротейную иммунную сыворотку.
Прогноз
Неблагоприятным исходам грозят случаи генерализированных заболеваний у новорожденных недоношенных детей. Острые кишечные инфекции, вызванные протеями, оканчиваются в большинстве случаев выздоровлением ребенка. Течение протейной инфекции бывает упорным, с рецидивами. В последние годы часто формируется вялотекущий пиелонефрит, трудно поддающийся лечению.
Профилактика Протейной инфекции у детей:
Специфических профилактических мер протеозов пока что нет. Для предупреждения протеозов важно соблюдать санитарно-гигиенические правила. Большие трудности представляет борьба с нозокомиальной протейной инфекцией, особенно в палатах для новорожденных и в урологических стационарах. Для снижения риска инфицирования протеем в указанных медицинских учреждениях необходимо наряду с применением дезинфекции и антисептических средств orpaничивать инвазивные манипуляции до минимума.
К каким докторам следует обращаться если у Вас Протейная инфекция у детей:
Семейство Enterobacteriaceae. Часть 1
Автор: врач – клинический фармаколог Трубачева Е.С.
.jpg)
Автор: врач – клинический фармаколог Трубачева Е.С.
Morganella spp. и Proteus spp.
Особо выдающихся представителей семейства Enterobacteriaceae мы уже разбирали в отдельных статьях, а именно представительницу рода Esherichia — кишечную палочку E.coli, а также одну из представительниц клебсиелл — Klebsiella pneumonia. В ближайших статьях мы постараемся осветить все оставшееся семейство, как, во-первых, одно из самых проблемных в плане развития резистентности к антимикробным препаратам, а во-вторых — как возбудителей, наиболее часто являющихся причиной внутрибольничных инфекций.
Микробиологические аспекты
Основными клинически значимыми представителями родов семейства Enterobacteriaceae, вызывающими заболевания у человека, являются:
Естественно совсем уж экзотику мы рассматривать не станем, но по наиболее часто встречающимся представителям обязательно пробежимся.
Клинические аспекты
Почему данное семейство так актуально? Наверное, потому, что почти ни одна нозология не обходится без его представителей. В самом широком смысле семейство Enterobacteriaceae является причиной следующих заболеваний:
Как мы видим, наши знакомые отметились практически везде. Но надо обязательно помнить, что выявление вышеуказанных представителей у здоровых людей из респираторного тракта, урогенитального и уж тем более желудочно-кишечного ни в коем случае не говорит о том, что человек чем-то болен, так как в большинстве своем эти микробы являются представителями нормальной микрофлоры, а не все люди умеют мыть руки, особенно летом.
Когда можно думать о наличии бактериальной патологии? Во-первых, когда имеется четкая клиника, во-вторых, когда микробы выделены из стерильных в норме сред, таких как кровь и ликвор, брюшная или плевральная полость, точнее, экссудат оттуда и, в-третьих, когда микроорганизмы выделены в клинически значимых концентрациях (тут в помощь будет ваша бак. лаборатория).
Стоит отметить еще один немаловажный момент — не все представители семейства Enterobacteriaceae умеют жить вне организма человека, и поэтому не размножаются во внешней среде, а потому обнаружение оных на пищевых продуктах и всевозможных поверхностях в лечебных учреждениях говорит о фекальном загрязнении, проще говоря, о неумении обрабатывать руки после посещения туалетной комнаты. Одним из таких микробов-детекторов является кишечная палочка, и стоит ее поймать даже не на руках персонала, а, например, на компьютерной мышке, как дальше можно уже ничего не искать, а начинать очередной этап избиения младенцев, пардон, обучения правилам асептики и антисептики, в частности, обработки рук.
Но давайте перейдем к частностям — и первым микроорганизмом, который будем сегодня рассматривать, станет:
Morganella spp.
Зверюшка названа так в честь своего первооткрывателя Гарри Р. Моргана.
Начнем традиционно с микробиологических аспектов
Семейство морганелл включает единственный вид M. morganii, включающий два подвида M. morganii и M. sibonii, которые различаются только ферментацией трегалозы.
Морганеллы являются представителями нормальной микрофлоры как человека, так и животных, а потому могут присутствовать в качестве сапрофитов в окружающей (внебольничной!) среде.
Морганеллы имеют довольно сложные отношения с антибактериальными препаратами и обладают природной резистентностью к:
Проявляют высокую чувствительность к:
Клинические аспекты
Как говорилось выше, морганеллы являются частью нормальной микрофлоры человека, крайне редко вызывая инфекционные заболевания. Чаще всего они являются возбудителями осложненных инфекций мочевыводящих путей.
Факторами риска развития инфекции являются:
В качестве механизмов резистентности морганеллы способны продуцировать бета-лактамазы, чем и объясняется их природная устойчивость к пенициллинам и цефалоспоринам 1-2 поколений. При нерациональном использовании антибиотиков они начинают вырабатывать бета-лактамазы расширенного спектра и факторы устойчивости к фторхинолонам, которыми довольно бодро делятся с соседями по семейству Enterobacteriaceae. Отдельно стоит отметить способность отдельных штаммов морганелл к резистентности к имипенему.
Какие заболевания вызывают чаще всего:
Терапевтические аспекты
Антибактериальная терапия будет полностью зависеть от результата из микробиологической лаборатории. Повторимся еще раз, микроб изначально умеет вырабатывать бета-лактамазы, а потому в случае развития осложненных инфекции мочевыводящих путей, которые чаще всего уже не связанны с кишечной палочкой, препаратами выбора становятся карбопенемы (имипенем, если штамм к нему чувствителен, или меропенем), дозирование которых проводится с учетом клиренса креатинина. Длительность лечения должна быть не менее 7 дней. В качестве альтернативы можно использовать цефалоспорин 4-го поколения Цефипим каждые 8 часов или фторхинолоны.
Аминогликозиды, несмотря на чувствительность к оным, при лечении заболеваний мочевыводящих путей лучше не применять в виду их нефро- и отоксичности, и по этой же причине их невозможно будет использовать около трех месяцев после проведенной терапии, например, в лечении синегнойной инфекции. Цефалоспорины третьего поколения тоже применять не стоит, так как морганеллы довольно быстро обзаводятся бета-лактамазами расширенного спектра, которые, как мы помним, эту генерацию препаратов быстро инактивируют.
Proteus spp.
Микробиологические аспекты
Протей долгое время был практически родным отцом морганеллы, так как последняя рассматривалась как один из видов рода протей. Этот род примечателен тем, что занимает почетное второе место по выявляемости после кишечной палочки в семействе Enterobacteriaceae.
В данный момент представителями рода протей являются P. mirabilis, вызывающий порядка 90% инфекционных заболеваний, а также P. vulgaris и P. penneri.
Клинические аспекты
Протеи выступают возбудителями порядка 10% неосложненных инфекций мочевыводящих путей, с чем могут быть связаны неудачи в лечении последних с использованием аминопенициллинов.
Как и все клинически значимые возбудители семейства Enterobacteriaceae, протей является возбудителем нозокомиальных инфекций, таких как пневмония, вплоть до сепсиса. Кроме того выступает возбудителем интраабдоминальных, а также хирургических инфекций кожи и мягких тканей, сепсиса, связанного с медицинскими вмешательствами как последствий нозокомиальной пневмонии в результате недостаточной дезинфекции, например, бронхоскопов.
Таким образом, мы видим, что, как и в предыдущем случае, проще правильно помыть руки и обработать инструменты, чем лечить это все с учетом природной и приобретенной резистентности.
Терапевтические аспекты
Как и в случае с морганеллой, нам просто необходим результат микробиологического исследования с определением чувствительности по МПК возбудителя либо результаты микробиологического мониторинга, которые помогут предположить зверей в случае неудачи ранее проводимого лечения.
В случае ампициллин-чувствительного P.mirabilis именно ампициллин может выступать препаратом первой линии. Кроме того, возможно использование цефуроксима и фторхинолонов. Обязательным аспектом лечения является его длительность. В случае неосложненных инфекций мочевыводящих путей (цистита) — не менее 3 дней, пиелонефрита — 10–14 дней, осложненных инфекций — 10–21 день. Сепсис является состоянием, требующим индивидуального подхода, но лечим не менее 14 дней.
На этом на сегодня мы закончим, но повторим одну базовую и, чего уж, наиважнейшую истину: в лечении инфекций, связанных с любым представителем семейства Enterobacteriaceae, самым главным будет являться профилактика. А именно правильное и тщательное мытье рук. Обеспечим мытье рук, не будет большинства проблем с инфекциями, вызванными указанным семейством.
Инфекция мочевых путей в пожилом возрасте (старше 65 лет) и ее коррекция в амбулаторной практике
Инфекция мочевыводящих путей (ИМП) — инфекционно-воспалительный процесс в мочевыводящих путях (мочеточники, мочевой пузырь, уретра) без вовлечения в патологический процесс паренхимы почек.
Инфекции мочевой системы широко распространены в пожилом возрасте. Этому способствует ряд факторов: изменение нормальных анатомо-физиологических особенностей органов малого таза (пролапс тазовых органов), несостоятельность эпителия мочевыводящих путей, уменьшение образования слизи, ослабление местного иммунитета, нарушения микроциркуляции, увеличение загрязнения в области уретры в результате недержания мочи, недержания кала, старческого слабоумия (несоблюдение правил личной гигиены).
Частота встречаемости ИМП у пожилых людей значительно выше, чем у молодых. По крайней мере, 20% женщин и 10% мужчин старше 65 лет имеют мочевую инфекцию. В сравнении с молодыми людьми, среди которых наличие мочевой инфекции в 30 раз чаще встречается у женщин, у пожилых людей соотношение встречаемости заболевания женщина/мужчина снижается до уровня 2:1.
Наиболее частым возбудителем мочевых инфекций является кишечная палочка, реже встречаются другие грамотрицательные микроорганизмы, а также стафилококки и энтерококки. В ряде случаев ИМП обусловлены хламидиями, уреаплазмой, а также грибковой флорой.
Примерно у 20% больных наблюдаются микробные ассоциации, частое сочетание — кишечная палочка и энтерококк. В течение болезни может наблюдаться смена возбудителя инфекционного процесса, в результате появляются полирезистентные формы микроорганизмов. Это особенно опасно при бесконтрольном и бессистемном применении антибактериальных препаратов. Следует отметить, что собственная мочевая флора, присутствующая и в норме в мочевыводящих путях, при поступлении в стационар очень быстро (за двое-трое суток) замещается на внутрибольничные резистентные штаммы. Поэтому инфекции, развивающиеся в стационаре, оказываются куда более тяжелыми, чем развивающиеся в домашних условиях.
Помимо «обычной» бактериальной флоры, ИМП нередко вызываются протопластами и L-формами бактерий.
Уропатогенными свойствами обладают микробы с наличием на клеточной мембране р-фимбрий, способствующих лучшей адгезии микроорганизма на эпителии мочевыводящего тракта с последующим восхождением по нему. Некоторые микробы обладают гемолизирующими свойствами, снижающими эффективность иммунной защиты, а также способностью расщеплять мочевину, вызывая ощелачивание мочи и риск формирования конкрементов.
Для возникновения ИМП необходимы предрасполагающие факторы со стороны макроорганизма и наличие микробного агента.
Клинические проявления ИМП варьируют от тяжелого воспалительного до бессимптомного течения. Наиболее часто пациенты жалуются на болезненность и чувство жжения в уретре, учащенное, болезненное мочеиспускание (в начале акта мочеиспускания), иррадиацию боли в промежность, выделения из уретры (слизисто-гнойные или кровянистые). При лабораторном исследовании наблюдаются: изменения в общем анализе крови (ускорение СОЭ, воспалительный бактериальный сдвиг в лейкоцитарной формуле), в общем анализе мочи (слизь, умеренное количество белка, лейкоциты), в биохимическом анализе крови отмечается повышение титра С-реактивного протеина, имеется наклонность к гиперкоагуляции крови. У части больных обнаруживаются нарушения функциональных показателей клубочкового и канальцевого аппарата. При цистоскопии находят изменения на слизистой мочевого пузыря. Кардинальным признаком инфекции мочевой системы считается бактериурия свыше 105 микробных тел в 1 мл мочи, собранной из средней части струи при свободном утреннем мочеиспускании, или любая степень бактериурии в моче, полученной при надлобковой пункции.
При острых ИМП и обострениях хронических главным принципом лечения является незамедлительность антимикробной терапии во избежание повреждающего действия микробного воспаления на почки. Поэтому стартовый препарат выбирается, как правило, эмпирически, на основе знаний этиологической характеристики вероятных возбудителей и их потенциальной чувствительности к данному препарату, а также исходя из опыта предшествовавшего лечения, клинической симптоматики, возраста больного, доступности лекарственных средств, с учетом возможных побочных действий. При отсутствии клинического эффекта через 3 дня эмпирической терапии проводится ее коррекция со сменой антибиотика, учитывая данные посева мочи. При легком течении ИМП обычно используются пероральные формы антимикробных препаратов. При тяжелом течении рекомендуется «ступенчатая» терапия, которая предусматривает использование в течение первых 3–5 дней парентеральных препаратов с последующей их сменой по мере купирования воспалительного процесса на пероральные препараты. Среднетяжелые и тяжелые формы ИМП рекомендуется лечить в условиях стационара.
Пенициллины
Для эмпирической терапии ИМП в настоящее время рекомендуется применение «защищенных» пенициллинов на основе амоксициллина с клавулановой кислотой (Амоксициллин, Аугментин, Амоксиклав), поскольку к ним сохраняется высокая чувствительность Escherichia сoli мочи (96–97%). У больных с незначительным снижением скорости клубочковой фильтрации (СКФ) дозы «защищенных» пенициллинов могут не подвергаться корректировке. При снижении СКФ менее 50 мл/мин (по формуле Кокрофта) дозы этих препаратов должны быть уменьшены на 25–75%. Препараты вводятся в 2–3 приема, пероральные формы могут применяться во время еды с целью предупреждения побочных действий в виде расстройств желудочно-кишечного тракта (тошнота, рвота, диарея), которые встречаются в 0,2–1,5% случаев. Как и при любой антибактериальной терапии, возможны аллергические реакции, чаще в виде кожной сыпи.
Режим дозирования:
Амоксициллин — внутрь, по 500 мг 3 раза в сутки; максимальная суточная доза — 6 г. При снижении СКФ до 10–30 мл/мин (у пациентов с хронической болезнью почек) препарат вводят в суточной дозе 1 г, затем — по 0,5 г каждые 12 ч; при СКФ менее 10 мл/мин — 1 г, затем по 0,5 г каждые 24 ч. У больных в состоянии анурии суточная доза не должна превышать 2 г. Больным, находящимся на гемодиализе, назначают дополнительно 2 г препарата: 0,5 г во время сеанса гемодиализа и 0,5 г после его окончания.
Аугментин — внутрь, по 500 мг 3 раза в сутки. При нарушении функции почек проводят коррекцию режима дозирования в зависимости от СКФ.?При СКФ больше 30 мл/мин коррекция дозы не требуется, при СКФ 10–30 мл/мин — 25 мг/кг 2 раза в сутки, при СКФ менее 10 мл/мин — 20 мг/кг 1 раз в сутки.
При проведении гемодиализа Аугментин применяют из расчета 25 мг/кг 1 раз/сут и дополнительно 12,5 мг/кг в конце диализа, затем 25 мг/кг/сут, поскольку суточная концентрация амоксициллина и клавулановой кислоты снижается.
Нельзя назначать Аугментин более 14 дней без оценки целесообразности продолжения терапии.
Амоксиклав — внутрь, по 375 или 625 мг (в зависимости от тяжести инфекции) 3 раза в сутки.
Максимальная суточная доза — 6 г. При почечной недостаточности необходимо уменьшение дозы или увеличение интервала между приемами (при СКФ 10–30 мл/мин интервал между приемами — 12 ч, менее 10 мл/мин — 24 ч).
Цефалоспорины
Основным механизмом действия цефалоспоринов, как и пенициллинов, является нарушение синтеза клеточной стенки бактерий за счет угнетения активности фермента транспептидазы. По данным АРМИДа, цефалоспорины III–IV поколения обладают высокой активностью в отношении E. coli. Резистентность последней не превышала 3,9%, причем не было выявлено резистентных штаммов к цефтазидиму и цефтибутену (III поколение), а к цефепиму (IV поколение) она составляла всего 0,9%. Цефтазидим, цефтибутен и цефепим были наиболее активными цефалоспоринами в отношении Klebsiella pneumoniae и Proteus spp. Наиболее активными в отношении Enterobacter spp. обладает цефепим. Резистентность к нему бактерий в 2–3 раза ниже, чем к другам цефалоспоринам. В отношении Pseudomonas aeruginosa наиболее активными цефалоспоринами были цефтазидим и цефепим.
Из пероральных препаратов наиболее высокая активность отмечалась у цефтибутена, превосходящая некоторые парентеральные цефалоспорины в отношении ряда грамотрицательных возбудителей.
Однако следует учитывать, что цефалоспорины, в отличие от амоксициллина/клавуланата, не действуют на энтерококки, которые являются возбудителями внебольничных форм ИМП.
Цефтазидим — внутрь, по 1–2 г каждые 8 ч или по 2 г каждые 12 ч; в тяжелых случаях — 6 г/сут. При нетяжелых инфекциях и ИМП — 0,5–1 г 2 раза в сутки. На фоне дисфункции почек (в зависимости от тяжести поражения) — 1 г через 12 или 24 ч либо 0,5 г каждые 24–48 ч.
Цефтибутен — внутрь, разовая доза для взрослых составляет 200–400 мг каждые 8 часов. Взрослым пациентам с почечной недостаточностью требуется коррекция дозы: при CКФ 49–30 мл/мин 200 мг в сутки или 400 мг через 48 ч; 29–5 мл/мин — 100 мг/сут или 400 мг через 96 ч. Пациентам, находящимся на гемодиализе (2–3 процедуры в неделю), назначают 400 мг или 9 мг/кг в конце каждого диализа.
Цефепим — внутрь, при нормальной функции почек — 0,5–1 г (при тяжелых инфекциях до 2 г) 2–3 раза в день. Курс лечения 7–10 дней и более. При нарушении функции почек дозу корректируют в зависимости от клиренса креатинина. Пациентам, находящимся на диализе, после каждого сеанса необходимо вводить повторную дозу, равную исходной.
При лечении пожилых пациентов цефалоспоринами необходимо контролировать функцию почек, вычисляя скорость клубочковой фильтрации, для предупреждения осложнений со стороны ЦНС (энцефалопатия, полинейропатия).
Макролиды
Для клинической практики максимальный интерес представляет активность макролидов в отношении грамположительных кокков и внутриклеточных возбудителей (кампилобактерий, микоплазм, легионелл, хламидий). Группа макролидов считается наименее токсичными антибиотиками.
Механизм антибактериального действия макролидов связан с нарушением синтеза белка рибосомами микробной клетки, в результате чего формируется выраженный бактериостатический эффект. В высоких концентрациях макролиды способны оказывать и бактерицидное действие в отношении бета-гамолитического стрептококка группы А, пневмококка, возбудителей коклюша и дифтерии. Макролиды обладают умеренной противовоспалительной и иммуномодулирующей активностью.
Рокситромицин, кларитромицин, азитромицин, джозамицин оказывают выраженный бактериостатический (при больших концентрациях и бактерицидный) эффект на Streptococcus spp., Staphylococcus spp., Bacillus anthracis, Corynebacterium diphtheriae, Haemophilus influenza, Shigella spp. Bordetella pertussis, Legionella spp., Chlamydia trachomatis, Mycoplasma spp., Ureaplasma urealyticum, Treponema pallidum, Borrelia burgdorferi.
Рокситромицин — внутрь, 300 мг/сут в 1–2 приема. Длительность курса зависит от показаний к применению, тяжести инфекционного процесса и активности возбудителя (от 5–12 дней). При нарушении функции печени и почек может потребоваться снижение дозы. При тяжелой печеночной недостаточности — 150 мг 1 раз в сутки.
Кларитромицин — внутрь. Режим дозирования и продолжительность курса лечения определяются индивидуально с учетом показаний, тяжести течения инфекции, чувствительности возбудителя. По 250–500 мг 2 раза в сутки; курс лечения — 6–14 дней. У больных с почечной недостаточностью (при СКФ менее 30 мл/мин или концентрации сывороточного креатинина более 3,3 мг/100 мл) дозу следует снижать в 2 раза. Максимальная длительность лечения у пациентов этой группы — не более 14 дней.
Азитромицин — внутрь (за 1 ч до или через 2 ч после еды), принимают 1 раз в сутки 1 г однократно.
Сульфаниламиды
Сульфаниламидные препараты — группа химиотерапевтических средств широкого противомикробного спектра действия. Сульфаниламидные препараты — производные амида сульфаниловой кислоты. В основе механизма антибактериального действия сульфаниламидных препаратов лежит блокада синтеза фолиевой кислоты в бактериях с последующим нарушением образования нуклеотидов, подавлением жизнедеятельности и размножения микроорганизмов.
Бисептол (Ко-тримоксазол) — комбинированный противомикробный препарат широкого спектра действия, в состав которого входят: сульфаниламид — сульфаметоксазол и производное диаминопиримидина — триметоприм.
Блокируя разные этапы биосинтеза фолиевой кислоты в микробной клетке, оба компонента препарата — триметоприм и сульфаметоксазол — не просто потенцируют бактериостатические эффекты друг друга, а приводят к появлению бактерицидного действия Бисептола.
Бисептол активен в отношении многих грамположительных и грамотрицательных микроорганизмов, являющихся основными этиологическими агентами при инфекциях мочевой системы: Staphylococcus spp., Streptococcus spp., Listeria monocytogenes, Neisseria gonorrhoeae, E. coli, Shigella spp., Salmonella spp., Yersinia spp., Klebsiella spp., а также против простейших Toxoplasma gondii, Pneumocystis carinii.
Применение рекомендуемых доз и продолжительность курса терапии Ко-тримоксазола (Бисептола) редко сопровождается серьезными осложнениями. Все же, в связи с биотрансформацией сульфаметоксазола в печени и последующей элиминацией через почки, возможно образование в ренальных канальцах кристаллов его ацетилированных метаболитов, которые нарушают функционирование тубулярных отделов нефрона и, в тяжелых случаях, могут привести к развитию интерстициального нефрита. Обильное щелочное питье предупреждает данные осложнения. При терапии Бисептолом должно обязательно контролироваться количество потребляемой жидкости. У пациентов с нарушениями функции почек, при которых клиренс эндогенного креатинина снижается до 30 мл/мин и ниже, должна использоваться половина возрастной нормы.
При тяжелом течении инфекций — по 480 мг 3 раза в сутки, при хронических инфекциях поддерживающая доза — 480 мг 2 раза в сутки. Минимальная длительность лечения — 4 дня; после исчезновения симптомов терапию продолжают в течение 2 дней. При хронических инфекциях курс лечения более длительный. Для профилактики рецидивов хронических ИМП — 480 мг 1 раз в сутки на ночь. Продолжительность лечения — 3–12 мес. При почечной недостаточности доза зависит от величины СКФ: при СКФ свыше 25 мл/мин — стандартная доза; при 15–25 мл/мин — стандартная доза в течение 3 дней, затем половину стандартной дозы. При СКФ менее 15 мл/мин назначают половину стандартной дозы только на фоне гемодиализа.
Нитрофураны
В течение многих лет препаратами выбора при микробно-воспалительных заболеваниях почек в амбулаторных условиях являются нитрофурановые препараты. Они эффективны в отношении грамположительных и грамотрицательных микробов. По данным АРМИДа, нитрофурантоин обладает высокой активностью в отношении E. coli (резистентность — 2,1%). Медленное развитие резистентности к нитрофуранам микробной флоры, малая токсичность сделали их незаменимыми для инфекции мочевой системы. Вследствие низких концентраций в паренхиме почек, нитрофурантоин используется только при остром цистите или вторичном пиелонефрите на фоне аномалий развития мочевой системы для предупреждения реинфицирования. Нитрофураны являются ингибиторами биосинтеза нуклеиновых кислот, акцепторами кислорода.
Нитрофурантоин (Фурадонин) ингибирует синтез ДНК и РНК, протеинов, препятствует нормальному образованию цитомембран, тормозит анаэробный метаболизм.
Фуразидин (Фурагин) обладает бактериостатическим действием, блокирует ферментные системы микроорганизмов.
В Институте органического синтеза АН Латвии на основе калиевой соли фуразидина в сочетании с магния карбонатом в соотношении 1:1 была разработана оптимизированная лекарственная форма Фурагина для перорального применения под торговым названием «Фурамаг». Магния карбонат препятствует превращению калиевой соли фуразидина в кислой среде желудка в фуразидин и обеспечивают в тонкой кишке более полное всасывание препарата в виде хорошо растворимой калиевой соли. Резистентность микроорганизмов к Фурамагу развивается крайне медленно, а бактериостатический эффект в 2 раза выше, чем у растворимого Фурагина. Фурамаг, в отличие от других антимикробных средств, не угнетает, а наоборот, стимулирует иммунную систему организма за счет активации системы комплемента и фагоцитарной активности лейкоцитов. Фурамаг обладает широким спектром действия, активен по отношению к грамотрицательной и грамположительной флоре, воздействует на стафилококки, Enterobacter aerogenes, Citrobacter spp., Proteus mirabilis, а наибольшую активность проявляет против E. coli. В отличие от других нитрофуранов, Фурамаг малотоксичен, даже аллергические реакции в виде кожной сыпи отмечаются крайне редко. Препарат рекомендуется принимать после еды, запивая большим количеством жидкости. При длительном использовании Фурамага желательно назначать витамины группы В. Назначается препарат в следующих дозах: для лиц пожилого возраста (старше 65 лет) по 0,05 г 3 раза в день курсом от 7 до 14 дней.
Учитывая изменение нормальных анатомо-физиологических особенностей органов малого таза, несостоятельность эпителия мочевыводящих путей, уменьшение образования слизи, ослабление местного иммунитета, увеличение загрязнения в области уретры, антибактериальную терапию у пожилых людей необходимо назначать, консультируясь с врачом-гинекологом или урологом.
При выборе оптимального антибактериального средства у больных пожилого возраста в первую очередь следует учитывать следующие факторы:
Длительность антимикробной терапии
Длительность антимикробной терапии инфекций мочевой системы должна быть оптимальной, до полного подавления активности возбудителя. Многочисленными исследованиями доказано, что длительность антимикробной терапии у лиц старше 65 лет с ИМП не должна быть меньше 7 дней. Оптимальная продолжительность начального курса лечения ИМП, если не исключен пиелонефрит, составляет 10–14 дней. Наличие аномалий развития органов мочевой системы, пузырно-мочеточниковый рефлюкс, уретроцеле и др. определяют более длительные сроки непрерывной антибактериальной терапии (до 4 недель и более). Короткий курс лечения показан пациентам, имеющим локальную симптоматику ИМП.
Эффективность антибактериальной терапии
Признаками эффективности антибактериальной терапии у пожилых пациентов с ИМП в активной фазе являются следующие:
При отсутствии клинического улучшения в течение 48 часов от начала лечения рекомендуется:
Антибактериальную терапию необходимо проводить в комбинации с препаратами, усиливающими местный иммунитет (Полиоксидоний, Виферон). Отличительной особенностью этих препаратов служит способность их воздействовать на иммунную систему в зависимости от ее состояния у конкретного пациента, т.?е. повышение исходно сниженных или понижение исходно повышенных показателей, что делает возможным назначение препарата без предварительного иммунологического исследования. Применение Полиоксидония в комплексной терапии позволяет повысить эффективность и сократить продолжительность лечения, значительно уменьшить использование антибиотиков, глюкокортикостероидов, удлинить срок ремиссии. Использовать Виферон и Полиоксидоний рекомендуется в виде суппозиторий.
Во время лечения необходимо проводить следующие исследования:
Фитотерапия при инфекциях мочевых путей
Пролит
Пролит — это комплекс из лекарственных трав, обладающих высокой биологической активностью по отношению к мочевыводящей системе человека.
Лекарственные травы, входящие в состав Пролита:
Пролит рекомендован в качестве БАД к пище — как источник органических кислот, дубильных веществ, калия. Способствует улучшению функционального состояния мочевыводящей системы и положительно влияет на состояние обмена веществ у людей, страдающих мочекаменной болезнью.
Препарат Пролит имеет две формы выпуска. Пролит пилюли № 100 удобен для подбора меньшей дозировки препарата, рекомендован на начальных этапах терапии МКБ, для профилактики, при назначении пожилым пациентам. Пролит Супер капсулы № 60 — это улучшенная формула препарата, в составе которой использованы более концентрированные экстракты лекарственных трав.
Бруснивер
Применяют при лечении острых и хронических заболеваний мочеполовой области и кишечника.
Бруснивер комбинированное средство растительного происхождения, обладающее антимикробной активностью.
В состав растительного сбора входят: брусники листья, зверобоя трава, череды трехраздельной трава, шиповника плоды.
Способ применения и дозы:
Внутрь или местно, в виде свежеприготовленного отвара или настоя. Отвар: один брикет (8 г) заливают 500 мл кипящей воды, настаивают в течение 1 ч и кипятят под крышкой на слабом огне в течение 15 мин, охлаждают при комнатной температуре в течение 45 мин. Настой: один брикет заливают в термосе 500 мл кипящей воды и настаивают не менее 2 ч. Полученное этими способами водное извлечение процеживают и применяют в теплом неразбавленном (внутрь, микроклизмы) или разбавленном в 2 раза (орошения, спринцевания, ванночки, примочки) виде. Внутрь назначают в дозах 1/4–1/3 стакана 3–4 раза в сутки. Наружно применяют в теплом виде. При этом для орошений, спринцеваний, ванночек отвар или настой разбавляют в 2–4 раза, для микроклизм используют по 25–50 мл неразбавленного теплого отвара (настоя).
ЦистоТранзит
ЦистоТранзит концентрат напитка — для очищения и улучшения функционального состояния почек и мочевыводящих путей.
ЦистоТранзит содержит биологически активные вещества, которые:
Растительные компоненты БАД «ЦистоТранзит», очищая почки, улучшают их состояние, что способствует более эффективной работе почек.
В состав Цистотранзита входят: трава хвоща полевого, трава золотарника канадского, трава горца птичьего, цветки ромашки, плоды клюквы.
Богатые кремнием соединения хвоща в организме образуют защитные коллоиды, препятствующие кристаллизации минеральных компонентов и затрудняющие образование мочевых камней.
Трава золотарника канадского (золотая розга) способствует растворению камней в почках и мочевом пузыре.
Благодаря растворимым соединениям кремниевой кислоты трава горца птичьего (спорыша) препятствует образованию мочевых камней. Спорыш способствует отхождению конкрементов из почек и мочевого пузыря.
Действие ромашки обусловлено комплексом веществ, содержащихся в цветочных корзинках. Полифенольное соединение ромашки, а также кумарины оказывают умеренное спазмолитическое действие.
Клюква сохраняет питательные и витаминные свойства благодаря содержанию в ягодах бензойной кислоты, обладающей противомикробными свойствами. Пектиновые вещества клюквы легко образуют нерастворимые соединения — хелаты — с тяжелыми и радиоактивными металлами, способствуя их детоксикации и выведению из организма.
Способ применения и дозы:
1 чайную ложку (5 мл) концентрата напитка растворить в 1 стакане (250 мл) воды, принимать взрослым 4 стакана в день. Допускается дневную дозу концентрата напитка — 4 чайные ложки (20 мл) — растворить в 1 литре воды и принимать в течение дня. Продолжительность приема — 20 дней. Рекомендуется повторять прием 4 раза в год (каждый сезон).
В. В. Смирнов, доктор медицинских наук, профессор
И. С. Мавричева, кандидат медицинских наук
А. Е. Гаврилова