Raoultella ornithinolytica в моче что это такое
Клебсиелла
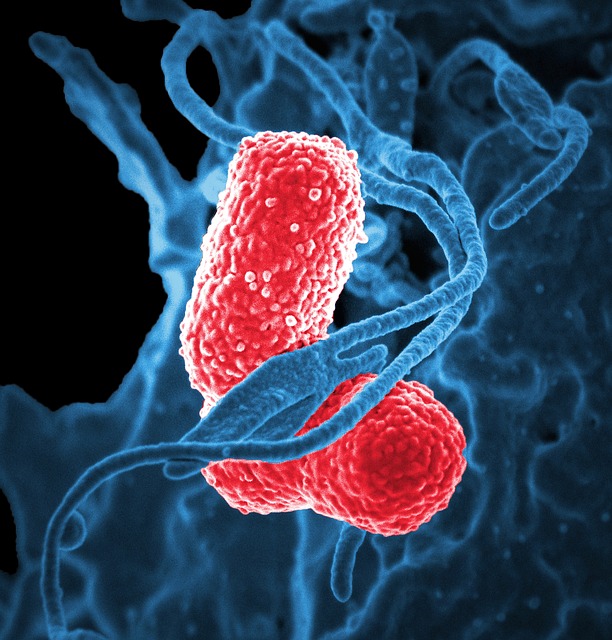
Темой нынешнего разговора будет, с точки зрения автора, королева внутрибольничных инфекций любого стационара — Klebsiella pneumonia (или палочка Фридлендера).
Автор: Трубачева Е.С., врач – клинический фармаколог
Темой нынешнего разговора будет, с точки зрения автора, королева внутрибольничных инфекций любого стационара — Klebsiella pneumoniae (или палочка Фридлендера). Да-да, автор не ошибся, именно она, а не синегнойки или ацинетки, а именно ее величество — клебсиелла, практически абсолютная убийца тяжелых и крайне тяжелых пациентов. Почему это именно так, мы сегодня и поговорим.
Микробиологические аспекты
Первое и главное, о чем надо знать, — Klebsiella pneumonia — это представитель нормальной микрофлоры кишечника. Еще раз и большими буквами — НОРМАЛЬНОЙ! Не надо ее там лечить (как и стафилококк в носоглотке) — она там живет, и это ее естественный ареал обитания.
А все остальные локации, где она может быть обнаружена: нижние дыхательные пути, мочевыводящий тракт, секрет простаты или содержимое полости матки (анальный сексуальный акт без презерватива — зло, имейте это в виду при сборе анамнеза, особенно у женщин с послеродовым эндометритом, автор такого навидался в достатке… мужчин это тоже касается, и обнаружение подобной зверюшки в секрете простаты должно навести на определенные мысли и вопросы, и пока пациент не закончит данную практику, простатит вы ему при всем желании не вылечите), кровь и в раны при раневых инфекциях после хирургического вмешательства на брюшной полости — могут указывать на возбудителя текущего состояния.
Что вызывает:
Общим у всех этих патологий является одно — они все тем или иным образом связаны с вмешательством, и чаще всего (опуская уже упомянутые анальные сексуальные акты) это вмешательство носит ятрогенный характер. Клебсиелла не умеет ни летать, ни ходить, ни даже ползать, в очаг ее приносят либо неправильно вымытые руки, либо плохо обработанное медицинское оборудование.
Эпидемиологические аспекты
Как мы уже обсуждали в статье о синегнойной палочке, при некотором желании и упертости эпидемиологической службы или клинического фармаколога (или команды из оных, так как каждый знает свое звено), извести неферментеров из стационара — не самая сложная задача. Было бы желание у администрации этим заняться. Что касается лечащих врачей и среднего персонала, то это тот случай, когда достаточно обработать перчатки и далее, на уровне ЦСО и утилизации отходов, правильно избавиться от контаминированого материала, и если инструментарий не одноразовый, то очистить и простерилизовать его. То есть даже на уровне обработанных (или стерильных) перчаток, касающихся только одной области пациента (другая область, если необходимо, требует смены перчаток, либо обработки рук с полным выдерживанием экспозиции, а не чуть-чуть антисептиком помазал-растер-побежал), вы уже снижаете риск контаминации оным зверьем с последующим развитием синегнойной инфекции. Про ацинетобактер будет отдельная глава в разделе «неферментеры».
С клебсиеллой все намного сложнее. Эта, не побоюсь громкого слова, зверища, живет в кишечниках всего персонала медицинских учреждений. И в первую очередь, как понятно из ее названия, поражает нижние дыхательные пути. А если персонал работает с антибиотиками, то клебсиелла еще и устойчивая ко всему арсеналу применяемых препаратов (это к вопросу о разумном ограничении доступа к препаратам резерва). Так как сама клебсиелла не имеет ножек и крылышек, то попадает в оные пути она двумя способами: или в случае аспирации, или на руках персонала и с оборудования. Иного не дано. При аспирации это будет личная дикая зверюшка пациента, в случае грязных шаловливых ручек или оборудования (например, эндоскопов) — клебсиелла, высеваемая в отделении в процессе микробиологического мониторинга. А если этот мониторинг углубленный, то напрямую покажет, какая именно хрюшка, выйдя из туалетной комнаты, не соизволила помыть руки, понадеявшись на перчатки. И нет, перчатки, даже стерильные в данном случае, не спасают, они не презерватив. Руки надо мыть и обрабатывать правильно, обязательно соблюдая технологию и экспозицию.
Как вы понимаете, истребить медицинский персонал мы не можем, поэтому и полностью очистить стационар от данной проблемы не получится. И она обязательно выскочит, стоит на секунду расслабиться, и выскочит на самом тяжелом больном, где еще умудрится смутировать в такого урода, которого не достанешь никаким антибиотиком.
На общемировом клебсиеллу тоже очень сильно боятся, и когда в 2010 году вдруг в Великобритании обнаружили штамм NDM (он устойчив вообще ко всему набору существующих антибиотиков и обозван абсолютным убийцей), паника была знатной. В результате проведенного эпидемиологического расследования, по итогам которого большая группа видных ученых стала персонами non-grata в Индии, было установлено, что данный штамм привезен оттуда и из Пакистана. Присутствие в сточных водах возбудителей, имеющих карбапенемазы (то есть это уже не внутрибольничная флора, это то, что там живет на улице) на момент проведения расследования составляла 90% по CTX-M15 и 36% по NDM. С чем связан сей факт? С безрецептурным масштабным использованием карбапенемов и… проблемами с проточной канализацией. Ее либо нет, либо ей не пользуются, а делают все по старинке. А так как земной шар оказался очень маленьким, теперь NDM-штаммы обнаруживаются по всей планете. У нас, например, очень быстро данным штаммом заселились клиники Санкт-Петербурга. И медицина перед ними бессильна. До тех пор, пока не налажен эпиднадзор, а персонал не моет руки после каждого посещения туалета.
Так как любого врага надо знать в лицо, то наиболее часто встречаемые портреты у автора тоже есть.
Итак, дикая и ничем ни разу не пуганная клебсиелла выглядит вот так:
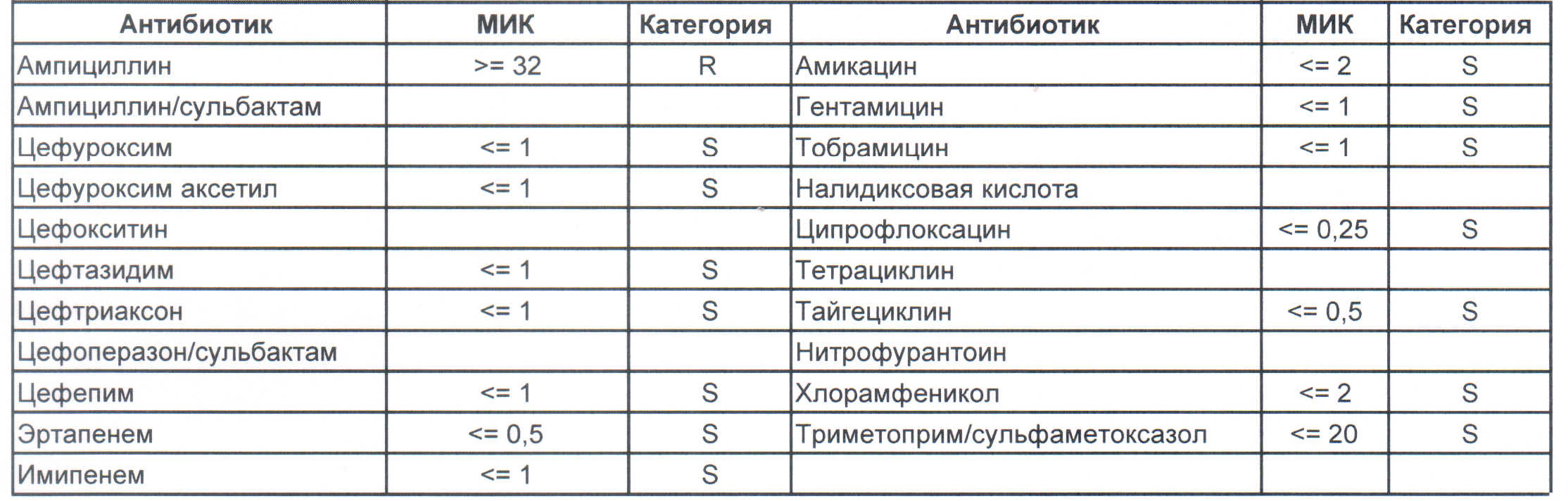
Где встречается? Те самые послеродовые эндометриты, как результат плотских утех, простатиты, а также раневые инфекции после оперативных вмешательств на брюшной полости у ранее не леченных пациентов.
— вы можете увидеть устойчивый внутрибольничный штамм, который еще можно чем-то полечить, но это будет тяжело и дорого, проще персонал научить руки мыть и бороды брить (фекальной микрофлоры в мужских бородах в таком достатке, что единственный вариант для тех, кто хоть как-то соприкасается с ранами, данное украшение не носить или не оперировать).
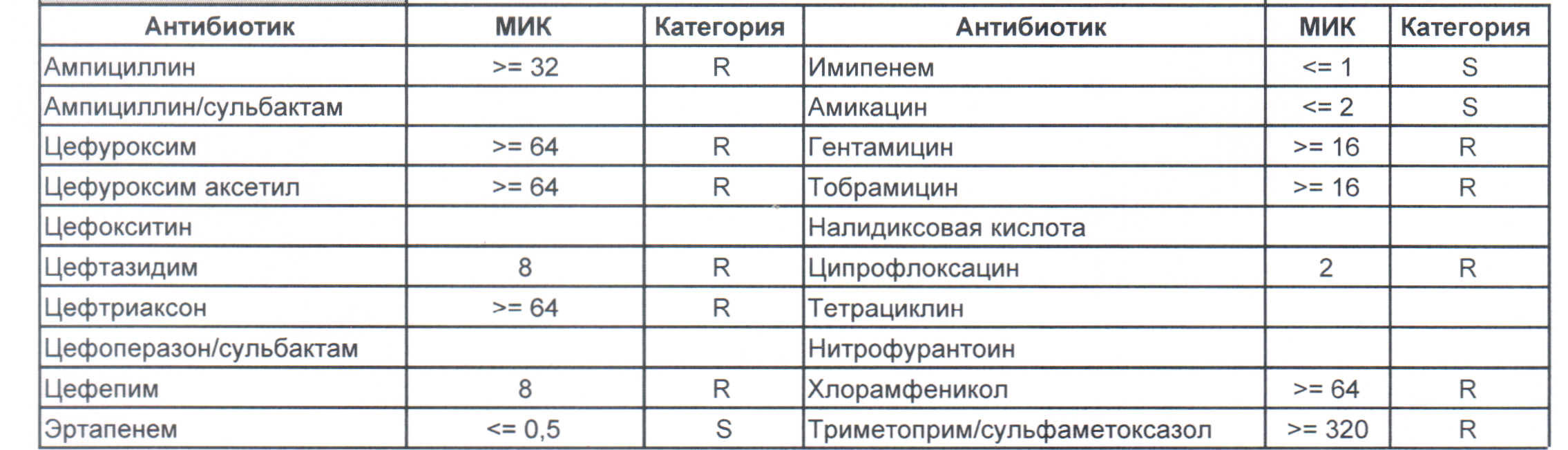
На следующей картинке:
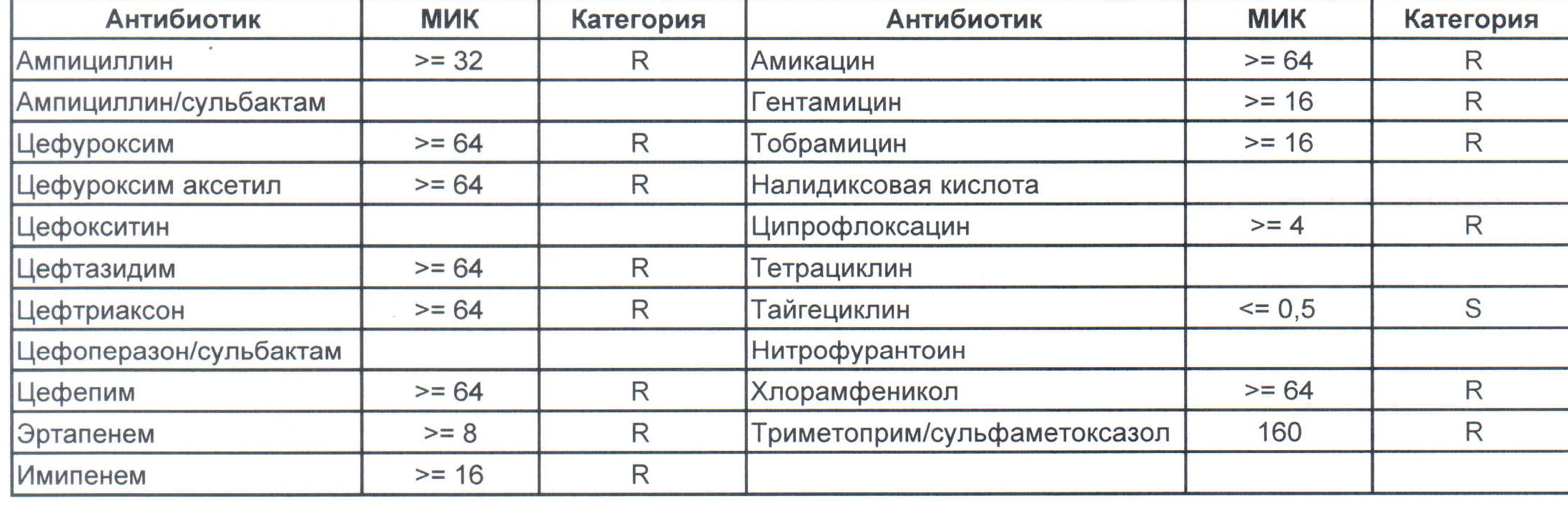
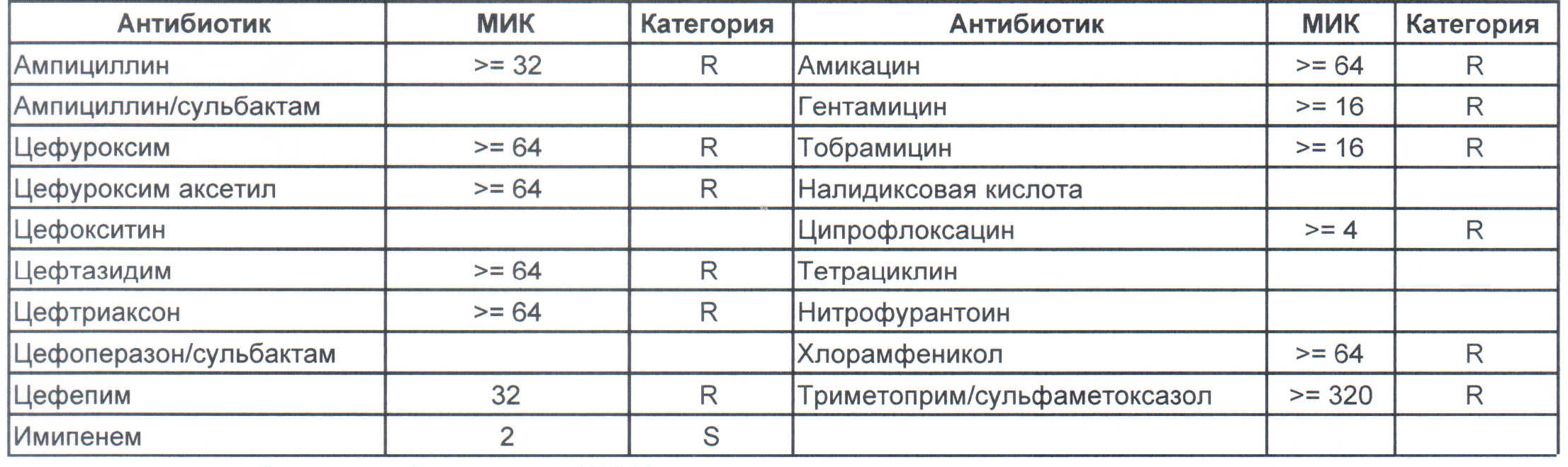
— мы видим практически неубиваемого зверя, который сам по себе вбивает тот самый последний гвоздь в гроб пациента. Но как же Тигециклин, спросите вы. Отвечу — тигацил является бактериостатиком, и пока он наберет необходимую силу, пациента уже отнесут и закопают. Но даже это еще не предел. Предел на следующем рисунке, и нет, Имипенем при указанной MIC уже бессилен:
Как вы понимаете — эти два зверя являются абсолютными убийцами, против которых в данный момент медицина бессильна полностью. И именно такое зверье живет в стационарах без микробиологического мониторинга и систем противостояния в виде эпидемического надзора. Именно эти звери убивают самых тяжелых пациентов, если каким-то образом (руки персонала или плохо обработанное оборудование) в них попали. Но что хуже всего, эти штаммы способны передавать свои факторы устойчивости другой грамотрицательной флоре, например, кишечным палочкам, а потому пациенты, инфицированные такими клебсиеллами, должны быть полностью изолированы и карантинизированы. Спасти их, скорее всего, не получится, но хотя бы всех остальных оградите от инфицирования и последующего летального исхода, да и сами такую зверюшку не подцепите (как вы помните «врач — это диагноз», так не будем его себе усложнять).
Чем лечить?
Дикая клебсиелла отлично лечится препаратами группы цефалоспоринов третьего ряда.
А вот внутрибольничную можно побороть, только четко понимая, с чем вы имеете дело, и обычный диско-дифузионный метод диагностики тут не поможет. Нужны автоматизированные системы с определением MIC. Но во главе угла все равно стоит инфекционная безопасность пациентов. Коллеги! Автор понимает, что выглядит «городской сумасшедшей», коим в свое время был объявлен Земмельвейс, но он вас умоляет — мойте руки после посещения туалета и мойте их правильно. Вам это ничего не стоит, а пациенты выживут. Ничего более эффективного против внутрибольничных клебсиелл пока не придумано. А эпидемиологи ваших учреждений будут проводить свои работы по контролю и дезинфекции отделений и целых зданий. Так получилось, что именно эту королеву ВБИ мы, врачи, медсестры и младший персонал, носим исключительно в себе. Берегите себя, своих близких и своих пациентов, тем более в это нелегкое для отечественной медицины время, с угрозой введения врачебных статей в УК. Клебсиелла — это почти всегда чистая ятрогения. Повторюсь — берегите себя и мойте руки.
Неосложненная и осложненная инфекция нижних мочевыводящих путей
Среди инфекций нижних мочевых путей (ИНМП) ведущее место занимает воспаление мочевого пузыря. Это самая частая урологическая инфекция, которая встречается как в амбулаторной, так и в стационарной практике. Распространенность инфекций мочевыводящих
Среди инфекций нижних мочевых путей (ИНМП) ведущее место занимает воспаление мочевого пузыря. Это самая частая урологическая инфекция, которая встречается как в амбулаторной, так и в стационарной практике.
Распространенность инфекций мочевыводящих путей (ИМП) в России составляет около 1000 случаев на 100 000 населения в год. Ежегодно регистрируется около 26–36 млн случаев острого цистита [1]. Можно предположить, что истинная распространенность заболевания значительно выше, поскольку многие пациенты не обращаются к врачу и лечатся сами. Мужчины чаще болеют циститом в пожилом возрасте, женщины — в молодом. Только в пожилом и старческом возрасте (к 70–75 годам) заболеваемость мужчин и женщин становится приблизительно одинаковой.
По числу случаев временной нетрудоспособности среди урологических заболеваний цистит занимает первое место [2, 3].
Согласно современной классификации ИНМП принято подразделять на неосложненную и осложненную. Наиболее частым проявлением неосложненной ИНМП является острый цистит. Он возникает при отсутствии обструктивных уропатий и структурных изменений в почках и мочевыводящих путях, без серьезных сопутствующих заболеваний и неврологических нарушений. Неосложненная ИНМП чаще выявляется у женщин с анатомически и функционально нормальным мочевым пузырем. Однако у 15–50% женщин с симптомами цистита выявляется клинически скрытая инфекция почек. В таком случае мы имеем дело с осложненным циститом, что нужно учитывать при диагностике и лечении.
В отличие от неосложненной ИНМП, осложненная инфекция возникает на фоне органических и функциональных изменений мочевого пузыря, нейрогенной патологии или серьезных сопутствующих заболеваний (сахарный диабет, нейтропения, иммуносупрессия) после применения инструментальных методов обследования и лечения. Проявлением осложненной инфекции мочевого пузыря является хронический цистит.
Европейская ассоциация урологов (Париж, 2006) предлагает использовать для распознавания осложненной ИМП так называемые факторы риска развития осложнений или неудач лечения. К ним относятся: мужской пол, пожилой возраст, госпитальная инфекция, беременность, функциональные или анатомические нарушения мочевых путей, камни в мочевых путях, недавнее вмешательство на мочевых путях, наличие катетера в мочевых путях, недавнее применение антибиотика, наличие симптомов заболевания более 7 дней на момент обращения, сахарный диабет, иммуносупрессия.
Следует помнить и учитывать некоторые клинические особенности цистита.
Источником бактериального неосложненного и осложненного цистита является нормальная микрофлора, колонизирующая периуретральную область и дистальную часть уретры. Инфицирование мочевого пузыря в 95% случаев происходит восходящим путем. Воспаление мочевого пузыря чаще всего вызывает неспецифическая микробная флора. Прежде всего это грамотрицательные энтеробактерии: кишечная палочка, протей, клебсиелла, синегнойная палочка, энтеробактер. Из грамположительных встречаются стафилококк, стрептококк, энтерококк. Как правило, неосложненная ИМП вызывается одним микроорганизмом, при осложненном цистите нередко определяется смешанная микрофлора [4].
У 0,4–30% больных с неосложненной ИМП в моче не выявляется патогенная микрофлора [5]. В таких случаях причиной заболевания могут быть вирусы, хламидии, микоплазмы, анаэробные микроорганизмы, для подтверждения этиологической роли которых нужно использовать специальные диагностические среды и методы исследования. Благодаря наличию у кишечной палочки уникальных факторов вирулентности (адгезины, уропатогенный специфический протеин, гемолизин, аэробактин) она играет ведущую роль в патогенезе неосложненной ИМП, при осложненной ИМП факторы вирулентности являются менее значимым условием возникновения инфекции.
Развитие цистита есть результат преобладания вирулентности этиологического инфекционного фактора над защитными механизмами мочевого пузыря. Необходимым условием развития бактериального неосложненного и осложненного цистита является адгезия значительного количества уропатогенных бактерий к уроэпителиальным клеткам с последующей инвазией их в стенку мочевого пузыря. Развитие и персистенция инфекции в стенке мочевого пузыря зависят от размера и интенсивности роста микробной колонии, обьема остаточной мочи, степени эксфолиации уретральных клеток с адгезированными уропатогенами, скорости потока мочи и частоты мочеиспусканий. После адгезии нормальный ток мочи или слизи не смывает бактерии. В результате происходит колонизация микроорганизмов. Адгезированные микроорганизмы не создают колоний на питательных микробиологических средах: этим объясняются трудности их выявления и недооценка в диагностике рецидивов. Уропатогенные штаммы E. coli способны формировать биопленки (микроколонии) на слизистой оболочке мочевого пузыря и внутри эпителиальных клеток, а также на некротических, рубцово-измененных тканях, катетерах. Микроорганизмы, образующие биопленку, обладают устойчивостью к антимикробной терапии. Бактерии в составе биопленки могут выживать при использовании антибиотиков в концентрациях, в 100–150 раз превышающих бактерицидные концентрации для планктонных форм бактерий того же вида [6].
Нарушение защитных механизмов мочевого пузыря повышает возможность адгезии и размножения в нем кишечной микрофлоры, вероятность развития инфекционно-воспалительного процесса и его рецидивирования.
Согласно современным представлениям, развитие инфекционно-воспалительного процесса в мочевом пузыре независимо от этиологии протекает по следующему «сценарию»: адгезия — инвазия — колонизация — пролиферация — повреждение тканей хозяина [7]. При неосложненных циститах поражается только слизистая оболочка мочевого пузыря. Иначе говоря, острый цистит — это поверхностная инфекция мочевого пузыря. В случае осложненной инфекции воспалительный процесс переходит на более глубокие слои (подслизистый, мышечный, серозный) стенки мочевого пузыря. Замещение гладкомышечных волокон соединительно-тканными в стенке мочевого пузыря ведет к его фиброзу, уменьшению емкости мочевого пузыря (микроцистит). Такие изменения наблюдаются при лучевом и интерстициальном цистите.
Развитию воспаления в мочевом пузыре способствуют следующие факторы:
Как в любом инфекционном процессе, взаимодействие факторов вирулентности возбудителя и целостность защитных механизмов макроорганизма во многом определяют развитие и течение инфекции. Уропатогенные штаммы E. coli имеют целый набор факторов вирулентности, с помощью которых они могут преодолевать даже ненарушенные защитные механизмы мочевого пузыря у женщин, обладают потенциальной способностью к восходящему распространению по мочевым путям. Установлено, что бактерии могут передавать друг другу различные факторы вирулентности: устойчивость к антибиотикам, выработку фактора колонизации, выработку токсинов, мембранных белков и др.
В настоящее время появляется все больше данных о значении в развитии бактериального неосложненного цистита наследственной предрасположенности (отсутствие секреции некоторых групп антигенов крови, дефекты муцинового слоя, повышенное содержание рецепторов для бактериальной адгезии на мембранах эпителиальных клеток) и поведенческих особенностей пациентов (сексуальная активность, использование влагалищных диафрагм, вибраторов и спермицидов, отсутствие мочеиспускания после полового акта, произвольное задерживание мочеиспускания, несоблюдение правил личной гигиены или неправильное их выполнение, недостаточный питьевой режим, ношение плотно облегающей одежды).
Цистит у женщин практически всегда связан с кольпитом или бактериальным вагинозом. Анатомо-физиологические особенности женского организма и его зависимость от состояния гормональной системы предопределяют выделение чисто женских клинических форм воспаления мочевого пузыря: цистит у девочек, дефлорационный цистит, цистит медового месяца, посткоитусный цистит, цистит у беременных, послеродовой, постклимактерический, инволюционный цистит.
Несмотря на легкость купирования острого неосложненного бактериального цистита при анатомически нормальных мочевых путях, цистит часто рецидивирует. У 50% больных склонность к рецидивам наблюдается в течение года, причем чаще у пациенток старше 55 лет [1, 8]. Принято различать рецидивирующий цистит и реинфекцию. Цистит считают рецидивирующим, если наблюдается три и более рецидива в год. Это сохраняющаяся инфекция, при которой определяется один и тот же микробный возбудитель из неликвидированного очага инфекции. Реинфекция — это инфекция, вызванная другим микробным возбудителем из кишечника и перианальной области. Современными исследованиями установлено, что повторные рецидивы цистита в 90% случаев представляют собой новое заболевание, а не рецидив предшествующего.
Высокая частота рецидивирования цистита обьясняется следующими причинами (наряду с перечисленными ранее причинами возникновения цистита):
Диагностика
Диагноз острого неосложненного цистита ставят с учетом анамнеза и клинических симптомов. Если данные анамнеза и жалоб не совпадают с клиникой цистита, то показано исследование мочи. Микроскопическое исследование мочи позволяет верифицировать острый цистит только у 50% больных, имеющих бактериальный показатель выше 100 000 КОЕ/мл.
Наличие лейкоцитов в моче является обязательным признаком цистита. О лейкоцитурии принято говорить, если в осадке мочи содержится 6 и более лейкоцитов в поле зрения микроскопа. Исследование нецентрифугированной мочи из средней порции с помощью простого гематоцитометра обладает высокой чувствительностью и позволяет выявить лейкоцитурию у больных с нормальными показателями общего анализа мочи, обнаружить инфекцию или колонизацию. В ряде случаев приходится исключать острый уретрит (хламидийный, гонорейный, герпетический) и вагинит (кандидозный, трихомонадный).
Если распознавание острого цистита не вызывает затруднений, то диагностика осложненного цистита представляет определенные трудности, особенно при интерстициальном цистите. При осложненной ИНМП необходимо диагностировать основное урологическое заболевание, особенно это касается пиелонефрита (первичного и вторичного). В связи с этим каждый больной с осложненным циститом подлежит общему и урологическому обследованию.
Мероприятия, проводимые для диагностики хронического цистита:
Дифференциальную диагностику осложненного цистита следует проводить со следующими заболеваниями: туберкулез мочевой системы, рак мочевого пузыря, уретральный синдром, вульвовагинит, уретрит.
Лечение
Лечение циститов должно быть комплексным и в первую очередь направлено на санацию очагов инфекции, быструю элиминацию микробного возбудителя, устранение причин частого рецидивирования и восстановление естественных защитных антибактериальных механизмов мочевого пузыря. Комплексное лечение включает в себя следующие виды терапии:
При неосложненной ИМП (острый цистит) лечение не представляет трудностей, оно проводится обычно в амбулаторных условиях и в основном заключается:
Больные, не получающие антибактериальные препараты, имеют повышенный риск развития осложнений и хронизации процесса. Нередко в повседневной практике применяются неадекватные методы лечения цистита. Одной из наиболее частых ошибок является назначение препаратов с низкой антимикробной активностью в отношении возбудителей неосложненной ИМП или с недоказанной их эффективностью. Повторное назначение антибиотиков одной группы способствует возникновению резистентных к ним штаммов.
Существенное влияние на результат лечения оказывает правильный первоначальный выбор антибактериального препарата.
В настоящее время при неосложненном остром цистите доказана эффективность терапии одной дозой и трехдневного курса, а более длительная не имеет никаких преимуществ. Такое лечение имеет свои достоинства: высокая клиническая и микробиологическая эффективность, снижение селекции резистентных штаммов, низкая частота нежелательных реакций, хорошая переносимость и более низкая стоимость лечения.
На сегодняшний день для лечения одной дозой лучшим препаратом является фосфомицина трометамол (Монурал) — антибиотик широкого спектра действия, активный в отношении большинства аэробных грамотрицательных (включая протей, клебсиеллу, энтеробактер, синегнойную палочку) и грамположительных бактерий, стафилококков (золотистого, эпидермального), стрептококков (сапрофитного, фекального). Препарат оказывает быстрое бактерицидное и длительное антиадгезивное действие, уменьшает коагрегацию бактерий, характеризуется отсутствием аллергии и перекрестной резистентности с другими антибиотиками.
Однократный прием Монурала (в дозе 3 г) по эффективности сопоставим с семидневным курсом терапии нитрофурантоином.
Считается, что если уровень резистентности уропатогенных штаммов E. coli к антибиотику составляет в регионе более 10–20%, то это является предпосылкой ограничения его использования как препарата выбора.
Наибольшее распространение при лечении неосложненной ИНМП получил трехдневный курс терапии фторхинолонами, обладающими широким спектром высокой микробиологической активности против основных возбудителей острого цистита, способными создавать высокие и длительно сохраняющиеся концентрации в моче после однократного приема. Наиболее эффективны и безопасны из них норфлоксацин, офлоксацин, ципрофлоксацин, левофлоксацин. Альтернативой фторхинолонам при остром цистите являются ингибиторозащищенные пенициллины (Аугментин, Амоксиклав), оральные цефалоспорины III и IV поколений.
Препараты выбора для трехдневного курса лечения неосложненного цистита:
У беременных женщин при неосложненном цистите рекомендуется использовать цефалоспорины I–III поколений, фосфомицина трометамол (однократно), альтернативные препараты: амоксициллин/клавуланат, нитрофурантоин.
Залогом успеха терапии острого цистита является своевременное и адекватное назначение антибиотиков буквально с момента появления клинических симптомов заболевания. Не нужно ждать результата бактериологического исследования, а лечить не откладывая. При неэффективности применения короткого курса терапии его нужно рассматривать как диагностический показатель, указывающий на наличие осложненной инфекции мочевого пузыря. В таких случаях пациенты должны быть подвергнуты тщательному урологическому обследованию для выявления сопутствующей патологии или осложненной уроинфекции.
При рецидиве воспаления мочевого пузыря, возникающего во время курса или через 2 нед после его окончания, можно думать об обострении воспалительного процесса; в этом случае его нужно лечить фторхинолонами в течение 7–14 дней. Лечение реинфекции проводится трехдневным курсом терапии и тем же препаратом, который был эффективен при первом эпизоде инфекции. Пациентам с часто рецидивирующим циститом (более трех обострений в течение года) должна проводиться превентивная терапия (прием небольших доз антибиотика каждый день на ночь). Превентивное лечение может проводиться от нескольких месяцев (6–12) до нескольких лет и более. Длительная регулярная профилактическая терапия приводит к стойкой ремиссии, а у ряда больных — к выздоровлению.
При осложненной инфекции мочевого пузыря терапия короткими курсами, а тем более одной дозой препарата противопоказана; назначаются длительные курсы антимикробной терапии — от 7 до 14 дней, а иногда в течение 4–6 нед. У больных с хроническим циститом необходимо устранение патогенетических факторов развития рецидивирующей хронической инфекции мочевого пузыря: инфравезикальной обструкции органического (стеноз уретры, парауретральный фиброз и др.) или функционального (гипертонус детрузора, детрузорно-сфинктерная диссинергия) характера.
При детрузорно-сфинктерной диссинергии необходимо назначать транквилизаторы с миорелаксирующим действием — Реланиум, Феназепам, Баклофен. В лечении гиперактивного мочевого пузыря широко применяются М-холинолитики, которые приводят к уменьшению тонуса детрузора, способствуют урежению позывов к мочеиспусканию, снижению имперактивности, облегчению удержания мочи. С этой целью применяют Дриптан (оксибутинина хлорид) — по 5 мг 3 раза в сутки, Детрузитол — по 2 мг 2 раза в сутки, Спазмекс (троспия хлорид) — по 5 мг 3 раза в сутки. Курс лечения — 3–6 мес. У больных с гипертонусом уретрального сфинктера и шейки мочевого пузыря следует назначать a-адреноблокаторы: Сетегис — по 2–5 мг на ночь, Корнам — 2–5 мг перед сном.
Инфекция нижних мочевых путей может быть обусловлена нейромышечными нарушениями гладкомышечных элементов мочевыводящего тракта и органов малого таза (чаще по гиперспастическому типу) или сочетаться с ними. Этому способствуют травмы и операции в анамнезе, занятия определенными видами спорта, патологические изменения в нижних конечностях, повышенная нагрузка на нижнюю часть спины (ношение туфель на шпильке). В результате нарушается иннервация мочевого пузыря и возникает его дисфункция, которая может вызвать рецидив цистита. Поэтому в комплексную терапию необходимо включать миорелаксанты (Феназепам, Баклофен) и спазмолитики (Папаверин, Галидор, Баралгин, Но-шпа).
Общее и местное противовоспалительное лечение применяется в основном при хроническом цистите — назначаются нестероидные противовоспалительные препараты (НПВП): диклофенак, пироксикам, лорноксикам, нимесулид; применяется местное лечение в виде промывания и инстилляций мочевого пузыря.
Боли при цистите часто принимают упорный, тягостный характер. При болезненном мочеиспускании назначают НПВП (нимесулид, кеторолак), при этом нельзя уменьшать количество потребляемой жидкости. Из обезболивающих средств наиболее эффективны Солпадеин — по 1–2 таблетки 4 раза в день, Гентос — по 15 капель 3 раза в день (в 1-й день до 8 раз в сутки), свечи с Анестезином, свечи с Цефеконом Н, микроклизмы с 2%-ным раствором новокаина.
Важнейшим звеном патогенетической терапии считается иммуномодулирующая терапия. Поэтому в комплексное лечение рекомендуется включать иммуномодулятор — Уро-Ваксом. Препарат представляет собой экстракт лиофилизированных бактериальных лизатов 18 различных штаммов E. Coli; назначается натощак по 1 капсуле в день в течение 10 дней при остром цистите и на срок до 3 мес при хроническом цистите и пиелонефрите. Через 3 мес после завершения вакцинации проводится ревакцинация, состоящая из трех десятидневных курсов в течение 3 мес.
Инфекции мочевого пузыря у женщин постменопаузального возраста связаны с эстрогенным дефицитом; проявлением урогенитальных расстройств является развитие атрофического цистоуретрита, синильного кольпита, выпадение слизистой оболочки уретры, сухость влагалища, зуд, жжение, частое и болезненное мочеиспускание, недержание мочи. Для лечения урогенитальных расстройств используют системную или местную терапию эстриолом (свечи или вагинальный крем Овестин), при этом чем раньше начато лечение, тем выше его эффективность.
Фитотерапия создает благоприятный фон для проведения антимикробной терапии, дополняет ее при хроническом течении заболевания. Чаще всего она используется для предупреждения развития осложнений и рецидивов заболевания, уменьшения выраженности воспалительных явлений и болей (Урокам, Урофлюкс, Канефрон, Фитолизин, Цистон).
В развитии ИМП существенное, а может быть и решающее значение имеют особенности социокультурного поведения пациентов.
В последние годы сексуальную активность считают основным фактором риска развития ИМП. Чаще всего цистит связан с регулярной половой жизнью. Поэтому необходимо четко выполнять правила сексуальной гигиены (обильные водные процедуры с туалетом наружных половых органов до полового акта и после, обязательное мочеиспускание после коитуса). При рецидивирующем течении цистита не следует пользоваться влагалищными диафрагмами и спермицидами, рекомендуется избегать сексуальных позиций, способствующих повышенной травматизации уретры. Если имеется связь между циститом и интимной близостью, то после полового акта необходим профилактический прием антибиотика (Фурадонин 50 мг, Фурамаг 50 мг, Норфлоксацин 200 мг, Ципрофлоксацин 125 мг). При отсутствии эффекта от профилактики инфекции после полового сношения женщинам необходимо проводить антибактериальное лечение в течение 6–12 мес.
Нарушения мочеиспускания у женщин и мужчин увеличивают риск возникновения ИМП. Мочеиспускание не следует подавлять произвольно: это ослабляет естественные защитные механизмы мочевого пузыря. При цистите нужно стараться добиться полного опорожнения мочевого пузыря.
Процесс выздоровления при цистите ускоряется при увеличении количества принимаемой жидкости. С профилактической целью рекомендуется пить 2–2,5 л жидкости в день. Лучше использовать обычную воду, неконцентрированные соки или минеральную воду без газа, настои трав, клюквенный и брусничный морс. Нельзя пить чай, кофе, кока-колу, газированные напитки, так как содержащийся в них кофеин раздражает слизистую оболочку мочевых путей.
Одежда не должна плотно облегать тело, чтобы не затруднять доступ крови к коже и не нарушать лимфоотток, не создавать перегрева и повышенной влажности в вагинально-анальной области, способствующих их колонизации и развитию инфекционных заболеваний.
В настоящее время большинство клиницистов рассматривают хронический цистит как вторичное заболевание, следствие поддерживающей его причины, которую необходимо найти и устранить. Только тогда можно добиться выздоровления. На сегодняшний день критериями излеченности цистита считаются ликвидация расстройств мочеиспускания, исчезновение бактериурии и лейкоцитурии, полное восстановление качества жизни и социальной адаптации пациента.
По вопросам литературы обращайтесь в редакцию.
Г. Н. Скрябин, кандидат медицинских наук, доцент
В. П. Александров, доктор медицинских наук, профессор
СПбМАПО, Санкт-Петербург