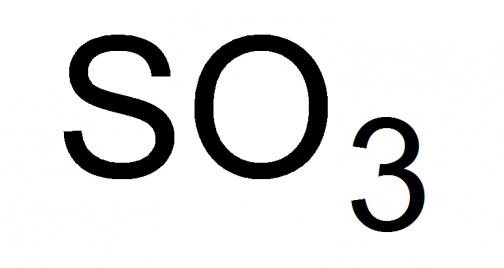So2 и so3 чем отличаются
Оксиды серы SO2 и SO3
Автор текста Анисимова Е.С. Из курса лекций по химии
Оксиды серы: SO2 и SO3
Атомы, элементы
1. В природе есть атомы, а в атомах есть протоны.
2. О. – Атомы с восемью протонами называются атомами кислорода (атомами химического элемента кислород).
3. Не путать атом кислорода с веществом «кислород», которым люди дышат:
дышат люди молекулами кислорода, которые состоят из двух атомов кислорода каждая.
4. Атом кислорода обозначается буквой О, а молекула из двух атомов О – это О2.
5. S. – Атомы с 16-тью протонами называются атомами серы (атомами химического элемента сера) и обозначаются буквой S.
6. Атомы с одинаковым числом протонов считаются атомами одного химического элемента.
7. Сера – это химический элемент.
Оксиды
8. Атомы кислорода могут соединяться с атомами другого химического элемента.
9. Соединения атомов кислорода с атомами серы называются оксидами серы.
10. Соединение из двух атомов водорода (Н) и одного атома кислорода (О) называется: молекулой оксида водорода или молекулой ВОДЫ.
S и 2О = SО2
11. Атом серы (S) может соединиться с двумя атомами кислорода (О).
12. Объединение одного атома серы S и двух атомов О даёт соединение состава SО2.
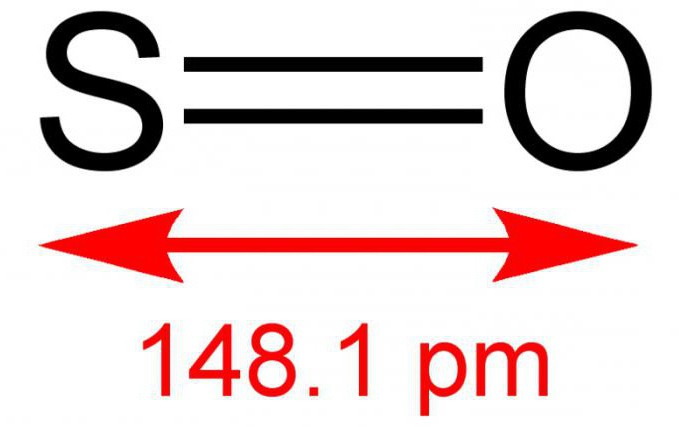
13. SО2 – это молекула. Формула молекулы.
14. SО2 является газом. В обычных условиях.
15. Вещество, молекулы которого имеют состав (и формулу) SО2, называется сернистым газом или оксидом серы IV.
16. SО2 – это формула молекулы сернистого газа.
SО2 и воздух
17. SО2 в атмосфере почти нет в норме. (Очень мало)
18. SО2 выделяется вулканами, заводами и автомобилями.
19. SО2 образуется при сжигании бензина, угля и т.д. Потому что примеси серы есть в угле и бензине.
20. В современной атмосфере SО2 больше, чем сто или тысячу лет назад.
21. Почему сейчас SО2 больше, чем сто лет назад? См. выше.
22. Поступление SО2 в атмосферу приводит к кислотным дождям.
23. Кислотные дожди портят здания, автомобили, памятники – всё созданное людьми. В том числе древние памятники искусства, шедевры архитектуры.
24. Из-за кислотных дождей во многих озёрах не стало рыбки.
25. Из-за кислотных дождей во многих лесах не стало листьев: листва опадает, деревья погибают.
26. Из-за кислотных дождей на многих полях не стало нормальной почвы: почва становится слишком кислой.
27. Из-за кислотных дождей на многих полях снизились урожаи.
28. Снижение урожаев грозит голодом.
29. Кислотные дожди портят леса, поля и озёра и создают угрозу голода.
30. Избавиться от кислотных дождей нужно за счёт снижения выбросов SO2 в атмосферу.
31. SO2 может быть источником серы для промышленности и с/х.
32. В атмосфере SO2 превращается в серную кислоту. (через…)
33. Много SO2 есть в атмосфере Венеры, вокруг неё целые облака из серной кислоты.
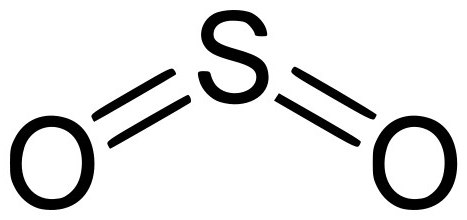
34. S и 3О = SО3
35. Атом серы (S) может соединиться с тремя атомами кислорода (О).
36. Объединение одного атома серы S и трёх атомов О даёт соединение состава SО3.
37. SО3 – это молекула. Формула молекулы.
38. SО3 является жидкостью. В обычных условиях.
39. SO3 – это единственный жидкий оксид, кроме воды.
40. Вещество, молекулы которого имеют состав (и формулу) SО3, называется оксидом серы-VI.
41. SО3 – это формула молекулы оксиды серы VI.
42. Контакт молекул SO3 с молекулами воды даёт серную кислоту.
Оксид серы в природе и жизни человека
В этой статье вы найдете информацию о том, что такое оксид серы. Будут рассмотрены его основные свойства химического и физического характера, существующие формы, способы их получения и отличия между собой. А также будут упомянуты области применения и биологическая роль данного оксида в его разнообразных формах.
Что представляет собой вещество
Оксид серы – это соединение простых веществ, серы и кислорода. Существует три формы оксидов серы, отличающиеся между собой степенью проявленной валентности S, а именно: SO (монооксид, моноокись серы), SO2 (серный диоксид или сернистый газ) и SO3 (триоксид или ангидрид серы). Все перечисленные вариации оксидов серы имеют схожие как химические, так и физические характеристики.
Общие данные о моноокисиде серы
Получают оксид серы (2) обычно при помощи сжигания серы или разложении ее ангидрида:
В воде вещество растворяется. В результате оксид серы образует тиосерную кислоту:
Общие данные о сернистом газе
Оксид серы – очередная форма оксидов серы с химической формулой SO2. Имеет неприятный специфический запах и не имеет цвета. Подвергаясь давлению, может зажигаться при комнатной температуре. При растворении в воде образует нестойкую сернистую кислоту. Может растворяться в растворах этанола и серной кислоты. Является компонентом вулканического газа.
В промышленности получают сжиганием серы или обжигом ее сульфидов:
В лабораториях, как правило, SO2 получают при помощи сульфитов и гидросульфитов, подвергая их воздействию сильной кислоты, а также воздействию на металлы с маленькой степенью активности концентрированной H2SO4.
Как и другие серные оксиды, SO2 является кислотным оксидом. Взаимодействуя со щелочами, образуя различные сульфиты, вступает в реакции с водой, создавая серную кислоту.
SO2 чрезвычайно активен, и это ярко выражается в его восстановительных свойствах, где окислительная степень оксида серы возрастает. Может проявлять свойства окислителя, если на него воздействует сильный восстановитель. Последнюю характерную особенность используют для производства фосфорноватистой кислоты, или для отделения S от газов металлургической области деятельности.
Оксид серы (4) широко используется человеком для получения сернистой кислоты или ее солей – это его основная область применения. А также он участвует в процессах виноделия и выступает там в роли консерванта (E220), иногда им протравливают овощехранилища и склады, так как он уничтожает микроорганизмы. Материалы, которые нельзя подвергать отбеливанию хлором, обрабатывают оксидом серы.
Общие данные о серном ангидриде
Серный газ, или, как его называют, серный ангидрид, – это высший оксид серы с химической формулой SO3. Жидкость с удушливым запахом, легколетучая при стандартных условиях. Способна застывать, образовывая смеси кристаллического типа из его твердых модификаций, при температуре от 16.9 °C и ниже.
Детальный разбор высшего оксида
При окислении SO2 воздухом под воздействием высоких температур, необходимым условием является наличие катализатора, например V2O5, Fe2O3, NaVO3 или Pt.
Термическое разложение сульфатов либо взаимодействие озона и SO2:
Окисление SO2 при помощи NO2:
К физическим качественным характеристикам относятся: наличие в состоянии газа плоского строения, тригонального типа и D3h симметрии, во время перехода от газа к кристаллу или жидкости образует тример циклического характера и зигзагообразную цепь, имеет ковалентную полярную связь.
В твердой форме SO3 встречается в альфа, бета, гамма и сигма формах, при этом он имеет, соответственно, разную температуру плавления, степень проявления полимеризации и разнообразную кристаллическую форму. Существование такого количества видов SO3 обусловлено образованием связей донорно-акцепторного типа.
К свойствам ангидрида серы можно отнести множество его качеств, основными из них являются:
Способность взаимодействовать с основаниями и оксидами:
Высший серный оксид SO3 имеет достаточно большую активность и создает серную кислоту, взаимодействуя с водой:
Вступает в реакции взаимодействия с хлороводородом и образует хлоросульфатную кислоту:
Для оксида серы характерным является проявление сильных окислительных свойств.
Применение серный ангидрид находит в создании серной кислоты. Небольшое его количество выделяется в окружающую среду во время использования серных шашек. SO3, образуя серную кислоту после взаимодействия с влажной поверхностью, уничтожает разнообразные опасные организмы, например грибки.
Подводя итоги
Оксид серы может находиться в разных агрегатных состояниях, начиная с жидкости и заканчивая твердой формой. В природе встречается редко, а способов его получения в промышленности довольно много, как и сфер, где его можно использовать. Сам оксид имеет три формы, в которых он проявляет различную степень валентности. Может быть очень токсичным и вызывать серьезные проблемы со здоровьем.
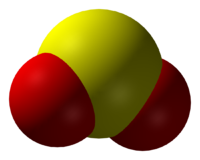
Оксид серы(IV)
| Оксид серы(IV) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид серы (IV) |
| Химическая формула | SO2 |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветный газ |
| Отн. молек. масса | 64.054 а. е. м. |
| Молярная масса | 64.054 г/моль |
| Плотность | 0,002927 г/см³ |
| Термические свойства | |
| Температура плавления | −75,5 °C |
| Температура кипения | −10,01 °C |
| Химические свойства | |
| Растворимость в воде | 11,5 г/100 мл |
| Классификация | |
| Рег. номер CAS | [7446-09-5] |
Окси́д се́ры (IV) (диокси́д се́ры, се́рнистый газ, се́рнистый ангидри́д) — SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой се́рнистой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, се́рной кислоте. SO2 — один из основных компонентов вулканических газов.
Содержание
Получение
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита:
В лабораторных условиях SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты. Образующаяся сернистая кислота H2SO3 сразу разлагается на SO2 и H2O:

Также диоксид серы можно получить действием концентрированной серной кислоты на малоактивные металлы при нагревании:
Химические свойства
Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
Со щелочами образует сульфиты:
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:


Последняя реакция является качественной реакцией на сульфит-ион SO3 2− и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы из отходящих газов металлургической промышленности используют восстановление SO2 оксидом углерода(II):
Или для получения фосфорноватистой кислоты:
Применение
Физиологическое действие
SO2 очень токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, сильное першение в горле и своеобразный привкус. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
При кратковременном вдыхании оказывает сильное раздражающее действие, вызывает кашель и першение в горле.
Интересно, что чувствительность по отношению к SO2 весьма различна у отдельных людей, животных и растений. Так, среди растений наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — роза, сосна и ель.
Воздействие на атмосферу
Из-за образования в больших количествах в качестве отходов диоксид серы является одним из основных газов, загрязняющих атмосферу.
Наибольшую опасность представляет собой загрязнение соединениями серы, которые выбрасываются в атмосферу при сжигании угольного топлива, нефти и природного газа, а также при выплавке металлов и производстве серной кислоты.
Наибольших концентраций сернистый газ достигает в северном полушарии, особенно над территорией США, Европы, Китая, европейской части России и Украины. В южном полушарии содержание его значительно ниже.
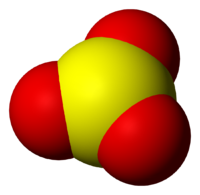
Оксид серы (VI)
Оксид серы (VI)
| Оксид серы(VI) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид серы(VI) |
| Химическая формула | SO3 |
| Отн. молек. масса | 80.06 а. е. м. |
| Молярная масса | 80.06 г/моль |
| Физические свойства | |
| Плотность вещества | 1.92 г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | 16,9 °C |
| Температура кипения | 45 °C |
| Энтальпия (ст. усл.) | −397.77 кДж/моль |
| Классификация | |
| номер CAS | [7446-11-9] |
Окси́д се́ры(VI) (се́рный ангидри́д, трео́кись се́ры, се́рный га́з) SO3 — высший оксид серы, тип химической связи: ковалентная полярная химическая связь. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
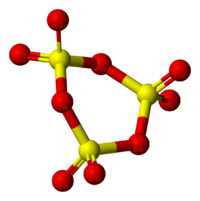
Находящиеся в газовой фазе молекулы SO3 имеют плоское тригональное строение с симметрией D3h (угол OSO = 120°, d(S-O) = 141 пм.) При переходе в жидкое и кристаллическое состояния образуются циклический тример и зигзагообразные цепи.
Твёрдый SO3 существует в α-, β-, γ- и δ-формах, с температурами плавления соответственно 16,8, 32,5, 62,3 и 95 °С и различающихся по форме кристаллов и степени полимеризации SO3. α-форма SO3 состоит преимущественно из молекул тримера. Другие кристаллические формы серного ангидрида состоят из зигзагообразных цепей: изолированных у β-SO3, соединенных в плоские сетки у γ-SO3 или в пространственные структуры у δ-SO3. При охлаждении из пара сначала образуется бесцветная, похожая на лёд, неустойчивая α-форма, которая постепенно переходит в присутствии влаги в устойчивую β-форму — белые «шёлковистые» кристаллы, похожие на асбест. Обратный переход β-формы в α-форму возможен только через газообразное состояние SO3. Обе модификации на воздухе «дымят» (образуются капельки H2SO4) вследствие высокой гигроскопичности SO3. Взаимный переход в другие модификации протекает очень медленно. Разнообразие форм триоксида серы связано со способностью молекул SO3 полимеризоваться благодаря образованию донорно-акцепторных связей. Полимерные структуры SO3 легко переходят друг в друга, и твердый SO3 обычно состоит из смеси различных форм, относительное содержание которых зависит от условий получения серного ангидрида.
Содержание
Получение
Можно получить термическим разложением сульфатов:
Тема «Оксиды серы» (сравнительная характеристика)
SO 2 -оксид серы ( IV ), сернистый газ, сернистый ангидрид, диоксид серы
SO 3 -оксид серы ( VI ), серный ангидрид, триоксид серы
1. Строение молекул
Самостоятельно по учебнику! Стр.85
2. Физические свойства
а) в промышленности:
1) при сгорании серы : S + O 2 → SO 2 + Q
2) при обжиге сульфидов, например:
FeS 2 – пирит, железный колчедан
а) в промышленности:
SO 2 – кислотный оксид, а значит реагирует
1) с водой, образуя кислоту:
2) с основными оксидами, образуя соль:
3) со щелочами, образуя соли (кислые и средние):
Допишите уравнения реакций, назовите продукты
SO 3 – кислотный оксид, а значит реагирует
1) с водой, образуя кислоту:
2) с основными оксидами, образуя соль:
3) со щелочами, образуя соли (кислые и средние):
Допишите уравнения реакций, назовите продукты
5. Химические свойства (особенные-специфические, окислительно-восстановительные)
в SO 2 сера находится в промежуточной степени окисления (+4), а, значит, может проявлять окислительно-восстановительную двойственность-быть и окислителем, и восстановителем:
в SO 3 сера находится в высшей степени окисления (+6),а значит может быть только окислителем:
Практического значения не имеет. Является промежуточным продуктом в производстве серной кислоты ( H 2 SO 4)
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Ищем педагогов в команду «Инфоурок»
Номер материала: ДВ-425307
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Безлимитный доступ к занятиям с онлайн-репетиторами
Выгоднее, чем оплачивать каждое занятие отдельно
В московских школах придумали новый формат классных часов с участием отцов
Время чтения: 2 минуты
ОНФ проверит качество охраны в российских школах
Время чтения: 2 минуты
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
Для школьников к 1 сентября разработают короткие экскурсионные маршруты
Время чтения: 1 минута
В Ленобласти педагоги призеров и победителей олимпиады получат денежные поощрения
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.