So4 химия что это
Сульфаты
Содержание
Свойства
Происхождение (генезис)
Образуются в условиях повышенной концентрации кислорода и при относительно низких температурах, то есть вблизи земной поверхности. Большей частью экзогенные, хемогенные (в месторождениях солей). Сульфаты Cu, Zn и других близких элементов образуются при разрушении сульфидов. В природе встречается 180 минералов сульфатов и на их долю приходится
Использование
Некоторые из сульфатов добывают для различных технических целей (гипс, барит и др.). для химической промышленности (мирабилит и др.), как руды Mg и др.
Качественные реакции
См. также
Литература
Ссылки
Примечания
Полезное
Смотреть что такое «Сульфаты» в других словарях:
СУЛЬФАТЫ — (ново лат., от sulfur сера). Серно кислые соли. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. СУЛЬФАТЫ новолатинск., от sulfur, сера. Серноватистокислые соли. Объяснение 25000 иностранных слов, вошедших в… … Словарь иностранных слов русского языка
СУЛЬФАТЫ — соли или эфиры серной кислоты Н2SO4. Соли Средние (напр., К2SO4) и кислые, или гидросульфаты (КНSO4), кристаллы. Средние соли распространены в природе (см. Сульфаты природные). Эфиры диорганилсульфаты ROSO2OR и органилсульфаты ROSO2ОМ (R… … Большой Энциклопедический словарь
СУЛЬФАТЫ — СУЛЬФАТЫ, соли и эфиры серной кислоты H2SO4. Соли средние (например, K2SO4) и кислые, или гидросульфаты (KHSO4), кристаллы. Средние соли распространены в природе (например, гипс). Эфиры применяют в органическом синтезе, как растворители … Современная энциклопедия
СУЛЬФАТЫ — СУЛЬФАТЫ, ов, ед. сульфат, а, муж. (спец.). Соли серной кислоты. | прил. сульфатный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Сульфаты — СУЛЬФАТЫ, соли и эфиры серной кислоты H2SO4. Соли средние (например, K2SO4) и кислые, или гидросульфаты (KHSO4), кристаллы. Средние соли распространены в природе (например, гипс). Эфиры применяют в органическом синтезе, как растворители. … Иллюстрированный энциклопедический словарь
СУЛЬФАТЫ — соли серной кислоты H2S04, содержащие ион SO2 ; или ион HSO гидросульфаты, а также природные минералы (С. меди, цинка, железа, свинца и др.), образующиеся при разрушении (см.). Большинство С. (за исключением CaS04, SrS04 и BaS04) хорошо… … Большая политехническая энциклопедия
сульфаты — ов; мн. (ед. сульфат, а; м.). [от лат. sulphur сера] Хим. Соли серной кислоты. Природные с. (класс минералов). * * * сульфаты соли или эфиры серной кислоты H2SO4. Соли средние (например, K2SO4) и кислые, или гидросульфаты (KHSO4), кристаллы.… … Энциклопедический словарь
Сульфаты — (от лат. sulphur, sulfur сера) сернокислые соли, соли серной кислоты H2SO4. Имеются два ряда С. средние (нормальные) общей формулы Mg2SO4 и кислые (Гидросульфаты) MHSO4, где М одновалентный металл. С. кристаллические вещества,… … Большая советская энциклопедия
СУЛЬФАТЫ — соли или эфиры серной кислоты H2SO4. Соли средние (напр., K2SO4) и кислые, или гидросульфаты (KHSO4),кристаллы. Средние соли распространены в природе (см. Сульфаты природные). Эфиры диорганилсульфаты ROSC2OR и органилсульфаты ROSO2OM (R органич.… … Естествознание. Энциклопедический словарь
Серная кислота
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Валентность серы в серной кислоте равна VI.
Способы получения
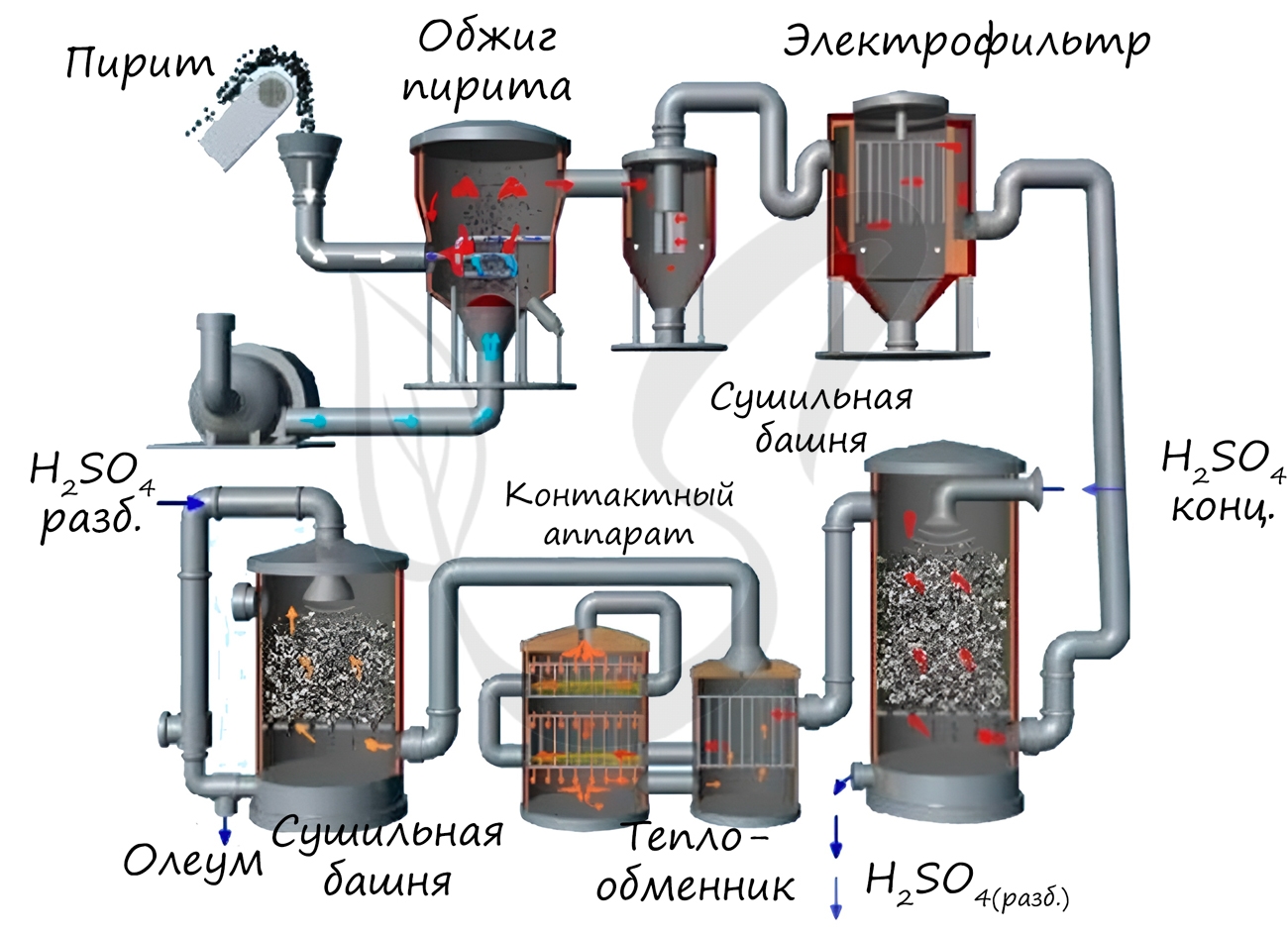
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравнения реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800 о С |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3): Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
Химические свойства
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4 – ⇄ H + + SO4 2–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Еще пример : при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Или с силикатом натрия:
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
4. Т акже серная кислота вступает в обменные реакции с солями.
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
Оксиды серы. Серная кислота
Сера с кислородом образует два оксида: SO2 – оксид серы (IV) и SO3 – оксид серы (VI).
Оксид серы (IV) — SO2 (сернистый газ, сернистый ангидрид)
Сернистый газ – это бесцветный газ с резким запахом, ядовит. Тяжелее воздуха более чем в два раза. Хорошо растворяется в воде. При комнатной температуре в одном объёме воды растворяется около 40 объёмов сернистого газа, при этом образуется сернистая кислота H2SO3.
Химические свойства
Сернистый газ – типичный кислотный оксид. Он взаимодействует:
а) с основаниями, образуя два типа солей: кислые (гидросульфиты) и средние (сульфиты):
б) с основными оксидами:
Сернистая кислота существуют только в растворе, относится к двухосновным кислотам. Сернистая кислота обладает всеми общими свойствами кислот.
Окислительно – восстановительные свойства
В окислительно-восстановительных процессах сернистый газ может быть как окислителем, так и восстановителем, потому что атом серы в этом соединении имеет промежуточную степень окисления +4.
Как окислитель SO2 реагирует с более сильными восстановителями, например с сероводородом:
Как восстановитель SO2 реагирует с более сильными окислителями, например с кислородом в присутствии катализатора, с хлором и т.д.:
Получение
1) Сернистый газ образуется при горении серы:
2) В промышленности его получают при обжиге пирита:
3) В лаборатории сернистый газ можно получить:
а) при действии кислот на сульфиты:
б) при взаимодействии концентрированной серной кислоты с тяжелыми металлами:
Применение
Сернистый газ находит широкое применение в текстильной промышленности для отбеливания различных изделий. Кроме того, его используют в сельском хозяйстве для уничтожения вредных микроорганизмов в теплицах и погребах. В больших количествах SO2 идет на получение серной кислоты.
Оксид серы (VI) – SO3 (серный ангидрид)
Серный ангидрид SO3 – это бесцветная жидкость, которая при температуре ниже 17 о С превращается в белую кристаллическую массу. Очень хорошо поглощает влагу (гигроскопичен).
Химические свойства
Как типичный кислотный оксид серный ангидрид взаимодействует:
а) с основаниями, образуя два типа солей – кислые (гидросульфиты) и средние (сульфаты):
Особым свойством SO3 является его способность хорошо растворяться в серной кислоте. Раствор SO3 в серной кислоте имеет название олеум.
Оксид серы (VI) характеризуется сильными окислительными свойствами (обычно восстанавливается до SO2):
Получение и применение
Серный ангидрид образуется при окислении сернистого газа:
В чистом виде серный ангидрид практического значения не имеет. Он получается как промежуточный продукт при производстве серной кислоты.
Серная кислота H2SO4
Упоминания о серной кислоте впервые встречаются у арабских и европейских алхимиков. Ее получали, прокаливая на воздухе железный купорос (FeSO4∙7H2O): 2FeSO4 = Fe2O3 + SO3↑ + SO2↑ либо смесь серы с селитрой: 6KNO3 + 5S = 3K2SO4 + 2SO3↑ + 3N2↑, а выделяющиеся пары серного ангидрида конденсировали. Поглощая влагу, они превращались в олеум. В зависимости от способа приготовления H2SO4 называли купоросным маслом или серным маслом. В 1595 г. алхимик Андреас Либавий установил тождественность обоих веществ.
Долгое время купоросное масло не находило широкого применения. Интерес к нему сильно возрос после того, как в XVIII в. был открыт процесс получения из индиго индигокармина – устойчивого синего красителя. Первую фабрику по производству серной кислоты основали недалеко от Лондона в 1736 г. Процесс осуществляли в свинцовых камерах, на дно которых наливали воду. В верхней части камеры сжигали расплавленную смесь селитры с серой, затем туда запускали воздух. Процедуру повторяли до тех пор, пока на дне ёмкости не образовывалась кислота требуемой концентрации.
В XIX в. способ усовершенствовали: вместо селитры стали использовать азотную кислоту (она при разложении в камере даёт NO2). Чтобы возвращать в систему нитрозные газы были сконструированы специальные башни, которые и дали название всему процессу – башенный процесс. Заводы, работающие по башенному методу, существуют и в наше время.

Серная кислота – это тяжелая маслянистая жидкость без цвета и запаха, гигроскопична; хорошо растворяется в воде. При растворении концентрированной серной кислоты в воде выделяется большое количество тепла, поэтому ее надо осторожно приливать в воду (а не наоборот!) и перемешивать раствор.
Раствор серной кислоты в воде с содержанием H2SO4 менее 70% обычно называют разбавленной серной кислотой, а раствор более 70% — концентрированной серной кислотой.
Химические свойства
Разбавленная серная кислота проявляет все характерные свойства сильных кислот. Она реагирует:
Процесс взаимодействия ионов Ва 2+ с сульфат-ионами SO4 2+ приводит к образованию белого нерастворимого осадка BaSO4. Это качественная реакция на сульфат-ион.
Окислительно – восстановительные свойства
В разбавленной серной кислоте растворяются металлы, которые в электрохимическом ряду напряжений находятся до водорода. При этом образуются сульфаты металлов и выделяется водород:
Металлы, которые в электрохимическом ряду напряжений находятся после водорода, не реагируют с разбавленной серной кислотой:
Концентрированная серная кислота является сильным окислителем, особенно при нагревании. Она окисляет многие металлы, неметаллы и некоторые органические вещества.
При взаимодействии концентрированной серной кислоты с металлами, которые в электрохимическом ряду напряжений находятся после водорода (Cu, Ag, Hg), образуются сульфаты металлов, а также продукт восстановления серной кислоты – SO2.

Более активными металлами (Zn, Al, Mg) концентрированная серная кислота может восстанавливаться до свободной серы или сероводорода. Например, при взаимодействии серной кислоты с цинком, магнием, алюминием в зависимости от концентрации кислоты одновременно могут образовываться различные продукты восстановления серной кислоты – SO2, S, H2S:
На холоде концентрированная серная кислота пассивирует некоторые металлы, например алюминий и железо, поэтому ее перевозят в железных цистернах:
Концентрированная серная кислота окисляет некоторые неметаллы (серу, углерод и др.), восстанавливаясь до оксида серы (IV) SO2:
Получение и применение

В промышленности серную кислоту получают контактным способом. Процесс получения происходит в три стадии:
Полученный олеум перевозят в железных цистернах. Из олеума получают серную кислоту нужной концентрации, приливая его в воду. Это можно выразить схемой:
Серная кислота находит разнообразное применение в самых различных областях народного хозяйства. Ее используют для осушки газов, в производстве других кислот, для получения удобрений, различных красителей и лекарственных средств.
Соли серной кислоты

Большинство сульфатов хорошо растворимы в воде (малорастворим CaSO4, еще менее PbSO4 и практически нерастворим BaSO4). Некоторые сульфаты, содержащие кристаллизационную воду, называются купоросами:
CuSO4 ∙ 5H2O медный купорос
FeSO4 ∙ 7H2O железный купорос
Соли серной кислоты имеют все общие свойства солей. Особенным является их отношение к нагреванию.
Сульфаты активных металлов (Na, K, Ba) не разлагаются даже при 1000 о С, а других (Cu, Al, Fe) – распадаются при небольшом нагревании на оксид металла и SO3:
Скачать:
Скачать бесплатно реферат на тему: «Производство серной кислоты контактным способом» Производство-серной-кислоты-контактным-способом.docx (238 Загрузок)
Скачать рефераты по другим темам можно здесь
*на изображении записи фотография медного купороса
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Серная кислота
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Получение
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.
Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
В окислительной башне смешивают оксиды азота (II) и (IV) с воздухом:
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
В ходе гидролиза нитрозилсерной кислоты получают азотистую кислоту и серную:
В упрощенном виде нитрозный способ можно записать так:
Химические свойства
В водном растворе диссоциирует ступенчато.
С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)
Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Серная кислота. Общая характеристика, получение, химические свойства
Серная кислота, также известная как масло витриола, или купоросное масло представляет собой минеральную кислоту, состоящую из элементов серы, кислорода и водорода, с молекулярной формулой H2SO4.
Она является бесцветной, не имеющей запаха вязкой жидкостью, которая растворима в воде и синтезируется в реакциях, которые являются сильно экзотермическими.
Чистая серная кислота является вязкой прозрачной жидкостью, как масло, и это объясняет старое название кислоты («масло витриола»).
Обладает следующими важными характеристиками:
Серная кислота в истории
Мухаммад ибн Закарий аль-Рази (854-925) считается первым, кто произвел серную кислоту. Серная кислота была названа «маслом витриола» средневековыми европейскими алхимиками, потому что она была приготовлена обжаркой «зелёного купороса» (сульфата железа (II)) в железной реторте.
В 1736 году лондонский фармацевт Джошуа Уорд использовал этот метод для начала первого крупномасштабного производства серной кислоты.
После нескольких уточнений этот способ, называемый процессом в свинцовой камере или «камерный процесс», оставался стандартом для производства серной кислоты в течение почти двух столетий.
В 1831 году британский торговец уксусом Перегрин Филлипс запатентовал «контактный процесс», который был гораздо более экономичным процессом производства серного ангидрида и концентрированной серной кислоты.
Получение серной кислоты
Существует несколько способов получения серной кислоты, в частности
Серная кислота и Вода
Концентрированная серная кислота обладает очень мощным дегидратирующим свойством, удаляя воду (H2O) из других химических соединений, включая сахар и другие углеводы, и получая углерод, тепло и пар.
Приготовление разбавленной кислоты может быть опасным из-за тепла, выделяющегося в процессе разбавления.
Вода обладает более высокой теплоемкостью, чем кислота, и поэтому сосуд из холодной воды будет поглощать тепло по мере добавления кислоты.
Поскольку реакция гидратации серной кислоты является очень экзотермической, разбавление всегда должно осуществляться добавлением кислоты к воде, а не воды к кислоте.
Реакция находится в равновесии, которое способствует быстрому протонированию воды, добавление кислоты к воде гарантирует, что кислота является ограничительным реагентом.
Эту реакцию лучше всего рассматривать как образование ионов гидроксония:
Серная кислота и Ожоги
Серная кислота способна вызывать сильные ожоги, особенно когда она находится в высоких концентрациях.
Серная кислота и ее Опасность
Основными профессиональными рисками, создаваемыми этой кислотой, являются контакт с кожей, приводящий к ожогам и вдыхание паров.
При более низких концентрациях наиболее часто сообщаемым симптомом хронического воздействия сернокислотных аэрозолей является эрозия зубов, обнаруженная практически во всех исследованиях.
В США допустимый предел воздействия на серную кислоту установлен на уровне 1 мг/м3: пределы в других странах аналогичны. Были сообщения о приеме серной кислоты в пищу, приводящем к дефициту витамина B12 с комбинированной дегенерацией.
Серная кислота и ее Применение
Производство H2SO4 в стране является хорошим показателем ее промышленной прочности.
Мировое производство в 2004 году составило около 180 миллионов тонн при следующем географическом распределении:
Большая часть этого количества (≈60%) потребляется на удобрения, в частности на суперфосфаты, фосфат аммония и сульфаты аммония.
Около 20% используется в химической промышленности для производства моющих средств, синтетических смол, красителей, фармацевтических препаратов, нефтяных катализаторов, инсектицидов и антифризов, а также в различных процессах, таких как кислотизация нефтяных скважин, восстановление алюминия, проклеивание бумаги, обработка воды.
Около 6% применений относятся к пигментам и включают краски, эмали, печатные краски, мелованные ткани и бумагу.
Остальное количество ( ≈14% ) применяется в таких отраслях, как производство взрывчатых веществ, целлофана, ацетата и вискозного текстиля, смазочных материалов, цветных металлов и батарей.
Серная кислота и Водоросли
H2SO4 используется в качестве защиты некоторыми морскими видами, например, фаэофит Desmarestia munda (порядок Desmarestiales) концентрирует серную кислоту в клеточных вакуолях.
Серная кислота и Венера
Серная кислота образуется в верхних слоях атмосферы Венеры при фотохимическом воздействии Солнца на диоксид углерода, диоксид серы и водяной пар.
В верхних, более холодных частях атмосферы Венеры серная кислота существует в виде жидкости, а густые облака серной кислоты полностью затмевают поверхность планеты, если смотреть сверху.
Серная кислота и Европа
Инфракрасные спектры, полученные космическим аппаратом NASA Galileo, показывают различные поглощения на спутнике Юпитера Европе, которые приписываются одному или нескольким гидратам серной кислоты.
Трактовка спектров несколько спорна. Некоторые планетологи предпочитают присваивать спектральные особенности сульфатному иону, возможно, как части одного или нескольких минералов на поверхности Европы.
Серная кислота на Земле
Чистая серная кислота не встречается естественным образом на Земле в безводной форме из-за ее большого сродства к воде.
Диоксид серы является основным побочным продуктом, получаемым при сжигании серосодержащих видов топлива, таких как уголь или нефть.
Поскольку серная кислота достигает перенасыщения в стратосфере, она может образовать частицы аэрозоля и обеспечить поверхность для роста аэрозоля путем конденсации и коагуляции с другими аэрозолями вода-серная кислота, что приводит к образованию стратосферного аэрозольного слоя.
Таблица 1: Химические свойства серной кислоты
Реагенты
Разбавленная H2SO4
Концентрированная H2SO4
Металлы активные
(Ca, Na, Ba, Zn, Mg)
Металлы средней активности
(Fe, Sn, Cr, Co, Ni, Pb)
Малоактивные металлы
(Hg, Ag, Cu, Bi)
H2SO4 (k.) + Au, Pt ≠ ни при каких условиях