Sodium hydroxide что это
Sodium hydroxide (Гидроксид натрия) в косметике. Что это такое, свойства, вред и польза, опасность для волос, кожи
Вещество Sodium hydroxide нередко используется в современной косметологии – косметике, ухаживающих и декоративных средствах для кожи и волос.
Что это за вещество
Sodium hydroxide может носить разные названия: гидроксид или гидроокись натрия, каустическая сода или каустик. Едкий натр или едкая щелочь — еще одно наименование, которое ярко характеризует свойства вещества. Химическая формула вещества — NaOH.
Оно используется повсеместно в косметике и туалетных принадлежностях, в медицине и косметологии, в гражданской обороне, в пищевой, легкой и тяжелой промышленности. Гидроксид натрия представляет собой хлопьевидную субстанцию белого цвета, которая с легкостью абсорбирует воду.

Вещество синтезируется из хлорида натрия. Вследствие своей щелочной природы, гидроксид натрия разъедает как органические вещества, так и металлы. Растворение в воде происходит на фоне выделения большого количества теплоты с получением гидратов.
Для чего его добавляют в состав косметики, полезные функции
Особенность Sodium hydroxide вступать во взаимодействие с маслами и образовывать соли натриевых жирных кислот обеспечивает основное действие вещества — омыление.
Свойства и функции у этого компонента в составе средств следующие:
Есть ли от него вред и насколько сильный, опасность применения
Sodium hydroxide является агрессивным веществом, способным разлагать белки и липиды в коже, слизистых и других тканях, поэтому из-за риска дерматитов и реакций сенсибилизации в косметических средствах применяется дозировано. В низких концентрациях его применение безопасно для человека.
Обычно располагается в конце списка INCI из-за малой дозировки. В составе косметических средств он не обладает канцерогенностью и иммунотоксичностью, поэтому обычно не представляет опасности для применения женщинами в период беременности, может применяться в детской косметике для ухода за кожей.
В какой обычно косметике присутствует
Sodium hydroxide является поверхностно-активным веществом и входит в состав ухаживающих косметических средств. Популярный в косметологии глицерин содержит в составе гидроксид натрия. Компонент добавляют в мыло, шампунь, крем, скраб, зубную пасту, глазные капли, жидкую пудру и жидкость для снятия лака. Средства с гидроксидом натрия подходят для любого типа кожи.
Например, следующие косметические средства содержат его в своем составе:
Запрещён ли он в разных странах?
Компонент Sodium hydroxide разрешен для производства косметических продуктов во всех странах с ограничениями по применению:
Правила и советы по применению косметики с этим веществом
Вещество гидроксид натрия в составе косметики не имеет каких-либо особенностей применения, поэтому следует ориентироваться на рекомендации по использованию конкретного продукта.
Щелочь Sodium hydroxide, находясь в свободном состоянии, вступает во взаимодействие с воздухом и водой, но в готовом продукте после реакции омыления она находится в связанном состоянии, поэтому косметические средства не требует особых условий хранения.
Поиск альтернативы
В качестве замены веществу, как моющим веществом может служить анионный ПАВ, произведенный из кокосового масла и кислоты — производной таурина. Он имеет пенообразующие свойства аналогичные лаурил-сульфату, но при этом изготовлен из природного сырья. Наименование в INCI: Sodium Lauroyl Methyl Isethionate.
Примером такого натурального пилинга может быть кокосовый скраб для тела производителя тайской косметики Banna. Другой натуральной заменой Sodium hydroxide выступает не омыляемый лецитин, полученного из сои (INCI: Behenyl alcohol Glyceryl stearate Phospholipids Glycine soja sterols). Этот натуральный эмульгатор снимает раздражение, питает и восстанавливает кожу.
Например, Pure Love ночной крем для лица с кислотами Омега 3 и Омега 6 (маслом черной смородины). Альтернативным моющим компонентом в шампуне может быть вещество алкилсукцинат (Sodium Lauroyl Methyl Isethionate). Пример мягкого шампуня на его основе — Klorane Nutri-Reparative with Desert Date.
В VII веке создали технологию мыловарения путем соединения гидроксида натрия с натуральными ароматическими маслами. Начиная с момента изобретения мыла и по сей день, очищающие и оздоравливающие свойства одновременно с безопасностью применения сделали Sodium hydroxide востребованным компонентом в современной косметике.
Видео о гидроксиде натрия
Мыло дома с нуля на гидроксиде натрия:
Гидроксид натрия (Е524)

Общая характеристика
Научное название добавки Е524 – гидроксид натрия или едкий натр. Это очень агрессивное вещество синтетического происхождения не имеет аналогов в природе. В естественных для себя условиях оно принимает вид белых чешуек или небольших гранул мыльных на ощупь.
В наше время широко используется в разных отраслях жизнедеятельности, в том числе медицине, фармакологии, пищевой индустрии. В сельском хозяйстве, например, каустическую соду используют для проверки коровьего молока на наличие примесей. Это вещество применяют в производстве разных видов бытовой химии (самые популярные – для прочистки водопроводных и канализационных труб). В косметологии едкий натр добавляют в шампуни, мыло, жидкости для снятия лака, кремы, а также в средства для избавления от ороговевшей кожи. Кроме того, гидроксид натрия – незаменимое вещество в нефтеперерабатывающей, целлюлозно-бумажной промышленности и в производстве дизельного топлива.
В пищевой промышленности гидроксид натрия используют для регуляции кислотности, как стабилизатор и эмульгатор. Несмотря на весьма агрессивные свойства и внушительный список побочных эффектов, каустическая сода в качестве пищевой добавки разрешена во всем мире.
Опасные свойства каустической соды
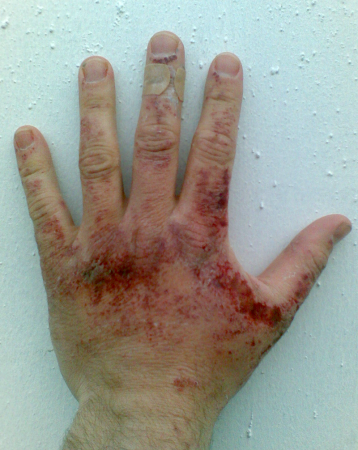
Каустическая сода – довольно опасное вещество. На коже и слизистых оболочках при контакте с ней образуются глубокие и очень болезненные раны. Очень опасен контакт каустической соды с глазами, так как вызывает атрофию зрительного нерва, что ведет к слепоте. Если случайно вдохнуть порошок едкого натра, начнется приступ сильного кашля, одышка, появится боль в горле и даже возможен отек дыхательных легких. И можно только представить себе, что это вещество способно делать с нашими внутренними органами. Если случайно проглотить каустическую соду, очень быстро в животе появится сильная боль и чувство жжения, возможен анафилактический шок. При малейшем подозрении на отравление гидроксидом натрия важно немедленно вызвать скорую помощь. Участки кожи, пораженные едким натром, следует промыть несильным раствором борной или уксусной кислоты, слизистые оболочки – чистой водой, глаза – сначала обработать очень слабым раствором борной кислоты, а затем водой.
Хоть в пищевой промышленности гидроксид натрия используют в микродозах, но при регулярном употреблении пищи, содержащей Е524, возможны побочные эффекты.
В чем может содержаться

Самая известная сдоба, приготовленная с использованием каустической соды – это немецкие рогалики. Черные консервированные оливки получают свой темный цвет и характерную консистенцию также благодаря добавке Е524. В изделиях из шоколада, какао, сливочного масла или других видов жиров гидроксид натрия ускоряет расщепление белков. Эта добавка приходит на помощь и тогда, когда необходимо быстро и без труда очистить плоды от кожицы. Для этого фрукты, ягоды или овощи просто обрабатывают каустической содой. Кроме того, регулятор кислотности Е524 используют в производстве кисломолочной продукции, маргаринов, мороженого, разных видов сладостей.
Гидроксид натрия – опасное химическое соединение. И хоть в пищевой промышленности Е524 используется в небольших дозах, которые обычно не представляют опасности для человека, излишняя осторожность не повредит. Если не желаете или не можете отказаться от Е-содержащей пищи сами, то постарайтесь хотя бы минимизировать количество «ешек» в рационе маленьких детей. А для этого не забывайте перед покупкой продукта проверять, из чего он состоит.
Sodium hydroxide
Гидроксид натрия – это вещество, которое можно обнаружить в составе некоторых косметических средств. Это достаточно серьезное вещество, которое ценится в составе ряда ухаживающих средств и дерматологических препаратов за антистатическую, отшелушивающую и подавляющую грибковую флору способность.
По сути, Sodium hydroxide – это едкая щелочь. Такой компонент хорош для предотвращения развития патогенной флоры. Однако при создании косметических средств компонент применяется очень дозировано, так как обладает достаточно сильным действием.
Основные особенности
Часто основной задачей гидроксида натрия в составе современных косметических средств является омыление жирных веществ. Ведь этот компонент отличается высоким щелочным свойством. Этот элемент способствует надежному смыванию вредоносных бактерий с поверхности кожных покровов и образованию тонкого защитного слоя на их поверхности.
Следует понимать, что вещество достаточно серьезное и может добавляться в косметические средства в четко дозированном количестве.
Что важно знать:
•Указанный компонент можно встретить в составе моющих и обеззараживающих косметических средств для кожи и волос;
•Щелочная основа высокоэффективна для устранения большого количества известных микробов с кожных поверхностей;
•Компонент может встречаться в составе препаратов, предназначенных для удаления бородавок и папиллом;
•В качестве отшелушивающей добавки sodium hydroxide может присутствовать в скрабах для тела и лица.
В низких концентрациях компонент безопасен для человеческого организма.
Гидроксид натрия — распространенная и полезная щелочь
Данный реактив, самая распространенная щелочь, более известен 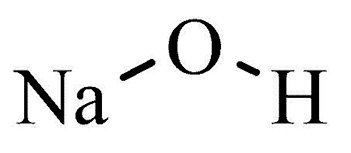
Важные особенности гидроксида натрия
Их важно знать, чтобы работа с этим реактивом была безопасной, и чтобы его применение принесло ожидаемые результаты.
Основные сферы применения едкого натра
Техника безопасности в работе с гидроксидом натрия
По ГОСТ 12.1.007-76 каустическая сода относится ко II классу токсичности (высокоопасна). Может вызвать сильный ожог кожи и слизистых, необратимое повреждение зрения при попадании в глаза. Именно поэтому работать с ней нужно в перчатках и защитных очках, использовать специальную одежду с виниловой пропиткой или прорезиненную.
При попадании вещества на слизистую ее как можно скорее нужно промыть большим количеством проточной воды, кожу промыть слабым раствором уксуса.
При большой поверхности ожога, при попадании реактива внутрь или в глаз следует не только приянть эти меры, но и незамедлительно обратиться к врачу.
Вы можете купить щелочь гидроксид натрия в нашем магазине, и мы надеемся, что вы будете соблюдать технику безопасности. Товар продается с доставкой, поэтому вы можете купить щелочь в Москве или другом городе России и вскоре получить его в своем городе.
Гидроксид натрия
| Гидроксид натрия | |
|---|---|
 | |
 | |
| Традиционные названия | едкий натр, каустик, каустическая сода, едкая щёлочь |
| Хим. формула | NaOH |
| Рац. формула | NaOH |
| Молярная масса | 39,997 г/моль |
| Плотность | 2,13 г/см³ |
| Т. плав. | 323 °C |
| Т. кип. | 1403 °C |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость в воде | 108,7 г/100 мл |
| ГОСТ | ГОСТ 4328-77 ГОСТ Р 55064-12 ГОСТ 2263-79 |
| Рег. номер CAS | 1310-73-2 |
| PubChem | 14798 |
| Рег. номер EINECS | 215-185-5 |
| SMILES | |
| Кодекс Алиментариус | E524 |
| RTECS | WB4900000 |
| ChEBI | 32145 |
| Номер ООН | 1823 |
| ChemSpider | 14114 |
| Пиктограммы СГС |  |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Гидроксид натрия (лат. Nátrii hydroxídum ; другие названия — каустическая сода, едкий натр) — самая распространённая щёлочь, химическая формула NaOH. В год в мире производится и потребляется около 57 миллионов тонн едкого натра.
Интересна история тривиальных названий как гидроксида натрия, так и других щелочей. Название «едкая щёлочь» обусловлено свойством разъедать кожу (вызывая сильные ожоги), бумагу и другие органические вещества. До XVII века щёлочью (фр. alkali ) называли также карбонаты натрия и калия. В 1736 году французский учёный Анри Дюамель дю Монсо впервые различил эти вещества: гидроксид натрия стали называть каустической содой, карбонат натрия — кальцинированной содой, а карбонат калия — поташом. В настоящее время содой принято называть натриевые соли угольной кислоты. В английском и французском языках слово sodium означает натрий, potassium — калий.
Содержание
Физические свойства
Гидроксид натрия — белое твёрдое вещество. Сильно гигроскопичен, на воздухе «расплывается», активно поглощая пары воды из воздуха. Хорошо растворяется в воде, при этом выделяется большое количество теплоты. Раствор едкого натра мылок на ощупь.
ΔH 0 растворения для бесконечно разбавленного водного раствора −44,45 кДж/моль.
Из водных растворов при +12,3…+61,8 °C кристаллизуется моногидрат (сингония ромбическая), температура плавления +65,1 °C; плотность 1,829 г/см³; ΔH 0 обр −425,6 кДж/моль), в интервале от −28 до −24 °C — гептагидрат, от −24 до −17,7 °C — пентагидрат, от −17,7 до −5,4 °C — тетрагидрат (α-модификация). Растворимость в метаноле 23,6 г/л (t = +28 °C), в этаноле 14,7 г/л (t = +28 °C). NaOH·3,5H2O (температура плавления +15,5 °C).
Химические свойства
Гидроксид натрия (едкая щёлочь) — сильное химическое основание (к сильным основаниям относят гидроксиды, молекулы которых полностью диссоциируют в воде), к ним относят гидроксиды щелочных и щёлочноземельных металлов подгрупп Iа и IIа периодической системы Д. И. Менделеева, KOH (едкое кали), Ba(OH)2 (едкий барит), LiOH, RbOH, CsOH, а также гидроксид одновалентного таллия TlOH. Щёлочность (основность) определяется валентностью металла, радиусом внешней электронной оболочки и электрохимической активностью: чем больше радиус электронной оболочки (увеличивается с порядковым номером), тем легче металл отдаёт электроны, и тем выше его электрохимическая активность и тем левее располагается элемент в электрохимическом ряду активности металлов, в котором за ноль принята активность водорода.
Водные растворы NaOH имеют сильную щелочную реакцию (pH 1%-раствора = 13,4). Основными методами определения щелочей в растворах являются реакции на гидроксид-ион (OH − ), (c фенолфталеином — малиновое окрашивание и метиловым оранжевым (метилоранжем) — жёлтое окрашивание). Чем больше гидроксид-ионов находится в растворе, тем сильнее щёлочь и тем интенсивнее окраска индикатора.
Гидроксид натрия вступает в следующие реакции:
Общая реакция в ионном виде:
Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия, действуя гидроксидом натрия на сульфат алюминия в водном растворе, при этом избегая избытка щёлочи и растворения осадка. Его и используют, в частности, для очистки воды от мелких взвесей.
например, с фосфором — с образованием гипофосфита натрия:
3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O с галогенами 2NaOH + Cl2 → NaClO + NaCl + H2O (дисмутация хлора при комнатной температуре) 6NaOH + 3Cl2 → NaClO3 + 5NaCl + 3H2O (дисмутация хлора при нагревании раствора) с металлами
Гидроксид натрия вступает в реакцию с алюминием, цинком, титаном. Он не реагирует с железом и медью (металлами, которые имеют низкий электрохимический потенциал). Алюминий легко растворяется в едкой щёлочи с образованием хорошо растворимого комплекса — тетрагидроксоалюмината натрия и водорода:
Эта реакция использовалась в первой половине XX века в воздухоплавании: для заполнения водородом аэростатов и дирижаблей в полевых (в том числе боевых) условиях, так как данная реакция не требует источников электроэнергии, а исходные реагенты для неё могут легко транспортироваться.
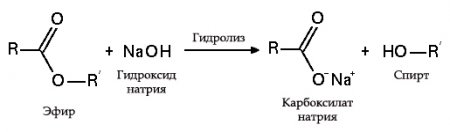
с эфирами, амидами и алкилгалогенидами (гидролиз):
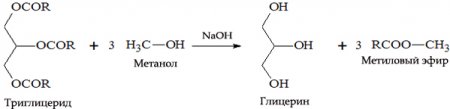
с жирами (омыление) такая реакция необратима, так как получающаяся кислота со щёлочью образует мыло и глицерин. Глицерин впоследствии извлекается из подмыльных щёлоков путём вакуум-выпарки и дополнительной дистилляционной очистки полученных продуктов. Этот способ получения мыла был известен на Ближнем Востоке с VII века.
В результате взаимодействия жиров с гидроксидом натрия получают твёрдые мыла (они используются для производства кускового мыла), а с гидроксидом калия либо твёрдые, либо жидкие мыла в зависимости от состава жира.
с многоатомными спиртами — с образованием алкоголятов: HOCH2CH2OH + 2NaOH → NaOCH2CH2ONa + 2H2O
Качественное определение ионов натрия
Методы получения
Гидроксид натрия может получаться в промышленности химическими и электрохимическими методами.
Химические методы получения гидроксида натрия
К химическим методам получения гидроксида натрия относятся пиролитический, известковый и ферритный.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество энергоносителей, получаемый едкий натр сильно загрязнён примесями.
В настоящее время эти методы почти полностью вытеснены электрохимическими методами производства.
Пиролитический метод
Пиролитический метод получения гидроксида натрия является наиболее древним и начинается с получения оксида натрия Na2О путём прокаливания карбоната натрия при температуре 1000 °C (например, в муфельной печи):
В качестве сырья может быть использован и гидрокарбонат натрия, разлагающийся при 200 °C на карбонат натрия, углекислый газ и воду.
Полученный оксид натрия охлаждают и очень осторожно (реакция происходит с выделением большого количества тепла) добавляют в воду:
Известковый метод
Известковый метод получения гидроксида натрия заключается во взаимодействии раствора соды с гашеной известью при температуре около 80 °С. Этот процесс называется каустификацией и проходит по реакции:
В результате реакции получается раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора фильтрацией, затем раствор упаривается до получения расплавленного продукта, содержащего около 92 % масс. NaOH. Затем NaOH плавят и разливают в железные барабаны, где он кристаллизуется.
Ферритный метод
Ферритный метод получения гидроксида натрия состоит из двух этапов:
Реакция 1 представляет собой процесс спекания кальцинированной соды с окисью железа при температуре 1100—1200 °С. При этом образуется спек — феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции 2; получается раствор гидроксида натрия и осадок Fe2O3*xH2O, который после отделения его от раствора возвращается в процесс. Получаемый раствор щёлочи содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % масс. NaOH, а затем получают твёрдый продукт в виде гранул или хлопьев.
Электрохимические методы получения гидроксида натрия
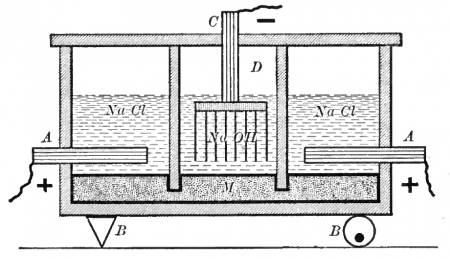
Электрохимически гидроксид натрия получают электролизом растворов галита (минерала, состоящего в основном из поваренной соли NaCl) с одновременным получением водорода и хлора. Этот процесс можно представить суммарной формулой:
Едкая щёлочь и хлор вырабатываются тремя электрохимическими методами. Два из них — электролиз с твёрдым катодом (диафрагменный и мембранный методы), третий — электролиз с жидким ртутным катодом (ртутный метод).
В мировой производственной практике используются все три метода получения хлора и каустика с явной тенденцией к увеличению доли мембранного электролиза.
| Показатель на 1 тонну NaOH | Ртутный метод | Диафрагменный метод | Мембранный метод |
|---|---|---|---|
| Выход хлора, % | 99 | 96 | 98,5 |
| Электроэнергия, кВт·ч | 3150 | 3260 | 2520 |
| Концентрация NaOH, % | 50 | 12 | 35 |
| Чистота хлора, % | 99,2 | 98 | 99,3 |
| Чистота водорода, % | 99,9 | 99,9 | 99,9 |
| Массовая доля O2 в хлоре, % | 0,1 | 1—2 | 0,3 |
| Массовая доля Cl − в NaOH, % | 0,003 | 1—1,2 | 0,005 |
В России приблизительно 35 % от всего выпускаемого каустика вырабатывается электролизом с ртутным катодом и 65 % — электролизом с твёрдым катодом.
Диафрагменный метод
Наиболее простым из электрохимических методов в плане организации процесса и конструкционных материалов для электролизера является диафрагменный метод получения гидроксида натрия.
Раствор соли в диафрагменном электролизере непрерывно подаётся в анодное пространство и протекает через, как правило, нанесённую на стальную катодную сетку асбестовую диафрагму, в которую иногда добавляют небольшое количество полимерных волокон.
Во многих конструкциях электролизеров катод полностью погружен под слой анолита (электролита из анодного пространства), а выделяющийся на катодной сетке водород отводится из под катода при помощи газоотводных труб, не проникая через диафрагму в анодное пространство благодаря противотоку.
Анод: 2Cl − → Cl2 + 2e − — основной процесс 2H2O → O2 + 4H + + 4e − 6ClO3 − + 3H2O → 2ClO3 − + 4Cl − + 1,5O2↑ + 6H + + 6e − Катод: 2H2O + 2e − → H2↑ + 2OH − — основной процесс ClO − + H2O + 2e − → Cl − + 2OH − ClO3 − + 3H2O + 6e − → Cl − + 6OH −
В качестве анода в диафрагменных электролизерах может использоваться графитовый или угольный электроды. На сегодня их, в основном, заменили титановые аноды с окисно-рутениево-титановым покрытием (аноды ОРТА) или другие малорасходуемые.
На следующей стадии электролитический щёлок упаривают и доводят содержание в нём NaOH до товарной концентрации 42—50 % масс. в соответствии со стандартом.
Поваренная соль, сульфат натрия и другие примеси при повышении их концентрации в растворе выше их предела растворимости выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или продолжают стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией.
Обратную, то есть кристаллизовавшуюся в осадок, поваренную соль возвращают назад в процесс, приготавливая из неё так называемый обратный рассол. От неё, во избежание накапливания примесей в растворах, перед приготовлением обратного рассола отделяют примеси.
Убыль анолита восполняют добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов, минеральных рассолов типа бишофита, предварительно очищенного от примесей или растворением галита. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния.
Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Благодаря относительной простоте и дешевизне диафрагменный метод получения гидроксида натрия до сих пор широко используется в промышленности.
Мембранный метод
Мембранный метод производства гидроксида натрия наиболее энергоэффективен, однако сложен в организации и эксплуатации.
С точки зрения электрохимических процессов мембранный метод подобен диафрагменному, но анодное и катодное пространства полностью разделены непроницаемой для анионов катионообменной мембраной. Благодаря этому свойству становится возможным получение более чистых, чем в случае с диафрагменного метода, щелоков. Поэтому в мембранном электролизере, в отличие от диафрагменного, не один поток, а два.
В анодное пространство поступает, как и в диафрагменном методе, поток раствора соли. А в катодное — деионизированная вода. Из анодного пространства вытекает поток обеднённого анолита, содержащего также примеси гипохлорит- и хлорат-ионов и хлор, а из катодного — щёлока и водород, практически не содержащие примесей и близкие к товарной концентрации, что уменьшает затраты энергии на их упаривание и очистку.
Щёлочь, получаемая с помощью мембранного электролиза, практически не уступает по качеству получаемой при помощи метода с использованием ртутного катода и постепенно заменяет щёлочь, получаемую ртутным методом.
Однако, питающий раствор соли (как свежий, так и оборотный) и вода предварительно максимально очищается от любых примесей. Такая тщательная очистка объясняется высокой стоимостью полимерных катионообменных мембран и их уязвимостью к примесям в питающем растворе.
Кроме того, ограниченная геометрическая форма а также низкая механическая прочность и термическая стойкость ионообменных мембран во многом определяют сравнительно сложные конструкции установок мембранного электролиза. По той же причине мембранные установки требуют наиболее сложных систем автоматического контроля и управления.
Ртутный метод с жидким катодом
В ряду электрохимических методов получения щёлоков самым эффективным способом является электролиз с ртутным катодом. Щёлоки, полученные при электролизе с жидким ртутным катодом, значительно чище полученных диафрагменным способом (для некоторых производств это критично). Например, в производстве искусственных волокон можно применять только высокочистый каустик), а по сравнению с мембранным методом организация процесса при получении щёлочи ртутным методом гораздо проще.
Установка для ртутного электролиза состоит из электролизёра, разлагателя амальгамы и ртутного насоса, объединённых между собой ртутепроводящими коммуникациями.
Катодом электролизёра служит поток ртути, прокачиваемой насосом. Аноды — графитовые, угольные или малоизнашивающиеся (ОРТА, ТДМА или другие). Вместе с ртутью через электролизёр непрерывно течёт поток питающего поваренной соли.
На аноде происходит окисление ионов хлора из электролита, и выделяется хлор:
2Cl − → Cl2 + 2e − — основной процесс 2H2O → O2 + 4H + + 4e − 6ClO3 − + 3H2O → 2ClO3 − + 4Cl − + 1,5O2 + 6H + + 6e −
Хлор и анолит отводится из электролизёра. Анолит, выходящий из электролизёра, донасыщают свежим галитом, извлекают из него примеси, внесённые с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают растворённый в нём хлор.
На катоде восстанавливаются ионы натрия, которые образуют слабый раствор натрия в ртути (амальгаму натрия):
Амальгама непрерывно перетекает из электролизёра в разлагатель амальгамы. В разлагатель также непрерывно подаётся высоко очищенная вода. В нём амальгама натрия в результате самопроизвольного химического процесса почти полностью разлагается водой с образованием ртути, раствора каустика и водорода:
Полученный таким образом раствор каустика, являющийся товарным продуктом, практически не содержит примесей. Ртуть почти полностью освобождается от натрия и возвращается в электролизер. Водород отводится на очистку.
Растущие требования к экологической безопасности производств и дороговизна металлической ртути ведут к постепенному вытеснению ртутного метода методами получения щёлочи с твёрдым катодом, в особенности мембранным методом.
Лабораторные методы получения
В лаборатории гидроксид натрия иногда получают химическими способами, но чаще используется небольшой электролизёр диафрагменного или мембранного типа.
Рынок каустической соды
В России, согласно ГОСТ 2263-79, производятся следующие марки натра едкого:
Применение
Едкий натр применяется во множестве отраслей промышленности и для бытовых нужд:
Меры предосторожности при обращении с гидроксидом натрия
Гидроксид натрия — едкое, токсическое и коррозионно-активное вещество. Оно относится к веществам второго класса опасности. Поэтому при работе с ним требуется соблюдать осторожность. При попадании на кожу, слизистые оболочки и в глаза образуются серьёзные химические ожоги. Попадание в глаза вызывает необратимые изменения зрительного нерва (атрофию) и, как следствие, потерю зрения. При контакте слизистых поверхностей с едкой щёлочью необходимо промыть поражённый участок струёй воды, а при попадании на кожу — слабым раствором уксусной или борной кислоты. При попадании едкого натра в глаза следует немедленно промыть их сначала слабым раствором борной кислоты, а затем водой.
При работе с едким натром рекомендуется следующие защитные средства: химические брызгозащитные очки для защиты глаз, резиновые перчатки или перчатки с прорезиненной поверхностью для защиты рук, для защиты тела — химически стойкая одежда, пропитанная винилом или прорезиненные костюмы.
Предельно допустимая концентрация гидроксида натрия в воздухе 0,5 мг/м³.