Sodium hypochlorite что это
Сферы применения гипохлорита натрия
Самая известная особенность гипохлорита натрия кроется в его антибактериальных свойствах проявляющихся из-за наличия гипохлорит-иона. Гипохлорит – производные соли и эфиры хлорноватистой кислоты. Гипохлорит-ион – окислитель, отвечающий за разложение органики в очищенной воде, при этом для активации этих свойств не требуется большой концентрации вещества и много времени.
Именно вышеописанное свойство определило самое популярное направление использования гипохлорита натрия – бытовое.
Подробнее о характеристиках, свойствах и технических условиях гипохлорит натрия, читайте в соответствующей статье.
Бытовое и промышленное использование
Гипохлорит натрия используется для следующих целей:
Дезинфекция и антибактериальные обработки
Для таких целей используют раствор, полученный заводским способом, заключающимся в поглощении хлора едким натром. Полученные растворы отличаются содержанием активного хлора и щелочности. Выпускаются в стальных цистернах, полиэтиленовых канистрах, бочках. Для целей дезинфекции и обеззараживания проводится орошение, протирание, мытье, замачивание необходимых объектов. Не подлежит обработке гипохлоритом натрия окрашенное и неокрашенное белье и прочие ткани, металлические предметы и конструкции, если они не защищены от коррозии.
Наибольшую популярность применение такого раствора имеется при обеззараживании воды в бассейнах, при производстве отбеливающих свойств, для очищения сточных вод, для дезинфекции медицинских помещений и мест общественного питания, при обработке технологического оборудования для производства продуктов питания.
Отбеливание
В самых популярных бытовых отбеливателях типа «Белизна», гипохлорит натрия и его содержащая хлорноватистая кислота работают на то, чтобы разрушать краситель любого рода. Ежегодно мировые компании производят около 5 миллионов тонн гипохлорита натрия используемого как отбеливатель и пятновыводитель. Его разрешено применять для хлопка, полиэстера, нейлона, льна, вискозы и многих других. Его уникальные особенности способны удалить следы травы и почвы, пятна крови, кофе, и устойчивые пятна от фруктовых соков.
В отбеливающих составах содержание гипохлорита натрия не должно превышать 2-10%. Выпускаются в жидкой форме, в пластике и стекле. Эффективность подтверждена без нагревания и механической обработки. Однако в этом направлении есть и минусы использования гипохлорита натрия. Так его применение приводит к преждевременному изнашиванию, сокращению сроков жизни материалов и тканей, невозможностью использования с металлическими конструкциями и стиральными машинами, короткий срок хранения растворов, специфический запах.
Растворение химических санитарно-технических отложений
Гипохлорит натрия отлично проявляет себя в качестве очистителя санитарно-технических комнат и помещений. Его способность удалять налет от воды, ржавчину и пищевые загрязнения имеет туже природу, что и отбеливание. Из-за этих способностей гипохлорит натрия входит в состав многих магазинных чистящих средств. Как правило, для этих целей применяется раствор с концентрацией данного вещества в пределах 3-6 %. Его можно найти в составе таких средств как: Белизна, Clorox Regular-Bleach, Aquachem Chlorinizor, Tiret, Domestos.
Применение гипохлорита натрия в медицине
Кроме вышеописанных характеристик (в бытовом и промышленном варианте) применение гипохлорита натрия распространено в медицинской отрасли.
И в данной области гипохлорит натрия известен своими обеззараживающими свойствами. Его применяют для дезинфекции ран, как антисептический раствор, противовирусное, противогрибковое, бактерицидное средство. Допустимо применение как наружно, так и в качестве местного использования.
В медицинской области его часто используют для обеззараживания воды. NaOCl «стоит на страже» поддержания гигиенических стандартов с начала XX века, был фаворитом в борьбе с холерой, дизентерией, брюшным тифом. Используется в составе 0,06% раствора наружно, так и для инъекций.
В хирургии распространена практика обработки хирургического инструмента, а также операционных ран раствором гипохлорита натрия. В стоматологии используется для орошения ротовой полости во время проведения хирургических манипуляций.
NaOCl в борьбе с COVID19
В настоящее время отдельно следует упомянуть, что гипохлорит натрия входит во многие средства для дезинфекции и обработки помещений. Всемирная организация здравоохранения называет одной из самых эффективных мер в COVID19 мытье и обработку рук и подручных предметов антибактериальными средствами. Конечно, в настоящее время точно не известно о «живучести» вируса на поверхности, но рекомендация обрабатывать поверхности берет свое начало со схожести коронавируса с другими вирусами, у которых жизнеспособность на поверхностях (от минут до нескольких дней) имеет доказательную базу.
В октябре 2020 года французские ученые в результате опытов сделали вывод, о живучести коронавируса SARS-Cov-2 на бумажных и полимерных банкнотах, стекле и нержавеющей стали в течение 28 дней. Такое открытие говорит о том, что средства дезинфекции как защита от опасного заболевания актуальны как никогда.
Во многие средства для дезинфекции входит гипохлорит натрия как неорганический активный хлор. Хлорактивные соединения имеет высокую эффективность и широкий спектр антивирусной активности, борются с бактериями многих типов, спорами и патогенными флорами, грибами.
Согласно рекомендации ВОЗ концентрация гипохлорита натрия в санитайзерах и жидкостях для обработки помещений должна быть не менее 0,5% по активному хлору.
Гипохлорит натрия в пищевой промышленности
Плохо очищенные поверхности при контакте с пищевыми продуктами приводят к тому, что в продуктах образуется патогенная микрофлора. В связи с чем, на любом производстве при контакте с пищевыми продуктами соблюдение санитарно-технических норм является стратегически важной задачей. Для этих задач гипохлорит натрия стали применять еще в начале ХХ века. Именно тогда опытным путем было выявлено, что данное вещество гораздо более стойкое в отношении всех спор и бактерий.
Гипохлорит натрия в пищевой сфере используется для таких целей как:
ООО «Эверест» предлагает оптовую продажу гипохлорита натрия. Поставки осуществляются в канистрах 25 кг и еврокубах. Оставьте заявку или свяжитесь по телефону: +7 (812) 448-47-55, чтобы получить выгодное предложение.
Гипохлорит натрия — полезное химическое соединение
Гипохлорит натрия — неорганическое вещество, соль хлорноватистой кислоты 
Жавелевая вода, на самом деле, является водным раствором гипохлорита калия, но название часто используют и для NaOCl. Лабарраковая вода названа в честь француза А. Лабаррака, впервые получившего именно гипохлорит натрия.
Свойства
В чистом виде гипохлорит натрия — мелкокристаллический порошок без цвета, с запахом хлора. Легко растворяется в воде, но влагу из воздуха не поглощает. Тем не менее, из-за своей неустойчивости, вещество достаточно быстро разлагается, оплывает и становится жидким. На практике обычно применяют водные растворы, более устойчивые, чем кристаллическая форма, хотя и растворы постепенно разлагаются, теряя активный хлор. Особенно активно раствор разлагается при нагревании и под действием света, поэтому хранить растворы гипохлорита натрия следует в прохладных, темных помещениях, в прочной таре с антикоррозионным покрытием.
Гипохлорит натрия — очень сильный окислитель; легко вступает в реакции с солями щелочных металлов, аммиаком, оксидами металлов, щелочами. Обладает ярко выраженным коррозионным воздействием на многие металлы. К гипохлориту натрия устойчивы почти все пластики, фторопласты, поливинилхлорид, многие резины, поэтому хранят его, обычно, в стальных емкостях с резиновым покрытием.
Так как в нормальных условиях водные растворы постепенно разлагаются с выделением кислорода, при хранении это нужно учитывать, заполняя емкость не полностью и периодически сбрасывая образовавшийся кислород. С течением времени водный раствор теряет свою активность.
Скорость разложения раствора сильно зависит от рН среды. Наибольшая скорость разложения — в кислой среде, наименьшая — в высокощелочной. Для хранения наиболее пригодны водные растворы с выраженной щелочной реакцией.
Влияние на окружающую среду и человека

Работы с растворами NaOCl должны проводиться с соблюдением техники безопасности и средств защиты. Концентрированные растворы вызывают химический ожог, особенно опасный для глаз — вплоть до полной потери зрения. Воздействие на кожу может привести к раздражению и язвам. Проглатывание — к ожогу пищевода, в тяжелом случае — к прободению ЖКТ. Вдыхание выделяющегося хлора приводит к токсикации, человеку становится трудно дышать.
Применение
— Для обеззараживания воды в системах городского водоснабжения, 
— Для дезинфекционной обработки помещений.
— Для изготовления производственных отбеливателей, дезинфектантов, СМС.
— В химическом производстве — для изготовления гидразина, антраниловой кислоты, метансульфоновой и синтетической аскорбиновой кислоты, модифицированного крахмала, некоторых других веществ, использующихся в производстве пестицидов и инсектицидов.
— В электрохимии — для травления.
— Для удаления из индустриальных газов опасных цианистых соединений.
— В лабораторной химии — ингредиент органического синтеза многих соединений, в том числе кетонов, карбоновых кислот, хлороформа, альдегидов, аминов и многих других.
— В медицине — для дезинфекционной обработки помещений, аппаратов, сантехники, мебели, белья, предметов обихода. Растворы гипохлорита натрия эффективны против большинства патогенов, вирусов (включая ВИЧ, гепатит, ротавирус), бактерий, грибков, токсинов. Применяется для наружной обработки кожи, полоскания горла и носа, для обработки ран в гинекологии, стоматологии, хирургии; для инъекций.
— Входит во множество средств бытовой химии, в том числе таких популярных, как «Белизна», Tiret, Domestos гель.
Журнал «Сырье и Упаковка»
Текущий номер
Ближайшие выставки
Партнеры
Гипохлориты и их применение в средствах бытовой химии
30.03.2020
| Д. А. Меркулов, к.х.н., зав. кафедрой фундаментальной и прикладной химии, ФГБОУ ВПО «Удмуртский государственный университет», г. Ижевск |
Введение
Гипохлоритами называют соли хлорноватистой кислоты HClO. Наиболее распространенными из них являются гипохлорит натрия, гипохлорит кальция и гипохлорит калия. Гипохлориты широко применяются для обеззараживания питьевой воды, отбеливания, дегазации и дезинфекции. Гипохлориты являются одними из самых важных химических соединений.
| Систематическое наименование | Традиционное название | Хим. формула | CAS № | М, г/моль |
|---|---|---|---|---|
| Гипохлорит натрия | Хлорноватистокислый натрий, лабарракова вода (гипохлорит натрия в смеси с хлоридом натрия и гидроксидом натрия) | NaClO | 7681–52–9 | 74,44 |
| Гипохлорит калия | Хлорноватистокислый калий, жавелевая вода (гипохлорит калия в смеси с гидрокарбонатом калия и хлоридом калия) | KClO | 7778–66–7 | 90,55 |
| Гипохлорит кальция | Хлорноватистокислый кальций, хлорная известь (гипохлорит кальция в смеси с хлоридом кальция, оксихлоридом кальция и гидроксидом кальция) | Ca(ClO) 2 | 7778–54–3 | 142,98 |
История открытия
В 1774 г. шведский химик Карл Вильгельм Шееле получил хлор (Cl 2 ) в результате взаимодействия оксида марганца(IV) MnO 2 и соляной кислоты (HCl). Позже, в 1785 г. французский химик Клод Луи Бертолле обнаружил, что водный раствор газообразного хлора («хлорная вода»), содержащий хлорноватистую и хлороводородную кислоты, может отбелить белье, и сообщил о своих выводах Французской академии наук.
Cl 2 + H 2 O = HClO + HCl
Знания об отбеливающих свойствах хлора были незамедлительно использованы Джеймсом Уаттом на текстильной фабрике в Глазго. Несмотря на то, что отбеливание с использованием хлора был значительно эффективнее традиционных способов отбеливания солнечным светом, слабыми растворами кислот и щелочей, применение хлора ограничивалось его токсичностью и разрушающим действием на ткани. Для стабилизации раствора газообразного хлора в воде и безопасности его применения, в 1787 г. на Парижском предприятии Societe Javel хлор стали пропускать через водный раствор карбоната калия (поташа)
Cl 2 + K 2 СO 3 = 2KHCO 3 + KClO + KCl.
Глава предприятия Леонард Альбан назвал новый продукт «Eau de Javel» («жавелевая вода»), и вскоре белильная жидкость стала популярной во Франции и Англии.
В 1820 г. француз Антуан Лабаррак усовершенствовал способ получения отбеливателя, заменив поташ на более дешевый гидроксид натрия (каустическую соду). Полученный раствор гипохлорита и хлорида натрия получил название «Eau de Labarraque» («лабарракова вода»).
Cl 2 + 2NaOH = NaClO + NaCl + H 2 O.
Широкое применение гипохлоритов для обеззараживания питьевой воды и дезинфекции стало возможным гораздо позже, в начале XX века, благодаря развитию промышленного производства хлора электролизом поваренной соли.
Физические свойства
Гипохлориты встречаются нам преимущественно в виде водных растворов, хотя некоторые из них можно выделить в твердом виде. Так, известен безводный гипохлорит натрия, который представляет собой неустойчивое бесцветное кристаллическое вещество. Из кристаллогидратов наиболее устойчивой формой является NaClO×5H 2 O. Это соединение представляет собой белые или бледно-зеленые ромбические кристаллы, расплывающиеся на воздухе. При нагревании пентагидрата гипохлорита натрия до температуры 24,4°С, он плавится. Кристаллогидрат NaClO×2,5H 2 O плавится при температуре 57,5°С. Моногидрат крайне неустойчив и разлагается выше 60°С, при более высоких температурах разложение протекает со взрывом.
Таблица 2. Плотности и температуры замерзания водных растворов гипохлорита натрия.
В отличие от гипохлорита калия, известного только в растворах, гипохлорит кальция можно выделить в форме бесцветных кристаллов, устойчивых в сухой атмосфере без углекислого газа. Из водных растворов гипохлорит кальция можно выделить в виде кристаллогидратов Ca(ClO) 2 ×2H 2 O, Ca(ClO) 2 ×3H 2 O, Ca(ClO) 2 ×4H 2 O.
Кислотно-основное равновесие между хлорноватистой кислотой и гипохлорит-ионом описывается обратимой реакцией с константой равновесия Ka = 2,63×10 –8 при 20°С.
Используя константу равновесия Ka, можно рассчитать мольное долевое распределение хлорноватистой кислоты и гипохлорит-ионов в зависимости от рН (рис.1).
Данные свидетельствуют, что при подкислении растворов гипохлоритов увеличивается доля неустойчивой хлорноватистой кислоты. При рН 7,58 существуют преимущественно гипохлорит-ионы.
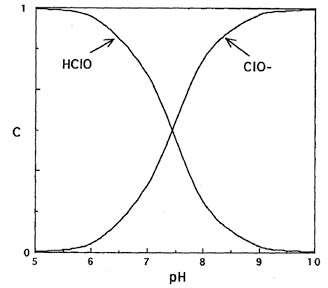
Рис. 1. Мольное долевое распределение хлорноватистой кислоты и гипохлорит-ионов в зависимости от кислотности среды.
Химические свойства
Гипохлориты являются неустойчивыми соединениями, легко разлагающимися с выделением кислорода. Разложение твердых гипохлоритов натрия и кальция можно представить уравнениями
2NaClO = 2NaCl + O 2 ↑ и 2Сa(ClO) 2 = СaCl 2 + O 2 ↑.
Процессы при комнатной температуре происходят медленно, а при нагревании могут протекать со взрывом. Параллельно реакциям, сопровождающимся образованием хлоридов и свободного кислорода, могут протекать реакции диспропорционирования
Разложение гипохлоритов в водных растворах зависит от кислотности раствора и его температуры. В сильнокислых средах при рН ≤ 3 хлорноватистая кислота при комнатной температуре разлагается до хлора и кислорода
4HClO = 2Cl 2 ↑ + O 2 ↑ + 2H 2 O.
Если при подкислении используется соляная кислота или в растворе присутствуют хлориды, образование кислорода не происходит
HClO + HCl = Cl 2 ↑ + H 2 O.
Хлорноватистая кислота очень слабая, поэтому она может быть вытеснена из раствора ее солей действием углекислого газа
ClO – + CO 2 + H 2 O = HCO 3 – + HClO.
В слабокислых и нейтральных средах при 3 2 ↑.
В нейтральных и щелочных растворах имеет место конкурирующая реакция образования хлоридов и хлоратов
При комнатной температуре реакция диспропорционирования протекает медленно, но при температурах выше 70°С эта реакция становится преобладающей.
В щелочных средах при рН > 7,5 в растворах преобладают гипохлорит-ионы, разлагающиеся следующим образом:
Около 95% от общего количества гипохлорит-ионов разлагается в результате последовательных реакций (1) и (2), причем реакция (1) является самой медленной (лимитирующей) и определяет общую скорость процесса. Реакция (3) не является основной, но отвечает за выделение кислорода, количество которого может быть значительным.
В присутствии некоторых ионов металлов, например, меди, никеля, кобальта наблюдается каталитическое разложение гипохлорит-ионов. Ионы железа обладают слабым каталитическим действием и являются сокатализаторами в сочетании с другими ионами металлов. В простейшем случае, при содержании ионов меди(II) в растворе в концентрации 1мг/кг порядки гомогенной реакции по гипохлориту и по меди(II) равны единице.
Гетерогенный катализ металлами и их нерастворимыми соединениями, является сложным и плохо воспроизводимым. Из нерастворимых катализаторов наибольшее мешающее влияние оказывает никель и его оксиды, которые попадают в растворы гипохлоритов при их контакте с легированными никелевыми сталями, используемыми для изготовления трубопроводов и резервуаров.
На константы скорости реакций (1)-(3) большое влияние оказывает ионная сила растворов. Высокие концентрации электролитов уменьшают константы скорости реакций и обеспечивают разумную стабильность при хранении растворов электролитов. Увеличение концентрации гипохлорит-ионов, напротив, уменьшает их стабильность в водных растворах. На рис. 2 показан феномен «кривой пересечения». Растворы гипохлорита натрия с концентрацией 9% и 5% при хранении разлагаются настолько, что через 50 недель показывают одинаковую концентрацию вещества, а через 100 недель первоначально более концентрированный раствор содержит гипохлорит-ионов меньше, чем разбавленный.
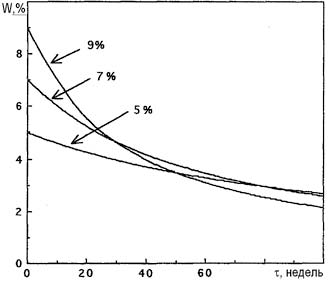
Рис. 2. Разложение гипохлорита натрия различных концентраций при 30°С.
Повышение температуры способствует ускорению процессов разложения гипохлоритов, поэтому целесообразно хранить растворы гипохлоритов в прохладном месте для обеспечения срока годности (рис. 3).

Рис. 3. Влияние температуры на разложение 5%-ного раствора NaClO.
Для стабилизации водных растворов гипохлоритов, а так же продуктов на их основе, каждый производитель применяет собственные методы, которые редко публикуются в виде статей. Однако известны некоторые запатентованные методы, которые, не претендуя на полноту, можно представить следующим списком:
Направление окислительно-восстановительных процессов с участием гипохлорит-ионов и хлорноватистой кислоты обусловлены значениями стандартных электродных потенциалов полуреакций в водной среде:
2HClO + 2H + + 2e – = Cl 2 ↑ + 2H 2 O, E° = 1,630 В,
HClO + H + + 2e – = Cl – + H 2 O, E° = 1,500 В.
в нейтральной и щелочной среде
Таким образом, гипохлорит-ионы и хлорноватистая кислота обладают выраженными окислительными свойствами, причем их окисляющая способность в кислой среде значительно выше, чем в нейтральной и щелочной средах.
Дезинфицирующее действие
Гипохлориты являются одними из лучших антибактериальных средств. Они убивают микроорганизмы очень быстро даже при очень низких концентрациях.
Наивысшее бактерицидное действие гипохлоритов проявляется в нейтральной среде, когда концентрации хлорноватистой кислоты и гипохлорит-ионов приблизительно равны (рис. 1). Образующиеся при разложении гипохлоритов активные частицы (атомарный кислород и хлор) обладают высоким биоцидным действием. Они уничтожают микроорганизмы, взаимодействуя с биополимерами в их структуре, способными к окислению. Аналогичным образом, например, действуют клетки человека нейтрофилы, гепатоциты и др., которые синтезируют хлорноватистую кислоту и сопутствующие высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями.
Бактерицидная активность гипохлоритов настолько велика, что они способны привести к гибели дрожжеподобных грибов, вызывающих кандидоз, Candida albicans, в течение 30 секунд при действии 5,0 – 0,5%-го гипохлоритного раствора. Патогенный Enterococcus faecalis погибает через 30 секунд после обработки 5,25%-ым раствором и через 30 минут после обработки 0,5%-ым раствором. Грамотрицательные анаэробные бактерии, такие как Porphyromonas gingivalis, Porphyromonas endodontalis и Prevotella intermedia, погибают в течение 15 секунд после обработки 5,0 – 0,5%-м раствором гипохлорит-ионов.
Несмотря на высокую биоцидную активность гипохлоритов, некоторые потенциально опасные простейшие организмы, например, возбудители лямблиоза или криптоспоридиоза, к сожалению, устойчивы к его действию.
При помощи гипохлорит-ионов можно успешно обезвреживать различные токсины (табл. 3).
Таблица 3. Результаты инактивации токсинов при 30-минутной экспозиции различных концентраций гипохлорита натрия («+» – токсин инактивирован; «–» – токсин остался активен).
| Токсин | 2,5% NaClO + 0,25 н. NaOH | 2,5% NaClO | 1,0% NaClO | 0,1% NaClO |
|---|---|---|---|---|
| Т-2 токсин | + | – | – | – |
| Бреветоксин | + | + | – | – |
| Микроцистин | + | + | + | – |
| Тетродотоксин | + | + | + | – |
| Сакситоксин | + | + | + | + |
| Палитоксин | + | + | + | + |
| Рицин | + | + | + | + |
| Ботулотоксин | + | + | + | + |
Методы анализа
Качественными реакциями на гипохлорит-ион могут служить:
Наиболее распространенным методом количественного анализа гипохлорит-иона является титриметрический метод с использованием йодида калия. Для проведения испытания водный раствор или водную суспензию, содержащие гипохлорит-ион, смешивают с избытком раствора йодида калия в сернокислой среде. Выдерживают герметично закрытую смесь в течение 5 минут в темном месте. Выделившийся йод титруют стандартизированным раствором тиосульфата натрия. В качестве индикатора вблизи точки эквивалентности используют крахмальный раствор.
При количественном определении гипохлорит-иона косвенным йодометрическим методом результаты анализа пересчитывают на концентрацию «активного хлора» в ыделившегося при реакции
2H + + ClO – + Cl – = Cl 2 ↑ + H 2 O.
Альтернативным методом количественного определения гипохлорит-иона является потенциометрический анализ с использованием бром-ионселективного электрода. Концентрацию гипохлорит-иона находят методом добавок анализируемого раствора к стандартному раствору или методом уменьшения концентрации анализируемого раствора при его добавлении к стандартному раствору.
Способы получения наиболее важных товарных продуктов
Крупнотоннажными гипохлоритсодержащими продуктами являются гипохлорит натрия и гипохлорит кальция. Их глобальный объем производства превышает 1 млн тонн/год. При этом почти половина этого объема используется в быту, а другая половина в промышленности. Гипохлорит калия, являющийся исторически первым гипохлоритом, нашедшим промышленное применение, производится в ограниченном количестве.
Для промышленного производства гипохлорита натрия используются химический и электрохимический методы. При химическом методе производится хлорирование водных растворов гидроксида натрия. Суть химического превращения не изменилась со времен его открытия и применения Лабарраком
Cl 2 + 2NaOH = NaClO + NaCl + H 2 O.
Существуют две производственные схемы данного метода:
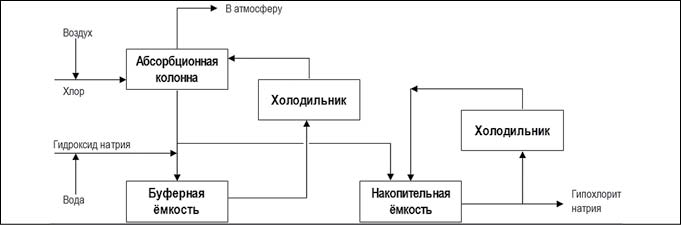
Рис. 4. Химический метод получения гипохлорита натрия основным процессом (рис. с сайта https://ru.wikipedia.org)
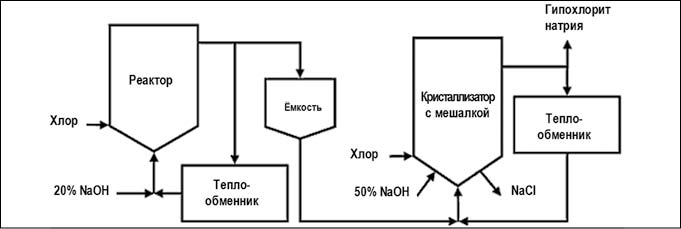
Рис. 5. Химический метод получения гипохлорита натрия концентрированным процессом (рис. с сайта https://ru.wikipedia.org)
При электрохимическом методе получения гипохлорита натрия водный раствор хлорида натрия подвергается электролизу в электролизере с открытыми электродными зонами (бездиафрагменный способ). Гидроксид натрия, образующийся на катоде, и хлор, выделяющийся на аноде, беспрепятственно смешиваются в ходе электрохимического процесса
NaCl + H 2 O = NaClO + H 2 ↑(суммарная реакция).
Гипохлорит кальция производится в виде хлорной извести, представляющей собой смесь целевого продукта с хлоридом кальция и гидроксидом кальция. В качества сырья для получения хлорной извести используется порошкообразный гидроксид кальция (пушенка), содержащий менее 1% свободной влаги и разбавленный влажным воздухом хлор. Небольшая влажность исходных веществ обеспечивает начало реакции гидролиза хлора, сопровождающейся нейтрализацией образующихся кислот известью. Затем реакция продолжается за счет воды, выделяющейся из гидроксида кальция при хлорировании
2Сa(OH) 2 + 2Cl 2 = Сa(ClO) 2 + СaCl 2 + 2H 2 O (суммарно).
Хлорирование пушенки осуществляется в аппаратах непрерывного действия – механических полочных камерах Бакмана.
Таблица 4. Производители гипохлорита натрия в России.
| Название предприятия | Сайт предприятия |
|---|---|
| «Каустик» ЗАО, г. Стерлитамак | www.kaus.ru/ |
| «Каустик» ОАО, г. Волгоград | www.kaustik.ru/ |
| «Новомосковский хлор» ООО, г. Новомосковск | www.hlor.biz/ |
| «Сода-хлорат» ООО, г. Березняки | www.soda.perm.ru/ |
Характеристика товарных гипохлоритов, обращение, хранение и транспортировка
В Российской Федерации гипохлориты производятся в соответствии с ГОСТ 11086–76 «Гипохлорит натрия. Технические условия» и ГОСТ 1692–85 «Известь хлорная. Технические условия». Гипохлорит натрия по назначению и показателям выпускается двух марок «А» и «Б» (табл. 5).
Таблица 5. Физико-химические показатели и назначение гипохлорита натрия по ГОСТ 11086–76