Sp3 что это в химии
Гибридизация атомных орбиталей
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
| σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов. |
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
 |  |
 |  |
 |  |
| π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи. |
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
С–С, С–Н, С–О
С=С, С=О
С≡С, С≡N
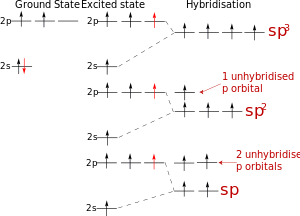
Гибридизация атомных орбиталей углерода
Электронная формула атома углерода в основном состоянии:
+6С 1s 2 2s 2 2p 2
+6С 1s 

В возбужденном состоянии: один электрон переходит с 2s-подуровня на 2р-подуровень.
+6С * 1s 2 2s 1 2p 3
+6С * 1s 2 

Таким образом, в возбужденном состоянии углерод содержит четыре неспаренных электрона, может образовать четыре химические связи и проявляет валентность IV в соединениях.
При образовании четырех химических связей атомом углерода происходит гибридизация атомных орбиталей.
| Гибридизация атомных орбиталей — это выравнивание электронной плотности атомных орбиталей разного типа с образованием новых, молекулярных орбиталей, форма и энергия которых одинаковы. |
Изображение с портала orgchem.ru
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода. Валентный угол Н–С–Н в метане равен 109 о 28’ |
Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
| Например, пространственное строение н-бутана |
При этом негибридная р-орбиталь располагается перпендикулярно плоскости, в которой расположены три гибридные sp 2 — орбитали.
Изображение с портала orgchem.ru
Модель молекулы этилена:
sp-Гибридизация
В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию:
| Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180 о друг к другу, что соответствует линейному строению. |
Изображение с портала orgchem.ru
При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали.
| Например, молекула ацетилена имеет линейное строение. |
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Гибридизация электронных орбиталей: sp3, sp2 и sp.
Гибридизация sp3, sp2 и sp в органической химии с практическими примерами.
Введение
Зачем нам теория гибридизации?
Вот один ответ на это. Экспериментально подтверждено, что атом углерода в метане (CH4) и других алканах имеет тетраэдрическую структуру.
Итак, чтобы предсказать валентность и геометрию атома углерода, мы рассмотрим его электронную конфигурацию и орбитали.
На первом этапе один электрон перепрыгивает с 2s на 2p орбиталь. Это приводит к возбужденному состоянию углерода:
Количество гибридных орбиталей всегда совпадает с количеством смешанных орбиталей.
Связи, которые образуются путем встречного перекрытия орбиталей, называются σ (сигма) связями, потому что электронная плотность сосредоточена на оси, соединяющей атомы C и H.
Чтобы обобщить это, любой атом с четырьмя группами (или атом или одинокая пара) является sp3 гибридизированным.
Например, какая гибридизация кислорода в следующей молекуле?
Получающиеся 3 sp2 — орбитали затем располагаются в тригональной плоской геометрии (120°).
Это создает три связи для каждого углерода и одну орбиталь слева.
Итак, два атома углерода в этилене, который является первым членом семейства алкенов, имеют двойную связь.
Вот некоторые ключевые параметры гибридизации sp2 и двойных связей, которые вам необходимо знать:
* Все атомы на двойной связи находятся в одной плоскости;
* Угол между атомами составляет 120°;
Один водород связывается с каждым атомом углерода, перекрывая его орбиталь с другой орбиталью.
Основные параметры sp гибридизации и тройной связи:
* Все атомы имеют линейную структуру;
* Угол между атомами составляет 180°;
* В тройной связи есть одна σ (сигма) и две π (пи) связи.
Гибридизация других элементов
В заключение, все, что мы обсуждали выше, относится не только к углероду.
Теория гибридизации работает с тем же принципом для всех других важных элементов в органической химии, таких как кислород, азот, галогены и многие другие.
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Большинство органических соединений имеют молекулярное строение. Атомы в веществах с молекулярным типом строения всегда образуют только ковалентные связи друг с другом, что наблюдается и в случае органических соединений. Напомним, что ковалентным называется такой вид связи между атомами, который реализуется за счет того, что атомы обобществляют часть своих внешних электронов с целью приобретения электронной конфигурации благородного газа.
По количеству обобществлённых электронных пар ковалентные связи в органических веществах можно разделить на одинарные, двойные и тройные. Обозначаются данные типы связей в графической формуле соответственно одной, двумя или тремя чертами:
Кратность связи приводит к уменьшении ее длины, так одинарная С-С связь имеет длину 0,154 нм, двойная С=С связь – 0,134 нм, тройная С≡С связь – 0,120 нм.
Типы связей по способу перекрывания орбиталей
Как известно, орбитали могут иметь различную форму, так, например, s-орбитали имеют сферическую, а p-гантелеобразную форму. По этой причине связи также могут отличаться по способу перекрывания электронных орбиталей:
• ϭ-связи – образуются при перекрывании орбиталей таким образом, что область их перекрывания пересекается линией, соединяющей ядра. Примеры ϭ-связей:
• π-связи – образуются при перекрывании орбиталей, в двух областях – над и под линией соединяющей ядра атомов. Примеры π-связей:
Как узнать, когда в молекуле есть π- и ϭ-связи?
При ковалентном типе связи ϭ-связь между любыми двумя атомами есть всегда, а π-связь имеет только в случае кратных (двойных, тройных) связей. При этом:
Укажем данные типы связей в молекуле бутин-3-овой кислоты:
Гибридизация орбиталей атома углерода
Гибридизацией орбиталей называют процесс, при котором орбитали, изначально имеющие разные формы и энергии смешиваются, образуя взамен такое же количество гибридных орбиталей, равных по форме и энергии.
В случае атомов углерода в гибридизации всегда принимает участие s-орбиталь, а количество p-орбиталей, которые могут принимать участие в гибридизации варьируется от одной до трех p-орбиталей.
Как определить тип гибридизации атома углерода в органической молекуле?
| Количество атомов, с которыми связан атом углерода | Тип гибридизации атома углерода | Примеры веществ |
| 4 атома | sp 3 | CH4 – метан |
| 3 атома | sp 2 | H2C=CH2 – этилен |
| 2 атома | sp | HC≡CH — ацетилен |
Потренируемся определять тип гибридизации атомов углерода на примере следующей органической молекулы:
Радикал. Функциональная группа
Под термином радикал, чаще всего подразумевают углеводородный радикал, являющийся остатком молекулы какого-либо углеводорода без одного атома водорода.
Название углеводородного радикала формируется, исходя из названия соответствующего ему углеводорода заменой суффикса –ан на суффикс –ил.
| Формула углеводорода | Название углеводорода | Формула радикала | Название радикала |
| CH4 | метан | -CH3 | метил |
| C2H6 | этан | -С2Н5 | этил |
| C3H8 | пропан | -С3Н7 | пропил |
| СnН2n+2 | …ан | -СnН2n+1 | … ил |
Функциональная группа — структурный фрагмент органической молекулы (некоторая группа атомов), который отвечает за её конкретные химические свойства.
В зависимости того, какая из функциональных групп в молекуле вещества является старшей, соединение относят к тому или иному классу.
R – обозначение углеводородного заместителя (радикала).
Радикалы могут содержать кратные связи, которые тоже можно рассматривать как функциональные группы, поскольку кратные связи вносят вклад в химические свойства вещества.
Если в молекуле органического вещества содержится две или более функциональных группы, такие соединения называют полифункциональными.
Химическая гибридизация sp, sp2, sp3
В соответствии с ТРВ в метана атомных орбиталей формы С четырех связей сг четыре атома H. 2р орбитали, с формами ∞ (нижней) части C расположены перпендикулярно друг к другу, так что Н должны быть отделены друг от друга другой под углом 90 °.
Кроме того, 2с орбиталь (сферическая) связывается с С 1s орбиты Н под углом 135 ° по отношению к другим трем Н. Однако экспериментально установлено, что углы в CH4 109,5º и что, кроме того, длины связей C-H эквивалентны.
Чтобы объяснить это, необходимо рассмотреть комбинацию исходных атомных орбиталей для формирования четырех вырожденных гибридных орбиталей (равной энергии). Здесь идет химическая химия. На что похожи гибридные орбитали? Это зависит от атомных орбиталей, которые их генерируют. Они также показывают смесь электронных характеристик этих.
Гибридизация зр 3
На изображении выше вы можете увидеть, как sp орбитали 3 (зеленый) установить тетраэдрическую электронную среду вокруг атома (A, который является C для CH4).
Почему 109,5º, а не другие углы, чтобы «нарисовать» другую геометрию? Причина в том, что этот угол сводит к минимуму электронные отталкивания четырех атомов, которые связаны с.
Таким образом, молекула СН4 может быть представлен в виде тетраэдра (тетраэдрическая молекулярная геометрия).
Это имеет основополагающее значение для эскиза органических структур, где углерод с простыми связями представляет точки расхождения; то есть структура не остается в одной плоскости.
интерпретация
Какова простейшая интерпретация для этих гибридных орбиталей без учета математических аспектов (волновых функций)? Sp орбитали 3 подразумевают, что они были созданы четырьмя орбиталями: одна с и три р.
Поскольку комбинация этих атомных орбиталей должна быть идеальной, четыре sp-орбитали 3 в результате они идентичны и занимают разные ориентации в пространстве (например, на орбиталях рх, ри и рZ).
Вышеуказанное применимо к остальным возможным гибридизациям: количество образовавшихся гибридных орбиталей такое же, как и у комбинированных атомных орбиталей. Например, sp-гибридные орбитали 3 d 2 они образованы из шести атомных орбиталей: одна s, три p и две d.
Отклонения углов ссылок
Согласно теории электрона пара отталкивания слоя Valencia (VSEPR), пара свободных электронов занимает больше объема, чем атом связанного. Это приводит ссылка отходит уменьшение напряжения электроники и отвлечение углов 109,5º:
Например, в молекуле воды атомы H связаны со sp-орбиталями 3 (зеленым цветом), а также пары электронов, которые не являются общими «:» занимают эти орбитали.
Отталкиванием этих пар электронов, как правило, представлены в виде «двух шаров с глазами», который, из-за их объема, репелленты двух звеньев сг O-H.
Таким образом, в воде углы звеньев действительно равны 105º вместо 109,5º, ожидаемых для тетраэдрической геометрии..
Какая геометрия у H тогда?2O? Имеет угловую геометрию. Почему? Поскольку, хотя электронная геометрия является тетраэдрической, две пары неразделенных электронов отвлекают ее от угловой геометрии.
Гибридизация зр 2
Когда атом объединяет две p и одну s орбитали, он генерирует три sp гибридных орбитали 2 ; тем не менее, орбитальная p остается неизменной (потому что их три), которая представлена оранжевой полосой на изображении выше.
Здесь три sp орбитали 2 они зеленого цвета, чтобы подчеркнуть их отличие от оранжевой полосы: «чистая» орбиталь.
Атом с sp-гибридизацией 2 может быть визуализирован как плоский тригональный пол (треугольник, нарисованный с помощью орбиталей sp 2 зеленого цвета), вершины которого разделены углами 120º и перпендикулярны полосе.
И какую роль играет чистая орбиталь? Это образует двойную связь (=). Sp орбитали 2 позволяют формировать три σ-связи, в то время как чистая p-орбитальная π-связь (двойная или тройная связь подразумевает одну или две π-связи).
Например, чтобы нарисовать карбонильную группу и структуру молекулы формальдегида (H2С = о), происходит следующим образом:
Sp орбитали 2 оба из C и O образуют связь σ, а их чистые орбитали образуют связь π (оранжевый прямоугольник).
Гибридизация зр
Верхнее изображение показывает атом А с sp-гибридизацией. Здесь орбиталь s и орбиталь s объединяются, чтобы создать две вырожденные sp орбитали. Однако теперь две чистые p-орбитали остаются неизменными, что позволяет A образовывать две двойные связи или тройную связь (≡).
Гибридные орбитали разделены углом 180 °. По этой причине связанные атомы расположены в линейной молекулярной геометрии (B-A-B). Наконец, на изображении ниже вы можете увидеть структуру аниона цианида:
Гибридизация (химия)
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам.
Содержание
Концепция гибридизации
Концепция гибридизации валентных атомных орбиталей была предложена американским химиком Лайнусом Полингом для ответа на вопрос, почему при наличии у центрального атома разных (s, p, d) валентных орбиталей, образованные им связи в многоатомных молекулах с одинаковыми лигандами оказываются эквивалентными по своим энергетическим и пространственным характеристикам.
Представления о гибридизации занимают центральное место в методе валентных связей. Сама гибридизация не является реальным физическим процессом, а только удобной моделью, позволяющей объяснить электронное строение молекул, в частности гипотетические видоизменения атомных орбиталей при образовании ковалентной химической связи, в частности, выравнивание длин химических связей и валентных углов в молекуле.
Концепция гибридизации с успехом была применена для качественного описания простых молекул, но позднее была расширена и для более сложных. В отличие от теории молекулярных орбиталей не является строго количественной, например она не в состоянии предсказать фотоэлектронные спектры даже таких простых молекул как вода. В настоящее время используется в основном в методических целях и в синтетической органической химии.
В 1954 году Нобелевский комитет удостоил Л.Полинга премии по химии «За изучение природы химической связи и его применение к объяснению строения сложных молекул». Но сам Л.Полинг не был удовлетворён введением σ,π — описания для двойной и тройной связи и сопряжённых систем.
В 1958 году на симпозиуме, посвящённом памяти Кекуле, Л.Полинг развил теорию изогнутой химической связи, учитывающую кулоновскую электронную корреляцию. По этой теории двойная связь описывалась как комбинация двух изогнутых химических связей, а тройная связь как комбинация трёх изогнутых химических связей. [1]
Этот принцип нашёл отражение в теории отталкивания электронных пар Гиллеспи — Найхолма. Первое и наиболее важное правило которое формулировалось следующим образом:
Второе правило состоит в том, что «все электронные пары, входящие в валентную электронную оболочку, считаются расположенными на одинаковом расстоянии от ядра». [2]
Виды гибридизации
sp-гибридизация
Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28′, что соответствует наименьшей энергии отталкивания электронов. Так же sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Гибридизация и геометрия молекул
Представления о гибридизации атомных орбиталей лежат в основе теории отталкивания электронных пар Гиллеспи-Найхолма. Каждому типу гибридизации соответствует строго определённая пространственная ориентация гибридных орбиталей центрального атома, что позволяет её использовать как основу стереохимических представлений в неорганической химии.