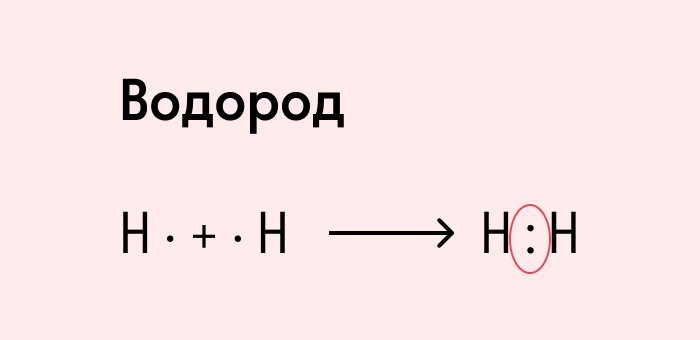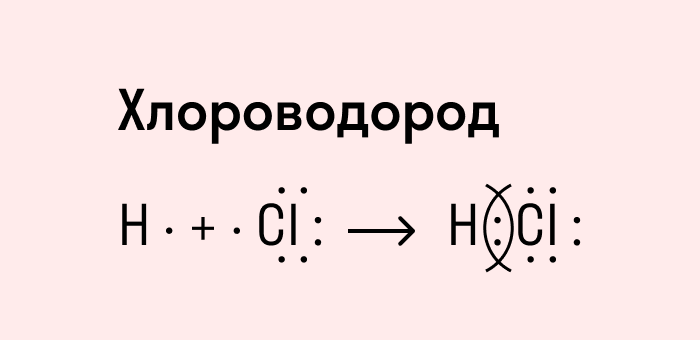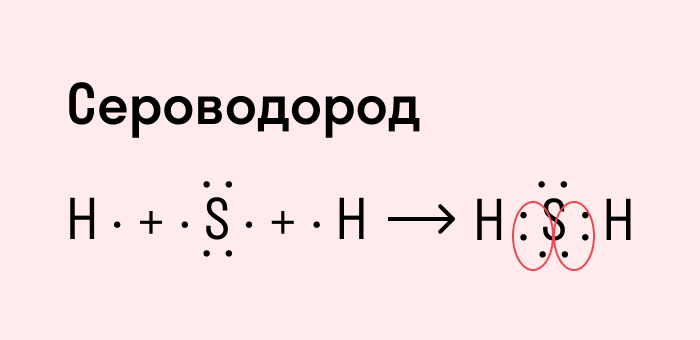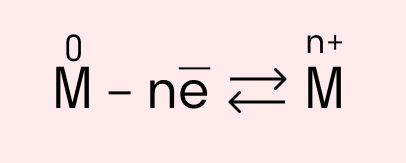ср4 какая химическая связь
Химическая связь
Химическая связь и строение вещества
Все системы стремятся к равновесию и к уменьшению свободной энергии — так гласит один из постулатов химической термодинамики. Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону. Они стремятся образовать устойчивую конфигурацию — 8-электронную или 2-электронную внешнюю оболочку. Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Механизм образования химической связи
Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
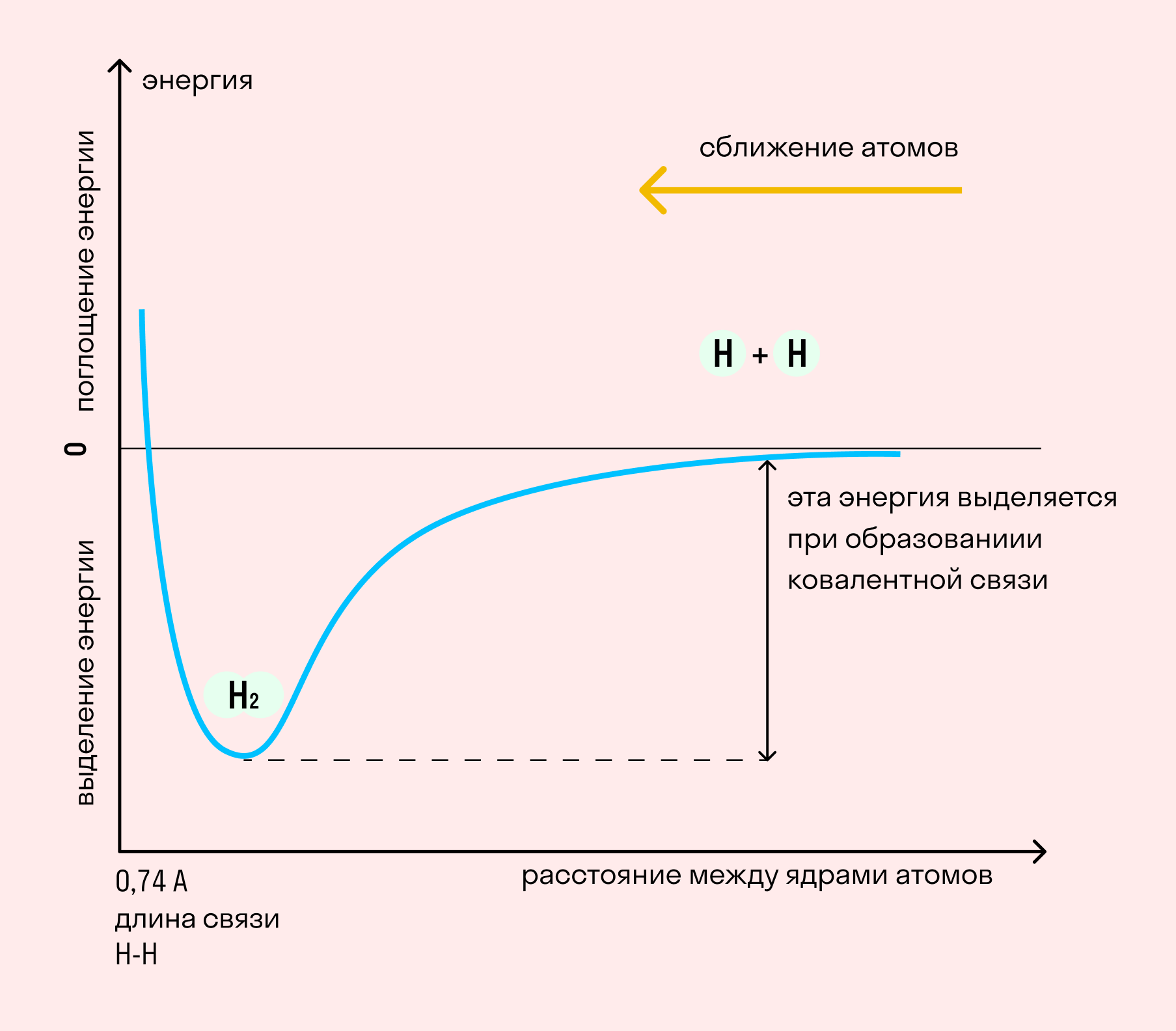
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
Основные типы химических связей
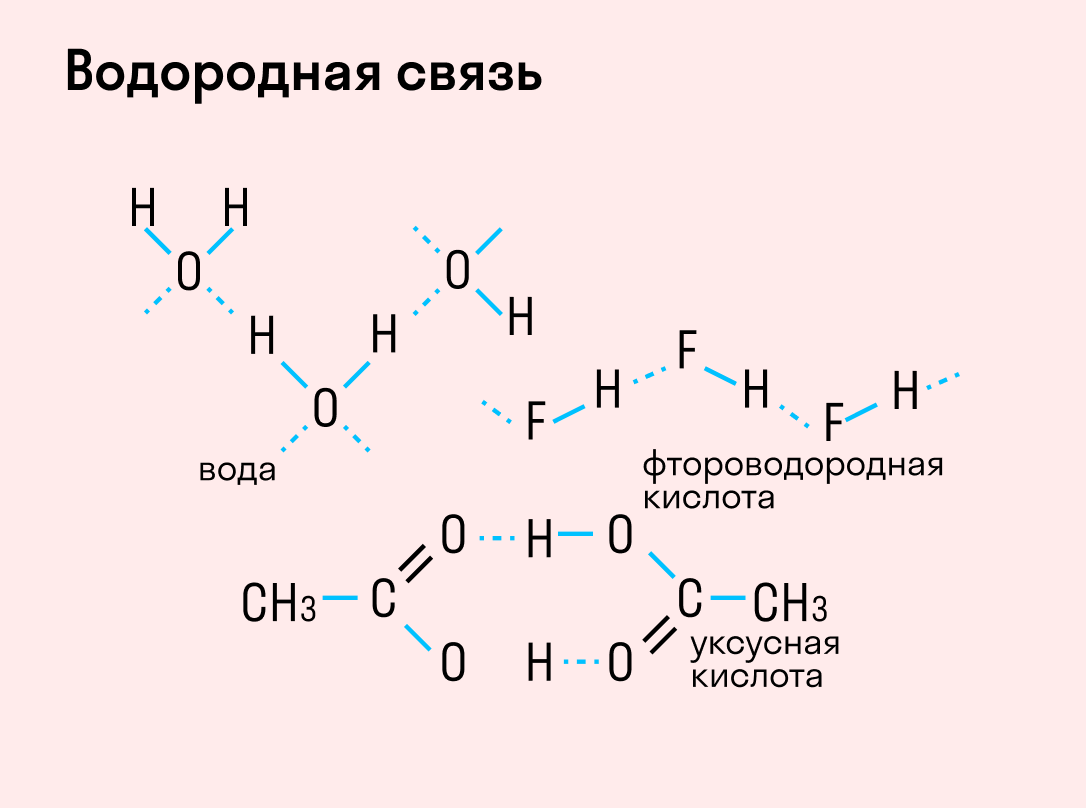
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Если это ковалентная связь — образуется атомная решетка, если водородная — молекулярная решетка, а если ионная или металлическая — соответственно, будет ионная или металлическая решетка. Таком образом, влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
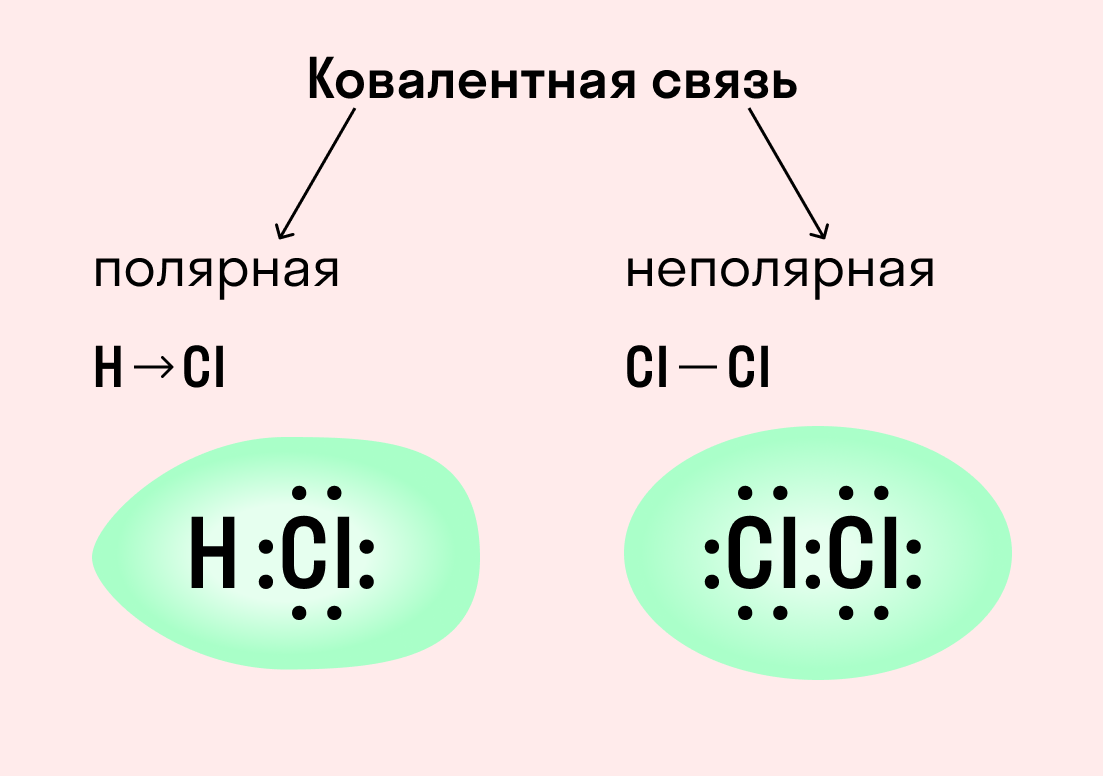
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
| Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
Число связей, которые могут быть у атома в молекуле вещества, называется валентностью.
Характеристики ковалентной связи:
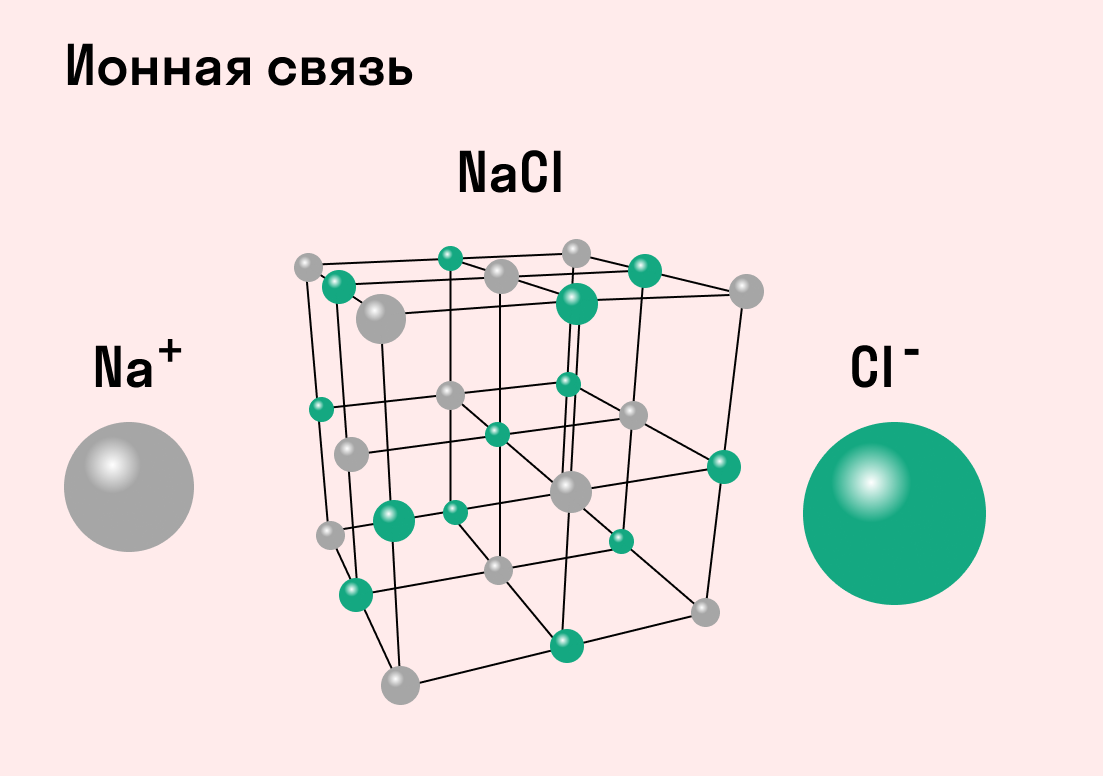
Ионная связь
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд. В результате этого процесса образуются ионы.
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.
Характеристики ионной связи:
не имеет направленности.
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
Характеризуется появлением электронных пар, принадлежащих обоим атомам.
Характеризуется появлением и взаимным притяжением ионов.
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов.
Ионы с противоположными зарядами подвержены кулоновскому притяжению.
Имеет направленность и насыщенность.
Ненасыщенна и не имеет направленности.
Количество связей, образуемых атомом, называется валентностью.
Количество ближайших соседей атома называется координационным числом.
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО.
Образуется между металлами и неметаллами — веществами со значимо разной ЭО.
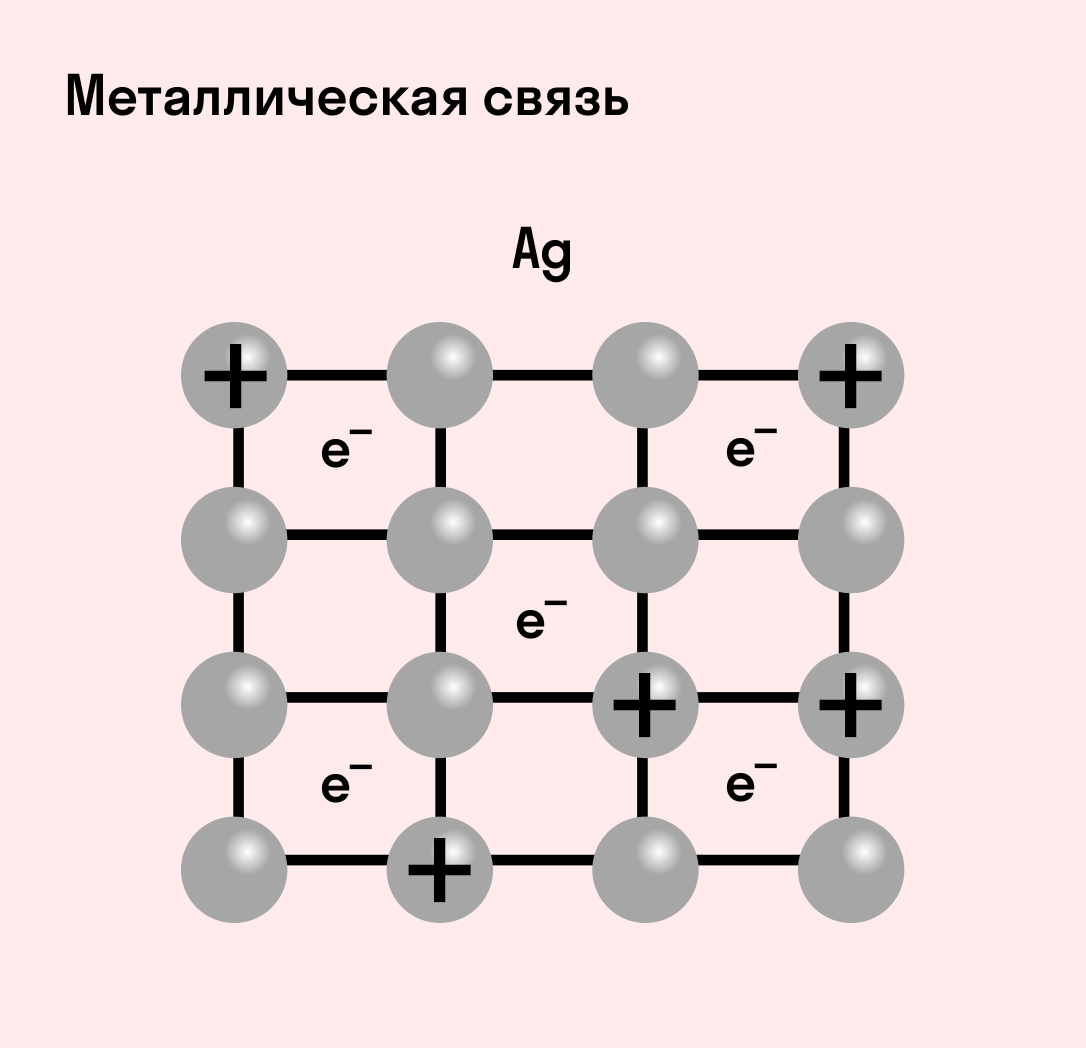
Металлическая связь
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
| Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества. |
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
Характеристики металлической связи:
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
Типы химической связи и их основные отличительные признаки
Водородная связь
Данный тип связи в химии стоит отдельно, поскольку он может быть как внутри молекулы, так и между молекулами. Как правило, у неорганических веществ эта связь происходит между молекулами.
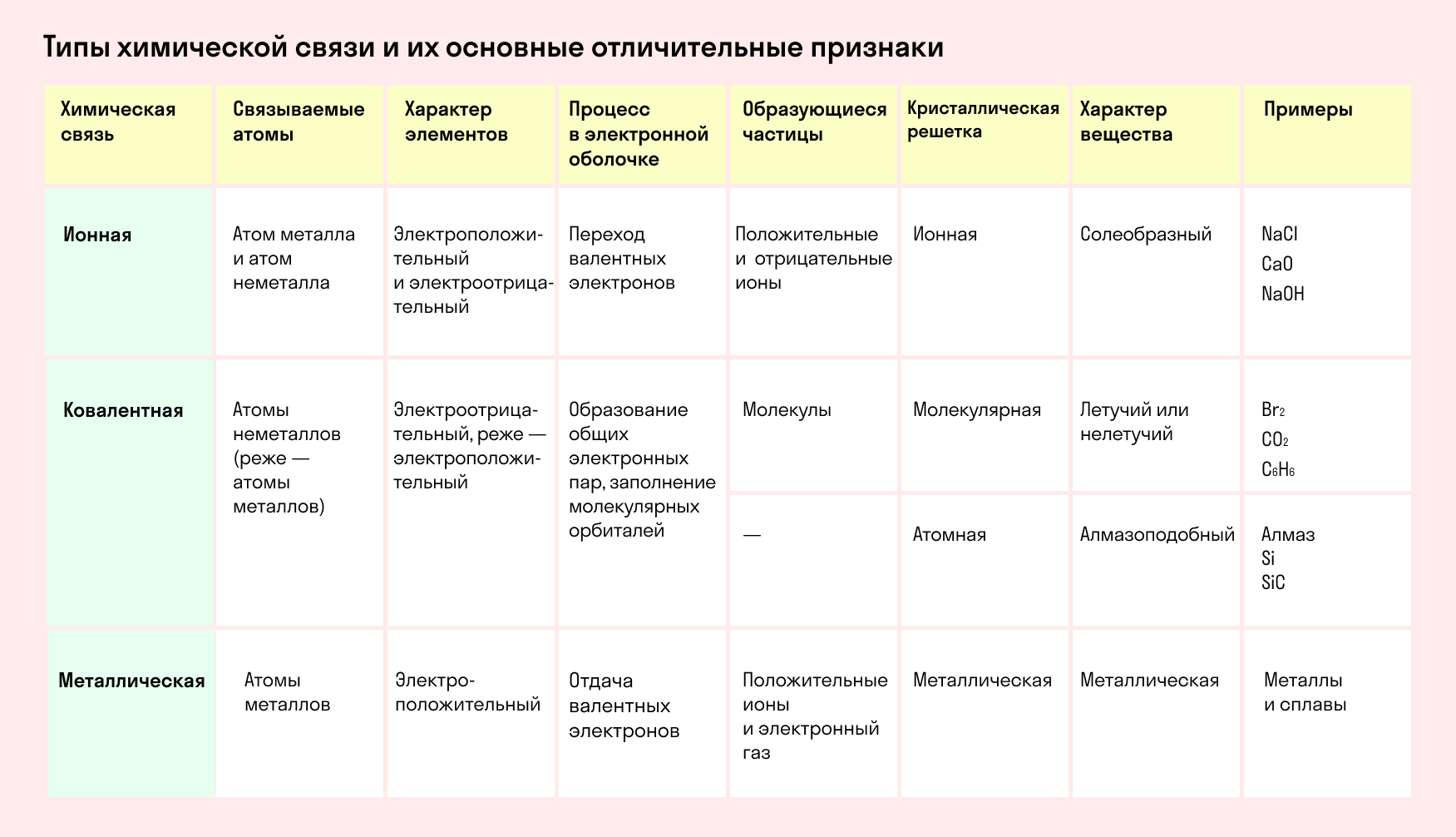
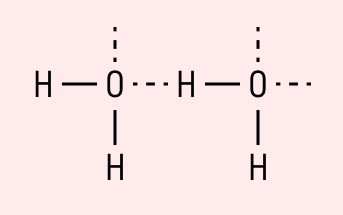
| Водородная связь образуется между молекулами, содержащими водород. Точнее, между атомами водорода в этих молекулах и атомами с большей ЭО в других молекулах вещества. |
Объясним подробнее механизм этого вида химической связи. Есть молекулы А и В, содержащие водород. При этом в молекуле А есть электроотрицательные атомы, а в молекуле В водород имеет ковалентную полярную связь с другими электроотрицательными атомами. В этом случае между атомом водорода в молекуле В и электроотрицательным атомом в молекуле А образуется водородная связь.
Такое взаимодействие носит донорно-акцепторный характер. Донором электронов в данном случае выступают электроотрицательные элементы, а акцептором — водород.
Графически водородная связь обозначается тремя точками. Ниже приведена схема такого взаимодействия на примере молекул воды.
Характеристики водородной связи:
Кратко о химических связях
Итак, самое главное. Химической связью называют взаимодействие атомов, причиной которого является стремление системы приобрести устойчивое состояние. Во время взаимодействия свободные внешние электроны атомов объединяются в пары либо внешний электрон одного атома переходит к другому.
Образование химической связи сопровождается выделением энергии. Эта энергия растет с увеличением количества образованных электронных пар и с сокращением расстояния между ядрами атомов.
Основные виды химических связей: ковалентная (полярная и неполярная), ионная, металлическая и водородная. В отличие от всех остальных водородная ближе к молекулярным связям, поскольку может быть как внутри молекулы, так и между разными молекулами.
Как определить тип химической связи:
Ковалентная полярная связь образуется в молекулах неметаллов между атомами со сходной ЭО.
Ковалентная неполярная связь имеет место между атомами с разной ЭО.
Ионная связь ведет к образованию и взаимному притяжению ионов. Она происходит между атомами металла и неметалла.
Металлическая связь бывает только между атомами металлов. Это взаимодействие положительных ионов в кристаллической решетке и свободных отрицательных электронов. Масса рассеянных по всему объему свободных электронов представляет собой «электронное облако».
Водородная связь появляется при условии, что есть атом с высокой ЭО и атом водорода, связанный с другой электроотрицательной частицей ковалентной связью.
Химическая связь и строение молекулы: типом химической связи определяется кристаллическая решетка вещества: ионная, металлическая, атомная или молекулярная.
Определить тип химической связи в 8 классе поможет таблица.
Урок №64. Ковалентная связь. Полярная и неполярная ковалентные связи
Сущность и виды химической связи
Атомы стремятся завершить свой внешний уровень (до 8 электронов, исключение водород, гелий до 2 электронов)
В образовании химической связи участвуют валентные электроны. Число валентных электронов определяется по номеру группы, в которой находится атом, образующий химическую связь. Число неспаренных валентных электронов Nе — =8-N группы
Классификация химических связей
1. По способу достижения завершенной электронной оболочки
2. По механизму образования химической связи
3. По способу перекрывания электронных орбиталей
I. По способу достижения завершенной электронной оболочки
КОВАЛЕНТНАЯ СВЯЗЬ
КОВАЛЕНТНАЯ СВЯЗЬ — это связь, возникающая между атомами за счет образования общих электронных пар: H 2 , HCl, H 2 O, O 2
ИОННАЯ СВЯЗЬ
ИОННАЯ СВЯЗЬ – образуется между атомами металлов и неметаллов, т.е. между атомами, резко отличающимися друг от друга по значениям электроотрицательности: NaCl, K 2 O, LiF.
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке.
II. По механизму образования химической связи (только для ковалентной связи)
III. По способу перекрывания электронных орбиталей (только для ковалентной связи)
По степени смещения общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
Каждый атом неметалла отдает в общее пользование другому атому наружные не спаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Образующиеся общие электронные пары смещены в сторону более электроотрицательного элемента согласно ряду электроотрицательности элементов, предложенному американским химиком Л. Полингом.
В результате на более электроотрицательном элементе образуется избыток электронной плотности ( частичный отрицательный заряд δ- ), а на менее электроотрицательном элементе образуется недостаток электронной плотности ( частичный положительный заряд δ+ ).
Самый электроотрицательный элемент – фтор F.
Встречаются исключения, когда ковалентную связь образуют атом неметалла и металла!
AlCl 3 , разница в электроотрицательности ∆ Э.О.
Химия
Именная карта банка для детей
с крутым дизайном, +200 бонусов
Закажи свою собственную карту банка и получи бонусы
План урока:
Словно компоненты конструктора, атомы соединяются между собой. И как бы, Вы не старались, но с единичным блоком можно соединить, только один блок. Деталь на 4 ячейки, может удержать не больше четырёх. Этот принцип сохраняется и в химии. За количество свободных ячеек отвечает валентность атомов элементов.
Результатом взаимодействия атомов является получение веществ. Виды химической связи атомов зависят от природы составляющих элементов.
Металлы отличаются малым количеством электронов на внешнем уровне сравнительно с неметаллами более низким значением электроотрицательности. Теперь наша задача вспомнить, как происходит изменение ЭО в таблице Менделеева или воспользоваться таблицей «Относительная электроотрицательность». Чем активнее неметалл, тем она выше и это говорит о том, что этот элемент, при образовании связи, будет забирать электроны.
Веществ насчитывается миллионы. Это могут быть простые вещества: металлы железо Fe, золото Au, ртуть Hg; неметаллы сера S, фосфор Р, азот N2. Так и сложные вещества: H2S, Ca3(PO4)2, (C6H10O5)n, молекулы белков и т.д.Комбинация элементов, входящих в состав веществ, определяет какие типы связей будут существовать между ними.
Ковалентная связь
Неметаллы из числа всех элементов находятся в меньшинстве. Но имея некоторые особенности в строении и способности иметь переменную валентность, число соединений, построенных этими элементами внушительное.
Чтобы иметь представление, по которому атомы соединяются, начнём с молекулы водорода Н2.
Давайте дадим волю фантазии, представим то, что нельзя увидеть. Допустим, что мы взяли в руки две одинаковые детали, имеющие такой вид:
Существует одна только комбинация их соединения, и между ними будет одно общее звено. Переместимся с нашего воображения к молекулам. Представим, что перед нами, два атома водорода и наша задача их соединить в молекулу. Покрутите мысленно детали, чтобы они объединились, необходимо их поставить друг на друга, связав их в определённом месте. Точки рядом означают, сколько электронов, располагающихся на наружном слое.
Атомы водорода, как детали, соединились одной связью, поэтому валентность в данном случае каждого из них будет равна I. Но степень окисления будет равна 0, так как вещество образовано элементом с одинаковым значением электроотрицательности.
Рассмотрим, как образуется молекула самого распространённого газа на нашей планете – азота N2.
Азот, имеет 3 неспаренных электрона. Это как взять две детали вида и соединить их.
Таким образом, азот трёхвалентен, а степень
Ковалентная связь в молекуле, состоящей из одного типа атомов, а именно неметаллов, носит название неполярная.
Во время построения молекулы, количество электронов стремится к завершению. Рассмотрим как образуется молекула О2. Каждому атому не хватает 2 электронов и они эту недостачу компенсируют общей электронной парой.
Также обращаем внимание, что степень окисления 0, ибо атомы равноправные партнёры, и их валентность равна II.
Ковалентная химическая связь образованная разными неметаллами называется полярная.
Возьмём два неметаллических элемента Водород и Хлор. Укажем электронные формулы внешнего слоя.
Такой вид образования соединений происходит по обменному механизму. Это значит, чтобы получить завершённую конфигурацию более электроотрицательные принимают электроны, менее – отдают, но при этом существует общая электронная пара.
Неметаллы образуют не только бинарные соединения, а возможно в состав будет входить три и более элемента. К примеру, молекула угольной кислоты H2СO3 состоит с 3 элементов. Как они между собой соединяться. Электроотрицательность возрастает в ряду ЭО (Н) + 2С +4 О −2 3. Это означает, что кислород будет притягивать на себя электроны углерода и водорода. Схематически это можно записать в следующем виде.
Чтобы построить структурную формулу, в центре записываем углерод. У него неспаренных 4 электрона. Поскольку атомов кислорода в количестве 3, каждый из них может принять 2 электрона. То путём не хитрых вычислений, видим что 4 электрона придёт от С и по одному от каждого Н. проверяем наш расчёт, учитывая нейтральность молекулы, считаем положительные и отрицательные заряды.
Н2 + С +4 О3 −2 (+1 ∙ 2) + (+4 ∙ 1) + (-2 ∙ 3) = 0
Существует ещё один механизм ковалентной связи, под названием донорно-акцепторный.
Чтобы понять этот принцип, опишем образование молекулы, имеющей не совсем приятный резкий, удушающий запах, аммиак NH3.
Незадействованные до этого «красные» электроны N «заселяются» в пустой s-орбитали, принадлежащей катиону водорода. Ион аммония имеет 3 связи, которые происходят по обменному механизму, а также одну, по донорно-акцепторному. Именно поэтому NH3 легко взаимодействует с кислотами и водой.
Ионная связь
Ионная химическая связь является пограничной ковалентной полярной. Отличаются тем, что для веществ, в которых локализуется ковалентная связь, характерно существование совместной электронной пары, тогда как для ионной связи свойственна полная отдача электронов. Следствием отдачи является образование заряженных частиц – ионов.
Определить тип связи помогут вычисления. Если разность значений электроотрицательностей больше 1,7, то для вещества характерна ионная связь. Если значение меньше 1,7, то свойственная полярная связь. Рассмотрим два вещества NaCl и СаС2. Оба они образованы металлом (Na и Са) и неметаллом (Clи С). Однако в одном случае связь будет ионная, во втором – ковалентная полярная.
Постулат физики гласит, что противоположности притягиваются. Т.е. положительные ионы притягивают отрицательные и наоборот.
Допустим, что необходимо получить вещество с атомов калия и фтора. Каждый атом стремится заполучить конфигурацию благородного газа. Достигнуть этого возможно двумя способами отдав или приняв электроны, образуя при этом ионы с желаемой конфигурацией.
Атому калия гораздо проще отдать 1 электрон, чем забрать у фтора 7. Принимая 1 электрон, F имеет завершённый уровень.
Аналогично калий, который с лёгкостью отдал свой электрон, его катион принял электронную формулу аргона.
Кальций двухвалентный металл, то для взаимодействия необходимо два атома фтора, поскольку он способен принять только один электрон. Схема образования ионной связи имеет вид.
Следует отметить, что ионная связь будет существовать между Naи О, а между С и О ковалентная полярная.
Металлическая связь
Металлы существуют в разных цветах: чёрные (железо), красные (медь), жёлтые (золото), серые (серебро), плавятся при разных температурах. Однако их всех объединяет наличие блеска, твёрдости, электропроводимости.
Металлическая связь имеет черты сходства с ковалентной неполярной. Металлы бедны электронами на внешнем уровне, поэтому при образовании связи, они не способны притягивать на себя их, для них свойственна отдача. Так как атомный радиус в металлах большой, это даёт возможность легко оторваться электронам, образовав катионы.
Электроны постоянно перемещаются от атома к иону и наоборот. Сами катионы можно сравнить с айсбергами, окружёнными отрицательными частицами.
Схема металлической связи
Водородная связь
Водородная химическая связь изображена …… пунктиром. Соединяясь между собою молекулы, играют и находят важную роль в живых организмах. С помощью водородной связи строится вторичная структура молекулы ДНК.
Типы кристаллических решёток
Чтобы получить вещество, а не просто набор молекул, необходимо частицы «запаковать» в своеобразный каркас – кристаллическую решётку.
Представьте перед собой геометрическую фигуру – куб, в вершинах будут находиться частицы, условно соединённые между собою.
Существует прямая зависимость между строением атома и типом кристаллической решётки.
Обратите внимание, что соединения с ковалентной неполярной связью образованные частицами-молекулами, которые запакованы в молекулярную кристаллическую решётку. Чаще всего это будут соединения по температурному режиму низкокипящие и летучие. Это известные вам вещества как кислород О2, хлор Cl2, бром Br2.
В узлах атомной кристаллической решётки находятся отдельные атомы, между которыми существует ковалентная неполярная связь. Атомная кристаллическая решётка свойственна алмазу. На данный момент это самое твёрдое вещество. Данный тип связи характерен для вещества, покрывающего значительную часть нашей планеты, это –SiO2 (песок) и карборунд SiC, имеющий похожие свойства с алмазом.
Ионная связь между атомами образует кристаллическую решётку, в узлах которой будут находиться катионы и анионы. Это строение объединяет между собой целый класс неорганических соединений солей, состоящих с катионов металлов и анионов кислотного остатка. Характерными особенностями этих веществ будут высокие температуры, при которых они плавятся и кипят.
Металлическая связь имеет металлическую кристаллическую решётку. В её строении можно провести параллель с ионной решёткой. В узлах будут размещаться атомы и ионы, а между ними электронный газ, состоящий из мигрирующих электронов от атома к электрону.
Обобщая данные сведения, можем сделать вывод, зная состав и строение, можем прогнозировать свойства и наоборот.