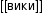стеклянный электрод какого рода
red-ox.ru
Электрохимические методы анализа. 1.6. Стеклянный электрод
1.6. Стеклянный электрод

между внутренним и внешним раствором образуется мембранный потенциал, значение которого является функцией активности ионов водорода во внутреннем и внешнем растворе. Полагая активность ионов во внутреннем растворе неизменной, потенциал стеклянного электрода можно описать зависимостью:
Так как процесс десорбции катионов натрия с поверхности стеклянной мембраны является обратимым:
то, очевидно, влияние активности ионов натрия на скачок потенциала в стеклянной мембране. Влияние примесного иона на значение потенциала стеклянного электрода удовлетворительно описывается уравнением:
Авторская редакция главы из книги Н.Г. Ярышев, Д.А. Панкратов, М.И. Токарев, Н.Н. Камкин, С.Н. Родякина. Физические методы исследования и их практическое применение в химическом анализе: Учебное пособие. ISBN: 978-5-4263-0122-1. М.:Прометей, 2012, 160 стр.
Учебное пособие адресовано студентам, аспирантам и др. специалистам химических и биологических факультетов педагогических вузов. Содержание пособия соответствует Государственному образовательному стандарту высшего профессионального образования и учебно-методическим комплексам по дисциплинам: современные физико-химические методы исследования неорганических и органических веществ и химия окружающей среды. Пособие содержит введение, 6 глав и приложение, в котором приведены методики анализа, применяемые в настоящее время в аналитической химии, в том числе в лабораториях экологического мониторинга, испытательных лабораториях и в центрах государственного санитарно-эпидемиологического контроля.
Стеклянный электрод какого рода
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
3.5 ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
3.5.4 Классификация электродов
По типу электродной реакции все электроды можно разделить на две группы (в отдельную группу выделяются окислительно-восстановительные электроды, которые будут рассмотрены особо в разделе 3.5.5).
Электроды первого рода
К электродам первого рода относятся электроды, состоящие из металлической пластинки, погруженной в раствор соли того же металла. При обратимой работе элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл. Т.о., электроды первого рода обратимы по катиону и их потенциал связан уравнением Нернста (III.40) с концентрацией катиона (к электродам первого рода относят также и водородный электрод).
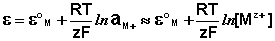
Электроды второго рода
Электродами второго рода являются электроды, в которых металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона и зависимость их электродного потенциала от температуры и концентрации аниона может быть записана в следующем виде:
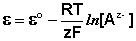
Водородный электрод представляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода. Адсорбируемый платиной водород находится в равновесии с газообразным водородом; схематически электрод изображают следующим образом:
Электрохимическое равновесие на электроде можно рассматривать в следующем виде:
Потенциал водородного электрода зависит от активности ионов Н + в растворе и давления водорода; потенциал стандартного водородного электрода (с активностью ионов Н + 1 моль/л и давлением водорода 101.3 кПа) принят равным нулю. Поэтому для электродного потенциала нестандартного водородного электрода можно записать:
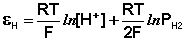
Каломельный электрод обратим относительно анионов хлора и уравнение Нернста для него имеет вид:
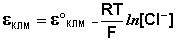
Величина потенциала хлорсеребряного электрода зависит от активности ионов хлора; данная зависимость имеет следующий вид:
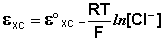
Чаще всего в качестве электрода сравнения используется насыщенный хлорсеребряный электрод, потенциал которого зависит только от температуры. В отличие от каломельного, он устойчив при повышенных температурах и применим как в водных, так и во многих неводных средах.
Электроды, обратимые относительно иона водорода, используются на практике для определения активности этих ионов в растворе (и, следовательно, рН раствора) потенциометрическим методом, основанном на определении потенциала электрода в растворе с неизвестным рН и последующим расчетом рН по уравнению Нернста. В качестве индикаторного электрода может использоваться и водородный электрод, однако работа с ним неудобна и на практике чаще применяются хингидронный и стеклянный электроды.
Хингидронный электрод является т.н. окислительно-восстановительным электродом (см. разд. 3.5.5); зависимость его потенциала от активности ионов водорода имеет следующий вид:
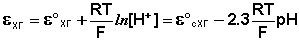
Принцип действия мембранного электрода заключается в следующем. Мембрана, селективная по отношению к некоторому иону (т.е. способная обмениваться этим ионом с раствором), разделяет два раствора с различной активностью этого иона. Разность потенциалов, устанавливающаяся между двумя сторонами мембраны, измеряется с помощью двух электродов. При соответствующем составе и строении мембраны её потенциал зависит только от активности иона, по отношению к которому мембрана селективна, по обе стороны мембраны.
Наиболее часто употребляется стеклянный электрод в виде трубки, оканчивающейся тонкостенным стеклянным шариком. Шарик заполняется раствором НСl с определенной активностью ионов водорода; в раствор погружен вспомогательный электрод (обычно хлорсеребряный). Потенциал стеклянного электрода с водородной функцией (т.е. обратимого по отношению к иону Н + ) выражается уравнением
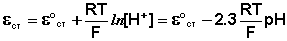
Необходимо отметить, что стандартный потенциал ε °ст для каждого электрода имеет свою величину, которая со временем изменяется; поэтому стеклянный электрод перед каждым измерением рН калибруется по стандартным буферным растворам с точно известным рН.
3.5.5 Окислительно-восстановительные электроды
Зависимость потенциала редокс-электрода ε RO от концентрации (активности) окисленной [Ox] и восстановленной форм [Red] для окислительно-восстановительной реакции, в которой не участвуют никакие другие частицы, кроме окислителя и восстановителя, имеет следующий вид (здесь n – число электронов, участвующих в элементарном акте окислительно-восстановительной реакции):
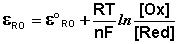
Из данного выражения следует уравнение для потенциала металлического электрода (III.40), т.к. активность атомов металла (восстановленной формы) в материале электрода равна единице.
В случае более сложных систем в выражении для окислительно-восстановительного потенциала фигурируют концентрации всех участвующих в реакции соединений, т.е. под окисленной формой следует понимать все соединения в левой части уравнения реакции
а под восстановленной – все соединения в правой части уравнения. Так, для окислительно-восстановительных реакций, протекающих с участием ионов водорода
уравнение Нернста будет записываться следующим образом:
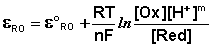
Знание величин электродных потенциалов позволяет определить возможность и направление самопроизвольного протекания любой окислительно-восстановительной реакции при одновременном наличии в растворе двух или более окислительно-восстановительных пар. Восстановленная форма любого элемента или иона будет восстанавливать окисленную форму другого элемента или иона, имеющего более положительный электродный потенциал.
Электроды
Стеклянные электроды
В растворах с одинаковой концентрацией водородных ионов на внутренней и на внешней поверхности стеклянного электрода возникают также потенциалы, отличающиеся друг от друга. Эта разность потенциалов носит название потенциала асимметрии. Потенциал асимметрии может иметь значение от нескольких милливольт в случае тонкостенных электродов из мягкого стекла до сотых долей вольта у толстостенных электродов из тугоплавкого стекла.
Для уменьшения потенциала асимметрии стеклянный электрод выдерживают в воде или в 0, 1 н. соляной кислоте.
В области рН от 2 до 9 стеклянные электроды можно рассматривать как идеальные водородные электроды; его потенциал зависит линейно от рН раствора. В кислых растворах с рН ниже 2 наблюдаются отклонения от истинного значения рН, увеличивающиеся с увеличением кислотности раствора. В щелочных средах отклонения более значительны и иногда начинаются с рН 9. В щелочных средах стеклянный электрод проявляет функции металлического электрода, обратимого по отношению к ионам щелочных металлов. Величина погрешности зависит как от сорта стекла электрода, так и от природы щелочных ионов в растворе и от температуры. Лучшими стёклами можно считать известково-натриевые, худшими — калиевые. Введение в стекло лития увеличивает область применимости стеклянного электрода до рН 13, но одновременно повышается его сопротивление. Наибольшие отклонения при определённом сорте стекла наблюдаются в растворах LiOH и NaOH и наименьшие — в КОН.
Величина потенциала асимметрии изменяется. Поэтому определение рН растворов производят по калибровочному графику рН — потенциал. В случае если потенциометр для измерения рН градуирован в единицах рН, прибор следует каждый раз регулировать по точному буферному раствору.
Постоянные времени стеклянных электродов лежат в пределах 1 — 10 с. Время установления потенциала увеличивается с понижением температуры, с уменьшением скорости протекания раствора и при загрязнении электродов. Существуют электроды, которые можно использовать при повышенных температурах (до 150°С).
Существует несколько теорий, объясняющих действие стеклянного электрода. Например, щелочные катионы, связанные с силикатными анионами в кристаллическую решётку (силикатный скелет), могут уходить из неё в раствор, а на их место из раствора приходят другие катионы. В кислом растворе малые по радиусу ионы водорода могут занять место любого катиона. В таком случае стеклянная поверхность приобретает свойства водородного электрода. В щелочном растворе свободные места в кристаллической решётке занимают катионы щелочного металла в зависимости от радиуса катиона и свободного пространства в силикатном скелете. Стеклянный электрод приобретает функцию металлического электрода.
Конструкции стеклянных электродов разнообразны. Для измерения рН кожи, бумаги применяются стеклянные электроды с плоской мембраной, для измерений в вязких средах и для медицинских целей — кольцевидные и игольчатые электроды. Для повышения механической прочности стеклянного электрода можно покрыть одну из поверхностей мембраны металлом. Существует конструкция проточного стеклянного электрода, выполненного в виде трубки, внутри которой протекает исследуемый раствор.
Со стеклянными электродами можно проводить измерения рН в присутствии окислителей, восстановителей, каталитических ядов, а также в присутствии ионов тяжёлых металлов, т.е. может применяться для большинства растворов и поэтому получил наиболее широкое применение (существуют также хингидронные электроды и сурьмяные электроды).
Стеклянный электрод
Стеклянные электроды — вид аналитического оборудования для определения концентрации ионов в растворе. Важная часть приборов химического анализа и физико-химических исследований. В современной практике широко применяются мембранные ионоселективные электроды (ИСЭ, в том числе и стеклянные), являющиеся частью гальванического элемента. Электрический потенциал электродной системы в растворе чувствителен к изменению содержания определённого вида ионов, что выражается и в зависимости электродвижущей силы (ЭДС) гальванического элемента от концентрации этих ионов.
Содержание
История
Уже в первых работах по изучению стеклянных электродов (СЭ) была обнаружена различная чувствительность разных по составу стёкол к изменению кислотности среды (pH), появились сведения о влиянии ионов щелочных металлов. [1]
Свойства стеклянных электродов (СЭ) и обзор теорий (до начала 1950-х гг.)
Изучение стеклянного электрода существенно расширило возможности применения такого рода измерительных приборов, — в средах и при условиях, препятствовавших, использованию водородных, амальгамных электродов. Особую остроту решение этого вопроса приобрело в период интенсивного развития ядерных технологий, когда контроль процесса очистки урана и оружейного плутония нужно было осуществлять непрерывно, максимально долго без калибровки, — этим условиям соответствует только стеклянный электрод. Вопрос стоял за воспроизводимостью свойств стеклянных электродов (в том числе обратимости их функций), требовалось определить также факторы, которые обуславливали эти свойства, причём на самом ответственном уровне — термодинамическом, позволявшем получить количественные характеристики, открывавшие путь к промышленному производству, многократно снижавшему себестоимость приборов, что, в свою очередь, делало их доступными для применения во многих других областях: от сельского хозяйства, биологии, медицины, — до контроля многих производственных процессов, использования в высоких технологиях, в научных исследованиях многих направлений, наконец.
Свойства стеклянного электрода и состав стёкол
Зависимость свойств СЭ от состава стёкол до определённого времени была значительно менее подробно изучена, чем влияние состава растворов на их поведение, что позволяло перечислить лишь ряд качественных или, в лучшем случае, полуколичественных закономерностей.
Таковы экспериментальные факты, на основе которых на начальном этапе развивалась теория СЭ.
Для объяснения свойств СЭ были высказаны различные предположения о механизме его действия. Эти объяснения находятся в тесной зависимости от того, как представляли себе авторы теорий строение мембран СЭ и механизм переноса электрического тока через них.
Мембранная или диффузионная теория
Рассмотрение основных работ по теории СЭ можно начать с мембранной или диффузионной теории, развитой Л. Михаелисом (L. Michaelis — 1926). В этой теории гальванический элемент со СЭ рассматривается как элемент, в котором растворы разделены пористой стеклянной полупроницаемой мембраной, то есть такой, в порах которой могут свободно передвигаться только ионы одного знака. Теория электродов с полупроницаемыми мембранами была развита в работах Доннана и других исследователей. Здесь, однако, роль мембраны представляется несколько иной, чем в доннановских мембранных равновесиях. Автор теории не предполагал наличия равновесия между растворами, разделёнными мембраной. Л.Михаелис считает, что стеклянная мембрана (так же, как и некоторые другие полупроницаемые мембраны) изменяет лишь диффузионный потенциал, который возникает между растворами в отсутствие мембран. Диффузионный потенциал между растворами изменяется благодаря избирательной проницаемости пор мембраны для ионов электролитов. Из общей теории известно, что диффузионный потенциал определяется активностью в растворе тех ионов, которыми переносится ток через границу раздела между этими растворами. Известно, что стекло заряжено отрицательно по отношению к раствору. Исследование многих авторов, в особенности работами И. М. Жукова с сотрудниками (1943, с З. П. Козьминой — 1946), установлено, что тонкопористые мембраны, несущие отрицательный заряд, преимущественно проницаемы для катионов. На этом основании предполагалось, что в порах стеклянной мембраны могут свободно передвигаться только катионы. [23] [24] [25]
Диффузионная теория может дать объяснение основным экспериментальным фактам. Однако это вызывает ряд серьёзных возражений. Основное возражение, высказанное в своё время М. Далом (1934), состоит в том, что для объяснения водородной функции СЭ вплоть до таких растворов, когда концентрация ионов водорода очень мала (pH=10), необходимо предположить, что ионы водорода обладают подвижностью, превосходящей подвижности всех остальных ионов в 10 11 раз. Если обратиться к работе Л. Михаелиса, в которой была развита диффузионная теория СЭ, то можно увидеть, что, действительно, наличие пористых мембран может несколько изменить значение отношения подвижностей катионов по сравнению с его значением в растворах. Но это изменение не так велико, чтобы служить основанием для подтверждения водородной функции СЭ вплоть до pH 10—11. [23] [26]
Из опытов С. И. Соколова и А. Г. Пасынского (1932) по изучению влияния различных ионов щелочных металлов, находящихся в растворе, на потенциал СЭ, известно, что при одинаковых условиях наибольшее отклонение от водородной функции вызывается ионами лития, меньшее — ионами натрия и затем — ионами калия. Однако опыт показывал, что относительные подвижности этих ионов как в растворах, так и в порах мембран следуют обратному порядку, то есть находится в соответствии с со степенью их гидратации. На границе раздела между стеклом и раствором с обеих сторон мембраны будут возникать потенциалы, как они возникают обычно на границе раздела двух различных фаз при распределении ионов между ними. Внутри мембраны дополнительно возникает диффузионный потенциал, так как в слоях мембраны, принадлежащих к разным растворам, будет различный ионный состав. В работе Д. Маршалла (1926) и для других мембран рассматривается подобные же представления. Однако в этом случае диффузионная теория СЭ в основных предпосылках становится очень близкой к другой теории, которая основана на представлениях об обмене ионов между стеклом и раствором. [12] [27]
Вопреки ряду замечаний против диффузионной теории, нельзя согласиться с тем, что М. Дал в своих экспериментах её опроверг. М. Дал (1931) измерил ЭДС элемента со СЭ при двух различных составах растворов. В первом случае мембрана СЭ отделяла 0,1 н. раствор соляной кислоты от 0,1 н. раствора натриевой щёлочи. Во втором случае к 1,0 н. раствору соляной кислоты был добавлен хлористый натрий. Несмотря на это, М. Дал получил почти одинаковое значение ЭДС элемента в обоих случаях. На этом основании он сделал вывод о независимости действия сторон мембраны и об отсутствии в них пор. Однако вывод М. Дала необоснован, так как и при наличии пор в мембранах он не получил бы заметного изменения ЭДС. элемента. Таким образом вопрос о справедливости диффузионной теории требовал экспериментального разрешения. Возможно, что использование радиоактивных индикаторов во многом могло бы способствовать этому. [28]
Обратимся теперь ко второй группе работ по теории СЭ, в которых стеклянная мембрана представляется сплошной, а не пористой. В этих работах предполагается, что во взаимодействие с растворами вступают лишь поверхностные слои стекла, а в толще мембраны стекло остаётся неизменным. Электрический ток внутри мембраны переносится ионами самого стекла.
Как уже было отмечено, механизм взаимодействия растворов электролитов со стеклом может пониматься по-разному, а поэтому могут быть различные предположения и о механизме действия СЭ. В одной из первых работ по СЭ, а именно, в работе Ф. Габера (1909) было высказано предположение, что в поверхностные слои стекла могут проникать из водных растворов молекулы воды. Вода диссоциирует в поверхностных слоях стекла на ионы водорода и гидроксила. Благодаря этому возникает постоянство концентрации ионов водорода в слоях. На основе высказанного предположения получила объяснение водородная функция СЭ. [4]
Так, если в обычном газовом водородном электроде постоянство активности ионов водорода на поверхности платины обеспечивается адсорбированным платиной водородом под определённым давлением, то в СЭ это постоянство обусловлено диссоциацией молекул воды в поверхностных слоях стекла. Ф. Габер показал также, что, если в стекло будет проникать кислота или щёлочь, то это должно вызвать отклонение от водородной функции. Теория Ф. Габера была развита в то время, когда свойства СЭ не были хорошо изучены, в частности не была известна специфика поведения СЭ в щелочных растворах. [4]
Ф. Гросс и О. Гальперн (1925) попытались расширить представление Ф. Габера, приняв во внимание факты, свидетельствующие о том, что в щелочных растворах отклонение от водородной функции у СЭ определяется наличием растворе щелочных металлов. Авторы частично учли также предположение К. Горовица о металлических функциях СЭ. Стекло и вода ими рассматриваются как две фазы с ограниченной растворимостью друг в друге. Предполагалось, что при растворении в воде электролиты распределяются между этими фазами. В теории рассматривается простейший случай раствора одного электролита. [29]
В щелочных растворах потенциал СЭ будет зависеть от концентрации ионов натрия в растворе. Но это не электрод с чисто натриевой функцией, так как его потенциал зависит от концентрации ионов водорода в растворе, как бы она мала ни была. И лишь при постоянстве концентрации ионов водорода в растворе, точнее при постоянстве их активности, может быть получено уравнение, которое показывает, что в этих условиях СЭ ведёт себя как натриевый электрод с коэффициентом перед знаком логарифма вдвое меньше теоретического коэффициента для обычного натриевого электрода.
Таким образом, если справедлива теория Ф. Гросса и О. Гальперна, СЭ, обладающие функцией водородных электродов, не могут ни при каком составе растворов действовать как нормальные натриевые электроды. Вряд ли можно эти выводы согласовать с имеющимися в литературе экспериментальными данными относительно поведения СЭ в щелочных растворах, согласно которым один и тот же электрод может обладать, в зависимости от состава раствора, или водородной, или натриевой функцией. Поэтому теорию Ф. Гросса и О. Гальперна можно считать ошибочной. Тем не менее наличие натриевой функции у СЭ не доказано строго. Не показано, что СЭ из одного и того же стекла могут переходить от полной водородной функции к полной натриевой функции.
Только подтверждение предположения о наличии натриевой функции у СЭ, обладающих водородной функцией в кислых растворах, основанное на строгом экспериментальном исследовании поведения СЭ в широкой области составов растворов, могло бы окончательно доказать несостоятельность теории Ф.Гросса и О.Гальперна.
Адсорбционные теории
Некоторыми из исследователей было высказано предположение, что поведение СЭ объясняется процессами адсорбции ионов на поверхности стекла (K. Horovitz — 1923, К. С. Евстропьев и Н. В. Суйковская — 1934). К числу адсорбционных теорий может быть отнесена работа Г. Тенделоо (H. J. C. Tendeloo — 1947), в которой автор попытался на основе представлений об обменной адсорбции ионов получить уравнение для потенциала СЭ и объяснить отклонение СЭ от водородной функции. Однако вывод уравнения следует назвать ошибочным. [30]
По физическому смыслу теория Г. Тенделоо должна быть отнесена к теориям, основанным на представлениях об обмене ионов. Автор допускает ошибочную трактовку всего вопроса, упуская из виду условие электронейтральности фаз и неправильно используя адсорбционное уравнение. Если бы Г. Тенделоо был дан верный вывод уравнения на основе высказанных положений, то уравнение для потенциала СЭ не могло бы отличаться от уравнения Б. П. Никольского. Вообще необходимо указать, что адсорбционная теория СЭ не может объяснить ряд экспериментальных фактов и находится с некоторыми из них в противоречии. Ещё в своё время Г. Фрейндлихом (H. Freundlich — 1929) с сотрудниками было показано, что адсорбция ионов на поверхности стекла прежде всего сказывается на величине электрокинетического потенциала и не имеет непосредственного значения в установлении разности электрических потенциалов между стеклянной фазой и водным раствором. Адсорбция многозарядных ионов заметно сказывается на величине электрокинетического потенциала, а в некоторых случаях даже изменяет его знак, но потенциал СЭ при этом изменяется незначительно, в соответствии с небольшим изменением активности ионов водорода в растворе. [31]
Кроме того потенциал СЭ зависит от концентрации тех ионов в растворе, которые способны проникать в стекло. Это, прежде всего, ионы водорода и ионы щелочных металлов. Наиболее вероятным является предположение о том, что распределение ионов между стеклом и водным раствором имеет определённое значение в установлении электродного потенциала. Так понимается причина возникновения разности потенциалов между стеклом и раствором в теории, основанной на представлениях об обмене ионов. Авторы рассматривают стекло, как твёрдый электролит с переменной «упругостью растворения» ионов.
Изменение «упругости растворения» ионов стекла вызывается замещением ионами из раствора. На этом основании дано качественное объяснение того факта, что СЭ, в зависимости от состава растворов и стёкол, могут вести себя подобно водородным, натриевым, калиевым или серебряным электродам. Подобные же представления легли в основу вывода уравнения для потенциала СЭ, который был дан М. Далом (M. Dole — 1934) во второй его теории. Первая теория М. Дала (M. Dole — Theory GE. 1931), от которой автор впоследствии отказался, объясняла действие СЭ возникновением диффузионных потенциалов с обеих сторон мембраны электрода на границе раздела между стеклом и водным раствором. М.Дал воспользовался методом статистики в той форме, в какой она была применена Р.Генри для объяснения некоторых вопросов электрохимии, и получил уравнение для потенциала СЭ. Для расчёта потенциала СЭ по концентрациям ионов водорода и натрия в растворе приняты разности энергий наиболее низких квантовых уровней на поверхности стекла и в растворе для ионов натрия и ионов водорода соответственно. Сам автор признаёт, что его уравнение только полуколичественно отражает действительную зависимость потенциала электрода от состава раствора в переходной области от водородной функции к предполагаемой натриевой функции. Экспериментальные точки не укладываются на кривую, вычисленную по уравнению. Следует отметить, что М. Далом не вполне чётко были сформулированы основные положения теории. Весь вывод мог бы быть построен и на представлении о поверхностной адсорбции ионов. Не оговорены автором те допущения в отношении значений коэффициентов активности ионов, которые он принимает при выводе уравнений.
Подробно развита теория, основанная на представлениях об обмене ионов, в работе Б. П. Никольского (1937). Исходным положением теории является тот факт, что на потенциал СЭ действуют только те ионы, которые способны двигаться в стекле. Известно, что стекло образует неподвижный анионный скелет, внутри которого могут двигаться только катионы. Поэтому установление разности потенциалов между стеклом и водным раствором будет определяться электрохимическим равновесием между этими фазами в отношении катионов. Характер электродной функции стекла, то есть термодинамическое соответствие изменения потенциала СЭ изменению концентрации какого-либо определённого вида ионов в растворе, определяется тем, насколько заполнены поверхностные слои стекла этими ионами.
Несмотря на то, что изложенная здесь теория в общих чертах удовлетворительно описывала поведение СЭ, она не лишена была некоторых недостатков. Уравнение не даёт качественного согласия с экспериментом в переходной области от водородной к натриевой функциям. В работе Б. П. Никольского и Т. А. Толмачёвой (1937) показывалось, что это расхождение может быть объяснено наличием в стекле мест с различной прочностью связи для ионов водорода. Однако оно нуждалось ещё в серьёзной экспериментальной проверке.
Следует сделать ещё одно замечание, которое имеет значение и для других теорий. Обычно выводилось уравнение для потенциала СЭ как уравнение для разности электрических потенциалов между стеклом и водным раствором. При этом не учитывался тот факт, что СЭ в гальванических элементах действует как двусторонняя мембрана, каждая из сторон которой находится в электрохимическом равновесии с растворами различного состава. Это может приводить к возникновению диффузионного потенциала внутри самой мембраны. В теории СЭ этот вопрос оставался нерешённым, и по аналогии с водными растворами предполагалось, что он имеет второстепенное значение.
И, наконец, при выводе уравнения для потенциала СЭ было принято предположение о неизменности коэффициентов активности ионов натрия и водорода в стекле. Хотя это предположение и имеет некоторые основания, но оно не строгое и экспериментально не было подтверждено. Несмотря на отмеченные выше недостатки, разрабатывавшаяся теория могла иметь руководящее значение при изучении электродных свойству стёкол. Новые экспериментальные данные подтверждли основные положения теории. Так опыты Д. Хогарда (G. Haugard — 1932, 1941) и Е. А. Матеровой (1951) показали, что между стеклом и водным раствором происходит обмен ионов. Работа, выполненная Е. А. Матеровой на кафедре физической химии ЛГУ, подтвердила определённую связь между обменом ионов и электрохимическими свойствами стекла. Опыт с радиоактивными индикаторами (J. W. Hensley, A. O. Long, J. E.Willard — 1948) также подтверждал предположение о том, что в стекло проникают ионы из растворов.
Обзор различных теорий СЭ показывает, что наиболее обоснованной явилась теория, руководствующаяся в своих предпосылках представлениями об обмене ионов. Однако и некоторые другие теории не могут быть отведены полностью.
Натриевая функции (НФ) стеклянных электродов
Доказательство НФ обычных СЭ, применяемых для определения pH, тесно связано с вопросом о поведении их в щелочных растворах. Было показано (W.S.Hughes, С. И. Соколов и А. Г. Пасынский, Б. П. Никольский и Т. А. Толмачёва), что в области сильнощелочных растворов кривые зависимости ЭДС от pH для элементов составленных из стеклянного и каломельного электродов, проходит через максимум. Максимум на кривых E=f (pH) появляется в том случае, когда в растворах одновременно с ростом pH увеличивается и концентрация ионов щелочных металлов. Такой ход кривой свидетельствует о том, что после достижения максимума в сильнощелочных растворах по мере увеличения концентрации ионов щелочных металлов потенциал СЭ принимает всё более положительное значение подобно соответствующему металлическому электроду. При этом установлено, что его потенциал в первом приближении изменяется пропорционально логарифму концентрации ионов щелочного металла (натрия). Таким образом, можно было притти к заключению, что СЭ ведёт себя подобно электроду, обратимому по отношению к ио-нам щелочных металлов. Однако это заключение обосновано лишь качественно, а не количественно. К сказанному относительно поведения СЭ из обычных электродных стёкол следует добавить, что в литературе можно встретить указания на плохую воспроизводимость значений ЭДС в щелочных растворах (D.A.MacInnes and D.Belcher) и сомнения в том, что СЭ ведут себя как вполне обратимые электроды в таких растворах (D.Hubbard and others — 1939, 1941, 1946, 1947, 1948).
Значительно полнее исследовано влияние изменение концентрации ионов щелочных металлов на потенциал СЭ, изготовленных из таких стёкол, которые проявляют электродную функцию лишь в достаточно кислых растворах.
В работах Горовица с сотрудниками (1923, 1925) и Шиллера (1924) подробно исследована зависимость потенциала СЭ от концентрации ионов щелочных и некоторых других металлов. Было замечено, что десятикратное изменение концентрации ионов щелочных металлов при определённых условиях может изменять потенциал СЭ по отношению к каломельному полуэлектроду на 50-55 мв. Если не принимать во внимание изменения коэффициентов активности ионов в растворах и диффузионных потенциалов элементов, то при наличии функции металлических электродов десятикратное изменение концентрации соответствующих ионов должно вызывать изменение потенциала электрода на 58 мв. Как видно, расхождение между опытными данными и теоретическими не очень большое, что и послужило основанием для предположения о наличии функций металлических электродов у стекла. Тем не менее, опыты Горовица и Шиллера не являются строгим доказательством этого предположения. Горовитц и Шиллер не сравнивали поведение в растворах стеклянных и соответствующих металлических электродов. Это, прежде всего, и не позволило дать авторам строгое и точное доказательство. Кроме того, в обсуждаемой работе изучалось поведение СЭ в элементах с диффузионными потенциалами. Для того чтобы строго судить о наличии натриевой функции у СЭ по данным ЭДС элемента с диффузионным потенциалом, необходимо знать зависимость этого потенциала и активности отдельных ионов от состава раствора. До поры не было известно точное выражение этой зависимости.
И наконец, Горовиц и Шиллер не принимали во внимание, что изменение солевого состава растворов приводит к изменению значения pH растворов. Поэтому на основании экспериментальных данных, полученных авторами, нельзя было ответить на вопрос, связано ли всецело изменение потенциала СЭ с их металлической функцией и не вызывается ли оно также изменением pH при сохранении отчасти и водородной функции у СЭ.
На основе опытов Горовица Урбан и Штейнер (F.Urban. and A.Steiner — 1931) предприняли попытку применить СЭ для анализа растворов на содержание в них ионов натрия в присутствии ионов калия. По утверждению авторов их метод анализа растворов может давать результаты с точностью до 3 %. Хотя эта работа и представляет некоторый шаг вперёд, однако и в ней, в основном по тем же причинам, НФ СЭ не была строго доказана.
В некоторых работах, которые были специально посвящены исследованию металлической функции СЭ, содержатся данные, имеющие существенное значение для решения данного вопроса. Исследование простых по составу стёкол позволило К. С. Евстропьеву и Н. В. Суйковской (1934) получить интересные выводы относительно влияния химического состава стекла на его электродные свойства. Например, в этой работе было установлено, что добавки окиси бора к стеклу, содержащему окись натрия и кремнезём, сужая область водородной функции СЭ, вместе с тем придаёт им способность отвечать на изменение концентрации ионов щелочных металлов в растворах. Однако в работе К. С. Евстропьева и Н. В. Суйковской (1934) так же, как и в других работах, исследовались элементы с диффузионными потенциалами, не принимались во внимание коэффициенты активности и не было осуществлено непосредственное сравнение поведения стеклянных и металлических электродов. Поэтому все критические замечания, высказанные в отношении работ Горовица, имеют значение и здесь.
В работе Лендиеля и Блюма (B.Lengyel and E.Blum — 1934) также показано, что электроды из боро- и алюмосиликатных стёкол не проявляют себя в полной мере как водородные электроды даже в кислых растворах, но отзываются на изменение концентрации ионов натрия в растворах. Экспериментальные данные, приводимые авторами, выявляют лишь самый общий характер электродной функции, показывая, что десятикратное изменение концентрации ионов натрия в растворах изменяет потенциал СЭ на 40-50 мв.
Тенделоо (H.J.Tendeloo — 1934, 1935, 1942, 1943) исследовал возможность изменения различных минералов и стёкол для изготовления электродов, обратимых по отношению к ионам щелочных и щелочноземельных металлов. Опыты с электродами из минералов не привели к положительным результатам. В методическом отношении работа Лендиеля и Блюма и исследования Тенделоо ничем существенным не отличаются от обсуждавшихся выше. Названные авторы, следовательно, также не дали строгого доказательства НФ СЭ.
Первая попытка более точного изучения НФ СЭ была предпринята Б. П. Никольским и Т. А. Толмачёвой (1937). В их работе отчётливее показано, как одни и те же СЭ, по мере изменения состава растворов, переходят от водородной к натриевой функции.
Для того чтобы более строго судить, соответствуют ли изменения потенциала СЭ функции натриевых электродов, были приняты во внимание изменения коэффициентов активности ионов натрия в растворах. Значения последних принимались численно равными средним коэффициентам активности электролитов, в которые входят ионы натрия. Расчёты показали, что зависимость потенциала СЭ от логарифма активности ионов натрия в растворе близка к линейной. Наклон прямых близок к теоретическому.
Однако рассмотренная выше нормировка коэффициентов активности ионов была принята произвольно, а поэтому доказательство НФ СЭ, данное в этой работе, не может считаться совершенно строгим. К тому же в работе Б. П. Никольского и Т. А. Толмачёвой, как и во всех других, не учитывалось изменение диффузионного потенциала.
Можно сказать, что в перечисленных выше работах НФ СЭ показана с точностью 5 мв на единицу pNa. (Есть основания предполагать, что в таких пределах может сказаться на значениях ЭДС рассматриваемых элементов изменение диффузионных потенциалов и коэффициентов активности ионов). Очевидно в силу того, что предположение о наличии НФ у СЭ не было доказано достаточно строго, могли появиться работы, в которых оспаривается это предположение. Так, в серии работ Хаббарда с сотрудниками (D.Habbard and others — 1939, 1941, 1946, 1947, 1948) доказывается, что наличие водородной функции у СЭ, изготовленных из различных по составу стёкол, всегда можно связать с образованием в поверхностных слоях стекла особой плёнки, состоящей из набухающего геля кремнекислоты. Кроме того, показывается, что отклонение от водородной функции по мере перехода к щелочным растворам связано с разрушением этой плёнки, с уменьшением её толщины.
Не высказывая никаких определённых соображений относительно того, как может влиять толщина поверхностной плёнки на потенциал СЭ, авторы отрицают наличие какой-либо определённой функции у СЭ в таких растворах, где они не ведут себя в полной мере как водородные электроды. Хаббард с сотрудниками опровергает предположение о переходе СЭ к НФ на том основании, что десятикратное изменение концентрации ионов натрия в растворе, по их данным, в некоторых случаях вызывает слишком большое изменение потенциала СЭ (107, 249, 339 мв на единицу шкалы pNa вместо 59 мв теоретических, соответствующих НФ).
Действительно, если изменения меньше, чем 59 мв на единицу pNa, можно объяснить неполным переходом от водородной к натриевой функции, то такие изменения, которые значительно превосходят теоретические, казалось бы, ставят под сомнение справедливость предположения о наличии НФ у СЭ. Однако авторы допускают серьёзную ошибку при обработке собственных экспериментальных данных.
В рассматриваемых работах производились измерения ЭДС гальванических элементов, в которых оба электрода, исследуемый стеклянный и вспомогательный (СЭ с водородной функцией), находились в одном и том же растворе. Изменения ЭДС такого элемента при переходе от одной концентрации раствора к другой связаны с изменением потенциала обоих электродов. Авторы ошибочно относят все изменения ЭДС элемента к изменению потенциала исследуемого СЭ, а поэтому и получают слишком большие значения. Если экспериментальные данные Хаббарда рассчитать с учётом этого обстоятельства, то оказывается, что изменения потенциала СЭ во всех случаях не превосходит 59 мв на единицу pNa. Следовательно, работами Хаббарда не опровергается предположение о НФ СЭ. Тем не менее, появление этих работ свидетельствует, что НФ СЭ не доказана также убедительно, как их ВФ.
Вшеизложенное позволяет сделать следующие выводы.
Многими работами показано, что в растворах, где СЭ не проявляют себя как водородные электроды, потенциал их может зависеть от концентрации ионов щелочных металлов. Характер этой зависимости согласуется с предположением о появлении у СЭ при определённых условиях функции металлических электродов. Но до настоящего времени это предположение не было проверено достаточно точным и строгим экспериментальным методом. В работах по исследованию НФ СЭ не было произведено непосредственное сравнение поведения стеклянных и натриевых электродов. Также не сравнивалось поведение СЭ в растворах с поведением других металлических электродов. В работах обычно использовались элементы с диффузионными потенциалами, что помимо неопределённости, вносимой изменениями этих потенциалов при переходе от одних растворов к другим, не позволяло проводить достаточно строгие расчёты с использованием коэффициентов активности электролитов. В большинстве работ изменения коэффициентов активности и не учитывалось. По тем же причинам не была достаточно строго исследована зависимость поведения СЭ от состава растворов в переходной области от водородной к натриевой функции.
Между тем, для дальнейшего развития теории СЭ и расширения области его применения, так же, как для решения некоторых вопросов химии стекла и теории обмена ионов, необходимо было иметь данные о влиянии состава растворов на электродные свойства стёкол, полученные достаточно строгими экспериментальными методами. В частности, требовалось окончательно решить вопрос о наличии функции металлических (натриевых) электродов у стёкол. В этом и состояла основная задача новых исследований.
Анализ ранее опубликованных работ показывал путь экспериментального решения поставленной задачи. Прежде всего следовало произвести непосредственное сравнение поведения в растворах стеклянных и натриевых электродов. Затем — изучить поведение СЭ в переходной области, применяя элементы без диффузионных потенциалов.
Для решения ряда теоретических и практических задач желательно было описанным выше методом произвести исследование электродных свойств стёкол, различных по своему химическому составу.
Доказательство наличия натриевой функции у стеклянных электродов
Для доказательства НФ СЭ недостаточно было установить, что потенциалы стеклянного и натриевого электродов изменяются одинаково, необходимо было также показать, что СЭ действуют при этом обратимо. Специальные опыты с электродами из стекла № 1, а также опыты с электродами из стёкол № 3 и 4 говорили о том, что стеклянные электроды удовлетворяют последнему требованию. Однако при длительном выдерживании СЭ в щелочных растворах можно было обнаружить и некоторые необратимые изменения его потенциала, которые обнаруживаются в том, что ЭДС элемента II очень медленно, но постоянно убывает. На это указывают также Хаббард и ряд других авторов (D.Habbard and others — 1939, 1941, 1946, 1947, 1948). Хаббард, отметив непрерывное изменение потенциала СЭ в таких растворах, в которых электроды не обладают водородной функцией, высказал сомнение в том, что электроды вообще здесь отвечают какой-либо определённой функции. Однако наши опыты достаточно отчётливо показывают, что на фоне медленных, необратимых изменений потенциала СЭ можно наблюдать быстрые и обратимые изменения потенциала, вызванные изменением состава растворов.
Таким образом, сравнительное изучение поведения в растворах стеклянных и натриевых электродов показало, что для каждого из исследованных стёкол есть такая область составов растворов, где изменения потенциала СЭ обратимы и равны изменениям потенциала натриевого электрода. Это достаточно строго доказывает наличие НФ у СЭ.
Наличие НФ у электродов, изготовленных из различных по составу стёкол — силикатных (стекло № 1), боросиликатных (стёкал № 2, 3) и алюмоборосиликатных (стекло № 4), — свидетельствует о достаточно общем характере изученного нами явления.
В практическом отношении существенное значение имеет тот факт, что у некоторых стёкол (стекло № 4) НФ проявляется не только в щелочных, но и в нейтральных и даже в кислых растворах.
Для общей теории СЭ весьма важным является тот факт, что в зависимости от состава растворов все исследованные стёкла обладают как водородной, так и натриевой функцией.
Теория стеклянного электрода в свете результатов опытов
Результаты проведённых опытов (М. М. Шульца) позволяют сделать определённые выводы относительно справедливости, некоторых из теорий СЭ, критический анализ которых был дан обзоре. В этом отношении существенное значение имеют факты: 1) строго доказано наличие НФ у СЭ при соответствующем составе раствора; 2) подтверждено предположение о возможности перехода СЭ от полной водородной функции к полной натриевой функции и 3) выяснена определяющая роль отношения активностей ионов натрия и ионов водорода в растворе для э.д.с. элемента II (стеклянный — водородный электрод).
Теория Гросса и Гальперна неприемлема для объяснения поведения СЭ, поскольку эта теория в своих выводах вопреки опыту, исключает возможность перехода СЭ от полной водородной функции к полной натриевой функции.
Не менее определённо результатами опытов подтверждается та критика, которой была подвергнута теория Тенделоо.
Итак, следует отметить, что доказательство НФ СЭ, подтвердив в общих чертах основные положения ионообменной теории СЭ, поставило на очередь решение новых задач. Прежде всего, требовалось подробное и строгое исследование поведения СЭ в переходной области от водородной к натриевой функции. Для успешного разрешения последней задачи необходимы были дополнительные сведения о поверхностных слоях стекла при воздействии на него различных растворов.
Электродные свойства стёкол и некоторые данные о поверхностных плёнках на них
До сих пор мы не останавливались на деталях процессов, характерных для поверхностных слоёв стекла, которые приводят к той или иной функции у СЭ. Для термодинамического рассмотрения вопроса достаточно было иметь лишь самые общие представления этих процессов. Например, предположить, как это было сделано в ионообменной теории, что в кислых растворах поверхностные слои стекла содержат ионы водорода, которые могут замещаться ионами натрия по мере перехода к более щелочным растворам.
И. В. Гребенщиков (И. В. Гребенщиков и Т. А. Фаворская) ещё в 1931 г. указывал на то, что поведение СЭ тесно связано с особыми свойствами поверхностных слоёв стекла. К настоящему времени, главным образом благодаря работам И. В. Гребенщикова и его школы, сложились определённые представления о строении и химических свойствах особой плёнки, образующейся на поверхности стекла под действием воды и кислых растворов.
«… Свободный кремнезём, не связанный с окислами, не реагирует с кислотами и оказывается не разрушенным ни действием воды, ни кислоты, а образует прочную поверхностную плёнку, в которой происходит коагуляция геля кремнекислоты» (И. В. Гребенщиков, А. Г. Власов, Б. С. Непорент и Н. В. Суйковская — 1946). Существенное значение для имеет тот факт, что плёнка содержит гель кремнекислоты, а следовательно, она содержит ионы водорода. Это и обуславливает появление водородной функции у электродов из силикатных стёкол. О той роли, которую играет кремнекислота в поведении СЭ, говорит следующий опыт. Хаббард показал, что СЭ из стекла 015, подвергавшиеся предварительному выщелачиванию, после прокаливания при 550 °C, теряют водородную функцию. Он объяснял этот факт разложением кремнекислоты при прокаливании с образованием негигроскопического слоя кремнезёма. Было установлено, что действием фтористоводородной кислоты, снимающей слой кремнезёма, СЭ возвращаются к ВФ. СЭ, не подвергшиеся выщелачиванию, как показал в той же работе Хаббард, не теряют водородной функции после прокаливания. Автор связывает это с тем фактом, что на невыщелоченной поверхности не образуется при прокаливании такая негигроскопическая плёнка кремнезёма, которая могла бы препятствовать образованию геля кремнекислоты («набуханию стекла», как говорит автор).
Немаловажное значение для понимания строения защитной плёнки, образующейся на поверхности стекла под действием воды и кислот, имели результаты опытов С. Н. Соколова и А. Г. Пасынского (1932), выявивших, что отклонения СЭ от водородной функции зависит от соотношения радиусов ионов щелочных металлов (негидратированных) в стекле и в растворе. Этот факт позволял предположить, что стеклообразующие окислы щелочных металлов могут накладывать, в известной мере, свой отпечаток на строение защитной плёнки.
Целый ряд фактов, и прежде всего процесс непрерывного растворения стекла в щелочах, протекающий с постоянной скоростью (W.Geffcen — 1939, W.A.Weyl — 1941), свидетельствует о том, что на поверхности стекла в щелочных растворах нет защитной плёнки. При этом условии поверхностные слои не содержат ионов водорода, а содержат ионы натрия. В соответствии с этим находится тот факт, что СЭ в щелочных растворах не обладают водородной функцией, а действуют, как доказано выше, в качестве натриевых электродов.
Несомненно, что объяснения Хаббарда, сводящего причину отклонений от водородной функции к уменьшению толщины защитной плёнки и необоснованно отвергающего наличие НФ у СЭ, были ошибочны. Различие в толщине плёнки, разумеется, само по себе не может быть фактором, определяющим изменение ЭДС гальванического элемента. С другой стороны, опыты М. М. Шульца, показывающие наличие НФ у СЭ, дали основание предполагать, что по мере перехода у щелочным растворам существенное значение приобретает процесс, который ведёт к образованию на стекле поверхностного слоя, всё более богатого ионами натрия.
Многие авторы работ по химической устойчивости стекла считали, что снятие защитной плёнки не поверхности стекла можно объяснить нейтрализацией кремнекислоты щелочными растворами и последующим растворением образующихся солей (W. Geffcken, W. A. Wеуll).
Немаловажное значение здесь имеет процесс обмена ионов между стеклом и раствором. Об этом свидетельствовует тот факт, что значение потенциала СЭ в переходной области от водородной функции к натриевой функции определяется отношением активностей ионов натрия и ионов водорода, а не просто щёлочностью (pOH) раствора. В свою очередь известно, что при одинаковой практически щёлочности растворов, в зависимости от концентрации натриевых солей, может быть различна скорость растворения стекла (F.Urban. and A.Steiner — 1931; (И. В. Гребенщиков, А. Г. Власов, Б. С. Непорент и Н. В. Суйковская — 1946). И. В. Гребенщиков с сотрудниками показал, какую большую роль при процессах полировки играют защитные плёнки. Ими же отмечается, что добавление нейтральных солей щелочных металлов всегда замедляет процесс полировки (И. В. Гребенщиков — 1933). Всё это подтверждало предположение, что обмен ионов играет существенную роль в разрушении защитной плёнки.
Подробное изучение электродных свойств стекла в переходной области от водородной к натриевой функции при параллельном изучении свойств поверхностных плёнок стекла другими методами позволило создать более определённые представления о происходящих в них процессах. Полезным оказалось параллельное изучение электродных свойств стекла и скорости его растворения в зависимости от отношения активностей ионов натрия и ионов водорода в растворах.
Практическое значение стеклянных электродов с натриевой функцией в нейтральных и слабокислых растворах
К сказанному следует добавить, что строгое доказательство натриевой функции стеклянных электродов открыло новую область приложения их на практике не только как водородных, но и как электродов, обратимых по отношению к ионам натрия и по отношению к ионам других щелочных металлов. Электроды нашли применение не только в химии, но и в биологии, почвоведении и других областях науки и практики.
До той поры в качестве обратимых электродов по отношению к ионам натрия применялись амальгамные. Стеклянные электроды с натриевой функцией обладают рядом преимуществ по сравнению с амальгамными:
1) применимы в более широкой области составов растворов, содержащих ионы натрия 0,001 м и выше);
2) пригодны для измерения в средах, содержащих окислители;
3) натриевая функция сохраняется при наличии в растворах ионов калия и щелочноземельных металлов.
Стеклянные электроды легче изготовить, чем амальгамные.
Было показано, что стекло № 4 (Да — Лендьеля и Блюма) обладает натриевой функцией в нейтральных и слабокислых растворах. Это стекло может служить для изготовления электродов с натриевой функцией. Было определено, что наполнять электрод целесообразно раствором хлористого натрия, а не кислотой, как поступали ранее, так как при этом условии электрод после изготовления должен приходить к равновесию быстрее и иметь более устойчивый потенциал. Однако стекло № 4 не лишено было ряда существенных недостатков, которые не позволяли рекомендовать его для широкого применения. Стекло № 4 обладало большим сопротивлением, тугоплавко, плохо припаивалось к обычным лабораторным стёклам. С трудом удавалось припаять плёнку из этого стекла к трубкам из молибденового стекла. Между тем, не было оснований для сомнения в том, что могут быть получены стёкла значительно лучшие по своим свойствам, — что можно повысить электропроводность стёкол за счёт введения в них большого количества окиси натрия. Увеличение содержания последней в стекле в этом случае не должно вызвать затруднений, возникающих в случае стёкол с водородной функцией, в которых слишком высокое содержание окиси натрия сокращает область этой функции (К. С. Евстропьев и Н. В. Суйковская — 1934; D.Habbard and others — 1939, 1941, 1946, 1947, 1948). В нейтральных растворах обладают натриевой функцией стёкла, содержащие окись бора и окись алюминия. Возникла потребность в получении боросиликатных стёкол с натриевой функцией, поскольку они менее тугоплавки, чем алюмосиликатные. Но, как показали опыты с серией боросиликатных стёкол, за счёт увеличения содержания только одной окиси бора, нельзя получить стёкла с натриевой функцией, пригодной для практических целей. Для того, чтобы стеклянные электроды обладали натриевой функцией в нейтральных растворах, приходилось вводить в стекло большое количество окиси бора (
11 %), что вызывало ухудшение химической устойчивости стёкол.
Было установлено, что наряду с окисью бора стекло должно содержать также окись алюминия. При сопоставлении данные разных авторов, занимавшихся исследованием натриевой функции стеклянных электродов, было высказано предположение, что этой функции будут отвечать стёкла, содержащие 15-20 % NA2O3, 65-70 % SiO2, около 10 % B2O + Al2O3.
Специальными исследованиями было установлено оптимальное соотношение окиси бора и окиси алюминия в стекле, которое позволяет получить стеклянные электроды с натриевой функцией в нейтральных растворах, при хорошей электропроводности и химической устойчивости самого стекла.
1. Непосредственным сравнением поведения в растворах стеклянных и натриевых (амальгамных) электродов доказано, что электроды из различных стёкол в пределах ошибок изменений (1 мв) обладают полной натриевой функцией при определённых составах растворов для каждого сорта стекла. Натриевая функция стеклянных электродов может считаться доказанной с точностью до 0,5 % для стекла № 4* и до 1-3 % для остальных стёкол.
2. Изменение природы и концентрации анионов в растворе (OH—, Cl—, SO4— —) не оказывает специфического влияния на нетриевую функцию стеклянных электродов.
3. При наличии в растворе ионов щелочных и щелочноземельных металлов стеклянные электроды отклоняются от натриевой функции. Например, стеклянные электроды из указанного стекла № 4, обладающие натриевой функцией в нейтральных растворах, отклоняются от этой функции, если в отношение концентрации ионов натрия и ионов калия в растворе меньше, чем 1 : 5, а ионов натрия и ионов бария меньше, чем 1 : 50.
4. Строго доказано, что стеклянные электроды из одного и того же стекла могут переходить с изменением состава растворов от полной водородной функции к полной натриевой функции. Поскольку в своих выводах теория Гросса и Гальперна противоречит этому факту, можно сказать, что она не применима для объяснения поведения стеклянных электродов в растворах.
5. Потенциал стеклянного электрода по отношению к водородному электроду в том же растворе одновременно определяется отношением активностей ионов натрия и ионов водорода в растворе м не зависит от абсолютных значений концентраций каждого из этих ионов. Этот факт находится в противоречии с уравнением, выведенным Тенделоо для потенциала стеклянного электрода, и показывает, что ионообменная теория правильно описывает поведение стеклянных электродов в растворах.
6. Наличие натриевой функции у стеклянных электродов хорошо согласуется с современными представлениями, разработанными, главным образом, школой акад. И. В. Гребенщикова, о процессах, происходящих в поверхностных слоях стекла при воздействии на него растворов.
7. Добавление к силикатному стеклу окиси бора и окиси алюминия сдвигает в сторону кислых растворов область перехода стеклянных электродов от водородной к натриевой функции.
8. Электроды из стекла, содержащего 14 % окиси бора и окиси алюминия (в сумме), обладают натриевой функцией в нейтральных и даже кислых растворах. Такие электроды могут иметь практическое значение как натриевые электроды; они обладают рядом преимуществ перед амальгамными (могут применяться в окислительных средах, при меньших концентрациях ионов натрия, в растворах, содержащих ионы калия, и др.).
Нужно отметить, что работы по исследованию свойств стеклянного электрода и электродных стёкол велись с 1930-х годов и многими другими учёными, не упомянутыми в данном обзоре, в основу которого положена кандидатская диссертация М. М. Шульца, первая его самостоятельная работа. Этими изысканиями, помимо его учителя, автора наиболее продуктивного варианта ионообменной теории Бориса Петровича Никольского, Герасима Петровича Авсеевича, чей вклад в развитие темы также велик, Константина Сергеевича Евстропьева, самого М. М. Шульца, занимались с довоенных времён, прежде всего — Пётр Алексеевич Крюков и Нина Викториновна Пешехонова. Однако доказана строго термодинамически натриевая функция СЭ, предопределившая дальнейшее развитие теории СЭ, была, как мы видим, именно М. М. Шульцем.