сульфат аммония какая химическая связь
Сульфат аммония (сернокислый аммоний)
Подробнее при переходе по ссылке
«>удобрение, вносится в качестве основного под различные культуры. Синтетический сульфат аммония белого цвета, а коксохимический – серый, синеватый или красноватый. Удобрение малогигроскопичное и при нормальных условиях хранения практически не слеживается, сохраняя хорошую рассеиваемость.
Агрохимикаты
| Макроэлементы, % | ||||||
| N | P | K | Ca | Mg | S | Fe |
| 21 | — | — | — | — | 24 | 0,007 |
| Микроэлементы, % | ||||||||
| Ag | B | Mo | Mn | Cu | Zn | Co | I | V |
| — | — | — | — | — | — | — | — | — |
Содержание:
Физические и химические свойства
Растворимость в воде: при 0°C – 70,5 г/100 г, при +25°C – 76,4 г/100 г, при +100°C – 101,7 г/100 г. Окисляется до N2 под действием сильных окислителей, например, марганцевокислого калия KMnO4.
Сульфат аммония содержит:
Фракционный состав удобрения:
Массовая доля остатка, не растворимого в воде, не превышает 0,02 %.
Применение
Сельское хозяйство
Сульфат аммония в сельском хозяйстве используют как основное удобрение под различные культуры.
Промышленность
Сульфат аммония в химической промышленности используют как компонент осадительной ванны при формировании вискозного волокна. В стекольной промышленности – в качестве добавки к стекольной шихте для улучшения ее плавкости.
Поведение в почве
При внесении в почву сульфат аммония быстро растворяется, и значительная часть катионов NH4 + входит в почвенно-поглощающий комплекс. Одновременно в почвенный раствор переходит эквивалентное количество вытесненных катионов. При этом ион аммония теряет подвижность. Это устраняет опасность его вымывания при промывном режиме почв.
Находясь в обменно-поглощенном состоянии, ионы аммония хорошо усваиваются растениями. (Изображение)
Вследствие нитрификации аммонийный азот переходит в нитратную форму. Скорость перехода аммонийного азота в нитратный зависит от необходимых для нитрификации условий: температуры, аэрации, влажности, биологической активности и реакции почвы. Одним из основных факторов, влияющим на скорость нитрификации, является степень окультуренности почв.
Переувлажнение и повышенная кислотность почв тормозят нитрификацию. Известкование кислых почв значительно ускоряет этот процесс. После превращения аммонийного азота в нитратный он приобретает все свойства нитратных удобрений. В результате процесса нитрификации в почве образуется азотная кислота и освобождается серная кислота.
В почве эти кислоты нейтрализуются, вступая во взаимодействие с бикарбонатами почвенного раствора и катионами почвенного поглощающего комплекса.
Нейтрализация минеральных кислот сопровождается использованием бикарбонатов почвенного раствора и вытеснением оснований из ППК водородом. Это ослабляет буферную способность почв и повышает их кислотность.
Однократное внесение сульфата аммония может и не повлиять на реакцию почвы. При систематическом использовании данного удобрения почвенная среда может значительно подкислиться. Степень подкисления увеличивается при меньшей буферной способности почв.
| Календарь внесения | |
| Апрель | Основное внесние |
| Сентябрь | Основное внесние |
Применение на различных типах почв
Сульфат аммония при длительном использовании оказывает на почву окисляющее действие.
На кислых почвах
На черноземах
На каштановых почвах
На легких почвах
Способы внесения
Подробнее при переходе по ссылке
Подробнее при переходе по ссылке
Подробнее при переходе по ссылке
Подробнее при переходе по ссылке
«>удобрения определяются свойствами почвы и климатическими условиями зоны.
Влияние на сельскохозяйственные культуры
Сульфат аммония обеспечивает сельскохозяйственные растения азотом на весь вегетационный период и положительно влияет на их рост, развитие и урожайность.
Овес, озимая рожь, лен
Рапс, капуста, редька масличная и другие крестоцветные
Картофель
Получение
Сульфат аммония получают двумя способами:
При написании статьи, также использовались следующие источники:
Сульфат аммония
Характеристики и физические свойства сульфата аммония
Он хорошо растворяется в воде (гидролизуется по катиону). Кристаллогидратов не образует.
Рис. 1. Сульфат аммония. Внешний вид.
Таблица 1. Физические свойства сульфата аммония.
Плотность (20 o С), г/см 3
Температура плавления, o С
Температура разложения, o С
Растворимость в воде (20 o С), г/100 мл
Получение сульфата аммония
Различают промышленные и лабораторные способы получения сульфата аммония. В первом случае используют реакцию нейтрализации серной кислоты синтетическим аммиаком. Кроме этого в качестве сырья для получения этого вещества применяют дымовые газы электространций и сернокислотных производств.
Основным лабораторным методом получения сульфата аммония считается реакция взаимодействия концентрированных серной кислоты и аммиака:
Химические свойства сульфата аммония
Сульфат аммония — это средняя соль, образованная слабым основанием – гидроксидом аммония (NH4OH) и сильной кислотой – серной (H2SO4).Гидролизуется по катиону. Характер среды водного раствора сульфата аммиака кислый. Уравнение гидролиза будет выглядеть следующим образом:
Сульфат аммония вступает в реакции обмена с кислотами, щелочами и другими солями:
Сульфат аммония окисляется перманганатом калия и дихроматом калия:
При нагревании до температуры 235 – 357 o С сульфат аммония разлагается на гидросульфат аммония и аммиак:
Применение сульфата аммония
Сульфат аммония нашел широкое применение в различных отраслях промышленности, таких как производство минеральных удобрений, текстиля (вискозное волокно), порошковых огнетушителей, а также в пищевой индустрии (добавка Е517) и биохимии.
Примеры решения задач
| Задание | Какой объем аммиака выделится в ходе реакции разложения сульфата аммония, если в неё вступило 10 г соли? |
| Решение | Запишем уравнение реакции разложения сульфата аммония: |
Рассчитаем количество сульфата аммония, вступившего в реакцию (молярная масса равна 132 г/моль):
Тогда, объем выделяющегося аммиака будет равен:
V (NH3) = 0,07 × 22,4 = 1,568 л.
| Задание | Вычислите массу серной кислоты, которая потребуется для получения сульфата аммония массой 7,9 г по реакции взаимодействия с аммиаком. |
| Решение | Запишем уравнение реакции взаимодействия серной кислоты с аммиаком с образованием сульфата аммония: |
Рассчитаем число моль сульфата аммония (молярная масса – 132 г/моль):
Масса серной кислоты, которая потребуется для получения сульфата аммония по реакции взаимодействия с аммиаком равна (молярная масса – 98 г/моль):
Сульфат аммония
| Сульфат аммония | |
|---|---|
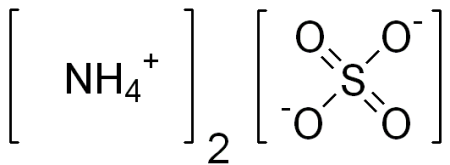 | |
| Систематическое наименование | аммония сульфат |
| Традиционные названия | аммоний сернокислый |
| Хим. формула | (NH4)2SO4 |
| Рац. формула | H8N2O4S |
| Состояние | твёрдое |
| Молярная масса | 132,14052 г/моль |
| Плотность | 1,769 г/см³ (20 °C) |
| Т. плав. | 235-280 °C |
| Т. разл. | 218 °C |
| Мол. теплоёмк. | 187,4 Дж/(моль·К) |
| Энтальпия образования | −1180,26 кДж/моль |
| Растворимость в воде | 75,4 г/100 г (20 °C) |
| ГОСТ | ГОСТ 9097-82 ГОСТ 3967-78 ГОСТ 10873-73 ГОСТ Р 51520-99 |
| Рег. номер CAS | 7783-20-2 |
| PubChem | 24538 |
| Рег. номер EINECS | 231-984-1 |
| SMILES | |
| Кодекс Алиментариус | E517 |
| ChEBI | 62946 |
| ChemSpider | 22944 |
| ЛД50 | 2840 (крысы; орально) |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Сульфат аммония (аммоний сернокислый, лат. ammonium sulphate ), (NH4)2SO4 — неорганическое бинарное соединение, аммонийная соль серной кислоты. Это бесцветные прозрачные кристаллы (или белый порошок) без запаха. Получают сульфат аммония действием серной кислоты на раствор аммиака и обменными реакциями с другими солями. Применяется в качестве удобрения, при производстве вискозы, в пищевой промышленности, при очистке белков в биохимии, в качестве добавки при хлорировании водопроводной воды. Токсичность сульфата аммония очень низкая.
Содержание
Физические свойства
Чистый сульфат аммония — бесцветные прозрачные кристаллы, в измельчённом виде — белый порошок. Запаха не имеет. Гигроскопичность невысокая.
Растворимость в воде (г/100 мл):
Растворимость в других растворителях (г/100 г):
Сульфат аммония с солями некоторых других металлов (алюминий, железо и пр.) образует двойные соли, например алюмоаммиачные квасцы, соль Мора.
Химические свойства
При нагревании до 147 °С сульфат аммония разлагается на соответствующий гидросульфат NH4HSO4 и аммиак по схеме:
При повышении температуры выше 500 °С гидросульфат аммония кипит с разложением на серный ангидрид, аммиак и воду:
Сульфат аммония окисляется до молекулярного азота сильными окислителями, например перманганатом калия.
Получение
В лаборатории получают действием концентрированной серной кислоты на концентрированный раствор аммиака.
Эту реакцию, как и все другие реакции взаимодействия аммиака с кислотами, проводят в приборе для получения растворимых веществ в твёрдом виде.
Среди основных способов получения сульфата аммония, которые наиболее часто используются в химической промышленности, имеются следующие: процесс нейтрализации серной кислоты синтетическим аммиаком; использование аммиака из газа коксовых печей для его химической реакции с серной кислотой; получение в результате обработки гипса растворами карбоната аммония; получение при переработке отходов, остающихся после производства капролактама. Вместе с тем имеются и другие способы производства сульфата аммония, например, получение этого вещества из дымовых газов электростанций и сернокислотных заводов. Для этого в горячие газы вводят газообразный аммиак, который связывает имеющиеся в газе окислы серы в различные соли аммония, в том числе и в сульфат аммония.
Очистка
Технический сульфат аммония часто загрязнен сульфатом железа. Избавиться от него простой перекристаллизацией невозможно, так как соли железа сокристаллизуются с сульфатом аммония, образуя двойную соль Мора.
Согласно Карякину, для очистки препарата 150 г его растворяют в 260 мл дистиллированной воды, нагревают до кипения, прибавляют 1-2 г пероксодисульфата аммония и кипятят до полного окисления железа (II) в железо (III). Полноту окисления необходимо проверить прибавлением к отфильтрованной пробе раствора гексацианоферрата (III) калия (красной кровяной соли) — синее окрашивание пробы указывает на неполноту окисления железа, в таком случае процесс очистки следует повторить.
После перехода всего железа в трехвалентное к раствору следует прибавить крепкий раствор аммиака до сильно щелочной реакции и отфильтровать. Полученный раствор упарить до консистенции жидкой кристаллической кашицы и дать охладиться до комнатной температуры. Кристаллы отсосать на воронке Бюхнера и промыть несколько раз дистиллированной водой.
В полученном реактиве может содержаться до 0,2 % сульфата кальция, который отделить никак не удастся.
Применение
Также используется в производстве вискозного волокна как компонент осадительной ванны.
В биохимии переосаждение сульфатом аммония является общим методом очистки белков.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E517.
Сульфат аммония используется в технологии хлорирования воды с аммонизацией — его вводят в обрабатываемую воду за несколько секунд до хлора. С хлором он образует хлорамины, связывая свободный хлор, благодаря чему значительно сокращается образование хлорорганики, вредной для организма человека, сокращается расход хлора, уменьшается коррозия труб водопровода.
Сульфат аммония является компонентом порошковых огнетушителей и огнезащитных средств.
Кроме того, находит применение при получении марганца электролизом, в производстве аммониево-алюминиевых квасцов, корунда. Добавляется к стекольной шихте для улучшения её плавкости.
Воздействие на человека
Сульфат аммония признаётся безопасным для человека и используется в качестве пищевой добавки в России, на Украине и в странах ЕС. Сульфат аммония используется в качестве заменителя соли и носит название пищевой добавки E517. В пищевой индустрии добавка сульфат аммония выступает в роли улучшителя качества муки и хлебобулочных изделий, увеличивая также их объём, является питанием для дрожжевых культур, применяется как стабилизатор и эмульгатор.
Сульфат аммония (сернокислый аммоний)
Микроэлементы, %
Сульфат аммония – удобрение, вносится в качестве основного под различные культуры. Синтетический сульфат аммония белого цвета, а коксохимический – серый, синеватый или красноватый. Удобрение малогигроскопичное и при нормальных условиях хранения практически не слеживается, сохраняя хорошую рассеиваемость. [2]
Содержание:
Физические и химические свойства
Растворимость в воде: при 0°C – 70,5 г/100 г, при +25°C – 76,4 г/100 г, при +100°C – 101,7 г/100 г. Окисляется до N2 под действием сильных окислителей, например, марганцевокислого калия KMnO4. [8]
Сульфат аммония содержит:
Фракционный состав удобрения:
Массовая доля остатка, не растворимого в воде, не превышает 0,02 %. [3]
Применение
Сельское хозяйство
Сульфат аммония в сельском хозяйстве используют как основное удобрение под различные культуры. [8]
Промышленность
Сульфат аммония в химической промышленности используют как компонент осадительной ванны при формировании вискозного волокна. В стекольной промышленности – в качестве добавки к стекольной шихте для улучшения ее плавкости. [8]
Схема реакции
Схема реакции обменных процессов между сульфатами аммония и катионами почвенного поглощающего комплекса (ППК), согласно: [9]
Поведение в почве
При внесении в почву сульфат аммония быстро растворяется, и значительная часть катионов NH4 + входит в почвенно-поглощающий комплекс. Одновременно в почвенный раствор переходит эквивалентное количество вытесненных катионов. При этом ион аммония теряет подвижность. Это устраняет опасность его вымывания при промывном режиме почв.
Находясь в обменно-поглощенном состоянии, ионы аммония хорошо усваиваются растениями. (Изображение)
Вследствие нитрификации аммонийный азот переходит в нитратную форму. Скорость перехода аммонийного азота в нитратный зависит от необходимых для нитрификации условий: температуры, аэрации, влажности, биологической активности и реакции почвы. Одним из основных факторов, влияющим на скорость нитрификации, является степень окультуренности почв.
Переувлажнение и повышенная кислотность почв тормозят нитрификацию. Известкование кислых почв значительно ускоряет этот процесс. После превращения аммонийного азота в нитратный он приобретает все свойства нитратных удобрений. В результате процесса нитрификации в почве образуется азотная кислота и освобождается серная кислота.
В почве эти кислоты нейтрализуются, вступая во взаимодействие с бикарбонатами почвенного раствора и катионами почвенного поглощающего комплекса.
Нейтрализация минеральных кислот сопровождается использованием бикарбонатов почвенного раствора и вытеснением оснований из ППК водородом. Это ослабляет буферную способность почв и повышает их кислотность.
Однократное внесение сульфата аммония может и не повлиять на реакцию почвы. При систематическом использовании данного удобрения почвенная среда может значительно подкислиться. Степень подкисления увеличивается при меньшей буферной способности почв. [9]
Сульфата аммония — основные преимущества
Минеральное удобрение сульфат аммония (аммоний сернокислый) содержит 21 % азота в аммонийной форме, 24% серы и является высокоэффективным азотно-серным удобрением.
По внешнему виду сульфат аммония — это кристаллический порошок белого или слабоокрашенного цвета, допускаются светло-желтый и розовый оттенок.
Рекомендуется и используется для азотно-серного питания всех типов сельскохозяйственных культур в основном удобрении и при подкормках.
При внесении сульфат аммония хорошо растворяется в воде, доступен и легко усваивается растениями, относительно мало подвижен и не вымывается из почв в условиях нормального увлажнения и при орошении.
По эффективности применения не уступает аммиачной селитре и карбамиду, а в части физико-химических свойств (негорючий, взрывобезопасный, неслеживается при долгом хранении) и своей стоимости выгодно отличается и обладает явным преимуществом.
Физико-химический состав сульфата аммония
| Наименование показателей | Норма |
| Массовая доля азота в пересчете на сухое вещество, % | 21 |
| Массовая доля воды, % | 0,3 |
| Массовая доля свободной серной кислоты, % | 0,05 |
| Сыпучесть, % | 100 |
Накопленный международный опыт, глубокий анализ научно-исследовательской работы и производственной практики применения удобрений позволяют говорить о дополнительных скрытых резервах повышения качества зерновых. По данным ряда российских и зарубежных ученых, у зерновых культур часто проявляются признаки дефицита серы, которые в производственных условиях трактуются как дефицит азота. В опытах с ячменем и пшеницей сильный недостаток серы в течение периода вегетации вызывал снижение фотосинтеза, продуктивности и особенно качества зерна.
Важнейшая роль серы в жизнедеятельности растений определяется тем, что она является составной частью всех белков и содержится в незаменимых аминокислотах (цистин, метионин), а также в растительных маслах и витаминах. Она имеет большое значение в окислительно-восстановительных процессах, происходящих в растениях, в активировании энзимов и белковом обмене.
Окисленная форма серы — исходный продукт для синтеза белков. При ее недостатке синтез белков задерживается, так как затрудняется синтез аминокислот, содержащих этот элемент. В связи с этим проявление признаков недостаточности серы сходно с признаками азотного голодания. Растения приостанавливаются в развитии, уменьшается размер листьев, удлиняются стебли. При серном голодании листья не отмирают, но имеют бледную окраску. Изучение дефицита серы в питании растений показало, что ее недостаточность вызывает нарушение азотного обмена.
Одним из традиционных источников пополнения серы является удобрение сульфат аммония N-21%, S-24%.
Основные преимущества сульфата аммония перед селитрой аммиачной и карбамидом
Сульфат аммония всегда дешевле — Экономика и цифры неумолимы, поэтому экономичность и доступность удобрений в значительной мере определяется стоимостью единицы действующего вещества. Стоимость 1 тонны азота в сульфате аммония примерно в 2 раза ниже, чем в аммиачной селитре и карбамиде. При оценке экономической эффективности необходимо, конечно же, учитывать и наличие серы 24%.
Сера оказывает непосредственное влияние на качество будущего урожая — Сульфат аммония в отличие от аммиачной селитры и карбамида содержит серу. Стоит заметить, что сера занимает одно из ведущих мест среди биогенных элементов после азота, фосфора и калия. Положительное влияние серы на урожай часто остается незамеченным, поскольку она воздействует не на величину, а на качество продукции.
Кроме того, внешнее проявление серного голодания растений почти полностью совпадает с признаками недостаточного азотного питания. В условиях недостатка в почве серы, снижается синтез белков, жиров, витаминов, а азот, что очень опасно, накапливается в виде нитратов. Помимо всего ухудшается хранение продуктов. В последние годы наблюдается тенденция снижения содержания серы в пахотных почвах во многих регионах России, около 80% пашни бедны серой. Таким образом, сульфат аммония можно считать удобрением с содержанием питательных веществ 45%.
Меньшие потери азота и забота об экологии — Известно, что при использовании азотных удобрений в сельском хозяйстве, особенно при несбалансированном соотношении питательных элементов, возникают экологические проблемы. К основным из них следует отнести: занитрачивание продукции, загрязнение подземных и поверхностных вод, потери азота до 20-30% из нитратных удобрений и карбамида, вследствие денитрификации и вымывания. Потери азота из нитратных удобрений значительно больше, чем из аммиачных. Если при поверхностном внесении сульфата аммония потери аммиака составляют, как правило, не более 1-3%, то у карбамида и аммиачной селитры 25-30% от внесенного количества азота. Важно также то, что этот элемент питания в сульфате аммония находится в наиболее доступной форме для растений и участвует в формировании урожая на протяжении всего вегетационного периода.
Утилизация соломы и использование ее для удобрения — Один из эффективных способов применения сульфата аммония — это внесение его с подгнивными остатками (измельченной соломой). При этом доза азота составляет 10 кг. д.в. на 1 тонну соломы, что обеспечивает ускоренное разложение клетчатки. Таким образом, одновременно решаются две важные проблемы — утилизация соломы и охрана окружающей среды.
При урожае зерновых 20-30 ц/га внесение сульфата аммония совместно с пожнивными остатками в почву будет обеспечивать возвращение 30-40 кг. азота, 50-80 кг. фосфора, 18-24 кг. калия, а также 35-45 кг. серы, способствующей значительному повышению белка в продукции.
Минеральное азотно-серное удобрение сульфат аммония представляет собой светлую кристаллическую соль и с оттенками желтого либо розового цвета, хорошо растворимую в воде. Продукт характеризуется слабой гигроскопичностью, поэтому не слеживается при длительном хранении и может храниться до 5 лет, не взрывоопасен.
Все эти свойства выгодно отличают его от других азотных удобрений, в частности от аммиачной селитры и карбамида.
Эффективность применения сульфата аммония при дефиците серы — Недостаток или избыток серы в первую очередь проявляется на молодых листьях и точках роста. Обратное передвижение её очень незначительно и поэтому она относится к трудно реутилизируемым элементам. В этом сера очень сильно отличается от фосфора. Недостаток серы у большинства растений имеет сходство с признаками недостатка азота, но при серном голодании он проявляется на молодых листьях — листья мелкие, стебли жесткие, рост растений ослабленный, окраска листьев равномерно бледно-зелёная. В сельскохозяйственной практике это часто приводит к ошибкам в диагнозе, завышению доз азотных удобрений, недобору урожаев и снижению качества продукции. Установлено, что растения содержат неодинаковое количество серы и соответственно испытывают разную потребность в этом элементе. Различие в содержании и потреблении серы сельскохозяйственными культурами обусловлены, прежде всего, биологическими особенностями растений, стадиями их развития, а также содержанием этого элемента в почве и атмосфере. По выносу серы на единицу сухого вещества ботанические семейства располагаются в следующий ряд: крестоцветные > лилейные > бобовые > маревые > злаковые, подсолнечник, картофель, овощные. Вынос серы из почв урожаями колеблется в пределах 30-60 кг/га, а у отдельных видов растений достигает 100 кг/га. Таким образом, как показали наши исследования, её баланс достаточно напряжён, а в ряде регионов даже отрицателен.
Исследованиями также достаточно четко установлено, что применение серосодержащих удобрений на почвах с недостаточным содержанием серы способствует повышению урожая и улучшению качества растительной продукции, увеличению доступности растениям фосфора, кальция, марганца; повышает окупаемость урожаями традиционных NPK удобрений.
Таким образом, накопленная информация свидетельствует о том, что сера как биогенный элемент в современных агроценозах имеет важное значение, но регуляцией её режима в производственной практике уделялось и уделяется недостаточное внимание. Именно об этом свидетельствуют материалы мониторинга состояния плодородия почв страны, учёт и востребование которых при разработке современных технологий выращивания сельскохозяйственных культур нам представляется необходимым и достаточно перспективным в повышении продуктивности земледелия.
Обобщение данных по содержанию подвижной серы в почвах страны на 01.01.2004 г. показало, что дефицит серы в земледелии страны продолжает увеличиваться. Из обследованных значительно больших площадей пахотных земель (>32%), чем на 01.01.1990 г., 54,7% имеют низкое содержание серы ( 12 мг/кг), т.е. площади почв, нуждающихся в пополнении запасов серы достигли к 2004 г 89,3%, против 77,4% в 1990 г. Особенно велика доля таких пахотных почв в Центральном округе (89,6%), Северо-Западном округе (94,5%), Южном округе (90%), Приволжском округе (90%). В остальных округах (Сибирском и Дальневосточном) этот показатель также достаточно велик (86,7 и 83,8%), хотя он несколько ниже, чем в целом по стране. В Центральном округе особенно выделяется Костромская и Тамбовская области, в которых количество почв, нуждающихся в пополнении запасов серы близко к 100% (соответственно, 97,4 и 99,2%); в Северо-Западном округе аналогичное положение в Новгородской (97,9%), в Южном округе — республика Калмыкия (99,2%) и в Волгоградская область (96,9%); в Поволжском округе — республика Татарстан (92%), Саратовская область (91,1%); в Сибирском округе — Алтайский край (94,6%). В других областях, краях и республиках эти показатели, хотя заметно меньше, но в целом свидетельствуют о неблагополучном практическом решении проблем серы в земледелии.
Средневзвешенный показатель содержания серы в целом по стране приблизился к границе абсолютно низкого его содержания и составляет всего 6,4 мг/кг, а в Северо-Западном и Южном округах понизился до 5,1 и 5,9 мг/кг. Особенно бедны серой почвы Костромской области (5,4 мг/кг), Смоленской (5,1 мг/кг), Тамбовской (3,1 мг/кг), Вологодской (5,1 мг/кг), Архангельской (4,7 мг/кг), Новгородской (4,1 мг/кг), Ульяновской (5,7 мг/кг); в республиках Карелия (4,5 мг/кг), Коми (4,4 мг/кг), Калмыкия (1,1 мг/кг), Хакасия (4,5 мг/кг) и Алтайского края (5,5 мг/кг).
Таким образом, сейчас проблема серы в земледелии стоит настолько остро, что её просто нельзя замалчивать и надо принимать конкретные меры по её решению.
По расчётам специалистов общая потребность в серосодержащих удобрениях страны на 2010 г. составит порядка 1,2 млн. т. д.в. В ассортименте серосодержащих удобрений предпочтение имеют сульфаты аммония, калия, натрия и суперфосфаты.
По данным большинства исследований на низкообеспеченных серой почвах все формы серосодержащих удобрений действуют практически равнозначно. Среди хорошо растворимых форм серосодержащих удобрений экономически наиболее перспективно применение сульфата аммония (стоимость 1 тонны азота в сульфате аммония примерно в 2 раза ниже, чем в аммиачной селитре и карбамиде).
Исследованиями белорусских учёных на дерново-подзолистых почвах показана более высокая агрономическая и экономическая эффективность применения сульфата аммония относительно других форм азотных удобрений. (В.В. Лапа, В.Н. Босак, 2006 г.)
| Азотные удобрения | Яровая пшеница сорт Иволга | Сахарная свекла сорт Кристалл | Гречиха сорт Илия |
| Аммиачная селитра | 24,9 | 71 | — |
| Сульфат аммония | 25,4 | 80 | 5,7-7,2 |
| Карбамид | 25,1 | 69 | 4,6-5,4 |
| КАС | 24,8 | 70 | — |
Примечание:
1) Под яровую пшеницу на фоне Р40К90 вносились различные формы азотных удобрений в дозе N60;
2) Под сахарную свёклу на фоне навоза 60 т/га + Р60К100 — в дозе N120;
3) Под гречиху на фоне Р40К90 в дозе N60-80;
4) С сульфатом аммония в почвах под культуры поступило серы (соответственно 1,2,3) – 70, 140 и 70-90 кг/га.
Особо следует отметить, что применение сульфата аммония под сельскохозяйственные культуры в необходимых дозах по азоту, оптимизирует не только азотное, но и серное питание растений, а также благоприятствует обеспечению положительного баланса этого элемента для последующих культур. Поэтому сульфат аммония следует рассматривать практически как комплексное удобрение (NS) с соотношением элементов равным (S:N =1,14).
Таким образом, сера в современных агроценозах находится в достаточно динамичном состоянии. Регуляция её содержания в почвах и растениях должна иметь не стихийные, а экономические, агрохимические и экологические управляемые формы. Анализ факторов недостаточной эффективности средств химизации показывает, что раннее при разработке системы применения удобрений вопросы питания растений серой не были столь острыми, т.к. в составе более широко используемых удобрений (сульфат аммония и калия, простой суперфосфат) содержалось большое количество серы.
С переходом на преимущественное применение концентрированных сложных удобрений, приток серы в почву с минеральными удобрениями резко сокращается. Вместе с этим увеличивается расход серы из почвы на вымывание и вынос её с возрастающими урожаями сельскохозяйственных культур. Следовательно, в определённых условиях растения могут испытывать серную недостаточность, в результате которой возможен недобор урожая культур и снижение качества продукции. При этом серное голодание влечёт за собой снижение нарастания сухой массы, замедление темпов наступления фаз онтогенеза, отставание созревания культур. Недостаток серы особенно сказывается на образовании репродуктивных органов и в снижении качественных показателей продукции. Из вышеизложенного следует, что в настоящее время при интенсификации земледелия актуальность оптимизации серного питания растений не снижается, а наоборот, увеличивается.










