сульфат меди какая среда
Гидролиз сульфата меди (II)
Общие понятия о гидролизе сульфата меди (II)
Если же вода присутствует (имеет тривиальное название медный купорос), то кристаллы синего цвета. Формула CuSO4.
Рис. 1. Сульфат меди (II). Внешний вид.
Гидролиз сульфата меди (II)
Сульфат меди (II) – соль, образованная сильной кислотой – серной (H2SO4) и слабым основанием – гидроксидом меди (II) (Сu(OH)2). Гидролизуется по катиону. Характер среды – кислый. Теоретически возможна вторая ступень.
Cu 2+ + SO4 2- + HOH ↔ CuOH + + SO4 2- + H + ;
CuOH + + SO4 2 + HOH ↔ Cu(OH)2 + SO4 2 + HOH.
Примеры решения задач
| Задание | К раствору сульфата меди (II) массой 25 г добавили железную стружку (3,1 г). Определите, какая масса меди образовалась в ходе реакции. |
| Решение | Запишем уравнение реакции: |
Рассчитаем количества веществ, вступивших в реакцию. Молярные массы, которых равны 160 и 56 г/моль, соответственно для сульфата меди (II) и железа:
υ(Fe)= m (Fe)/M(Fe) = 3,1/56 = 0,05моль.
Сравним полученные значения:
Расчет ведем по веществу, которое находится в недостатке. Это железо. Согласно уравнению реакции υ(Fe)=υ(Cu)= 0,05 моль. Тогда масса меди будет равна (молярная масса – 64 г/моль):
m(Cu)= υ(Cu)× M(Cu)= 0,05×64 =3,2г.
| Задание | Какая концентрация раствора сульфата меди (II) будет, если к 180 г 30% — го раствора этой соли добавить ещё 10 г того же вещества? |
| Решение | Найдем массу растворенного вещества сульфата меди (II) в 30%-м растворе: |
msolute (CuSO4) = ω/100% × msolution (СuSO4) = 30/100 × 180 =54 г.
Найдем общую массу растворенного вещества сульфата меди (II) в новом растворе:
Рассчитаем массу нового раствора:
Определим массовую концентрацию нового раствора:
Медный купорос ГОСТ 19347-99
| Медный купорос | |
|---|---|
| Систематическое наименование | медный купорос |
| Традиционные названия | пентагидрат: сульфат меди (II), медь сернокислая техническая |
| Хим. формула | CuSO 4 |
| Состояние | кристаллическое |
| Молярная масса | 159,609 (сульфат) 249.685 (пентагидрат) г/моль |
| Плотность | 3,64 г/см³ |
| Твёрдость | 2,5 |
| Т. разл. | выше 650 °C |
| pKa | 5⋅10 −3 |
| Координационная геометрия | Октаэдрическая |
| Кристаллическая структура | безв. — ромбическая пентагидрат — триклинная пинакоидальная тригидрат — моноклинная |
| ГОСТ | ГОСТ 19347-99 |
| Рег. номер CAS | 7758-98-7 |
| PubChem | 24462 |
| Рег. номер EINECS | 231-847-6 |
| SMILES | |
| Кодекс Алиментариус | E519 |
| RTECS | GL8800000 |
| ChEBI | 23414 |
| ChemSpider | 22870 |
| ПДК | в воздухе: мр 0,009, сс 0,004; в воде: 0,001 |
| ЛД50 | крысы, орально: 612,9 мг/кг мыши, орально: 87 мг/кг |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Медный купорос (медь сернокислая, сульфат меди (II) ) — неорганическое соединение, медная соль серной кислоты с формулой CuSO 4. Нелетучее вещество, не имеет запаха. В безводном виде — белый порошок, очень гигроскопичное. В виде кристаллогидратов — прозрачные негигроскопичные кристаллы различных оттенков синего с горьковато-металлическим вяжущим вкусом, на воздухе постепенно выветриваются (теряют кристаллизационную воду).
Сульфат меди(II) хорошо растворим в воде. Из водных растворов кристаллизуется голубой пентагидрат CuSO4·5H2O — медный купорос. Токсичность медного купороса для теплокровных животных относительно невысока, в то же время, он высокотоксичен для рыб.
Обладает дезинфицирующими, антисептическими, вяжущими свойствами. Применяется в медицине, в растениеводстве как антисептик, фунгицид или медно-серное удобрение.
Реакция гидратации безводного сульфата меди (II) экзотермическая и проходит со значительным выделением тепла.
Содержание
Нахождение в природе
В природе встречается в виде минералов халькантита (CuSO4·5H2O), халькокианита (CuSO4), бонаттита (CuSO4·3H2O), бутита (CuSO4·7H2O) и в составе некоторых других минералов.
Получение
В промышленности
В промышленности загрязненный сульфат меди(II) получают растворением меди и медных отходов в разбавленной серной кислоте H2SO4 при продувании воздуха:
растворением оксида меди(II) CuO в H2SO4:
сульфатизирующим обжигом сульфидов меди и как побочный продукт электролитического рафинирования меди.
В лабораторных условиях
В лаборатории CuSO4 можно получить действием концентрированной серной кислоты на медь при нагревании:
температура не должна превышать 60 °С, при большей температуре в значительных количествах образуется побочный продукт — сульфид меди(I):
Также в лабораторных условиях сульфат меди (II) может быть получен реакцией нейтрализации гидроксида меди(II) серной кислотой, для получения сульфата меди высокой чистоты используют соответственно чистые реактивы:
Чистый сульфат меди может быть получен следующим образом. В фарфоровую чашку наливают 120 мл дистиллированной воды, прибавляют 46 мл химически чистой серной кислоты плотностью 1,8 г/см 3 и помещают в смесь 40 г чистой меди (например, электролитической). Затем нагревают до 70—80 °С и при этой температуре в течение часа постепенно, порциями по 1 мл, прибавляют 11 мл конц. азотной кислоты. Если медь покроется кристаллами, прибавить 10—20 мл воды. Когда реакция закончится (прекратится выделение пузырьков газа), остатки меди вынимают, а раствор упаривают до появления на поверхности пленки кристаллов и дают остыть. Выпавшие кристаллы следует 2—3 перекристаллизовать из дистиллированной воды и высушить.
Очистка
Очистить загрязненный или технический сульфат меди можно перекристаллизацией — вещество растворяется в кипящей дистиллированной воде до насыщения раствора, после чего охлаждается до приблизительно +5 °С. Полученный осадок кристаллов отфильтровывается. Однако даже многократная перекристаллизация не позволяет избавиться от примеси соединений железа, которые являются наиболее распространенной примесью в сульфате меди.
Для полной очистки медный купорос кипятят с диоксидом свинца PbO2 или пероксидом бария BaO2, пока отфильтрованная проба раствора не покажет отсутствия железа. Затем раствор фильтруют и упаривают до появления на поверхности пленки кристаллов, после чего охлаждают для кристаллизации.
По Н. Шоорлю очистить сульфат меди можно так: к горячему раствору CuSO4 прибавить небольшие количества пероксида водорода H2O2 и гидроксида натрия NaOH, прокипятить и отфильтровать осадок. Выпавшие из фильтрата кристаллы дважды подвергаются перекристаллизации. Полученное вещество имеет чистоту не ниже квалификации «ХЧ».
Глубокая очистка
Для этого готовится водный, насыщенный при 20°С раствор сульфата меди (вода используются только бидистиллированная). В него добавляют перекись водорода в количестве 2-3 мл 30 % раствора на 1 литр, перемешивают, вносят свежеосаждённый основной карбонат меди в количестве 3-5 грамм, нагревают и кипятят 10 минут для разложения H2O2.
Затем раствор охлаждают до 30—35 °С, фильтруют и приливают 15 мл 3%-ного раствора диэтилдитиокарбамата натрия и выдерживают в мешалке три-четыре часа не понижая температуры. Далее раствор быстро процеживают от крупных хлопьев комплексов и вносят активированный уголь БАУ-А на полчаса при перемешивании. Затем раствор следует отфильтровать вакуумным методом.
Дальше в раствор CuSO4 приливают на 1 л около 200 мл насыщенного раствора NaCl квалификации «Ч» и вносят чистый алюминий в проволоке или обрезках до полного прохождения реакции, выделения меди и просветления раствора (при этом выделяется водород). Выделенную медь отделяют от алюминия взбалтыванием, осадок промывают декантацией сперва водой затем заливают горячим 5—10 % раствором соляной кислоты ХЧ при взбалтывании в течение часа и постоянным подогревом до 70—80 °С, затем промывают водой и заливают 10—15%-ной серной кислотой (ОСЧ 20-4) на час с подогревом при том же интервале температур. От степени и тщательности промывания кислотами, а также квалификации применяемых далее реактивов зависит чистота дальнейших продуктов.
После промывки кислотами медь снова моют водой и растворяют в 15—20%-ной серной кислоте (ОСЧ 20-4) без её большого избытка с добавлением перекиси водорода (ОСЧ 15-3). После прохождения реакции полученный кислый раствор сульфата меди кипятят для разложения избытка перекиси и нейтрализуют до полного растворения вначале выпавшего осадка перегнанным 25%-ным раствором аммиака (ОСЧ 25-5) или приливают раствор карбоната аммония, очищенного комплексно-адсорбционным методом до особо чистого.
После выстаивания в течение суток раствор медленно фильтруют. В фильтрат добавляют серную кислоту (ОСЧ) до полного выпадения голубовато-зелёного осадка и выдерживают до укрупнения и перехода в зелёный основной сульфат меди. Зелёный осадок выстаивают до компактности и тщательно промывают водой до полного удаления растворимых примесей. Затем осадок растворяют в серной кислоте, фильтруют, устанавливают рН=2,5—3,0 и перекристаллизовывают два раза при быстром охлаждении, причем при охлаждении раствор каждый раз перемешивают для получения более мелких кристаллов сульфата меди. Выпавшие кристаллы переносят на воронку Бюхнера и удаляют остатки маточного раствора с помощью водоструйного насоса. Третья кристаллизация проводится без подкисления раствора с получением чуть более крупных и оформленных кристаллов.
Физические свойства
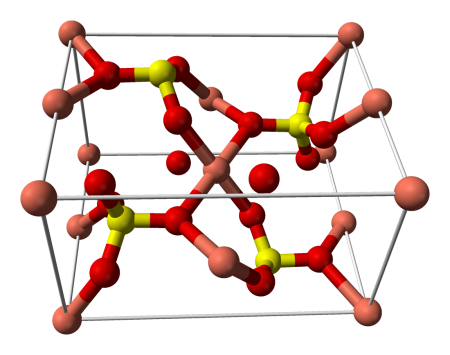
Строение кристаллогидрата
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO4 2− по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.
Термическое воздействие
При нагревании пентагидрат последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4·3H2O (этот процесс, выветривание, медленно идёт и при более низких температурах [в том числе при 20—25 °С]), затем в моногидрат (при 110 °С) CuSO4·H2O, и выше 258 °C образуется безводная соль.
Выше 650 °C становится интенсивным пиролиз безводного сульфата по реакции:
Растворимость
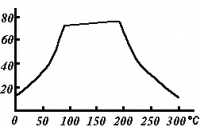
Растворимость сульфата меди (II) по мере роста температуры проходит через плоский максимум, в течение которого растворимость соли почти не меняется (в интервале 80—200 °C). (см. рис.)
Химические свойства
Электролитическая диссоциация
CuSO4 — хорошо растворимая в воде соль и сильный электролит, в растворах сульфат меди(II) так же, как и все растворимые соли, диссоциирует в одну стадию:
Реакция замещения
Реакция замещения возможна в водных растворах сульфата меди с использованием металлов активнее меди, стоящих левее меди в электрохимическом ряду напряжения металлов:
Реакция с растворимыми основаниями (щелочами)
Сульфат меди(II) реагирует с щелочами с образованием осадка гидроксида меди(II) голубого цвета:
Сокращённое ионное уравнение (Правило Бертолле)
Реакция обмена с другими солями
Сульфат меди вступает также в обменные реакции по ионам Cu 2+ и SO4 2-
Прочее
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na2[Cu(SO4)2]·6H2O.
Сульфат меди и медный купорос, характеристика, свойства и химические реакции
Сульфат меди и медный купорос, характеристика, свойства и химические реакции.
Сульфат меди – неорганическое вещество, имеет химическую формулу CuSO4.
Краткая характеристика сульфата меди:
Сульфат меди – неорганическое вещество белого цвета.
Химическая формула сульфата меди CuSO4.
Сульфат меди – неорганическое химическое соединение, соль серной кислоты и меди.
С водой сульфат меди образует кристаллогидраты: пентагидрат сульфата меди CuSO4·5H2O, именуемый также медный купорос, тетрагидрат сульфата меди CuSO4·4H2O, тригидрат сульфата меди CuSO4·3H2O, гидрат сульфата меди CuSO4·H2O.
Растворим также в глицерине, метаноле, этиленгликоле. Не растворим в ацетоне, этаноле.
Сульфат меди негорюч, пожаро- и взрывобезопасен.
Сульфат меди является пищевой добавкой Е519.
В природе сульфат меди встречается в виде минералов халькантита (CuSO4·5H2O), халькокианита (CuSO4), бонаттита (CuSO4·3H2O), бутита (CuSO4·7H2O) и в составе некоторых других минералов.
Краткая характеристика медного купороса:
Медный купорос – неорганическое вещество синего цвета различных оттенков.
Химическая формула медного купороса CuSO4·5H2O.
Медный купорос – пентагидрат сульфата меди.
Хорошо растворяется в воде. Растворим также в глицерине, метаноле, этаноле, этиленгликоле.
На воздухе постепенно выветривается (теряет кристаллизационную воду).
Медный купорос негорюч, пожаро- и взрывобезопасен.
Медный купорос относится к веществам 2-го класса опасности в соответствии с ГОСТ 12.1.007.
Физические свойства сульфата меди:
| Наименование параметра: | Значение: |
| Химическая формула | CuSO4 |
| Синонимы и названия иностранном языке | copper(II) sulphate (сopper(II) sulfate (англ.) |
халькокианит (рус.)
Физические свойства медного купороса:
| Наименование параметра: | Значение: |
| Химическая формула | CuSO4·5H2O |
| Синонимы и названия иностранном языке | sodium sulfate (англ.) |
copper(II) sulfate pentahydrate (англ.)
меди(II) сульфат пентагидрат (рус.)
медный купорос (рус.)
медь сернокислая пятиводная (рус.)
халькантит (рус.)
Химические свойства сульфата меди. Химические реакции сульфата меди и кристаллогидратов меди:
1. реакция сульфата меди и железа :
2. реакция сульфата меди и цинка :
В результате реакции образуются сульфат цинка и медь.
3. реакция сульфата меди и олова :
В результате реакции образуются сульфат олова и медь.
4. реакция взаимодействия сульфата меди, меди и хлорида натрия:
CuSO4 + Cu + 2NaCl → 2CuCl + Na2SO4 (t = 70 °C).
В результате реакции образуются хлорид меди и сульфат натрия.
5. реакция взаимодействия сульфата меди и аммиака :
В результате реакции образуется сульфат тетраамминмеди (II).
6. реакция взаимодействия сульфата меди и гидроксида натрия:
7. реакция взаимодействия сульфата меди и гидроксида калия:
В результате реакции образуются сульфат калия и гидроксид меди.
8. реакция взаимодействия сульфата меди и гидроксида лития:
В результате реакции образуются сульфат лития и гидроксид меди.
9. реакция взаимодействия сульфата меди и гидроксида кальция:
В результате реакции образуются сульфат кальция и гидроксид меди.
10. реакция взаимодействия сульфата меди и сульфида калия:
В результате реакции образуются сульфат калия и сульфид меди.
11. реакция взаимодействия сульфата меди и хлорида бария:
В результате реакции образуются сульфат бария и хлорид меди.
12. реакция взаимодействия сульфата меди и сульфита натрия:
В результате реакции образуются сульфат натрия и сульфит меди.
13. реакция взаимодействия сульфата меди и сульфата железа (II) :
В результате реакции образуются медь и сульфат железа (III). В ходе реакции используется концентрированный раствор сульфата железа (II).
14. реакция термического разложения сульфата меди:
15. реакция термического разложения кристаллогидратов сульфата меди:
Пентагидрат сульфата меди CuSO4·5H2O разлагается на тетрагидрат сульфата меди CuSO4·4H2O и воду.
Тетрагидрат сульфата меди CuSO4·4H2O разлагается на гидрат сульфата меди CuSO4·H2O и воду.
Гидрат сульфата меди CuSO4·H2O разлагается на сульфат меди CuSO4 и воду.
Применение и использование сульфата меди и медного купороса:
Сульфат меди и медный купорос используется во множестве отраслей промышленности и для бытовых нужд:
– в химической промышленности как исходное сырьё для получения других соединений меди ;
– в сельском хозяйстве медный купорос применяется как антисептик, фунгицид и медно-серное удобрение ;
– в пищевой промышленности в качестве пищевой добавки 519 как фиксатор окраски и консервант;
– в быту для выведения пятен ржавчины на потолке после затоплений.
Примечание: © Фото //www.pexels.com, //pixabay.com
сульфат меди реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие сульфата меди
реакции