сульфат меди какой электролит
Сульфат меди(II)
| Сульфат меди(II) | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Меди(II) сульфат |
| Традиционные названия | Медный купорос |
| Химическая формула | CuSO4 |
| Физические свойства | |
| Молярная масса | 159,61 г/моль |
| Плотность | 3,60 г/см³ |
| Термические свойства | |
| Химические свойства | |
| pKa | 5·10 −3 |
| Растворимость в воде | 31,6 г/100 мл |
| Структура | |
| Координационная геометрия | Октаэдрическая |
| Кристаллическая структура | Триклинная |
| Классификация | |
| Рег. номер CAS | 7758-98-7 |
| RTECS | GL8800000 |
Сульфат меди(II) (CuSO4) — медная соль серной кислоты, белые кристаллы, хорошо растворимые в воде. Однако из водных растворов, а также на воздухе хотя бы с незначительным содержанием влаги кристаллизуется голубой пентагидрат CuSO4 · 5H2O — медный купорос.
Содержание
Получение
В промышленности получают растворением Cu и медных отходов в разб. H2SO4 при продувании воздуха; растворением CuO в H2SO4; сульфатизирующим обжигом сульфидов Cu; как побочный продукт электролитич. рафинирования Cu.

В лаборатории можно получить действием концентрированной серной кислотой на медь при нагревании:
Температура не должна превышать 60 градусов Цельсия, так как образуется побочный продукт:
Также в лабораторных условиях сульфат меди (II) может быть получен реакцией нейтрализации гидроксида меди (II) серной кислотой:
Очистка
Физические свойства
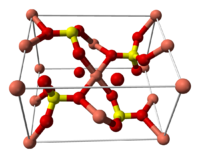
Строение кристаллогидрата
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO4 2− по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.
Термическое воздействие
При нагревании последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4 · 3H2O (этот процесс, то есть выветривание, частично идёт и просто на воздухе), затем в моногидрат (110°) CuSO4 · H2O, и выше 258 °C образуется безводная соль. Термическое разложение становится заметным выше 650 °C:
Растворимость
Растворимость сульфата меди(II) по мере роста температуры проходит через плоский максимум, в течение которого растворимость соли почти не меняется (в интервале 80-200 °C). (см. рис.)
Химические свойства
Диссоциация
CuSO4 — хорошо растворимая в воде соль и сильный электролит, в растворах cульфат меди (II) так же, как и все растворимые соли, диссоциирует в одну стадию:
Реакция замещения
Реакция замещения возможна в водных растворах сульфата меди с использованием металлов активнее меди, стоящих левее меди в электрохимическом ряду напряжения металлов.
Реакция с растворимыми основаниями (щелочами)
Сульфат меди(II) реагирует с щелочами с образованием осадка гидроксида меди(II) голубого цвета:

Реакция обмена с другими солями
Сульфат меди вступает также в обменные реакции по ионам Cu 2+ и SO4 2-

Прочее
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na2[Cu(SO4)2]·6H2O.
Ион Cu 2+ окрашивает пламя в зеленый цвет.
Применение
Сульфат меди(II) — наиболее важная соль меди — часто служит исходным сырьём для получения других соединений. Например, гидроксида меди (II) — Cu(OH)2 — вещества, необходимого для качественных реакций на глюкозу, глицерин.
Безводный сульфат меди можно использовать как индикатор влажности, с его помощью в лаборатории проводят обезвоживание этанола и некоторых других веществ.
Наибольшее количество непосредственно применяемого CuSO4 расходуется на борьбу с вредителями в сельском хозяйстве, в составе бордоской смеси с известковым молоком — от грибковых заболеваний и виноградной тли. Для этих целей сульфат меди (II) имеется в розничной торговле.
В строительстве водный раствор сульфата меди применяется для нейтрализации последствий протечек, ликвидации пятен ржавчины, а также для удаления выделений солей («высолов») с кирпичных, бетонных и оштукатуренных поверхностей; а также как антисептическое и фунгицидное средство для предотвращения гниения древесины.
Также он применяется для изготовления минеральных красок, в медицине, как один из компонентов электролитических ванн для меднения и т. п. и как часть прядильных растворов в производстве ацетатного волокна.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E519. Используется как фиксатор окраски и консервант.
В пунктах скупки лома цветных металлов раствор медного купороса применяется для выявления цинка, марганца и магния в алюминиевых сплавах и нержавейке. При выявлении этих металлов появляются красные пятна.
Токсикология
Токсикологические данные
Первая помощь при отравлении
При попадании вещества на кожу необходимо снять его ватой или куском ткани, затем обмыть прохладной водой с мылом. При попадании в глаза необходимо обильно промыть их проточной водой. При попадании через дыхательные пути нужно вывести пострадавшего на свежий воздух, прополоскать рот водой. При попадании в желудочно-кишечный тракт необходимо промыть желудок пострадавшего 0,1%-ым раствором марганцовки, дать выпить пострадавшему солевое слабительное — сульфат магния 1-2 ложки, вызвать рвоту, дать мочегонное.
Безопасность
Хранить в сухом прохладном месте при температуре от −30 до +30 °C, отдельно от лекарств, пищевых продуктов и кормов для животных, в недоступном для детей и животных месте. Запрещается хранение вещества в поврежденной упаковке.
Производители и поставщики
Сульфат меди (II), как средство от гниения, сорняков и т. д. находится в розничной продаже в супермаркетах и хозяйственных магазинах. Чаще всего на прилавках можно найти упаковку весом в 100 граммов. Производство данной продукции осуществляется компанией ЗАО Фирма «Август». Также медный купорос можно найти в химических магазинах разной фасовки. Обычно это пластиковые банки весом в 1 кг или полиэтиленовые мешки весом в 500 г.
Нахождение в природе
В природе изредка встречается минерал халькантит, состав которого близок к CuSO4 ∙ 5H2O
Сульфат меди(II)
Из Википедии — свободной энциклопедии
наименование

пентагидрат — триклинная пинакоидальная
тригидрат — моноклинная
крысы, орально [2] [3] : 300 мг/кг
мыши, орально: 87 мг/кг



Сульфа́т ме́ди(II) (медь (II) серноки́слая, традиционное название кристаллогидрата — ме́дный купоро́с) — неорганическое соединение, медная соль серной кислоты с формулой CuSO4.
Нелетучее вещество, не имеет запаха. В безводном виде — белый порошок, очень гигроскопичное. В виде кристаллогидратов — прозрачные негигроскопичные кристаллы различных оттенков синего. На воздухе постепенно выветриваются (теряют кристаллизационную воду). Имеет горьковато-металлический вяжущий вкус.
Сульфат меди(II) хорошо растворим в воде. Из водных растворов кристаллизуется в виде голубого пентагидрат CuSO4·5H2O — медный купоро́с. Токсичность медного купороса для теплокровных животных относительно невысока, в то же время, он высокотоксичен для рыб.
Обладает дезинфицирующими, антисептическими, вяжущими свойствами. Применяется в медицине, в растениеводстве как антисептик, фунгицид или медно-серное удобрение.
Реакция гидратации безводного сульфата меди(II) экзотермическая и проходит со значительным выделением тепла (79 кДж/моль).
Электролит для гальваники
Приготовление электролита для осаждения меди
Сернокислые электролиты для меднения делятся на кислые и медные. Кислые это те, в которых кислоты по рецепту больше чем медного купороса. Медные наоборот, кислоты меньше чем медного купороса. Пропорции кислоты и медного купороса выбираются в зависимости от используемого блеска.
Кислые сернокислые электролиты
К кислым относятся добавки Cupracid-TP и J-Plate Cu-400, рецепты электролитов для них описаны ниже.
Рецепты кислых растворов
1. J-Plate Cu-400
Плотность тока 0,1-8 А/дм.кв, оптимальное 2-3 А/дм.кв.
Температура 20-30 градусов, скорость осаждения при плотности тока 3 А/дм.кв. равна 0,66 мкм/мин.
2. Cupracid TP
Плотность тока 1,4-3,5 А/дм.кв, оптимальное 2 А/дм.кв.
Температура 20-26 градусов, скорость осаждения при плотности тока 2 А/дм.кв. равна 0.6 мкм/мин.
Медные сернокислые электролиты
К медным относятся добавки Chemeta RV-T, ЦКН-74, Cupracid 210, составы электролитов для них описаны ниже.
Рецепты медных растворов
1. Chemeta RV-T
Плотность тока 2-8 А/дм.кв, оптимальное 4,5 А/дм.кв.
Температура 20-28 градусов, скорость осаждения при плотности тока 4,5 А/дм.кв. равна 1 мкм/мин.
2. ЦКН-74
Плотность тока 1-4 А/дм.кв, оптимальное 3 А/дм.кв.
Температура 18-28 градусов, скорость осаждения при плотности тока 3 А/дм.кв. равна 0,6 мкм/мин.
3. Cupracid 210
Плотность тока 1-6 А/дм.кв, оптимальное 3 А/дм.кв.
Температура 20-30 градусов, скорость осаждения при плотности тока 3 А/дм.кв. равна 0,7 мкм/мин.
Приготовление электролита меднения с добавкой J-PLATE CU-400
Далее для примера посмотрим приготовление самодельного электролита с добавкой J-PLATE CU-400 на 10 литров.
J-Plate Cu-400 рецепт на 1 литр.
Пересчитаем количество реактивов на 10 литров, получим следующий рецепт для приготовления своими руками электролита гальванического меднения.
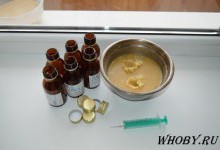
Взвешиваем медный купорос 900 грамм и пересыпаем его в канистру.
Взвешиваем аккумуляторный электролит 5,4 кг и переливаем его в емкость с медным купоросом.
Доливаем в емкость воду до уровня 10 литров.
Данная статья опубликована на сайте whoby.ru. Постоянная ссылка на эту статью находится по этому адресу http://whoby.ru/page/elektrolit-dlja-galvaniki
Читайте статьи на сайте первоисточнике, не поддерживайте воров.
Растворяем полностью медный купорос, путем бултыхания канистры и затем добавляем туда 1,25 грамм соли NaCl.
Далее нужно добавить в раствор активированный уголь из аптеки, из расчета 3 грамм на 1 литр. В нашем случае добавляем 30 грамм, это 12 пачек по 10 таблеток весом 0,25 грамм (фото данного процесса нет).
Хорошо перемешиваем и даем постоять электролиту меднения 2 часа. В течении этого времени нужно изредка перемешивать раствор с интервалом примерно 15 минут.
После того, как пройдет 2 часа, отфильтровать электролит от угля через фильтр.
После фильтрации прирабатываем электролит. Для этого берем фольгированный текстолит (если не жалко) или латунную или медную пластину.
Предварительную приработку электролита меднения нужно проводить в течении 5 часов на плотности тока 0.2 А/дм.кв. В моем случае фольга имела размеры 150х120 мм, площадь которой равна 1,8 дм.кв.
У фольги 4 стороны, значит общая площадь равна 1.8*4 = 7.2 дм.кв. На источнике выставляем ток 7.2*0.2 = 1,44 ампера, опускаем в ванну заготовку и держим там ее в течении 5 часов используя качалку (заготовка поствоянно движется в электролите).
После 5 часов приработки, добавляем в ванну 60 мл блескообразующей добавки J-PLATE CU-400. После тщательного перемешивания прирабатываем электролит меднения на плотности тока 1 А/дм.кв. в течниии 1 часа. На источнике выставляем ток 7.2*1 = 7.2 ампера.
После приработки электролита, проверим его на реальной плате. Для этого активируем текстолит и покрываем его химической медью. Это можно не делать, взять обычный фольгированный текстолит и провести тест на нем (мне жалко портить текстолит для этого, поэтому я сделал так, как описано ниже).
Обезжириваем, затем активируем текстолит.
Покрываем химической медью текстолит.
Погружаем плату в ванну для гальваники, и держим там 50 минут. В результате получаем вот такое покрытием. Если учесть, что это первая гальваника в данном электролите и используемый текстолит не первой свежести (весь поцарапанный), то считаю результат отличный.
Результат работы электролита для гальваники с блеском J-Plate Cu-400
Хочу предоставить несколько фото плат, гальваника медью которых была проведена в этом кислом электролите меднения. Данные фото предоставил mial пользователь форума радиокот, за что ему отдельная благодарность.
Очистка (восстановление) электролита гальванического меднения
В результате работы ванны гальваники, в электролит меднения попадает органика, что приводит к ухудшению работы электролита и появлению некачественных покрытий.
Чтобы избавиться от органики, электролит меднения нужно обработать перекисью водорода и активированным углем.
Делается это так, электролит нагревается до 50 градусов, затем в него добавляется 30% перекись водорода из расчета 3 мл на 1 литр раствора. Все хорошо перемешивается и выдерживается 1 час.
Потом в электролит меднения добавляется активированный уголь из аптеки из расчета 3 грамма на 1 литр раствора. Все перемешивается и выдерживается 1 час, затем электролит фильтруется от угля.
После фильтрации прирабатываем раствор на плотности тока 0,2 А/дм.кв. в течении 2 часов. После добавляем необходимое рецептурное количество блеска и прирабатываем еще раз электролит на плотности тока 1 А/дм.кв в течении 1 часа.
Хочу отметить, что данная процедура восстановления применима для всех рецептов сернокислых электролитов для гальваники.
На этом все, желаю не дырявых штанов и качественных плат.
Статью написал: Admin Whoby.Ru
Если вам понравилась статья, нажмите на кнопку нужной социальной сети расположенной ниже. Этим действием вы добавите анонс статьи к себе на страницу. Это очень поможет в развитии сайта.






Еще записи по теме
К некоторым блескоообразователям, тот же cupracid 210, в тех листе указываются аноды с содержанием фосфора 0,3-0,6%.. на сколько это важно в данной задаче, или вполне подойдут обычные аноды 99,9%?
и еще, уголь с серной кислотой не прореагирует с распадом оной на оксид углерода, оксид серы и воду?
Да везде нужны фосфорсодержащие аноды. Я использовал шинку от трансформатора, можно посмотреть тут http://whoby.ru/page/vannagalvanik
Уголь с серкой не прореагирует, только с блеском. После угля, придется добавлять по новой блеск.
По поводу ошибки сессии. 1. Долго держим страницу перед отправкой комментария (надо обновить, потом писать комментарий). 2. Каким то образом меняется ip адрес между моментом открытия станицы и нажатием кнопки отправить.
Как мне объяснили, анод из чистой меди быстрее растворяется и шламит электролит, от чего тот быстрее выходит из строя.. фосфоросодержащий анод более равномерно растворяется..
чтож, буду пока пользоваться чисто медными анодами, но в специальных чехлах, а чуть позже куплю с фосфором.
п.с. я конечно не спец, но, думаю, это не совсем правильный алгоритм.. тот же роселеком каждый запрос может отправлять с разного адреса.
Ну а куда деваться, если нет фосфоросодержащих анодов.
еще момент, надо ли, после гальваники вынимать электроды, промывать их и чехлы, сливать электролит в канистру?
У меня нет чехлов на анодах. После гальваники всегда вынимаю аноды, мою их в поточной воде, сушу. Сливаю электролит с ванны, мою ее, затем кладу туда аноды и убираю до следующего раза.
Чтобы аноды не окислялись, можно их хранить в воде, но я так не делаю.
Еще есть пара вопросов.
1. истощается ли электролит, либо он компенсирует недостаток меди за счет анодов?
2. не портятся ли со временем(временем стояния в канистре) блескообразователи?
3. на каких режимах работает источник тока с реверсом.. (из того что нашел, 2,5А/дм-20мс, реверс 6А/дм-1мс).
4. по какому принципу работает реверсный источник?(в плане, сам БП генерирует нужные величины, либо блок просто генерирует определенное напряжение, а потом стоит DС/DС источник тока?
5. какое получается, примерно, удельное сопротивление электролита? (площадь, расстояние до анодов, напряжение/ток).
6. после «восстановления» электролита, блес добавляется как в новый электролит? (на примере купрацида 210, основание, компонент А, компонент В.)
и где-то проскакивало что проблема возникает с многокомпонентными блескообразователями.
вот результат приработки электролита с купрацидом 210. как видно, блеск работает замечательно..
1. Истощается, компенсируется путем добавления нужного количества медного купороса.
2. У каждого реактива есть свой срок хранения, но это не значит, что после длительного времени он перестанет работать.
3,4. Не использовал реверс и поэтому не изучал эту тему, ответить не могу.
5. Делал некоторые замеры в медном электролите, для кислого значения будут другими. Вот файл, других данных у меня нет.. http://whoby.ru/uploads/down/U-vs-I.xls
6. Да, как в новый, так как старый блеск был расщеплен углем полностью.
Вопрос к adminu. Почему идет указание взвешивания (серки) электролита на весах? Почему не в мл? Вроде удобнее в миллилитрах.
Готовлю опытный электролит. Как на J-Plate Cu-400, то есть кислый. Раньше пользовался преимущественно медными. Возник вопрос насчет количества соли. Понимаю что все взято из рекомендаций по добавкам, но может быть есть какие-то соображения почему такие колебания в количестве?
Ну я думаю, что в медном электролите при NaCL = 0,125 гр./л. произойдет пассивация анодов, а в кислом нет, из за большего количества серной кислоты.
Чем больше соли, тем пластичней осадок (может я ошибаюсь).
И еще вопросик про предварительную приработку электролита. Откуда взялись такие значения как 0,2 А на кв/дм? Логика подсказывает что это должно быть по анодам. Для насыщения электролита ионами меди до оптимального состояния купорос-кислота. Может это и не так. Если что прошу поправить. Или при протекании определенного тока через количество литров электролита.
Еще интересуют диапазоны по соли для медных и кислых электролитов. Для медных я перепробовал от 50 до 100 мг. Разницы особой не заметил. Ни в пластичности и аноды не пассивировались. Как растворялись так и продолжали растворяться. Использую обычную медь.
Медные 0,05..0,1 гр/л, кислые 0,9..1,42 гр/л по соли NaСL
Эта процедура нужна для получения максимальной чистоты раствора.
Ну это не я придумал.
По соли спасибо. Буду пробовать.
Медные 0,05..0,1 гр/л, кислые 0,9..1,42 гр/л по соли NaСL
По медным согласен, а по кислым наверно 0,09..0,142 гр/л
Изготовление блескообразующей добавки прошло неудачно.
И теперь вопрос. Где взять блеск физлицу? Например J-Plate Cu-400. Купрацид 210 есть в невареактив. Это три компонента. Общая стоимость приближается к 3 тыс.руб.
Найти юр. лицо, купить, потом продать на форуме излишки, желающих будет море и окупится.
Воспользовался советом. Но цена.
Можно взять любые пропорции из диапазона. Взятые в пропорции в рецепте, показывают только то, что электролит медный.
Я хотел выяснить есть ли опыт использования ЦКН-74? Подводные камни.. Или может известно кто использует. На просторах интернета очень мало информации на эту тему.
а пробовал кто этот рецепт:
Нет, я не пользовался, кто использует, не знаю.
Это все так и осталось на той странице, вряд ли кто пользуется, может evsi и попробовал.
Рецепт с тиомочевиной пробовал. В качестве блескообразователя добавлял унитиол
0,05. Блестит так, что совершенно четко видно свое отражение, как в зеркале. Паяется изумительно. Токи на медном электролите без подгаров ампер до 10. Рассеивающая способность огромная. При аноде с одной стороны и плате в квадратный дециметр медью пытается покрыться другая сторона. По крайней мере сантиметра по 2-3 с краев. НО. Медь настолько напряженная (хрупкая), что не выдерживает и малейшего перегиба. Игрался с количеством. Ничего не получилось. Если (может) унитиол в качестве блескообразователя и подойдет, то тиомочевина в качестве выравнивателя никоим образом. Кстати в патенте от BASF имеется общая формула как у унитиола. Проблема с выравнивателями. Смотрю на белый стрептоцид (растворимый). Продается в тюбиках 5% в виде мази. По общим формулам патентов BASF может (вроде) подойти. В остальных 95% глицерин. Помешать не должен. В качестве замедлителя планирую макрогол. Добавлять пробовал. Ароматические добавки электролиту не мешают. Admin несколько лет назад рассуждал на эту тему.
Если рецепт указан в хлорид ионах, то чтобы перевести на NaCL, то нужно хлор ионы умножить на 1,75.
По поводу расхода хлор ионов, наверно да, раз есть методика определения их в электролите.
Примерно соответствует. Но откуда такая цифра? 1,75 Не видел. Не встречал.
Ну хлор ионов в NaCl, в 1,75 раз меньше, чем весит сам NaCl, вот и вся арифметика.
Поправь, если что не так. Картинок много. В ворде было проще сделать и потом скинуть на яндекс диск.
А как блеск вообще?
Ну блестит, значит работает, что тут еще добавить.
После очистки электролита углем, блеск добавляют заново. Вопрос, а NaCl тоже заново засыпать надо?
Нет, NaCl добавлять не надо. Но, если по каким либо причинам, соли было добавлено слишком много (при приготовлении электролита), то чтобы избавиться от нее, в электролит добавляют двукратную дозу (от NaCL) сульфата серебра. Дают электролиту отстояться в течении суток (иногда перемешивая), затем фильтруют. Все хлор ионы присоединяться к серебру и выпадут в осадок в виде хлорида серебра.
После фильтрации, электролит нужно приработать на плотности тока 1 А/дм2 в течении не менее 2 часов. В результате чего, излишки не прореагированного сульфата серебра, осядут на заготовку виде серебра. После этого, в раствор добавляется рецептное количество NaCL.
Спасибо. А есть ли рецепт приготовления хлорида палладия непосредственно из палладия, так как металл достать проще и дешевле. И как самодельный хлорид палладия дозировать применительно к вашим рецептам активации.
Если металл чистый, растворить в горячей азотке, выпарить при 100..120 градусах до суха. Затем нитрат палладия растворить солянкой и выпарить при 100..120 градусах. Можно для уверенности еще раз растворить получившийся порошок солянкой и выпарить. Азотки и солянки брать без фанатизма, чтобы потом долго не выпаривать.
Дозировать также, как в рецептах.
То есть в теории я получу 1 грамм хлорида из 1 грамма металла, я правильно понял?
Нет, если память не изменяет, то примерно 1,7 грамма хлорида.
Прошу прощения, активированным углём мы ведь купорос очищаем? От органики? Нельзя ли эту процедуру провести перед добавлением серной кислоты? Готовый автомобильный электролит должен быть чистым и не нуждается такой очистке.
Очищают готовый раствор купороса с серной кислотой.