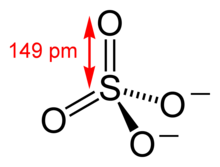
сульфат соль какой кислоты
Сульфаты
Содержание
Свойства
Происхождение (генезис)
Образуются в условиях повышенной концентрации кислорода и при относительно низких температурах, то есть вблизи земной поверхности. Большей частью экзогенные, хемогенные (в месторождениях солей). Сульфаты Cu, Zn и других близких элементов образуются при разрушении сульфидов. В природе встречается 180 минералов сульфатов и на их долю приходится
Использование
Некоторые из сульфатов добывают для различных технических целей (гипс, барит и др.). для химической промышленности (мирабилит и др.), как руды Mg и др.
Качественные реакции
См. также
Литература
Ссылки
Примечания
Полезное
Смотреть что такое «Сульфаты» в других словарях:
СУЛЬФАТЫ — (ново лат., от sulfur сера). Серно кислые соли. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. СУЛЬФАТЫ новолатинск., от sulfur, сера. Серноватистокислые соли. Объяснение 25000 иностранных слов, вошедших в… … Словарь иностранных слов русского языка
СУЛЬФАТЫ — соли или эфиры серной кислоты Н2SO4. Соли Средние (напр., К2SO4) и кислые, или гидросульфаты (КНSO4), кристаллы. Средние соли распространены в природе (см. Сульфаты природные). Эфиры диорганилсульфаты ROSO2OR и органилсульфаты ROSO2ОМ (R… … Большой Энциклопедический словарь
СУЛЬФАТЫ — СУЛЬФАТЫ, соли и эфиры серной кислоты H2SO4. Соли средние (например, K2SO4) и кислые, или гидросульфаты (KHSO4), кристаллы. Средние соли распространены в природе (например, гипс). Эфиры применяют в органическом синтезе, как растворители … Современная энциклопедия
СУЛЬФАТЫ — СУЛЬФАТЫ, ов, ед. сульфат, а, муж. (спец.). Соли серной кислоты. | прил. сульфатный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Сульфаты — СУЛЬФАТЫ, соли и эфиры серной кислоты H2SO4. Соли средние (например, K2SO4) и кислые, или гидросульфаты (KHSO4), кристаллы. Средние соли распространены в природе (например, гипс). Эфиры применяют в органическом синтезе, как растворители. … Иллюстрированный энциклопедический словарь
СУЛЬФАТЫ — соли серной кислоты H2S04, содержащие ион SO2 ; или ион HSO гидросульфаты, а также природные минералы (С. меди, цинка, железа, свинца и др.), образующиеся при разрушении (см.). Большинство С. (за исключением CaS04, SrS04 и BaS04) хорошо… … Большая политехническая энциклопедия
сульфаты — ов; мн. (ед. сульфат, а; м.). [от лат. sulphur сера] Хим. Соли серной кислоты. Природные с. (класс минералов). * * * сульфаты соли или эфиры серной кислоты H2SO4. Соли средние (например, K2SO4) и кислые, или гидросульфаты (KHSO4), кристаллы.… … Энциклопедический словарь
Сульфаты — (от лат. sulphur, sulfur сера) сернокислые соли, соли серной кислоты H2SO4. Имеются два ряда С. средние (нормальные) общей формулы Mg2SO4 и кислые (Гидросульфаты) MHSO4, где М одновалентный металл. С. кристаллические вещества,… … Большая советская энциклопедия
СУЛЬФАТЫ — соли или эфиры серной кислоты H2SO4. Соли средние (напр., K2SO4) и кислые, или гидросульфаты (KHSO4),кристаллы. Средние соли распространены в природе (см. Сульфаты природные). Эфиры диорганилсульфаты ROSC2OR и органилсульфаты ROSO2OM (R органич.… … Естествознание. Энциклопедический словарь
Соли кислот сульфаты. Состав. Минералы
Автор текста Анисимова Е.С. Из курса по химии. См. сначала файлы «Кислоты».
Авторские права защищены. При копировании и распространении обязательна ссылка на источник и страницу https://vk.com/bch_5
Соли кислот: сульфаты. Состав. Минералы.
Серная кислота (понятие)
1. В природе есть атомы разных типов (с разным числом протонов).
2. Есть такое сочетание атомов: два атома Н, один атом S и четыре атома О.
3. Сочетание из 2Н, одного атома S и четырёх атомов О записывают так: Н2SO4.
4. Н2SO4 – это формула молекулы.
5. Молекулы состава Н2SO4 называют молекулами серной кислоты.
6. Серная кислота – это вещество, молекулы которого имеют состав Н2SO4.
Соли серной кислоты
Калий вместо водорода
7. Если буквы Н в Н2SO4 поменять на буквы К, то получится К2SO4.
8. Два атома Н в Н2SO4 можно заменить двумя атомами К: К2SO4.
9. К2SO4 – это соль серной кислоты. (Не путать с пищевой солью!)
10. К – это атом калия.
11. К2SO4 – это калиевая соль серной кислоты.
12. К2SO4 – удобрение! Помогает сделать пищу и избежать голода людей!
13. К2SO4 даёт почве (и растениям) одновременно и серу, и калий, в которых растения нуждаются. Калийное удобрение.
14. 2Н в Н2SO4 можно заменить не атомами К, а атомами Na или другого металла – будут другие соли.
Натрий вместо Н
15. Два атома Н в Н2SO4 можно заменить двумя атомами Na: будет Na2SO4.
16. Na2SO4 – это натриевая соль серной кислоты.
17. В природе есть сочетание Na2SO4 и десяти молекул Н2О. Его формула: Na2SO4*10Н2О.
18. Na2SO4*10Н2О в природе называется минералом мирабилитом (глауберова соль).
Соли. Понятие.
19. Замена атомов Н на атомы металлов в молекуле кислоты превращает кислоту в соль.
20. Замена всех атомов Н кислоты на атомы металла даёт среднюю соль.
21. Соль – это продукт замены атомов Н на атомы металла в молекуле кислоты.
22. Соли серной кислоты называют сульфатами.
Сульфаты
23. Меняя атомы Н на атомы металлов в молекуле Н2SO4, мы получаем соли серной кислоты – сульфаты.
24. К2SO4 и Na2SO4 – сульфаты.
25. Соли серной кислоты называются сульфатами.
26. К2SO4 – это калиевая соль серной кислоты или сульфат калия.
27. Na2SO4 – это натриевая соль серной кислоты или сульфат натрия.
28. К2SO4 и Na2SO4 – примеры средних солей. (Без атомов Н).
Кальций вместо Н в Н2SO4 (сульфаты кальция)
29. Два атома Н можно заменить не двумя атомами К, а одним атомом кальция (Са).
30. Замена двух атомов Н одним атомом Са превращает Н2SO4 в СаSO4.
31. СаSO4 – это формула, она показывает состав молекулы вещества.
32. Вещество с формулой СаSO4 называется сульфатом кальция.
33. СаSO4 – это кальциевая соль серной кислоты или сульфат кальция.
Минералы сульфата кальция
34. Вещество СаSO4 в природе есть в виде минерала ангидрит.
35. Ангидрит – минерал, состоящий из молекул состава СаSO4.
Гидраты сульфата кальция
36. СаSO4 бывает связан с Н2О.
37. Соединения СаSO4 с водой называются гидратами СаSO4.
38. Гидраты СаSO4 – это сочетания СаSO4 и Н2О.
39. Если на две молекулы СаSO4 приходится одна молекула Н2О (полугидрат сульфата кальция), то минерал с таким составом называется алебастром.
40. Состав алебастра: СаSO4*0,5Н2О.
41. Схема образования алебастра (не реакция): 2СаSO4 + Н2О = 2(СаSO4*0,5Н2О)
42. Если на одну молекулу СаSO4 приходится две молекулы Н2О, то минерал с таким составом называется гипсом.
43. Состав гипса: СаSO4*2Н2О.
44. Схема образования гипса (не реакция): СаSO4 + 2Н2О = СаSO4*2Н2О.
45. Если смочить порошок алебастра – он соединится с водой и станет твёрдым (гипсом).
46. Гипс используют в медицине, в строительстве, в скульптуре.
Магний вместо Н в Н2SO4 (сульфат магния)
47. Два атома Н можно заменить не двумя атомами К, а одним атомом магния (Mg).
48. Замена двух атомов Н одним атомом Mg превращает Н2SO4 в MgSO4.
49. MgSO4 – это формула, она показывает состав молекулы вещества.
50. Вещество с формулой MgSO4 называется сульфатом магния.
51. MgSO4 – это магниевая соль серной кислоты или сульфат магния.
Гидраты сульфата магния
52. MgSO4 бывает связан с Н2О.
53. Соединения MgSO4 с водой называются гидратами MgSO4.
54. Гидраты MgSO4 – это сочетания MgSO4 и Н2О.
55. На одну молекулу MgSO4 приходится семь молекул Н2О: минерал с таким составом называется горькой или английской солью.
Медь (Cu) в Н2SO4 (сульфаты меди)
56. Два атома Н можно заменить не двумя атомами К, а одним атомом кальция меди (Сu).
57. Замена двух атомов Н одним атомом Сu превращает Н2SO4 в СuSO4.
58. СuSO4 – это формула, она показывает состав молекулы вещества.
59. Вещество с формулой СuSO4 называется сульфатом меди.
60. СuSO4 – это медная соль серной кислоты или сульфат меди.
Минералы сульфата меди
61. СuSO4 бывает связан с Н2О.
62. Соединения СuSO4 с водой называются гидратами СuSO4.
63. Гидраты СuSO4 – это сочетания СuSO4 и Н2О.
64. Про пять (пента) молекул Н2О говорят «пента гидрат».
65. Пентагидрат – это пять молекул воды.
66. Соединение одной молекулы СuSO4 и пяти молекул Н2О записывают так: СuSO4*5Н2О.
67. Соединение СuSO4 и пяти молекул Н2О (СuSO4*5Н2О) называется пентагидратом сульфата кальция.
68. Вещество с формулой СuSO4*5Н2О есть в природе в виде минерала.
69. Минерал состава СuSO4*5Н2О называют цианозитом или халькантитом.
70. Цианозит имеет синий цвет.
Железо (Fe) в FeSO4 (сульфат железа)
71. Два атома Н можно заменить не двумя атомами К, а одним атомом железа (Fe).
72. Замена двух атомов Н одним атомом Сu превращает Н2SO4 в FeSO4.
73. FeSO4 – это формула молекулы.
74. Формула FeSO4 показывает состав молекулы вещества.
75. Вещество с формулой FeSO4 называется сульфатом железа.
76. Сульфат железа FeSO4 – это соль серной кислоты. (Продукт замены Н в кислоте).
Минералы сульфата железа
77. Вещество с формулой FeSO4 есть в природе в виде минерала.
78. Минерал состава FeSO4 называют мелантеритом.
Стронций (Sr) в SrSO4 (сульфат стронция)
79. Два атома Н можно заменить не двумя атомами К, а одним атомом стронция (Sr).
80. Замена двух атомов Н одним атомом Sr превращает Н2SO4 в SrSO4.
81. SrSO4 – это формула молекулы.
82. Формула SrSO4 показывает состав молекулы вещества.
83. Вещество с формулой SrSO4 называется сульфатом стронция.
84. Сульфат стронция SrSO4 – это соль серной кислоты. (Продукт замены Н в кислоте).
Минералы сульфата стронция
85. Вещество с формулой SrSO4 есть в природе в виде минерала.
86. Минерал состава SrSO4 называют целестином.
87. Ищите картинки целестина!
Минералы сульфаты
88. Примеры минералов – рубин, песок, мел, мрамор, мирабилит, цианозит, целестин и т.д.
89. К минералам относят только твёрдые тела, только природного происхождения, с определённым химическим составом, неорганические.
90. Одна из групп минералов – это сульфаты разных металлов.
91. Минерал, который является сульфатом стронция – целестин.
92. Формула целестина – SrSO4.
93. Минерал, который является сульфатом железа – мелантерит.
94. Формула мелантерита (молекулы) – FeSO4.
95. Минерал, который является сульфатом кальция – ангидрит.
96. Формула ангидрита (молекулы) – СаSO4.
Гидраты сульфатов
97. Часто сульфаты связаны с водой, то есть являются гидратами.
98. Минерал, который является гидратом сульфата натрия – мирабилит.
99. В формуле мирабилита на одну молекулу сульфата натрия – десять молекул воды.
100. Формула молекулы мирабилита – Na2SO4*10Н2О.
101. Минерал, который является гидратом сульфата меди – цианозит (халькантит).
102. В формуле цианозита на одну молекулу сульфата натрия – пять молекул воды.
103. Формула молекулы цианозита – СuSO4*5Н2О.
104. Минерал, который является гидратом сульфата магния – английская соль.
105. В формуле английской соли на одну молекулу сульфата магния – семь молекул воды.
106. Формула молекулы горькой английской соли – MgSO4*7Н2О.
107. Минерал, который является гидратом сульфата кальция – гипс и алебастр.
108. В формуле гипса на одну молекулу сульфата кальция – две молекулы воды.
109. Формула молекулы гипса – СаSO4*2Н2О.
110. В формуле алебастра на две молекулы сульфата кальция – одна молекула воды. (Или на одну – половинка)
111. Формула молекулы алебастра – СаSO4*0,5Н2О. (Полугидрат).
112. Из минералов сульфатной группы можно добыть серу, но есть более удобные источники серы (сульфиды, самородная сера).
113. Ищите картинки минералов!
Состав веществ: схемы, а не реакции.
114. S + 3О = SO3 (оксид серы VI)
115. SO3 + H2O = H2SO4 (серная кислота)
К
116. Меняем в H2SO4 2Н на 2К, получаем: К2SO4.
117. H2SO4 + 2К = К2SO4 (сульфат калия).
Na
118. Меняем в H2SO4 2Н на 2Na, получаем: Na2SO4.
119. H2SO4 + 2Na = Na2SO4 (сульфат натрия).
Fe
120. Меняем в H2SO4 2Н на 1 Fe, получаем: FeSO4.
121. H2SO4 + 1 Fe = FeSO4 (сульфат железа).
122. FeSO4 – формула вещества минерала мелантерит, его хим состав.
Sr
123. Меняем в H2SO4 2Н на 1 Sr, получаем: SrSO4.
124. H2SO4 + Sr = SrSO4 (сульфат стронция).
125. SrSO4 – формула вещества минерала целестин, его хим. состав.
Ca
126. Меняем в H2SO4 2Н на 1 Са, получаем: СаSO4.
127. H2SO4 + 1 Са = СаSO4 (сульфат кальция).
128. СаSO4 – формула вещества минерала ангидрит, его хим состав.
129. Добавляем 2 Н2О к CаSO4, получаем: CаSO4*2Н2О.
130. CаSO4 + 2Н2О = CаSO4*2Н2О (дигидрат сульфата кальция).
131. CаSO4*2Н2О – формула вещества минерала гипс, его хим состав.
132. Добавляем 0,5 Н2О к CаSO4, получаем: CаSO4*0,5Н2О.
133. CаSO4 + 0,5Н2О = CаSO4*0,5Н2О (полугидрат сульфата кальция).
134. То же самое: 2CаSO4 + 1Н2О = 2CаSO4*Н2О.
135. CаSO4*0,5Н2О – формула вещества минерала алебастр, его хим состав.
Mg
136. Меняем в H2SO4 2Н на 1 Mg, получаем: MgSO4.
137. H2SO4 + 1 Mg = MgSO4 (сульфат магния).
138. Добавляем 7 Н2О к MgSO4, получаем MgSO4*10Н2О.
139. MgSO4 + 7Н2О = MgSO4*7Н2О (гепта-гидрат сульфата магния).
140. MgSO4*7Н2О – формула вещества минерала горькая английская соль, его хим состав.
Cu
141. Меняем в H2SO4 Н на 1 Cu, получаем: CuSO4 (сульфат меди)
142. H2SO4 + Сu = CuSO4 (сульфат меди).
143. Добавляем 5 Н2О к CuSO4, получаем: CuSO4*5Н2О
144. CuSO4 + 5Н2О = CuSO4*5Н2О (пентагидрат сульфата меди).
145. СuSO4*5H2O – формула вещества минерала цианозит, его хим состав.
Какие бывают сульфаты, как образуются?
Как правило, все соли этой группы имеют светлый оттенок, определенную степень твердости, а многие из них прекрасно растворимы в водной среде.
Основная группа обладает осадочным происхождением. К примеру, это химически выявленные морские осадки. Львиная доля – это минеральное сырье после окисления.
Сульфаты
В научных кругах известны как продукты, которые можно получить в результате вулканической деятельности (натуральные).
Также они могут быть не только на основе реакции серной кислоты, но также водными, безводными. Различают варианты сложных, когда к комплексу [SO4]2 добавляется пара анионов (ОН).
Где можно встретить сульфаты?
В промышленных сточных водах продукт может оказаться в нескольких случаях: 1. На предприятии используются непосредственно сырьевые добавки на основе сульфатов. 2. В производстве используется оксид серы, который при окислении дает искомые вещества. 3. На предприятии используются добавки для изготовления удобрений.
При смешивании вод с разными составами могут возникать белые налеты на трубопроводах, кранах и в самом чайнике при кипячении.
Как проверить концентрацию анионов?
Для этого берется в качестве основного компонента сульфат бария и в зависимости от того, сколько его получится в супензии (при разведении с водой), можно узнать количество анионов. Применяется способ турбидиметричности. Критерии определения: плотность, высота суспензионного столба, прозрачность. Также для анализа потребуется максимально очищенная вода и мутномер. Прибор можно изготовить самостоятельно.
Какой уровень ПДК допустим в водохранилищах
И естественных водоемах. Если рассматривать водоемы, предназначенные для хозяйственно-питьевого характера, то ПДК составляет около 500 мг/л.
Сульфаты купить в Москве / приобрести с доставкой
Компания ООО ТПК осуществляет прямые поставки продукта в Москву и Московскую область.
Наши склады расположены в Тульской области. Это пара часов езды после погрузки
товара до вашего склада. Логисты просчитают максимально быстрый маршрут, и наш автотранспорт доставит все в срок. Поставка и покупки производятся с заводов
производителей, без посредников и третьих лиц.
Благодаря этому вы получаете
цену, которая не просто конкурентоспособна, она сэкономит ваш бюджет. Плюс вы
получаете постоянного поставщика в нашем лице (на рынке промышленной химии
более 14 лет).
Осуществляем импорт и экспорт любого вида промышленной химии по России, в СНГ и зарубежье.
Предлагаем вашему вниманию химическое сырье следующих вариантов:
Продажа сульфат натрия оптом – ознакомиться с сырьем более подробно.
Природный продукт, который применяется в качестве премиксов для комбикормов. Помогает птице и животным набрать необходимый вес за счет увеличения аппетита.
Также сырье используется в пищевой сфере и на производствах. Страна изготовитель: Турция и Китай.
Продажа сульфат цинка оптом (цинк сернокислый) – ссылка на карточку товара.
Применяется в качестве удобрения для сельхоз культур, а также в качестве добавки в медицинской сфере и химической. Производство – Китай. Мешки по 25 кг.
Продажа марганца сернокислого оптом – информация о продукте.
Используется в медицинской сфере, в качестве добавки для БАДов. Производство – Китай, прямые поставки. Фасовка – по 25 килограмм.
Продажа сульфат меди оптом (медный купорос) – где применяется, для чего используется.
Используется как удобрение. Производитель – Китай. Фасовки – мешки по 25 кг.
Продажа сульфат железа оптом (железный купорос) – всегда в наличии.
Производитель – Китай, Россия. Поставляется в мешках по 25 кг. А также возможны поставки в других вариантах (фасовка на заводе заранее оговаривается: 50 кг мешки или МКР).
Продажа магнезии оптом от производителя (магний сернокислый) – продукт в наличии.
Производство – Россия или Китай. Быстрая доставка. Почитать поподробнее о сырье.
Все вышеперечисленные позиции вы можете приобрести с сертификатами качества, изготовленные по ГОСТ и соответствующие нормам выпуска.
Сульфат соль какой кислоты
§8.7 Соли. Названия и классификация солей.
В предыдущих параграфах этой главы вы постоянно встречались с реакциями, в которых образуются соли.
Солями называются вещества, в которых атомы металла связаны с кислотными остатками.
NaCl – хлорид натрия,
Na 2 SO 4 – сульфат натрия,
СаSO 4 – сульфат кальция,
СаCl 2 – хлорид кальция,
(NH 4 ) 2 SO 4 – сульфат аммония.
Формула соли строится с учетом валентностей металла и кислотного остатка. Практически все соли – ионные соединения, поэтому можно говорить, что в солях связаны между собой ионы металла и ионы кислотных остатков:
Na + Cl – – хлорид натрия
Ca 2+ SO 4 2– – сульфат кальция и т.д.
Названия солей составляются из названия кислотного остатка и названия металла. Главным в названии является кислотный остаток. Названия солей в зависимости от кислотного остатка показаны в таблице 8-6.
Таблица 8-6. Построение названий солей. В верхней части таблицы приведены кислородсодержащие кислотные остатки, в нижней – бескислородные.
Соль какой кислоты
Валентность остатка
Ca(NO 3 ) 2 нитрат кальция
Кремниевая H 2 SiO 3
Na 2 SiO 3 силикат натрия
PbSO 4 сульфат свинца
Na 2 CO 3 карбонат натрия
Фосфорная H 3 PO 4
AlPO 4 фосфат алюминия
Бромоводородная HBr
NaBr бромид натрия
Сероводородная H 2 S
FeS сульфид железа (II)
NH 4 Cl хлорид аммония
Фтороводородная HF
CaF 2 фторид кальция
Из таблицы 8-6 видно, что названия кислородсодержащих солей имеют окончания » ат «, а названия бескислородных солей – окончания » ид «.
В некоторых случаях для кислородсодержащих солей может использоваться окончание » ит «. Например, Na 2 SO 3 – сульфит натрия. Это делается для того, чтобы различать соли серной кислоты (H 2 SO 4 ) и сернистой кислоты (H 2 SO 3 ) и в других таких же случаях.
Любую соль можно получить соответствующей реакцией нейтрализации. Например, сульфит натрия образуется в реакции между сернистой кислотой и основанием (едким натром). При этом на 1 моль кислоты требуется взять 2 моля основания:
сульфит натрия (средняя соль)
Если взять только 1 моль основания – то есть меньше, чем требуется для полной нейтрализации, то образуется кислая соль – гидросульфит натрия:
гидросульфит натрия (кислая соль)
Кислые соли образуются многоосновными кислотами. Одноосновные кислоты кислых солей не образуют.
Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода.
Названия кислых солей содержат приставку «гидро» (от слова hydrogenium – водород). Например:
NaHCO 3 – гидрокарбонат натрия,
K 2 HPO 4 – гидрофосфат калия,
KH 2 PO 4 – дигидрофосфат калия.
Основные соли образуются при неполной нейтрализации основания. Названия основных солей образуют с помощью приставки «гидроксо». Ниже приведен пример, показывающий отличие основных солей от обычных (средних):
хлорид магния ( средняя соль)
гидроксохлорид магния ( основная соль)
Основные соли, помимо ионов металла и кислотного остатка, содержат гидроксильные группы.
Основные соли образуются только из многокислотных оснований. Одноокислотные основания таких солей образовать не могут.
В таблице 8-6 приведены международные названия солей. Однако полезно знать также русские названия и некоторые исторически сложившиеся, традиционные названия солей, имеющих важное значение (таблица 8-7).
Таблица 8-7. Международные, русские и традиционные названия некоторых важных солей.
Международное название
Традиционное название
В быту – как моющее и чистящее средство
Гидрокарбонат натрия
Натрий углекислый кислый
Пищевой продукт: выпечка кондитерских изделий
Применяется в технике
Натрий сернокислый
Лекарственное средство
Магний сернокислый
Лекарственное средство
Применяется в зажигательных смесях для головок спичек
В химии и в технике до сих пор сохраняется много старинных названий. Например, каустическая сода – вовсе не соль, а техническое название гидроксида натрия NaOH. Если обыкновенной содой можно почистить раковину или посуду, то каустическую соду ни при каких обстоятельствах брать в руки или использовать в быту нельзя!
Эти простые знания могут пригодиться в жизни – мало ли с какими веществами придется столкнуться в будущем.
** Строение солей аналогично строению соответствующих кислот и оснований. Ниже приведены структурные формулы типичных средних, кислых и основных солей.
В заключение приведем строение и название основной соли, формула которой, на первый взгляд, выглядит очень сложной: [Fe(OH) 2 ] 2 CO 3 – дигидроксокарбонат железа (III).
На самом деле, при рассмотрении структурной формулы такой соли становится ясно, что эта соль – продукт частичной нейтрализации гидроксида железа (III) угольной кислотой:
8.23. Закончите уравнения реакций. Определите, какие соли (средние, кислые, основные) получаются при данном мольном соотношении реагентов. Назовите эти соли.
в) 3Ca(OH) 2 + 2H 3 PO 4 =
г) Ca(OH) 2 + H 3 PO 4 =
Сульфат соль какой кислоты
Физические свойства серной кислоты
Техника безопасности при обращении с концентрированной серной кислотой
Помните! Кислоту вливать малыми порциями в воду, а не наоборот!
Производство серной кислоты
1-я стадия. Печь для обжига колчедана
1) измельчение железного колчедана (пирита)
2) метод «кипящего слоя»
3) 800°С; отвод лишнего тепла
4) увеличение концентрации кислорода в воздухе
После очистки, осушки и теплообмена сернистый газ поступает в контактный аппарат, где окисляется в серный ангидрид (450°С – 500°С; катализатор V 2 O 5 ):
3-я стадия . Поглотительная башня
Воду использовать нельзя из-за образования тумана. Применяют керамические насадки и принцип противотока.
Химические свойства разбавленной серной кислоты
2) Взаимодействие с металлами:
Разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений до водорода:
Zn 0 + 2 H + → Zn 2+ + H 2 0 ↑
3) Взаимодействие с основными и амфотерными оксидами :
4) Взаимодействие с основаниями:
H 2 SO 4 + 2 NaOH → Na 2 SO 4 + 2 H 2 O (реакция нейтрализации)
Если кислота в избытке, то образуется кислая соль:
2 H + + Cu ( OH )2 → Cu 2+ + 2 H 2 O
5) Взаимодействие с солями, если в результате реакции образуется осадок или выделяется газообразная летучая кислота:
Качественная реакция на сульфат-ион:
Образование белого осадка BaSO 4 (нерастворимого в кислотах) используется для определения серной кислоты и растворимых сульфатов.
Особые свойства концентрированной серной кислоты
1. Очень гигроскопична, поглощает воду из окружающей среды; органические вещества обугливаются! Опыт «Гигроскопичность серной кислоты»
Взаимодействие серной кислоты с металлами разной активности с образованием соли, воды и продукта восстановления серы (S, H2S, SO2) : ОПЫТ
3. Серная кислота окисляет неметаллы :
С 0 + 2H 2 S +6 O 4 (конц) → C +4 O 2 + 2S +4 O 2 + 2H 2 O
Самый крупный потребитель серной кислоты — производство минеральных удобрений. На 1 т P₂O₅ фосфорных удобрений расходуется 2,2-3,4 т серной кислоты, а на 1 т (NH₄)₂SO₄ — 0,75 т серной кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Применение солей серной кислоты
Железный купорос FеSО4•7Н2O применяли раньше для лечения чесотки, гельминтоза и опухолей желез, в настоящее время используют для борьбы с сельскохозяйственными вредителями.
Медный купорос CuSO4•5Н2O широко используют в сельском хозяйстве для борьбы с вредителями растений.
«Глауберова соль» (мирабилит) Nа2SO4•10Н2O была получена немецким химиком И. Р. Глаубером при действии серной кислоты на хлорид натрия, в медицине ее используют как слабительное средство.
«Бариевая каша» BaSO4 обладает способностью задерживать рентгеновские лучи в значительно большей степени, чем ткани организма. Это позволяет рентгенологам при заполнении «бариевой кашей» полых органов определить в них наличие анатомических изменений.
Гипс СаSO4•2Н2O находит широкое применение в строительном деле, в медицинской практике для накладывания гипсовых повязок, для изготовления гипсовых скульптур.
№1. Осуществите превращения по схеме:
№2. Закончите уравнения практически осуществимых реакций в полном и кратком ионном виде:
№3. Запишите уравнения реакций взаимодействия разбавленной серной кислоты с магнием, гидроксидом железа (III), оксидом алюминия, нитратом бария и сульфитом калия в молекулярном, полном и кратком ионном виде.