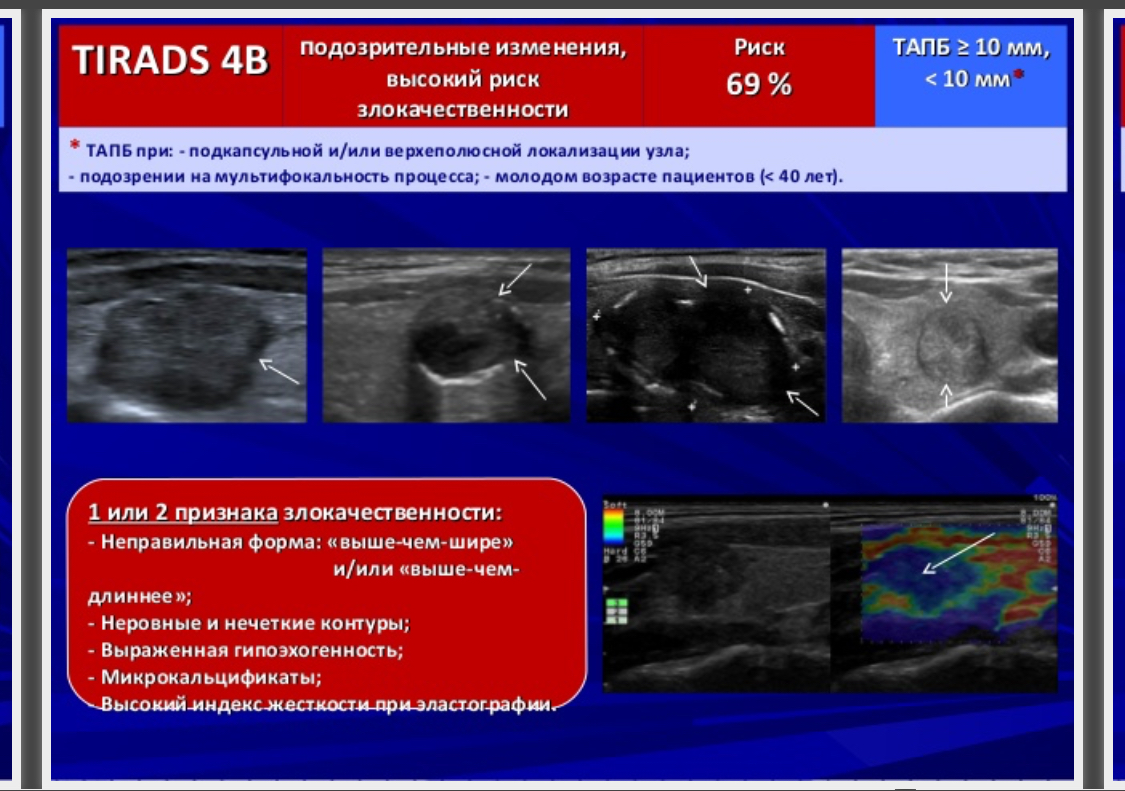
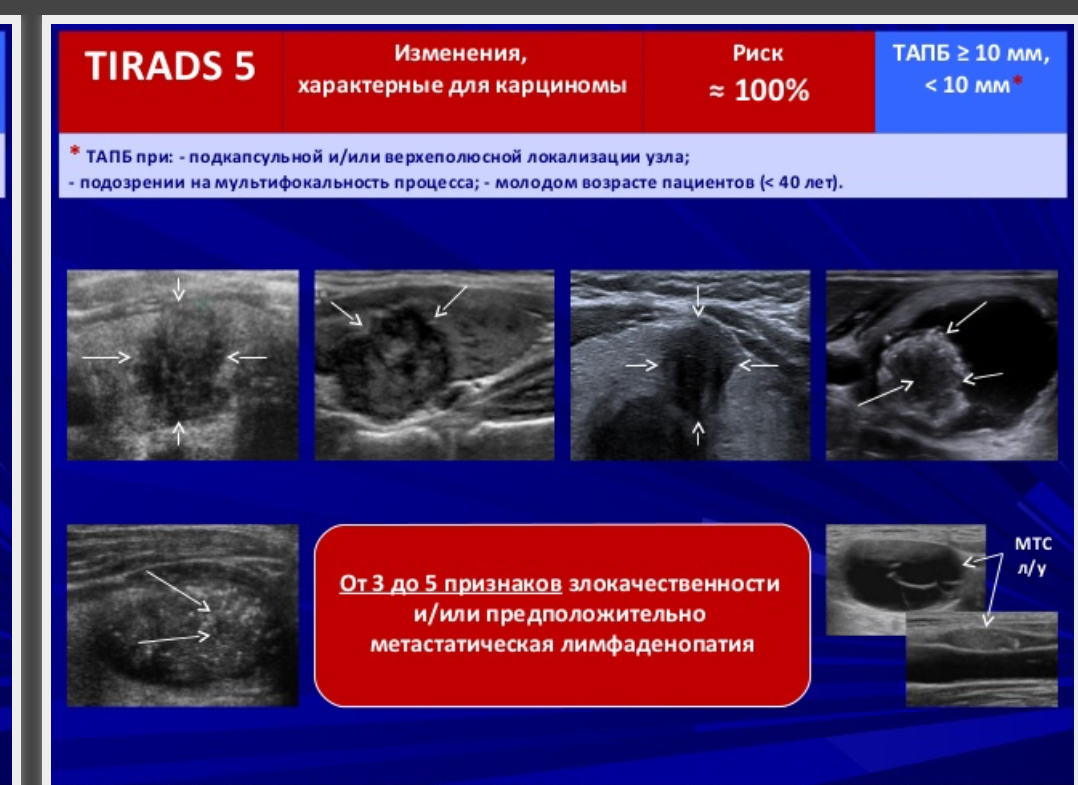
Ti rads 3 в щитовидной железе что означает
Эластография
В последнее время врачи столкнулись с эпидемией опухолей ЩЖ, вызванной улучшением технологии исследований, в первую очередь УЗИ. Ультразвуковая диагностика до сих пор является одним из основных методов лучевой визуализации при выявлении узлов щитовидной железы.
Основная диагностическая задача состоит в оценке добро- или злокачественности выявленных изменений, при этом размер узла не является определяющим фактором, проводить же массовую ТАПБ узловых образований (УО) ЩЖ нецелесообразно.
В связи с этим возникла необходимость в создании новой ультразвуковой классификации узлов ЩЖ, которая бы отвечала следующим требованиям:
Актуальность проблемы не вызывает сомнений – хирургическая тактика либо динамическое наблюдение находится в прямой зависимости от правильно проведенного исследования (категория TI—RADS. 2014)
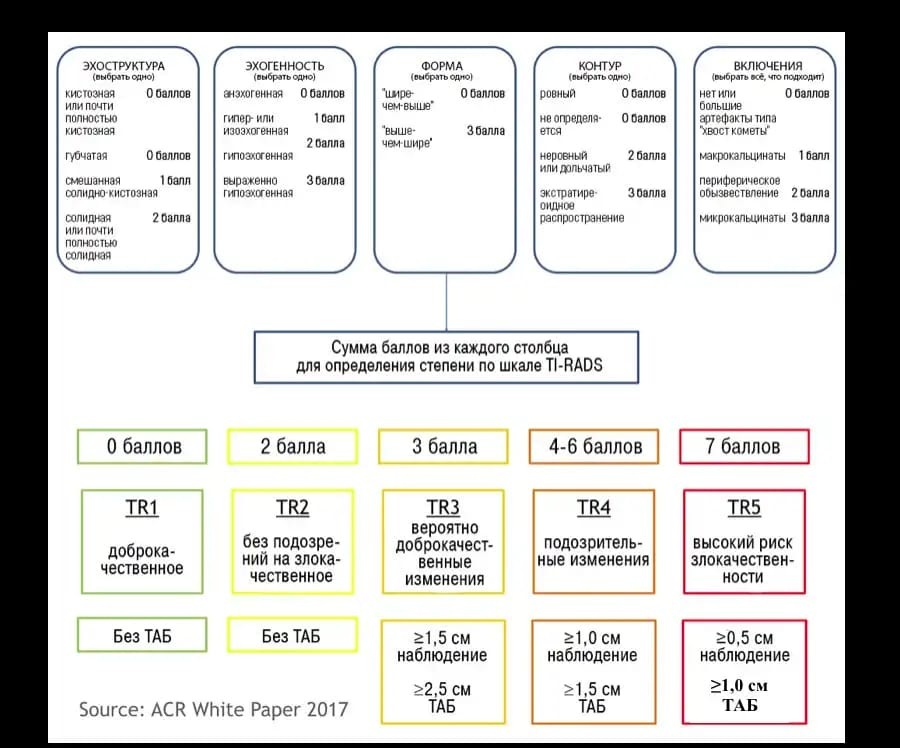
Классификация TI-RADS
TI-RADS – это акроним от Thyroid image reporting and data system. Классификация TI-RADS разработаннаяAmerikan Coiiege of Radiology (ACR) используется для того, чтобы определить дальнейшую тактику ведения пациентов, у которых выявили узловые изменения в щитовидной железе. В 2017 году разработана стандартизированная шкала оценки изменений щитовидной железы (шкала ACR TI-RADS), рекомендации для выполнения тонкоигольной аспирационной биопсии (ТАБ) и повторных исследований.
Схожая с классификацией ВI-RADS, в сонографической классификации TI-RADS выделяют:
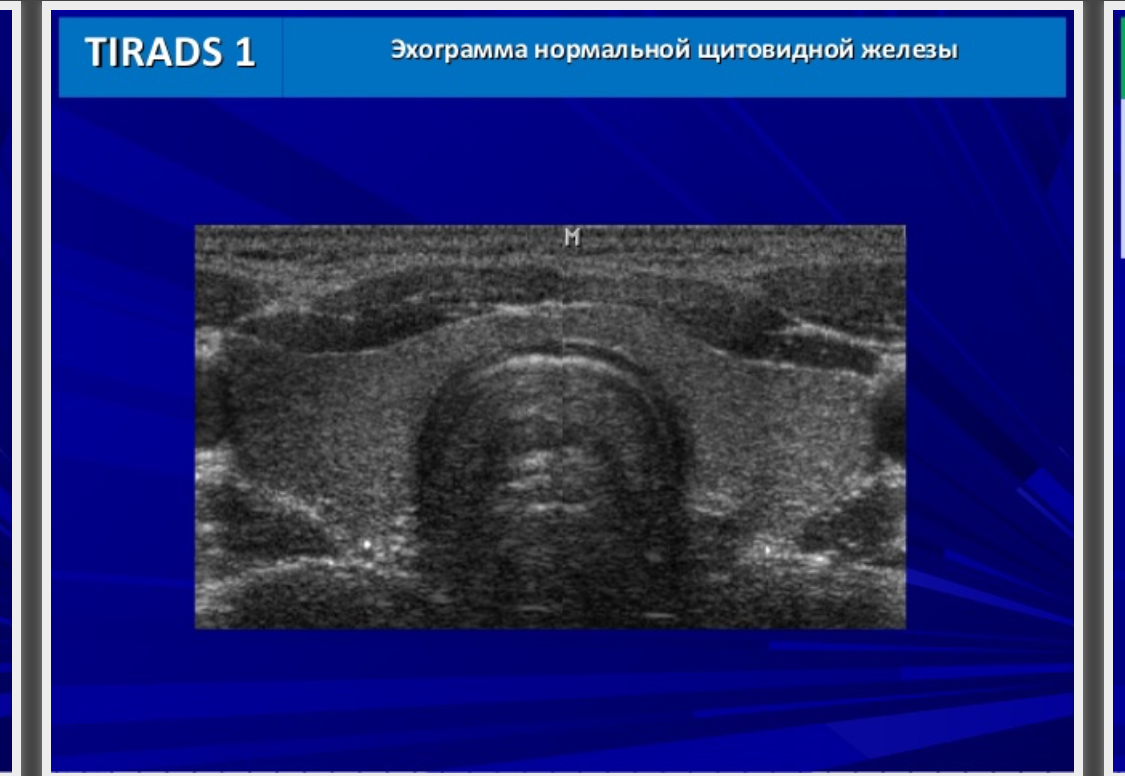
TI—RADS 1 – нормальная щитовидная железа
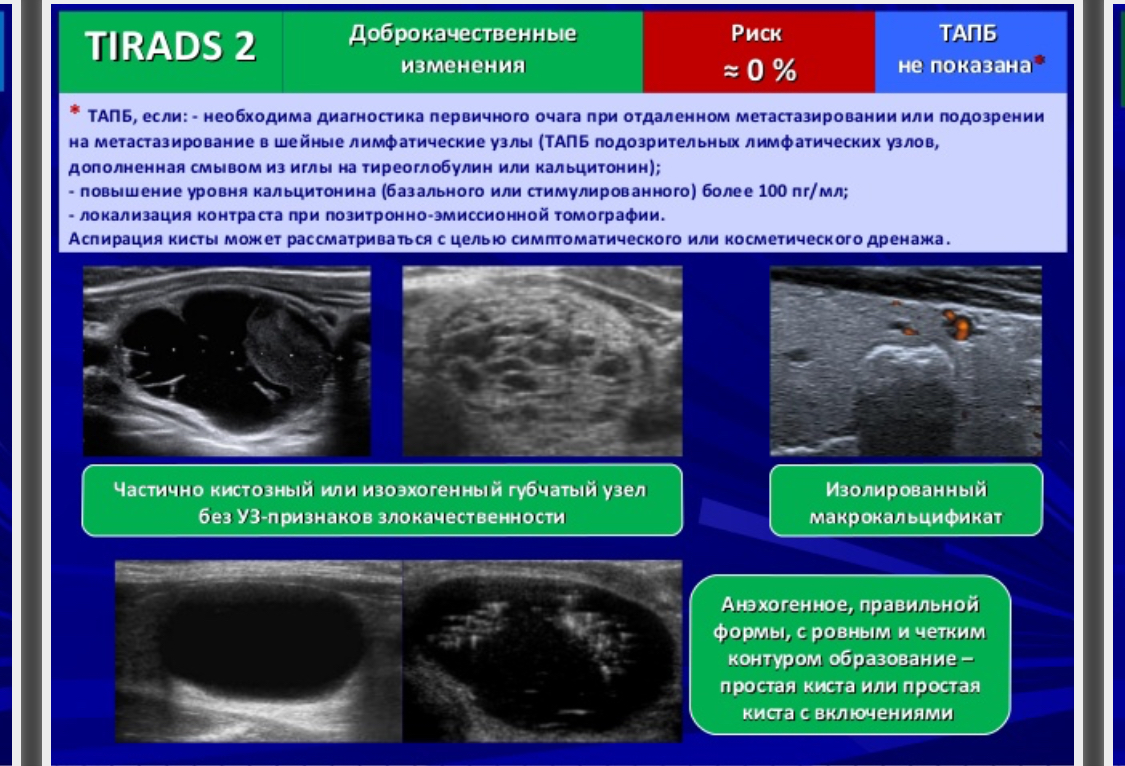
TI—RADS 2 – доброкачественные изменения в щитовидной железе.
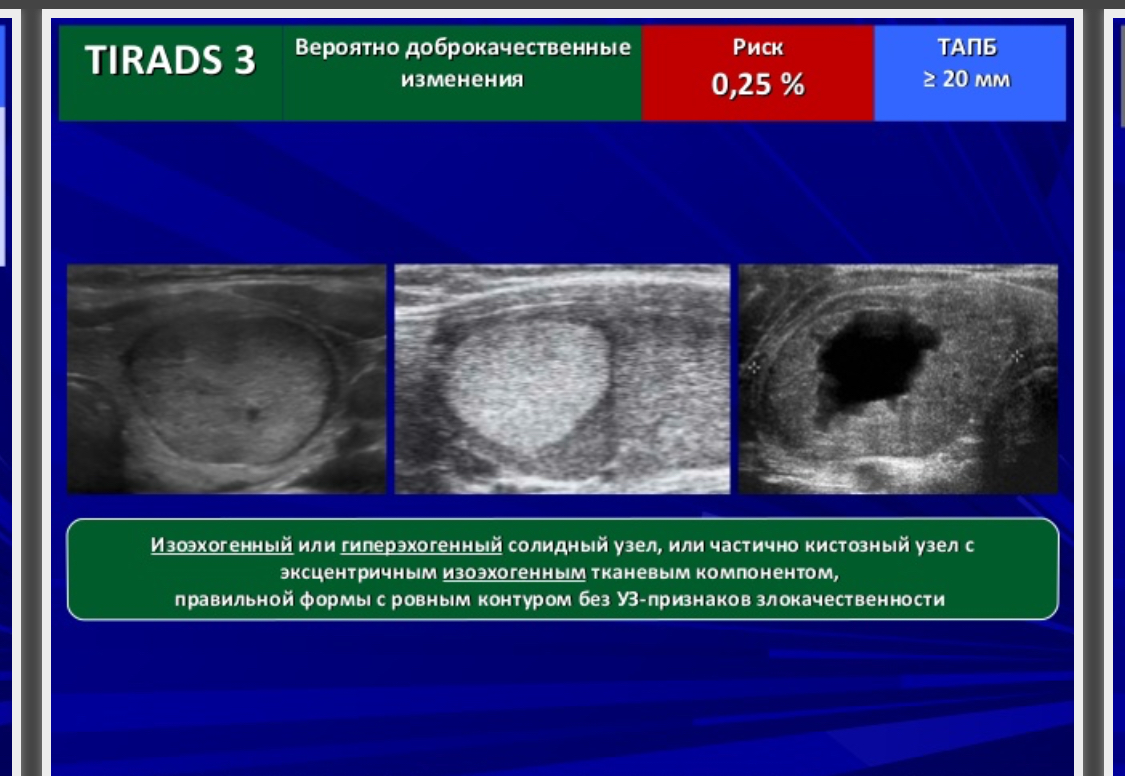
TI—RADS 3 – вероятно доброкачественные изменения в щитовидной железе.
TI-RADS 5 – вероятнее злокачественные изменения щитовидной железы ( более 80% вероятность злокачественности).
TI-RADS 6 – предшествующая биопсия доказала злокачественность
Предложенная классификация TI-RADS, основанная на данных УЗИ отражает дифференцировку узловых образований ЩЖ в зависимости от онкологического риска и позволяет:
— стандартизировать протокол УЗИ ЩЖ, минимизировать субъективный фактор в интерпретации ультразвуковой картины узловых образований ЩЖ;
— выработать единый кодифицированный подход к узловым образованиям ЩЖ со стороны врачей ультразвуковой диагностики и клиницистов.
-четко определить показания к проведению ТАПБ узловых образований ЩЖ;
-значительно сократить число неоправданных ТАПБ ЩЖ и необоснованных операций на ЩЖ.
Сегодня ультразвуковая диагностика, состоящая из:
— эхографии (В-режим) – метод визуального изучения органов и тканей
— допплерографии (режим ЦДК и ЭДК) – метод оценки движения жидкостей и тканей in vivo)
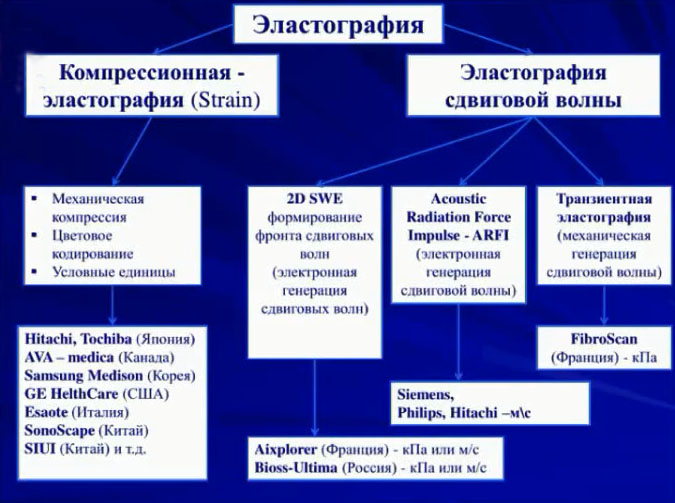
Термин «эластография» ( от лат. еlasticus – «упругий» и греч. урафw – «пишу») был предложен в 1991 году врачами исследователями из Хьюстона (США). Физической основой эластографии является модуль Юнга (английского физика XIX века), характеризующий свойства мягких тканей сопротивляться растяжению/сжатию при упругой деформации.
ОПРЕДЕЛЕНИЕ ЭЛАСТОГРАФИИ
ВИДЫ УЛЬТРАЗВУКОВОЙ ЭЛАСТРОГРАФИИ
В зависимости от различных техник исполнения эластографии, требуется разное время для оценки эластограммы.
УЛЬТРАЗВУКОВАЯ ЭЛАСТРОГРАФИЯ
Среди других методов оценки жесткости тканей наибольшее распространение получила технология ультразвуковой эластографии – ЭГ или соноэластография – СЭГ ( Elastography Sonoelastography) – визуализация тканей и органов с отображением различия эластичности ( или обратной ей характеристики – жесткости) нормальных и патологически измененных тканей на основе оценки локальной деформации при дозированной компрессии или вибрации.
Стандартизированная методика компрессионной эластографии ( strain— эластографии):
ИНФОРМАТИВНОСТЬ ЭЛАСТОГРАФИИ:
ПОКАЗАНИЯ ДЛЯ КОМПРЕССИОННОЙ ЭЛАСТОГРАФИИ
— новообразования поверхностно расположенных органов ( молочной железы, щитовидной железы, лимфатических узлов, мягких тканей)
— диффузные заболевания поверхностно расположенных органов ( молочной железы, щитовидной железы, лимфатических узлов, мягких тканей) – менее изучено
— новообразования органов малого таза ( предстательной железы,маьтки и ее придатков, лимфатических узлов)
ВЫВОДЫ
«Не все раки являются жесткими и не все жесткие области являются раком, так что говорить о эластографии как об инструменте, который обеспечивает четкое пороговое значение, является небезопасным»
Krouskop TA, Wheeler TM, Kallel F et al. Elastic moduli of breast and prostate tissues under compression. Ultrason Imaging 1998; 20:260-274
Эластография – это многообещающий метод, который может значительно улучшить результаты ультразвуковой диагностики щитовидной железы.
Основная задача эластографии – это выявление злокачественного перерождения. Ранняя диагностика, в частности тонкоигольная биопсия, ведет к назначению надлежащего лечения.
Эластография чаще используется для повышения уверенности в результате, особенно при совпадении с результатами стандартного исследования.
Эластография, по данным разных авторов, не является методом, который заменяет традиционное УЗИ в настоящее время, но в сочетании с ним является полезным инструментом повышенной чувствительности.
Метод ультразвуковой эластографии – это МЕТОДИКА – часть ультразвукового метода!
Рак узлов щитовидной железы
«Клиника щитовидной железы» доктора А.В. Ушакова предлагает высоко профессиональную помощь в экспертной оценке рака щитовидной железы.
Рак щитовидной железы ― формирование нетипичной ткани внутри узлов железы, с изменением качественных признаков клеточного состава и его структуры. Злокачественный процесс в узлах образуется в результате нарушения в системе иммунного контроля при интенсивном размножении клеток. В результате складывается матричная ветвь клеток с совершенно другими свойствами. В зависимости от источника клеток и выраженности их отличия от основного здорового клеточного состава, различается несколько вариантов рака в щитовидной железе. Помните: рак бывает только в узлах железы, вне узлов рака нет.
Основные варианты рака щитовидной железы
Папиллярный рак ― наиболее часто встречающийся злокачественный процесс щитовидной железы. По данным разных исследователей, частота папиллярного рака составляет около 70-80% от всех случаев тиреоидной злокачественности. При этом папиллярный рак является наименее агрессивным. Узлы с таким раком могут многие годы присутствовать в железе, никак не проявляя себя и не распространяя свою ткань за пределы узловой границы. Метастазирование при этом раке не характерно.
Фолликулярный рак щитовидной железы встречается реже папиллярного (почти в 10-15% среди всех вариантов злокачественности). Это более активный тканевой процесс. При фолликулярном раке на стадиях активного развития может наблюдаться прорастание ткани из узла, а также присутствует вероятность метастазирования раковых клеток в лимфоузлы.
Медуллярный рак образуется, в отличие от двух первых вариантов, из С-клеток, участвующих в продукции кальцитонина ― гормона, регулирующего кальциевый обмен. Вот почему при выявлении узлов предлагается проведение анализа крови с оценкой концентрации кальцитонина. Это более агрессивная форма рака, но встречаемость его очень мала (1-3%). Медуллярному раку свойственно метастазирование.
Анапластический рак является самым активным и потому агрессивным. Встречается реже других вариантов рака. Метастазирование при этом случае рака значительно выражено.
Диагностика рака щитовидной железы
Рак щитовидной железы обычно не имеет симптомов. Содержание популярных статей вида «10 симптомов рака щитовидки», как правило, не соответствуют реальности. Лишь крайне редко и в очень запущенных случаях агрессивных вариантов рака щитовидной железы может быть охриплость голоса из-за раздражения возвратного нерва. Выступание наружу узла железы ― не признак рака.
Только 4% узлов щитовидной железы, выявляемых при УЗИ, оказываются раком. Тем не менее, каждый узел требует внимательного исследования для исключения или подтверждения злокачественного процесса.
В настоящее время распространены и применяются два способа диагностики рака узлов щитовидной железы ― УЗИ и цитологическое исследование после пункционной биопсии. Ультразвук служит для выявления узла и оценки его качеств. Результат УЗИ помогает определиться с показанием к диагностической пункции узла. При таком показании (в 80-90% случаях) пациенту рекомендуется пункция узла, получение элементов ткани (биопсия) и последующее цитологическое исследование под микроскопом (осуществляет врач-морфолог).
Кроме указанных способов, существует геномный способ диагностики щитовидного рака. Одним из вариантов этого исследования является методика Afirma Genomic Sequencing Classifier (GSC), позволяющий достовернее выявлять рак узлов щитовидной железе по сравнению с предшествовавшим вариантом ― Afirma Gene Expression Classifier (GEC).
Предполагается, что геномная диагностика рака подходит для тех случаев диагностики, когда после УЗИ и цитологического исследования биоптата был получен сомнительный вывод.
И всё же, геномная методика Afirma GSC не обладает 100% результатом. Её применение лишь на несколько процентов повысило вероятность подтверждающего ответа, достигнув лишь 91% по уровню чувствительности теста. В результате, среди узлов, «подозрительных» на вероятность рака, геномная методика окажет помощь с точностью до 68%.
TI-RADS в диагностике рака
УЗИ при раке щитовидной железы
УЗИ представляет не только первый, но и наиболее важный способ диагностики рака. Очень многое в этом исследовании зависит от знаний, опыта и внимания специалиста. Не следует пренебрегать возможностями УЗИ в пользу цитологической диагностики и полностью полагаться на последнее, которое часто бывает малоконкретным.
В настоящее время различают 5 ультразвуковых признаков злокачественности узла. Их выраженность, сочетание и количество в определенной мере будут указывать на вероятность рака.
1. Изменение границы узла. Врач должен внимательно во всех проекциях рассмотреть границу узла и оценить, насколько она заметная, равномерная и чёткая. При отсутствии явной границы (плавном переходе ткани узла в окружающую ткань), её извитости, присутствии заметных выступов и т.п. можно предположить активный внутриузловой процесс и прорастание ткани из узла.
2. Гипоэхогенная ткань в узле (темная ткань). Размножение клеток в узле (пролиферация) может приводить к формированию плотных клеточных масс, которые при УЗИ становятся заметны в виде гипоэхогенности, т.е. более темного фона. Это явление может быть вызвано совершенно иным, а именно доброкачественным процессом, исходящим от проникновения (инфильтрации) лимфоцитов или микрофолликулярной ткани аденомы. Важно обращать внимание на форму и границы этой гипоэхогенной зоны. При её плавном равномерном крае, постепенно переходящим в остальную ткань узла или ограниченной пределом узлового сегмента, процесс является доброкачественным. Важно не путать гипоэхогенность и анэхогенность.
3. Микрокальцинаты. Это явление заметно в виде множества мелких светлых точек среди ткани узла. Эти образования могут не распространять гипоэхогенную тень от ультразвукового датчика. Но не все светлые точки и линии являются микрокальцинатами. Помните, что врач должен суметь отличить их от мелких скоплений коллоида и от уплотнения соединительной ткани. Иначе, приняв последние два варианта за микрокальцинаты, может быть выявлена высокая вероятность рака и даже назначена операция.
4. Несоответствие формы узла форме доли. В этом случае при УЗИ щитовидной железы передне-задний размер узла будет больше его других размеров. Иначе говоря, наибольший размер узла будет располагаться не вдоль доли, а поперек. Такая особенность указывает на незакономерный рост клеток. Форма (соответственно и размеры) доброкачественных узлов стремится к правильной (сфере или эллипсу). Ткань в доброкачественных узлах разрастается или равномерно (способствуя сферичности), или в направлении полюсов доли (т.е. вдоль, а не поперек доли).
5. Неупорядоченный кровоток в узле. В допплеровских режимах УЗИ (при ЦДК или ЭДК) врач должен проверить особенности кровотока. Понятие «смешанный» кровоток не несет пользы в оценке рака узла. Смешанный кровоток (т.е. по краю и внутри узла) случается при всех узлах и поэтому не может указывать на вероятность злокачественности. Напротив, упорядоченность сосудистой сети узла может свидетельствовать как в пользу доброкачественности, так и ориентировать в вероятности рака узла. Под упорядоченностью кровотока понимается распределение сосудов преимущественно по границе сегментов (т.е. вокруг узла и внутри него в области перегородок между его частями).
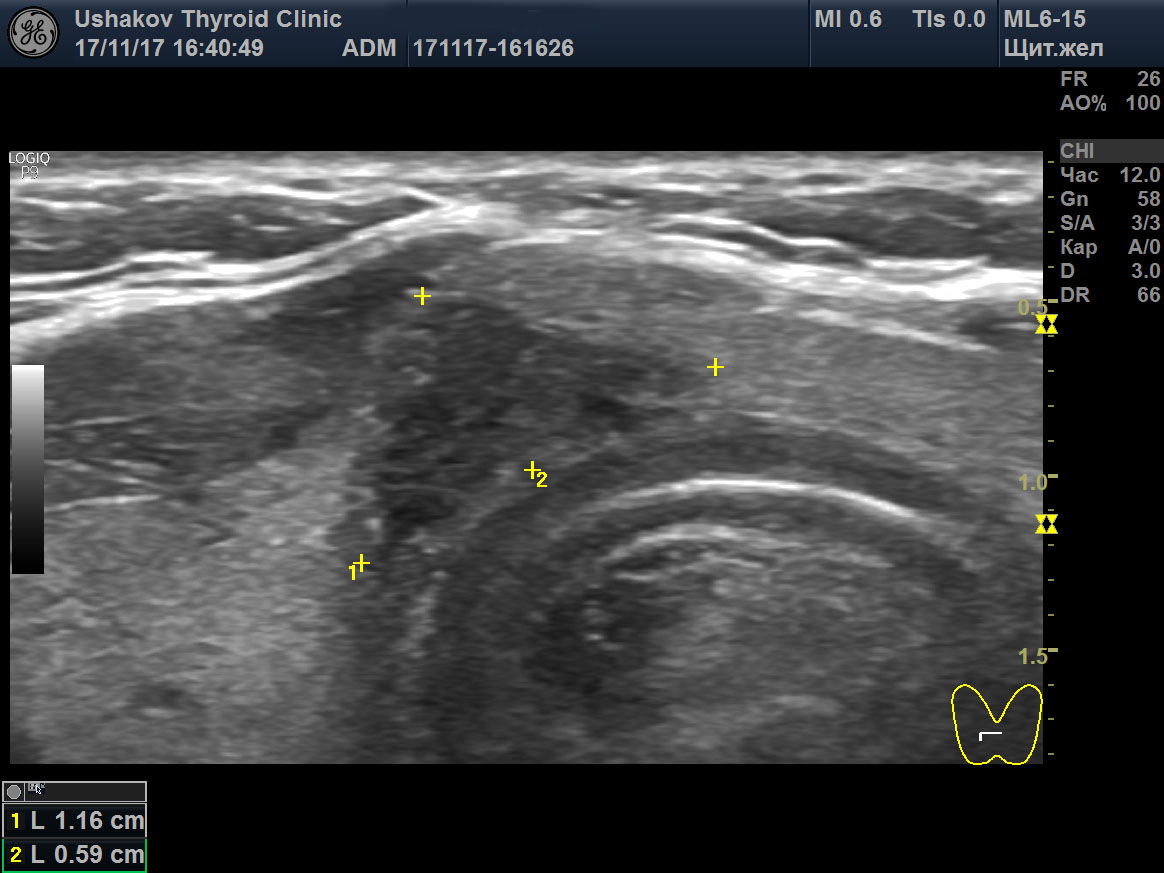 | 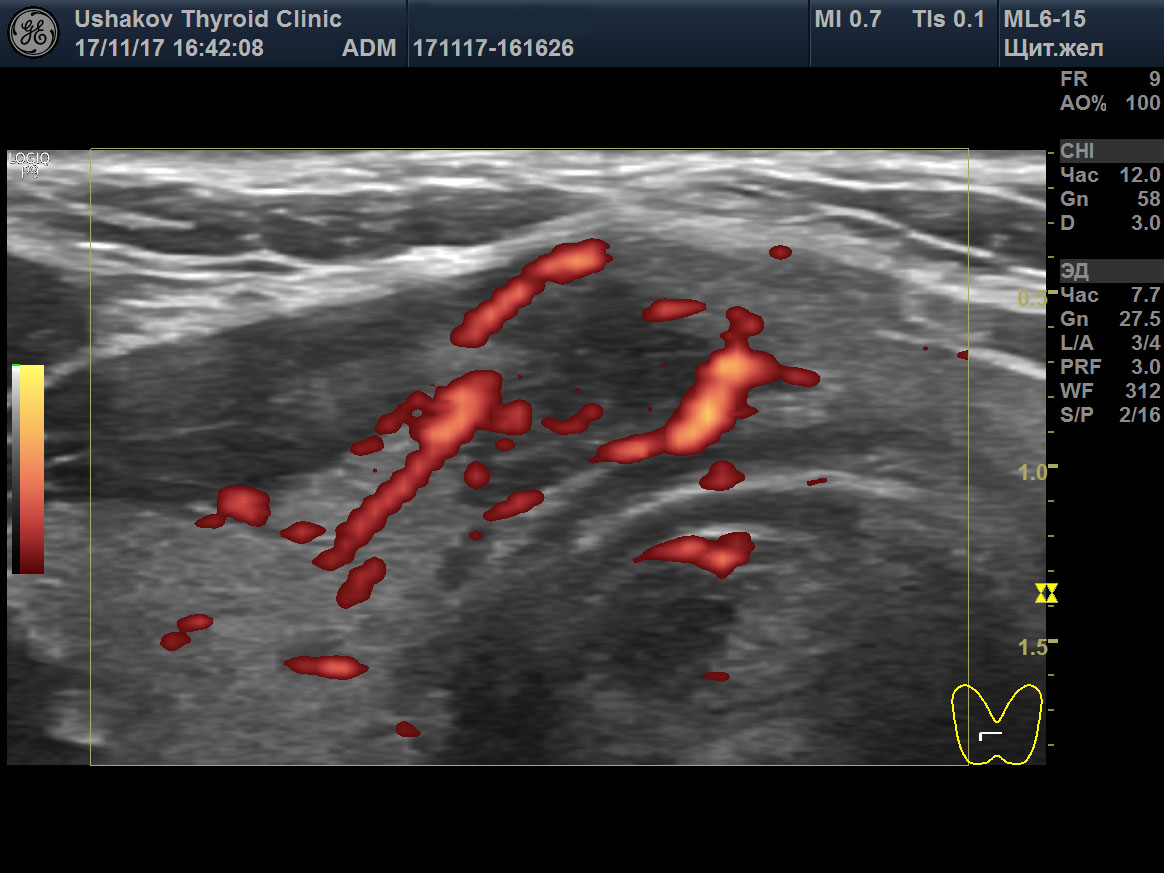 |
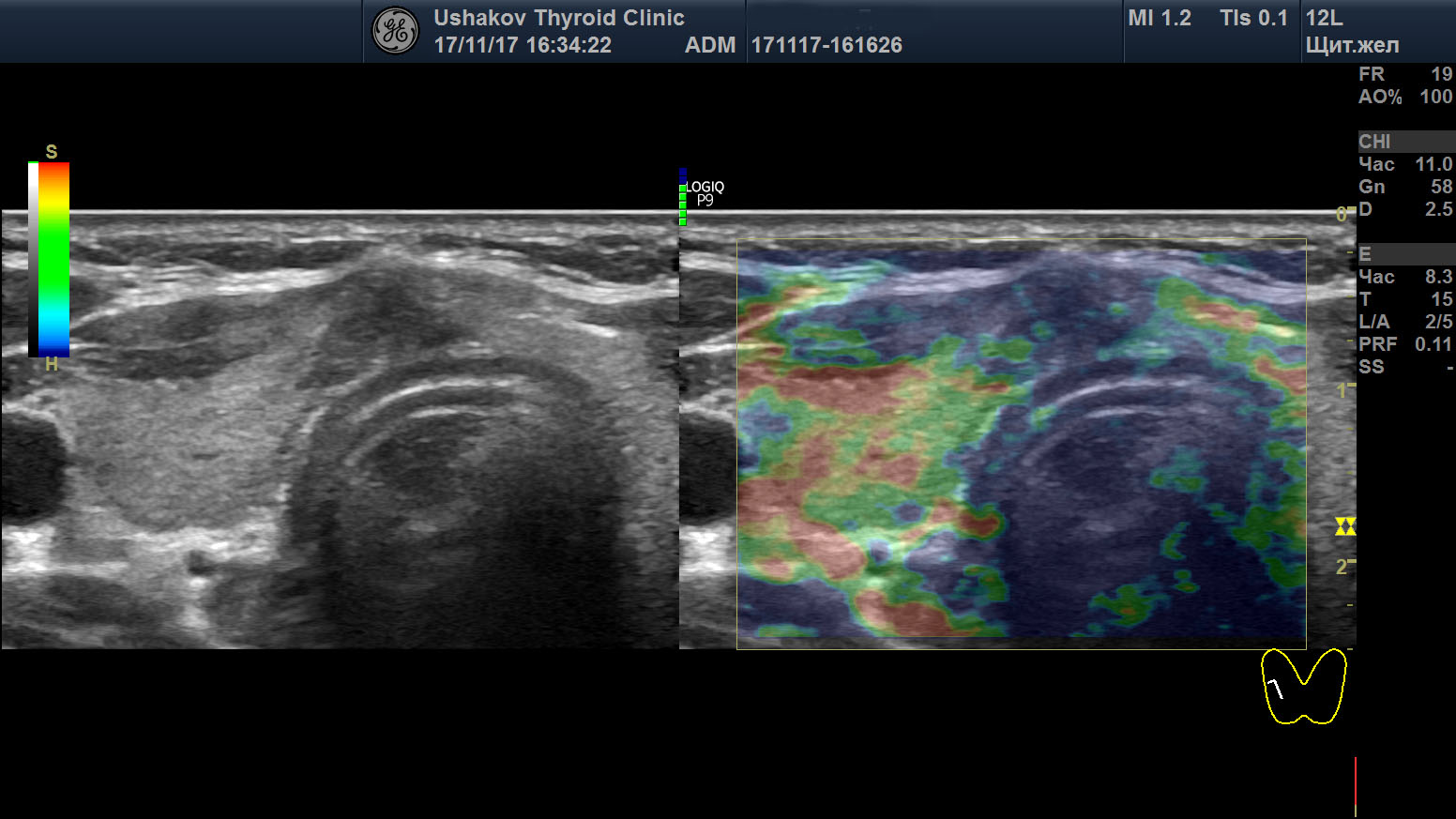
| Рисунок 1. В правой части перешейка щитовидной железы узел с признаками рака: 1) неправильная форма, вытянут не вдоль, а поперёк перешейка, 2) содержит значительно гипоэхогенную ткань, 3) граница узла в некоторых участках прерывистая. Класс по TI-RADS соответствует 4С. | Рисунок 2. Этот же узел в режиме ЭДК. Кровоток узла значительной интенсивности с признаками неупорядоченности распределения сосудов. |
Рисунок 3. Этот же узел в режиме компрессионной эластографии. Значительно увеличена жесткость узловой ткани ― признак плотного расположения клеток в ткани узла (свойственно злокачественности).
Важные требования при УЗИ. При выявлении узла или узлов в щитовидной железе врач-сонолог должен внимательно исследовать все узлы, оценив их качества по указанным пяти признакам. В случае присутствия одного или большего количества таких признаков или в случае сомнений, а также при контрольном (проверочном) УЗИ после выявленного другим врачом «рака узла», специалист должен описать в «Протоколе УЗИ щитовидной железы» все 5 признаков (показав доброкачественные или злокачественные свойства). В разделе «Заключение» медицинского документа «Протокол УЗИ щитовидной железы» каждый узел должен быть оценён классом по системе TI-RADS.
Классификация узлов TI-RADS
Классификация узлов TI-RADS (по J.Y. Kwak et all., 2011) создана для определения показания к проведению пункционной биопсии. Диагностика узлов по TI-RADS ― не оценка рака и не «приговор», как могут думать пациенты. TI-RADS ― это интеллектуальный инструмент врача в: 1) характеристике узлов щитовидной железы с позиции вероятности рака в системе передачи информации от одного врачу другому и 2) формировании показания для пункционной биопсии.
| TI-RADS | Признаки | Вероятность рака |
| 1 | норма (макроструктурна полноценность) | 0% |
| 2 | доброкачественные | 0% |
| 3 | возможно доброкачественные | 0-4% |
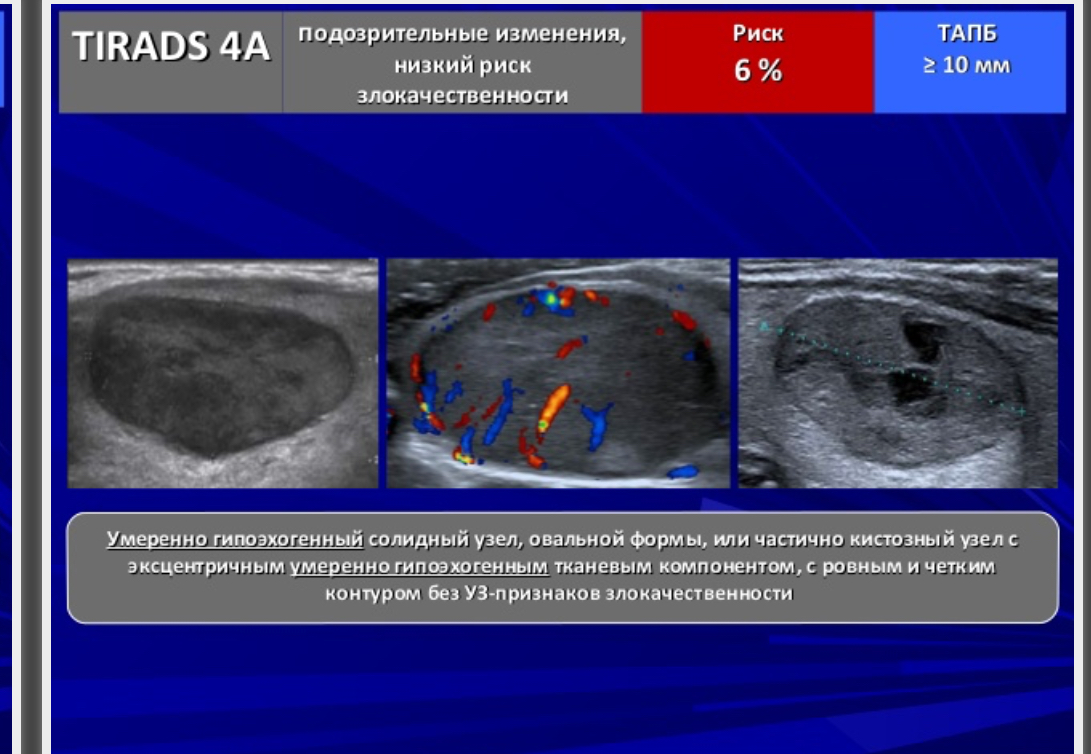
| 4А | 1 признак рака | до 10% |
| 4В | 2 признака рака | 10-80% |
| 4С | 3 или 4 признака рака | 80% |
| 5 | 5 признаков рака | >80% |
| 6 | цитологическое подтверждение рака | >90% |
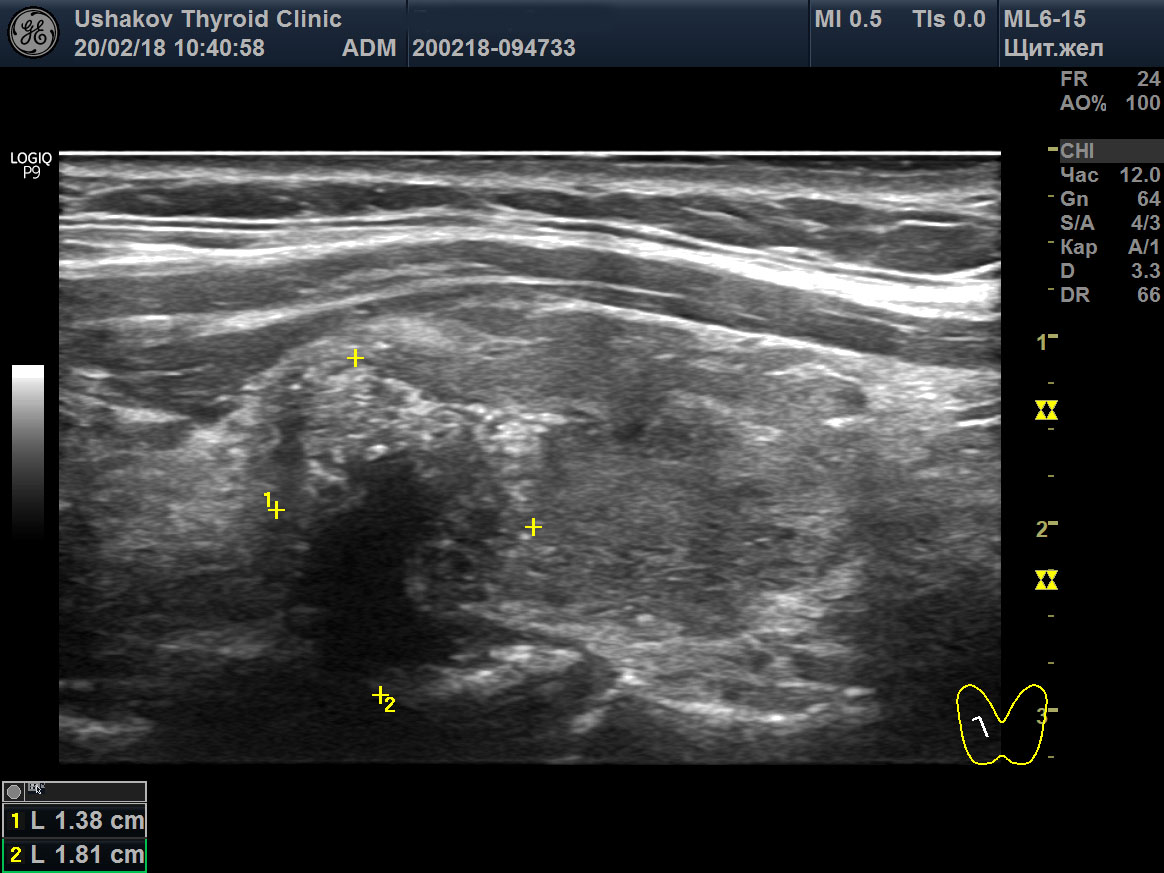 | 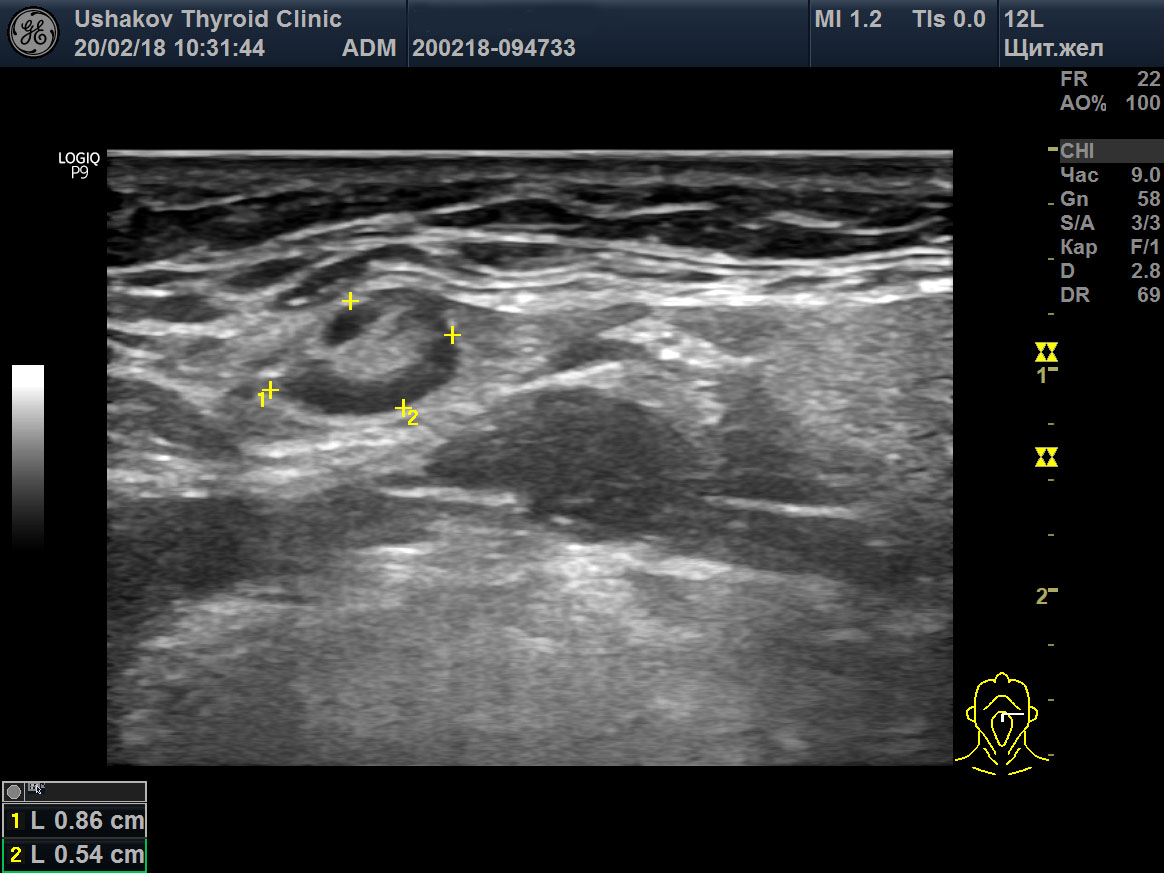 |
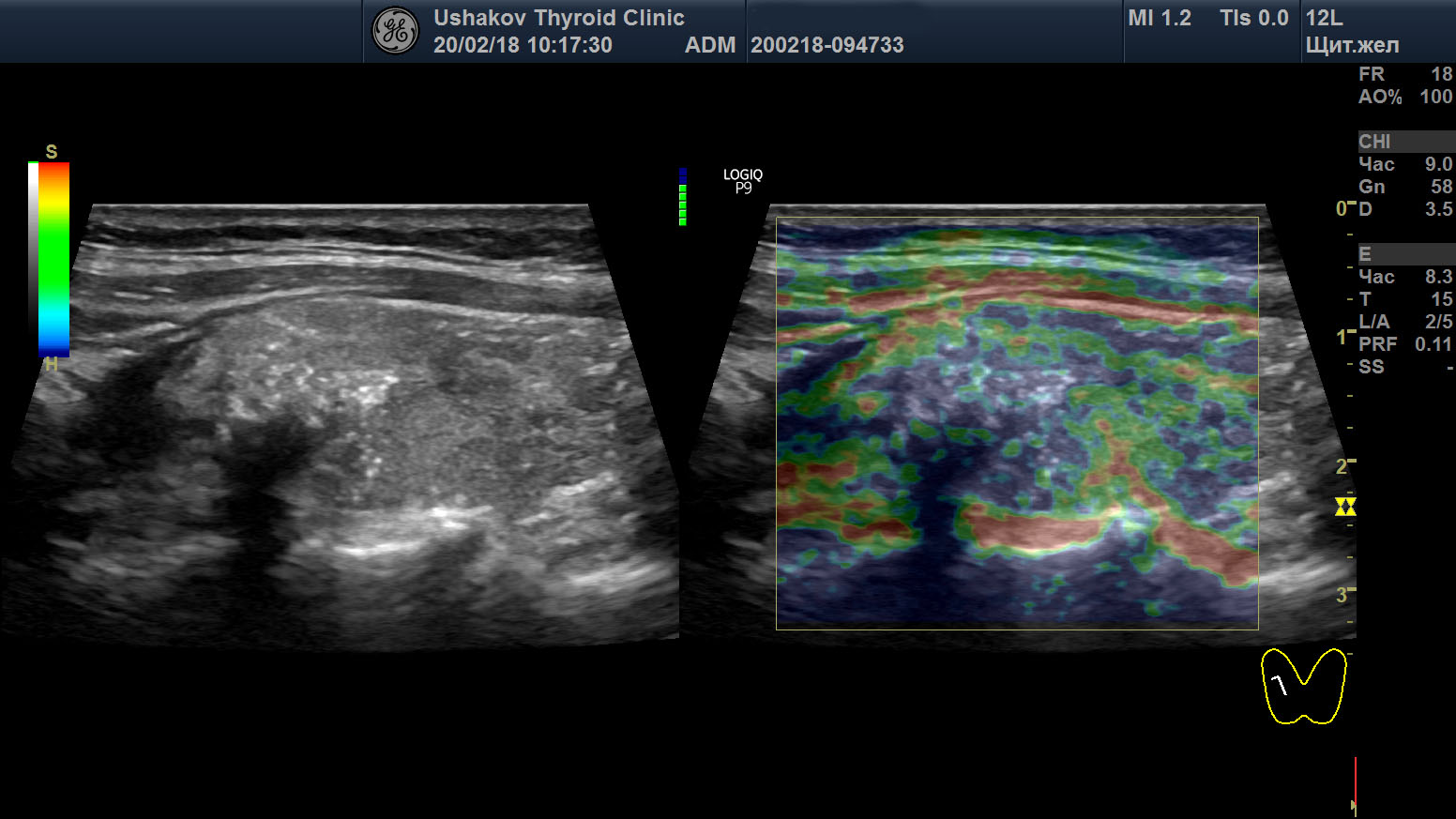
| Рисунок 4. Узел верхней (краниальной) части правой доли щитовидной железы (ограничен желтыми метками). Признаки рака узла: 1) неправильная форма, 2) неравномерный край узла, местами прерывистая граница, 3) значительно гипоэхогенная (темная) зона внутри узла, постепенно переходящая в остальную ткань, 4) микрокальцинаты. Класс по TI-RADS соответствует 4С. | Рисунок 5. Изменённый регионарный лимфатический узел. Отношение сторон меньше коэффициента 2 (округлый), внутри определяется значительное разрастание ткани (признак метастазирования). |
Рисунок 6. Этот же узел в режиме компрессионной эластографии. Значительно увеличена жесткость узловой ткани ― признак плотного расположения клеток в ткани узла и её разрушения с накоплением жидкости (свойственно злокачественности). Микрокальцинаты определяются в виде скоплений мелких белесых точек.
Цитологическая диагностика проводится после пункционной биопсии узла щитовидной железы (обязательно под контролем УЗИ!). В результате пациенту предоставляется медицинский документ «Протокол цитологического исследования». В этом документе, помимо анкетных данных и мест забора материала из узла или узлов, должны находиться два раздела ― «Описание» и «Заключение».
Протокол без «Описания» мало информативен и потому не имеет реальной клинической пользы. Дело в том, что только по данным подробного описания того, что врач-морфолог увидел в микроскоп, можно сделать вывод о реальности рака или его отсутствии. Из «Описания» следует краткий вывод ― «Заключение», но из «Заключения» никакое «Описание» не создать. Если в «Заключении» лишь предполагается рак (например, «фолликулярная опухоль» и/или класс Батесда 4), то оценить его реальность можно только по данным «Описания»! Требуйте от врача соблюдения оформления медицинской документации. Это в ваших собственных интересах.
Обращайте особое внимание на стиль текста «Протокола цитологического исследования. Есть уверенность ли предположение (подозрение)? На каких конкретных признаках основано одно или другое? Что это за признаки ― общие (неконкретные) или чётко указывающие на определённое изменение?
В случаях предположительности и неточности обязательна дополнительная диагностика. Лучше в другом медучреждении у другого специалиста. Впрочем, контрольную диагностику желательно проводить в любом случае, для того, чтобы убедиться в достоверности диагноза.
Восемь важных советов
2. Заранее поясняйте специалисту перед диагностической процедурой свои требования к результату исследования. Это относится к данным УЗИ и, особенно, ― к «Протоколу цитологического исследования биоптата щитовидной железы».
3. Во время УЗИ, в случае выявления узлов, специалист должен исследовать регионарные лимфатические узлы шеи. Обратите на это внимание.
4. Вместе с протоколом УЗИ, как минимум, обязательно должны быть представлены снимки узла (или узлов) в двух основных проекциях и в режиме ЦДК (или ЭДК). Это современное требование к формированию «Протокола УЗИ щитовидной железы» (себестоимость одного снимка мала; не превышает 10-15 руб.).
5. После получения диагностического «Протокола» внимательно изучите его. Проверьте присутствие в нем нужных пунктов и их содержание. Заранее изучите, что именно должно быть в разделах «Протокола».
6. Помните, что «атипичными клетками» могут являться доброкачественные клетки, измененные в результате перенапряжения.
7. Увеличение тиреоглобулина по данным анализа крови не является маркером рака. Поэтому не следует беспокоиться при увеличении значения этого показателя. Тиреоглобулин постоянно выделяется из щитовидной железы в кровь вместе с гормонами (Т4 и Т3). Увеличение концентрации тиреоглобулина ― признак интенсивной деятельности ткани или её разрушения. Может быть увеличена при разрушении ткани доброкачественного узла и при подостром тиреоидите.
8. Вы всегда можете получить второе профессиональное мнение. При необходимости, сделайте контрольное УЗИ щитовидной железы. Нередко случается, что врачи при УЗИ принимают за узлы очаговые диффузные образования (в таком случае пациенту напрасно проводится пункционная биопсия), или доброкачественные признаки трактуются как злокачественные.
«Клиника щитовидной железы» доктора А.В. Ушакова предлагает высоко профессиональную помощь в экспертной оценке рака щитовидной железы.
О необходимости внедрения классификации TI-RADS в России
Полный текст:
Аннотация
В мировых профессиональных медицинских сообществах продолжается активное обсуждение модификаций системы стратификации признаков злокачественности узлов щитовидной железы TI-RADS (англ. Thyroid Imaging Reporting And Diagnostic System). Система предназначена в первую очередь для отбора узлов для выполнения пункционной биопсии. Классификация должна быть единой для всех медицинских учреждений нашей страны, простой в использовании и понятной для врачей различных специальностей. В статье представлена модификация TI-RADS, подготовленная для обсуждения в профессиональных сообществах России. Выделены “большие” эхопризнаки (специфичность ≥95%), наиболее характерные для рака щитовидной железы, и “малые” признаки (специфичность ≥90%), дополнительные, позволяющие перевести узел из категории TI-RADS 3 в категорию TI-RADS 4 для выполнения пункции. При сравнении показателей диагностической информативности данного варианта TI-RADS с европейским (EU-TIRADS) отмечено, что оба варианта имели одинаковую специфичность – 93%. Отечественный вариант несколько превышал европейский по показателям чувствительности, соответственно 94,2 и 91,0%, что можно объяснить учетом дополнительных “малых” признаков злокачественности, что позволяет рекомендовать к обсуждению в России предложенный отечественными экспертами вариант TI-RADS.
Ключевые слова
Для цитирования:
Фисенко Е.П., Сенча А.Н., Катрич А.Н., Сыч Ю.П., Цветкова Н.В., Борсуков А.В., Костромина Е.В. О необходимости внедрения классификации TI-RADS в России. Клиническая и экспериментальная тиреоидология. 2019;15(2):55-63. https://doi.org/10.14341/ket10115
For citation:
Fisenko E.P., Sencha A.N., Katrich A.N., Sych Yu.P., Tsvetkova N.V., Borsukov A.V., Kostromina E.V. Оn the need to introduce the TI-RADS classification in Russia. Clinical and experimental thyroidology. 2019;15(2):55-63. (In Russ.) https://doi.org/10.14341/ket10115
Система стратификации признаков злокачественности узлов ЩЖ TI-RADS должна быть проста в применении и понятна не только специалистам, выполняющим пункционную биопсию узлов ЩЖ, но и тем врачам первичного звена (в первую очередь специалистам ультразвуковой диагностики), которые чаще первыми дифференцируют очаговые изменения ЩЖ и должны решить вопрос о передаче пациента в службы (специалистам-клиницистам), непосредственно занимающиеся морфологической оценкой и определением дальнейшей тактики ведения пациента. На это в очередной раз обращено внимание в последних предложенных вариантах TI-RADS американскими и европейскими коллегами [1, 2].
Система TI-RADS также предполагает стандартизацию обмена медицинской информацией между врачами-клиницистами (эндокринологами, хирургами) и специалистами ультразвуковой диагностики, что требует более быстрой валидации данной системы в РФ с закреплением этого в клинических рекомендациях для двух специальностей: эндокринологии и ультразвуковой диагностики.
Дифференцировка узлов ЩЖ часто проводится не столько по наличию основных признаков злокачественности (раки), сколько по их отсутствию (доброкачественные образования) [3, 4]. Однако хорошо известно, что рак щитовидной железы (РЩЖ) имеет много “масок” (клинических, ультразвуковых, цитологических) и часто имитирует доброкачественную природу узла.
Набор эхопризнаков, наиболее часто встречающихся при РЩЖ при мультипараметрическом УЗИ, практически совпадает в большинстве литературных источников [5–10], что представлено и в Российских клинических рекомендациях по диагностике и лечению высокодифференцированного РЩЖ у взрослых (2017) [11]:
– снижение эхогенности узла;
– вертикальная пространственная (или непараллельная) ориентация узла или “размеры выше больше, чем шире”;
– наличие микрокальцинатов в узле;
– неровные (мелкодольчатые, звездчатые, лучистые) и нечеткие контуры.
Эти признаки являются высокоспецифичными (таблица), что подтверждается многочисленными исследованиями, в том числе метаанализом [5, 9, 10, 12–20].
Таблица. Показатели специфичности эхографических признаков злокачественности в узлах щитовидной железы по данным различных авторов
Автор
УЗ-признак
Неровный контур
Вертикальная ориентация
Снижение эхогенности
Микрокальцинаты
В работах последних лет обращено внимание, что признак “понижение эхогенности” узлов ЩЖ следует подразделять на “умеренное” и “значительно сниженное” [1, 2]. При этом специфичность признака “выраженное снижение эхогенности” значительно превышает “умеренное снижение эхогенности” узла в диагностике РЩЖ [19, 20].
Наибольшие разногласия возникают при обсуждении термина “нечеткие границы” узла, что связано с субъективной оценкой врача-оператора. Известно, что доброкачественные гиперпластические процессы, представленные узловыми образованиями, часто не имеют капсулы, в связи с чем четкость их контуров тем хуже определяется, чем меньше размер очага [14, 20, 21], что приводит к гипердиагностике инвазивных процессов. Использование высокочастотных датчиков (12–18 МГц) позволяет определить микродольчатость, лучистость/игольчатость/звездчатость инфильтрирующих краев опухоли, что более важно для проведения дифференциально-диагностического процесса [1, 20].
Основные противоречия представленных в литературе модификаций TI-RADS сводятся к распределению узлов в категориях Т3 и Т4, Т5. В первой группе более ранних вариантов TI-RADS в категорию Т3 предложено определять узлы без перечисленных выше признаков злокачественности, соответственно начиная с Т4 – с признаками злокачественности [5–9]. Пункцию предложено выполнять и в категории Т3 (однако не представлены критерии отбора узлов для пункции в данной категории), и в категориях Т4, Т5. Распределение узлов в Т4 и Т5 определяется количеством выявленных признаков злокачественности. При этом Т4 подразделяется на подкатегории (2 или 3).
Во второй группе вариантов TI-RADS предложено отказаться от подразделения Т4 на подкатегории, что значительно облегчает работу. Разделение на категории преимущественно идет по характеру их эхогенности [1, 2].
В нашей стране также продолжается обсуждение классификации TI-RADS. Выделены ультразвуковые признаки, по которым происходит отбор узлов из категории Т3 (изо- или гиперэхогенных) в Т4 для пункции (согласно логике системы BI-RADS, а именно она взята в основу TI-RADS [22], узел, требующий выполнения биопсии, из Т3 (категория для динамического наблюдения узлов) должен быть перенесен в категорию Т4). Основными критериями в этом случае для узлов ЩЖ являются следующие “малые” ультразвуковые признаки злокачественности, полученные в В-режиме [19, 23, 24]:
– умеренное снижение эхогенности или неравномерная эхогенность узла (наличие гипоэхогенных включений);
– округлая форма узла;
– неравномерной толщины хало вокруг узла;
– наличие макрокальцинатов в узле.
Таким образом, появление этих признаков в гипер- или изоэхогенных узлах указывает на необходимость их морфологической оценки, т.е. перевода в категорию Т4 для выполнения пункционной биопсии.
К “малым” признакам отнесены также патологический интранодулярный сосудистый рисунок (по результатам применения цветокодированных режимов) и высокая жесткость узла (по результатам применения количественных и качественных параметров ультразвуковой эластографии). Эти методики широко внедряются в мировой ультразвуковой диагностике, однако на настоящий момент для оценки узлов ЩЖ являются дополнительными [23, 25]. При наличии соответствующей аппаратуры эти признаки могут быть определены как на этапе первичного диагностического поиска, так и на этапе непосредственного решения вопроса о выполнении биопсии при использовании оборудования высокого или экспертного класса.
Суммируя вышесказанное, мы предлагаем на страницах журнала обсудить возможный вариант TI-RADS, приемлемый для всех служб в нашей стране, и, возможно, сформировать общие рекомендации.
Проект TI-RADS
TI-RADS 1. Нет очаговых изменений в паренхиме ЩЖ.
TI-RADS 2. Очаговые образования, не требующие морфологической оценки (макрофолликулы; губчатые или кистозные узлы), представленные на рис. 1.
TI-RADS 3. Очаговые структуры, требующие динамического наблюдения без выполнения биопсии (гипер- или изоэхогенные образования с ровными контурами, в том числе на фоне аутоиммунного тиреоидита; кальцинированные узлы по типу “яичной скорлупы”) (рис. 2).
Пункция в категории TI-RADS 3 возможна по настоянию пациента или при наличии клинической необходимости по рекомендации лечащего врача.
При отрицательной динамике в процессе выполнения динамического мониторинга предполагается перевод в категорию TI-RADS 4 узлов, которые за 6–12 мес наблюдения значительно изменили свои характеристики в В-режиме:
– увеличились размеры узла (объем увеличился более чем на 30%);
– узлы приобрели шаровидную форму, появились кальцинаты, деформация капсулы узла (и/или капсулы ЩЖ);
– появились патологически измененные лимфатические узлы шеи, не выявляемые ранее.
Все гипоэхогенные узлы предлагается отнести в категории 4 и 5.
Рис. 1. Категория TI-RADS 2: а – кистозно расширенный или макрофолликул; б – губчатый узел (стрелки).
Рис. 2. Категория TI-RADS 3: а – изоэхогенный очаг (стрелки), окруженный тонким хало (узловой зоб); б – гиперэхогенный очаг округлой формы, с четкими контурами, тонким гипоэхогенным ободком на фоне аутоиммунного тиреоидита; в – кальцинированный узел по типу “яичной скорлупы”.
TI-RADS 4. Узлы более 1,0 см в диаметре с “малыми” признаками злокачественности для выполнения ПУНКЦИИ (рис. 3):
– неравномерно утолщенное хало;
Рис. 3. TI-RADS 4: а – узел шаровидной формы, с ровными и четкими контурами, умеренно пониженной эхогенности, с участками более низкого эхо, с макрокальцинатом. Узел окружен тонким хало (фолликулярная неоплазия); б, в, г (поперечное и продольное сканирование левой доли ЩЖ) – изоэхогенные узлы с гипоэхогенными включениями, с четкими контурами, с тонким хало (фолликулярная аденома); д – изоэхогенный узел с гипоэхогенными включениями, с неравномерно утолщенным хало (фолликулярный рак).
TI-RADS 5. Солидные узлы с “большими” признаками злокачественности для выполнения ПУНКЦИИ:
– значительно сниженная эхогенность;
– вертикальная пространственная ориентация образования;
– неровный контур образования: бугристый, микродольчатый, лучистый;
– наличие в опухоли микрокальцинатов;
Рис. 4. TI-RADS 5. Узлы ЩЖ размером >1,0 см (папиллярные раки): а, б – узлы значительно пониженной эхогенности с микрокальцинатами, с неровными микродольчатыми контурами; в – узел вертикальной пространственной ориентации, с нечеткими, неровными контурами, значительно сниженной эхогенности, с множественными микрокальцинатами; г – узел с микродольчатыми нечеткими контурами, неравномерно пониженной эхогенности, с микрокальцинатами; д – узел значительно пониженной эхогенности, вертикальной пространственной ориентации, с нечеткими, неровными (лучистыми) контурами; е – узел с нечеткими контурами, с множественными микрокальцинатами.
При наличии измененных лимфатических узлов (шаровидная форма, исчезновение дифференцировки внутренних структур, кистозные изменения, кальцинаты) к указанию категории ТI-RADS целесообразно в заключении добавлять “ЛИМФАДЕНОПАТИЯ”. На основании заключения ультразвукового исследования и клинико-лабораторных данных врач-эндокринолог принимает окончательное решение о необходимости выполнения пункционной биопсии узла ЩЖ и измененных лимфатических узлов шеи.
Представленный вариант модификации TI-RADS наиболее близок к европейскому варианту [1]. Для работы в условиях нашей страны менее приемлемыми представляются варианты TI-RADS, предлагающие присвоение баллов каждому ультразвуковому признаку, с дальнейшим распределением узлов по категориям TI-RADS в зависимости от суммы баллов [2, 9].
Группой авторов проведено пилотное исследование по оценке воспроизводимости европейского варианта системы ТI-RADS и варианта, предложенного группой отечественных авторов, при помощи критерия Кохрейна [26]. Доля совпадений результатов (когда разные исследователи относили один и тот же узел к одинаковой категории) составила 79%, коэффициент Кохрейна составил 03–05 (p < 0,001), что свидетельствует о хорошей воспроизводимости данного метода оценки злокачественного потенциала узлов ЩЖ разными операторами.
Оба варианта TI-RADS имели одинаковую специфичность – 93%. Отечественный вариант несколько превышал европейский по показателям чувствительности: 94,2 против 91,0% соответственно, что можно объяснить учетом большего количества “малых” признаков злокачественности. Нам представляется важным обратить внимание на эти признаки. В ряде работ показано, что в 13,4% случаев в раковых узлах ЩЖ не удается выявить ни одного “большого” признака злокачественности; в 10,1% случаев выявляется только один “большой” признак рака; в 25,6% случаев определяется сочетание одного “большого” признака с несколькими “малыми”; в 13% случаев удается дифференцировать только “малые” признаки злокачественности [21, 27].
“Малые” признаки чаще возникают в узлах, приближающихся к 2,0 см в диаметре [21]. В настоящее время мы оперируем размерами узлов до 1,0 см и свыше 1,0 см, согласно ряду российских клинических рекомендаций [11, 28]. В последних западных вариантах TI-RADS размеры узлов разделяют от 0,5; 1,0; 1,5; 2,0 см и более [1, 2]. Возможно, нам также следует рассмотреть данные модификации.
Заключение
Мы предлагаем провести широкое обсуждение предложенного варианта классификации TI-RADS для его дальнейшей оптимизации и приемлемой стандартизации в обозримом будущем. Наш подход обусловлен желанием сблизить позиции отечественных специалистов ультразвуковой диагностики и российских эндокринологов. Переход на единую информационную диагностическую площадку этих двух специальностей, надеемся, будет положительно влиять на конечные показатели результатов ведения пациентов с узловыми новообразованиями ЩЖ.
Дополнительная информация
Источник финансирования. Работа выполнена без привлечения внешних источников финансирования на личные средства авторов.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов: Фисенко Е.П. – концепция и инициатива создания публикации, анализ материалов, написание текста; Сыч Ю.П. – сбор и обработка материалов, анализ материалов, написание текста; Сенча А.Н. – сбор и анализ материалов, редактирование текста; Катрич А.Н. – сбор и анализ материалов, редактирование текста; Цветкова Н.В. – сбор и анализ материалов, редактирование текста; Борсуков А.В. – сбор и анализ материалов, редактирование текста; Костромина Е.В. – сбор и анализ материалов, редактирование текста. Все авторы внесли существенный вклад в проведение поисково-аналитической работы и подготовку статьи, прочли и одобрили итоговую версию до публикации.
Благодарности. Коллектив авторов выражает искреннюю благодарность коллегам, принявшим активное участие в обсуждении и подготовке материалов статьи: профессору кафедры ультразвуковой диагностики ФГБОУ ДПО РМАНПО Заболоцкой Наталье Владленовне, заведующей отделением ультразвуковой диагностики ФГБУ “НМИЦ эндокринологии” Минздрава России Солдатовой Татьяне Васильевне, заведующей отделением ультразвуковой диагностики НИИ клинической и экспериментальной радиологии ФГБУ “НМИЦ онкологии им. Н.Н. Блохина” Минздрава России, профессору Синюковой Галине Тимофеевне, старшему научному сотруднику НИИ клинической и экспериментальной радиологии ФГБУ “НМИЦ онкологии им. Н.Н. Блохина” Минздрава России Данзановой Татьяне Юрьевне, врачу отделения лучевой диагностики ФБУ здравоохранения “Центральная медико-санитарная часть № 141” ФМБА России, г. Удомля Тверской области, Пищугиной Алене Владимировне.