Toxocara canis что это
Токсокароз
Токсокароз — разновидность гельминтоза, паразитарная инфекция, вызванная гельминтами Тохосаrа canis и Тохосаrа mystax, обитающими в организме диких и домашних собак и кошек соответственно. С фекалиями животных личинки попадают в почву, где продолжают свое развитие. Поэтому путь передачи инфекции — фекально-оральный, наиболее распространенный среди детей. Заразиться можно через немытые руки после общения с этими животными, работы на садовых участках, детских игр в песочницах, а также употребляя в пищу немытые фрукты и овощи, на которые личинки токсокар могут попасть вместе с землей.
Симптомы и лечение токсокароза
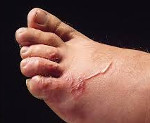
Токсокара — особый вид гельминтов, паразитирующих, в основном, в организме животных (собак, кошек, большого рогатого скота), поэтому развитие токсокароза у людей встречается редко. Попадая в кишечник человека, личинки Toxocara проникают в кровоток и мигрируют внутри организма, поражая печень, сердце, легкие и даже глаза. У инфицированного человека увеличиваются лимфоузлы и появляются симптомы интоксикации. В зависимости от локализации инфекции возможны боли в животе, мышцах и суставах, кашель, покраснение глаз. Одним из признаков заражения является псевдоаллергическая реакция в виде крапивницы или экземы. Хотя бывает и бессимптомная форма заболевания.
Профилактика токсокароза состоит в регулярной дегельминтизации домашних животных и личной гигиене. При подтверждении инфицирования паразитом Тохосаrа больному назначают противогельминтные препараты.
Диагностика токсокароза
Поскольку личинки паразитов никогда не задерживаются в кишечнике, их невозможно обнаружить при исследовании кала на яйца глистов. Единственная возможность выявить токсокароз — анализ крови. В Лабстори выполняется несколько видов исследований, позволяющих диагностировать токсокароз.
Позволяет заподозрить паразитарную инфекцию. При инфицировании гельминтами (как и при аллергических состояниях) повышается уровень эозинофилов.
Дают возможность определить токсокароз и степень его развития. Иммуноглобулины в крови появляются спустя четыре дня — две недели после заражения и сохраняются на протяжении нескольких лет. В результате анализа определяется титр антител, который показывает стадию заболевания, что особенно важно при терапии паразитарной инфекции. Низкие титры иммуноглобулинов могут оказаться ложноположительным результатом в случаях аутоиммунной патологии, беременности и других видах гельминтозов. Отрицательный результат может оказаться ложным при глазной форме токсокароза.
Проводится при подозрении на гельминтоз неясного происхождения и позволяет определить тип паразита путем определения антител класса IgG к антигенам описторхисов, эхинококков, трихинелл и токсокар.
Подготовка к исследованию
Исследования крови на токсокароз не требуют особой подготовки. Рекомендации в этом случае обычные: воздержаться от приема пищи в течение 8 часов до процедуры забора крови, не курить в течение получаса до исследования, не принимать накануне жирной и острой пищи.
Toxocara canis что это
Получить результаты
Компания «Новые Медицинские Технологии»
Токсокароз
Министерство здравоохранения и медицинской промышленности РФ
Российская медицинская академия последипломного образования
А.Я. Лысенко, Т.Н. Константинова, Т.И. Авдюхина
Учебное пособие. Российская медицинская академия последипломного образования. М., 1999
В учебном пособии представлены новейшие данные литературы и собственных исследований авторов по клинике, диагностике, лечению, эпидемиологии и профилактике токсокаpоза. Пpедназначено для широкого круга врачей теpапевтов, инфекционистов, педиатpов, офтальмологов, эпидемиологов и дpугих.
МОРФОЛОГИЯ И ЖИЗНЕННЫЙ ЦИКЛ ВОЗБУДИТЕЛЯ
ПАТОГЕНЕЗ И ПАТОЛОГИЯ
КЛИНИКА
УРОВЕНЬ ЗАБОЛЕВАЕМОСТИ ТОКСОКАРОЗОМ
ДИАГНОСТИКА
Таблица 1 Диагностическая ценность клинических признаков висцерального
токсокароза в баллах (по L.T. Glickman, 1978)
| Признаки | |
| 1. Эозинофилия периферической крови | 5 |
| 2. Лейкоцитоз | 4 |
| 3. Увеличение СОЭ | 4 |
| 4. Гипер—глобулинемия | 3 |
| 5. Гипоальбуминемия | 3 |
| 6. Анемия | 2 |
| 7. Рецидивирующая лихорадка | 3.5 |
| 8. Легочный синдром | 3.5 |
| 9. Рентгенологические признаки поражения легких | 2 |
| 10. Увеличение размеров печени | 4 |
| 11. Неврологические расстройства | 1.5 |
| 12. Кожные поражения | 1 |
| 13. Лимфаденопатия | 1 |
При сочетании симптомов и признаков, превышающих в сумме 12 баллов, предположение о токсокарозе можно считать достаточно клинически обоснованным, чтобы обследовать больного на токсокароз иммунологическим методом.
Существенное значение в постановке диагноза токсокароза имеет эпидемиологический анамнез. Указание на содержание в семье собаки или на тесный контакт с собаками, наличие привычки пикацизма свидетельствуют об относительно высоком риске заражения токсокарозом. Наличие аллергии на шерсть животных также часто встречается при токсокарной инвазии.
ЛЕЧЕНИЕ
Проблема специфической терапии токсокароза не может считаться решенной. Удовлетворительные результаты получают при назначении минтезола (тиабендазола), вермокса (метобендазола) и дитразина (диэтилкарбамазина).
Минтезол обычно назначают из расчета 25-50 мг на 1 кг массы тела в сутки в течение 5-10 дней подряд. Наблюдаемые побочные явления, связанные с влиянием минтезола, кратковременны и быстро проходят после отмены препарата. К ним относятся ухудшение аппетита, тошнота, головные боли, сонливость, боли в животе. Препарат быстро всасывается из желудочно-кишечного тракта и выводится почками. Не отмечено его отрицательного влияния на сердечно-сосудистую систему и органы дыхания.
Вермокс назначают независимо от возраста по 100 мг 2 раза в сутки в течение 2-4 нед. Взрослым иногда суточную дозу увеличивают до 300 мг. Побочные явления (боли в животе, тошнота, диарея) возникают крайне редко.
Дитразин цитрат назначают из расчета 2-6 мг на 1 кг массы тела в сутки в течение 2-4 недель. При лечении могут возникнуть побочные реакции: головная боль, головокружение, тошнота, иногда лихорадка.
Мы использовали для лечения больных в 1988-1990 гг. альбендазол фирмы «Смит Клайн Френч» (Великобритания), который назначали из расчета 10 мг/кг массы больного в течение 10-20 дней. Во время приема препарата редко возникали боли в животе, тошнота, диарея, которые исчезали после его отмены.
Изучение сравнительной эффективности для лечения висцерального и глазного токсокароза тиабендазола и альбендазола, проведенное в 1989 в Цюрихе (D. Sturchler, P. Schubarth) показало высокую эффективность обоих препаратов при применении их в дозе 10 мг/кг массы в течение 5 суток. При возможности авторы рекомендуют предпочтение отдавать альбендазолу. Поскольку эти препараты обладают тератогенным эффектом, их не следует применять для лечения беременных.
Побочные явления, возникающие при применении вышеуказанных препаратов, могут быть связаны не только с токсическим действием антигельминтных препаратов, но и с реакцией организма на гибель личинок токсокар. Поэтому в процессе лечения целесообразно назначать также антигистаминные средства.
Критериями эффективности лечения следует считать прогрессивное снижение уровня эозинофилии, регресс клинических проявлений болезни, снижение уровня специфических антител до уровня 1:800 и ниже. При медленном улучшении клинико-лабораторных показателей курсы специфической терапии проводят через 3-4 мес. Иногда требуется 4-5 курсов лечения.
Лечение глазного токсокароза впервые успешно было проведено в 1968 г. Девочку 13 лет с периферической гранулемой и помутнением стекловидного тела излечили субконъюнктивальными инъекциями депомедрола. Некоторые специалисты не отмечают эффекта от применения кортикостероидов. Ряд специалистов рекомендует применение противогельминтных препаратов по тем же схемам, как при висцеральном токсокарозе, назначение комбинированных курсов специфической терапии. Имеются сообщения об успешном использовании фото- и лазерокоагуляции для разрушения токсокарных гранулем. В некоторых случаях лечение глазного токсокароза осуществляется хирургическими методами. Описано (W. Kent, W. Brooks et al., 1989) успешное излечение 12 пациентов с диагнозом глазного токсокароза (повышенные титры противотоксокарных антител выявлены у 11) с помощью витрэктомии. У всех больных гранулемы располагались в заднем поле или по периферии сетчатки.
Прогноз при токсокарозе в большинстве случаев благоприятный. Однако, при интенсивной инвазии и проникновении личинок в жизненно важные органы заболевание может привести к летальному исходу.
ЭПИДЕМИОЛОГИЯ
ПРОФИЛАКТИКА
Токсокароз
Токсокароз – это хроническое инфекционное заболевание, вызываемое личинками круглого червя токсокары. Для инвазии характерна лихорадка, рецидивирующие высыпания и увеличение размеров печени. Патология сопровождается поражением глазных яблок и внутренних органов: сердца, головного мозга, легких. Диагностика заключается в обнаружении специфических антител к возбудителю. Лечение этиотропное (антигельминтные препараты), также применяются средства симптоматической терапии, в некоторых случаях производятся хирургические вмешательства.
МКБ-10
Общие сведения
Токсокароз относится к гельминтозам, связанным с миграцией личинок гельминта животных (кошек, собак, лисиц). Токсокару в 1782 году открыл немецкий ученый Вернер, заболевание человека, вызываемое этим гельминтом, известно с 1950 года. Гельминтоз распространен повсеместно, наибольшее число случаев зарегистрировано во Франции, Испании, Австрии, США, Индии, Японии, Корее, Бразилии, Китае и России. Сезонность летне-осенняя. В группу риска входят дети младше 6 лет, что обычно связано с геофагией, работники коммунальных служб, ветеринары, собаководы, автослесари, владельцы приусадебных участков и землекопы.
Причины токсокароза
Возбудитель – круглый червь Toxocara, наиболее часто встречаются инвазии видами Т. сanis (собачий) и T. сati (кошачий). Основной цикл развития паразита не включает в себя человеческий организм, поэтому люди оказываются случайными хозяевами гельминта, который в подобных условиях неспособен достигать половозрелой формы. Источником инфекции является больное животное (чаще собака), больной человек эпидемиологически не опасен. Считается, что доля зараженных токсокарозом среди взрослых собак варьирует от 15 до 50%, щенков – до 80%.
Больные животные выделяют яйца гельминтов с фекалиями, сами паразиты в половозрелой форме находятся у постоянного хозяина в пищеварительном тракте. Наиболее опасными считаются дворы, детские площадки, парки, поскольку контаминация земли яйцами паразита встречается в 10-40% почвенных проб. Инфицирование людей происходит контактным и пищевым путем – при поглаживании, играх со зверями, особенно бродячими, употреблении в пищу немытых ягод, фруктов и овощей. Отмечено, что тараканы могут поглощать яйца токсокар с последующим выделением до 25% потенциально жизнеспособных особей, что играет важную роль в распространении инфекции в быту.
Патогенез
После попадания яиц токсокары в тонкий кишечник человека (преимущественно двенадцатиперстную кишку) высвобождаются личинки, проникающие в системный кровоток через слизистую оболочку. Сначала токсокары заносятся в печень и правую половину сердца, затем в легочную артерию и левый желудочек, откуда выходят в большой круг кровообращения. Распространяясь по организму, личинки оседают в различных органах и тканях, вызывая геморрагические и некротические изменения, образование воспалительных очагов в виде гранулем, в центре которых находится некротизированная ткань и личинка, вокруг – воспалительный инфильтрат.
При попадании в кровеносное русло продуктов жизнедеятельности возникают аллергические реакции. Часть личинок гибнет, оставшиеся гельминты выделяют особую маскирующую субстанцию, которая позволяет им персистировать в организме до 10 лет, периодически мигрируя по кровеносной системе и поражая новые ткани. Характерной особенностью токсокар является формирование гранулем в поджелудочной железе, головном мозге, печени, легких, миокарде и мезентериальных лимфатических узлах. Патогенез поражения глаз до конца не изучен, имеются гипотезы о низкой активности инвазии и малой выраженности иммунного ответа.
Патогенез эпилепсии при токсокарозе окончательно не ясен. Предполагается, что поражение головного мозга может привести к формированию волокнистых рубцов после острого воспаления или хронических гранулем. Другая теория объясняет появление эпилептических припадков при повреждении нейронов усиленным образованием провоспалительных цитокинов из-за повышения проницаемости гематоэнцефалического барьера, вызываемого паразитами, а также аутоантителами к нейрональным элементам, которые нередко обнаруживаются у больных токсокарозом.
Классификация
Классификация токсокароза у человека основывается на глубине инвазии в организм человека. Гельминтоз практически всегда протекает с минимальной либо неспецифической клиникой (субклинически), бессимптомная форма встречается в 13% случаев заболевания, органные поражения более характерны для детей. Выделяют следующие виды токсокароза:
Симптомы токсокароза
Инкубационный период определить сложно, считается, что он может занимать несколько лет. При остром начале наблюдается лихорадка до 38,5°C и выше, поражения дыхательной системы – от заложенности носа, сухого кашля и першения в горле до тяжелой одышки и астматического статуса. На коже появляется зудящая сыпь в виде волдырей и пятен, при подкожном расположении личинок видны приподнятые над поверхностью прямые или извилистые красновато-коричневые ходы. У детей нередко выявляются увеличенные плотноэластические безболезненные лимфоузлы. Пациенты с токсокарозом часто предъявляют жалобы на боли в животе, тошноту, иногда – рвоту и срывы стула.
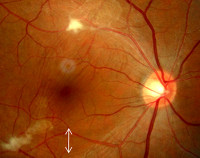
Глазной токсокароз сопровождается постепенным ухудшением зрения, зрения, появлением «точек» перед глазами, слепого участка в поле зрения (скотомы). В подавляющем большинстве случаев поражается один глаз. Температурная реакция и явления интоксикации отсутствуют. Поражения нервной системы характеризуются повышением раздражительности, гиперактивностью, сильными головными болями, эпилептическими припадками и параличами, могут протекать с выраженной лихорадкой (более 39°C), ознобами, усталостью, слабостью, нарушениями сознания, утратой способности к продуктивному контакту.
Осложнения
Наиболее частые осложнения висцерального токсокароза – бронхиальная астма, хронический бронхит и эпилепсия, глазного – отслойка сетчатки и односторонняя слепота. Подкожное расположение личинок токсокар приводит к присоединению вторичной бактериальной инфекции, образованию инфильтраов, абсцессов и флегмон, поражение легких – к тяжелым пневмониям смешанной этиологии с нарастающей дыхательной недостаточностью. Массивная инвазия гельминтов, полиорганное поражение могут стать причиной летального исхода. У беременных женщин токсокароз часто выявляется невынашивание, задержка внутриутробного развития плода.
Диагностика
Диагноз токсокароза подтверждается врачом-инфекционистом. Для исключения сочетания висцерального и глазного гельминтоза обязательным является осмотр офтальмолога, по показаниям назначаются консультации других специалистов. Диагностические методы, необходимые для верификации токсокарозного поражения, включают следующие методики:
Дифференциальную диагностику проводят с аскаридозом, при котором нередко наблюдаются кишечная непроходимость, острая обструкционная дыхательная недостаточность. Необходимо исключить описторхоз и стронгилоидоз, которые протекают с желтухой, болями в правом подреберье и срывами стула. Глазную форму токсокароза дифференцируют от ретинобластомы, проявляющейся лейкокорией, косоглазием, слезотечением, светобоязнью, вторичной глаукомой. Кожные проявления могут быть следствием укусов насекомых, воздействия аллергенов.
Лечение токсокароза
Показанием для стационарного лечения являются висцеральные формы болезни. Постельный режим назначается только при наличии лихорадки и рекомендуется до 2-4 дней устойчивого отсутствия высоких цифр температуры тела. Специальной диеты нет, однако, учитывая некоторые побочные эффекты применяемых препаратов, рекомендуется воздержаться от приема жирной, жареной пищи, алкоголя, специй, маринадов, сладостей. Важно соблюдение питьевого режима, исключение контакта с возможными пищевыми и бытовыми аллергенами. Недопустимо самовольное прекращение начатого медикаментозного лечения.
Прогноз и профилактика
Прогноз при неосложненных формах благоприятный, летальных случаев не описано. Длительность приема лекарственных средств может составлять до 3-4 недель и более, иногда требуются несколько курсов с перерывами в 2-4 месяца. Критериями эффективности считаются исчезновение клиники, снижение уровня антител и эозинофилии крови. Описаны случаи диссеминированного токсокароза среди ВИЧ-инфицированных лиц в стадии СПИДа, а также пациентов, длительно принимающих системные глюкокортикостероиды или проходящих лучевую терапию по поводу онкологических болезней.
Профилактические вакцины на основе ДНК показали положительный эффект в экспериментах на мышах, исследования в настоящее время продолжаются. Рекомендуется осуществлять контроль за популяцией бродячих животных, проводить выгул собак на специально отведенных территориях. Важными мерами неспецифической борьбы с заболеваемостью являются отучение детей от поедания земли, привитие навыков личной гигиены после игр на улице, песочнице, общения с животными; тщательное мытье ягод, зелени, овощей и фруктов перед едой; назначение антигельминтных препаратов беременным собакам, новорожденным щенкам.
ТОКСОКАРОЗ: современный подход
Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут бы
Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут быть также личинки других аскарид — кошки (T. mystax), коровы, буйвола, (T. vitulorum). Однако роль этих возбудителей в патологии человека практически не изучена
Половозрелые формы T. canis — крупные раздельнополые черви длиной 4 — 18 см локализуются в желудке и тонком кишечнике животных (собак). Интенсивность инвазии у собак может быть очень высокой, особенно у молодых животных. Средняя продолжительность жизни половозрелых особей составляет 4 месяца, максимальная — 6 месяцев. Самка паразита за сутки откладывает более 200 тыс. яиц. В 1 г фекалий может содержаться 10 000—15 000 яиц, так что в почву попадают миллионы яиц, обусловливая тем самым высокий риск заражения токсокарозом.
 |
Яйца токсокар округлой формы, крупнее яиц аскариды (65—75 мкм). Наружная оболочка яйца толстая, плотная, мелкобугристая. Внутри яйца располагается темный бластомер.
Цикл развития возбудителя следующий. Выделившиеся яйца токсокар попадают в почву, где, в зависимости от влажности и температуры почвы, созревают за 5—36 суток, становясь инвазионными. Инвазионность яиц сохраняется в почве длительное время, в компосте — несколько лет.
Жизненный цикл токсокары сложный. Выделяют основной цикл и два варианта вспомогательных. Основной цикл происходит по схеме: окончательный хозяин (псовые) — почва — окончательный хозяин (псовые). Передача инвазии осуществляется геооральным путем. Вспомогательный цикл (вариант 1) идет трансплацентарно, в этом случае паразит в личиночной стадии переходит от беременной самки к плоду, в организме которого совершает полную миграцию, достигая в кишечнике щенка половозрелой стадии. Инвазированный щенок становится функционально полноценным окончательным хозяином, источником инвазии.
Вспомогательный цикл (вариант 2) осуществляется по цепи: окончательный хозяин (псовые) — почва — паратенический хозяин. Паратеническим (резервуарным) хозяином могут быть грызуны, свиньи, овцы, птицы, земляные черви. Человек также выступает в роли паратенического хозяина, но не включается в цикл передачи инвазии, являясь для паразита биологическим тупиком. Дальнейшее развитие возбудителя происходит при условии, что паратенический хозяин будет съеден собакой или другим окончательным хозяином. Механизм передачи инвазии при этом варианте — геооральный — ксенотрофный.
В зависимости от возраста хозяина реализуются разные пути миграции личинок токсокар. У молодых животных (щенков до 5 недель) почти все личинки совершают полную миграцию с достижением половозрелых форм в кишечнике и выделением яиц во внешнюю среду. В организме взрослых животных большая часть личинок мигрирует в соматические ткани, где сохраняет жизнеспособность несколько лет. В период беременности и лактации у беременных сук возобновляется миграция личинок. Мигрирующие личинки через плаценту попадают в организм плода. Личинки остаются в печени пренатально инвазированных щенков до рождения, а после рождения личинки из печени мигрируют в легкие, трахею, глотку, пищевод и попадают в желудочно-кишечный тракт, где через 3—4 недели достигают половозрелой стадии и начинают выделять во внешнюю среду яйца. Кормящие суки могут передавать щенкам инвазию также через молоко.
У человека цикл развития возбудителя, его миграция осуществляется следующим образом. Из яиц токсокар, попавших в рот, затем в желудок и тонкий кишечник выходят личинки, которые через слизистую оболочку проникают в кровеносные сосуды и через систему воротной вены мигрируют в печень, где часть из них оседает, инцистируется или окружается воспалительными инфильтратами, образуя гранулемы. Часть личинок по системе печеночных вен проходит фильтр печени, попадает в правое сердце и через легочную артерию — в капиллярную сеть легких. В легких часть личинок также задерживается, а часть, пройдя фильтр легких, по большому кругу кровообращения заносится в различные органы, оседая в них. Личинки токсокар могут локализоваться в различных органах и тканях — почках, мышцах, щитовидной железе, головном мозге и др. В тканях личинки сохраняют жизнеспособность многие годы и периодически, под влиянием различных факторов, возобновляют миграцию, обусловливая рецидивы заболевания.
Токсокароз — широко распространенная инвазия, она регистрируется во многих странах. Показатели пораженности плотоядных являются высокими во всех странах мира. Средняя пораженность собак кишечным токсокарозом, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах у части животных достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз. Распространенность инвазии в различных регионах точно неизвестна, поскольку токсокароз не подлежит обязательной регистрации. Совершенно очевидно, что токсокароз имеет широкую геграфию распространения, и число больных значительно выше официально регистрируемых.
| Токсокароз широко распространен и регистрируется во многих странах. Средняя пораженность кишечным токсокарозом собак, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз |
Патогенез токсокароза сложный и определяется комплексом механизмов в системе паразит — хозяин. В период миграции личинки травмируют кровеносные сосуды и ткани, вызывая геморрагии, некроз, воспалительные изменения. Ведущая роль принадлежит иммунологическим реакциям организма в ответ на инвазию. Экскреторно-секреторные антигены личинок оказывают сенсибилизирующее действие с развитием реакций немедленного и замедленного типов. При разрушении личинок в организм человека попадают соматические антигены личинок. Аллергические реакции проявляются отеками, кожной эритемой, увеличением резистентности дыхательных путей к вдыхаемому воздуху, что клинически выражается развитием приступов удушья. В аллергических реакциях принимают участие тучные клетки, базофилы, нейтрофилы, но основную роль играют эозинофилы. Пролиферация эозинофилов регулируется Т-лимфоцитами при участии медиаторов воспалительных реакций, выделяемых сенсибилизированными лимфоцитами, нейтрофилами, базофилами. Образующиеся иммунные комплексы привлекают в очаг поражения эозинофилы. Вокруг личинок токсокар кумулируются сенсибилизированные Т-лимфоциты, привлекаются макрофаги и другие клетки — формируется паразитарная гранулома.
Патоморфологическим субстратом токсокароза является выраженное в различной степени гранулематозное поражение тканей. При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими. При токсокарозе находят многочисленные гранулемы в печени, легких, поджелудочной железе, миокарде, лимфатических узлах, головном мозге и других органах.
Клинические проявления определяются интенсивностью инвазии, распределением личинок в органах и тканях, частотой реинвазии и особенностями иммунного ответа человека. Симптоматика токсокароза малоспецифична и имеет сходство с клиническими симптомами острой фазы других гельминтозов. Заболевание обычно развивается внезапно и остро или после короткой продромы проявляется в виде легкого недомогания. Появляется температура — субфебрильная в легких случаях и высокая до 39°С и выше, иногда с ознобом, — в тяжелых случаях инвазии. Могут наблюдаться кожные высыпания в виде крапивницы или полиморфной сыпи, иногда отеки типа Квинке. В остром периоде наблюдается легочный синдром различной степени тяжести: от легких катаральных явлений до острого бронхита, пневмонии, тяжелых приступов удушья. Особенно тяжело легочный синдром протекает у детей раннего возраста. Рентгенологически выявляется усиление легочного рисунка, «летучие» инфильтраты, картина пневмонии. Наряду с этим у части больных отмечается увеличение печени, иногда и селезенки. Лимфаденопатия более выражена у детей. Иногда имеет место абдоминальный синдром в виде приступов болей в животе, симптомов диспепсии. Возможно развитие миокардита, панкреатита. Известны случаи поражения щитовидной железы, проявляющиеся симптомами опухоли. Возможно поражение мышечной ткани с развитием болезненных инфильтратов по ходу мышц. При миграции личинок в головной мозг развиваются симптомы поражения ЦНС: упорные головные боли, эпилептиформные приступы, парезы, параличи. У детей заболевание сопровождается слабостью, легкой возбудимостью, нарушением сна.
Наиболее характерным лабораторным показателем является повышенное содержание эозинофилов в периферической крови. Относительный уровень эозинофилии может колебаться в широких пределах, достигая в ряде случаев 70 — 80% и более. Повышается содержание лейкоцитов (от 20х109 до 30х109 на 1 л). При исследовании пунктата костного мозга выявляется гиперплазия зрелых эозинофилов. У детей нередко отмечается умеренная анемия. Некоторые исследователи отмечают прямую корреляцию между тяжестью клинических проявлений инвазии и уровнем эозинофилии и гиперлейкоцитоза периферической крови. Характерным лабораторным признаком является также ускорение СОЭ, гипергаммаглобулинемия. В случаях поражения печени наблюдается повышение билирубина, гиперферментемия.
В хронической стадии болезни острые клинические и лабораторные признаки затухают. Наиболее стабильным лабораторным показателем остается гиперэозинофилия периферической крови.
Выделяют субклиническое, легкое, среднетяжелое и тяжелое течение токсокароза. Возможна так называемая бессимптомная эозинофилия крови, когда явные клинические проявления инвазии отсутствуют, но наряду с гиперэозинофилией выявляются антитела к антигенам T.canis.
Одной из наиболее серьезных проблем, связанных с токсокарозом, является его взаимосвязь с бронхиальной астмой. При сероэпидемиологических исследованиях установлено, что у больных бронхиальной астмой нередко обнаруживаются антитела к антигенам T.canis классов Ig G и Ig E. В зависимости от остроты паразитарного процесса, его длительности и длительности клинических проявлений бронхиальной астмы преобладает тот или другой класс иммуноглобулинов. Имеются клинические наблюдения, свидетельствующие об улучшении течения бронхиальной астмы или выздоровлении после ликвидации токсокарозной инвазии.
Паразитологический диагноз устанавливается редко и только по наличию в тканях характерных гранулем и личинок и их идентификации при исследовании биопсийного и секционного материала. Это возможно при пункционной биопсии печени, легких, оперативном вмешательстве. Обычно диагноз токсокароза устанавливается на основании данных эпидемиологического анамнеза, клинической симптоматики и гематологических проявлений. Используют также иммунологические реакции, позволяющие выявлять антитела к антигенам токсокар. Обычно применяют ИФА с секреторно-экскреторным антигеном личинок токсокар второго возраста. В настоящее время в России выпускается коммерческий диагностикум. Диагностическим титром считают титр антител 1:400 и выше (в ИФА). Титр антител 1:400 свидетельствует об инвазированности, но не болезни. Титр антител 1:800 и выше свидетельствует о заболевании токсокарозом. Практика показывает, что прямая корреляция между уровнем антител и тяжестью клинических проявлений токсокароза существует не всегда. Не всегда имеется и корреляция между уровнем антител и гиперэозинофилии крови.
При постановке диагноза и определении показаний к специфической терапии следует учитывать, что токсокароз протекает циклически с рецидивами и ремиссиями, в связи с чем возможны значительные колебания клинических, гематологических и иммунологических показателей у одного и того же больного.
М. И. Алексеева и соавт. (1984) разработали алгоритм диагностики токсокароза, основанный на оценках в баллах значимости клинических симптомов и сопоставлении клинико-эпидемиологических и лабораторных показателей. Этот метод может быть перспективен при проведении массовых обследований населения.
Дифференциальный диагноз проводят с миграционной стадией других гельминтозов (аскаридоз, описторхоз), стронгилоидозом, эозинофильной гранулемой, лимфогранулематозом, эозинофильным васкулитом, метастазирующей аденомой поджелудочной железы, гипернефромой и другими заболеваниями, сопровождающимися повышенным содержанием эозинофилов в периферической крови. Следует иметь в виду, что у больных с системными лимфопролиферативными заболеваниями и серьезными нарушениями в системе иммунитета иммунологические реакции могут быть ложно положительными. В этих случаях необходим тщательный анализ клинической картины заболевания.
| При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими |
Глазной токсокароз. Патогенез этой формы токсокароза до конца не ясен. Существует гипотеза об избирательном поражении глаз у лиц с инвазией низкой интенсивности, при которой не развивается достаточно выраженная иммунная реакция организма из-за слабого антигенного воздействия небольшого числа поступивших в организм личинок токсокар.
Эта форма токсокароза чаще наблюдается у детей и подростков, хотя описаны случаи заболевания и у взрослых.
Для токсокароза характерно одностороннее поражение глаз. Патологический процесс развивается в сетчатке, поражается хрусталик, иногда параорбитальная клетчатка. В тканях глаза формируется воспалительная реакция гранулематозного характера. Патологический процесс часто принимают за ретинобластому, проводят энуклеацию глаза. При морфологическом исследовании обнаруживают эозинофильные гранулемы, иногда — личинки токсокар.
Клинически поражение глаз протекает как хронический эндофтальмит, хориоретинит, иридоциклит, кератит, папиллит. Глазной токсокароз — одна из частых причин потери зрения.
Диагностика глазного токсокароза сложна. Количество эозинофилов обычно нормальное или незначительно повышено. Специфические антитела не выявляются или выявляются в низких титрах.
Разработано недостаточно. Применяют противонематодозные препараты — тиабендазол (минтезол), мебендазол (вермокс), медамин, диэтилкарбамазин. Эти препараты эффективны в отношении мигрирующих личинок и недостаточно эффективны в отношении тканевых форм, находящихся в гранулемах внутренних органов.
Минтезол (тиабендазол) назначают в дозах 25—50 мг/кг массы тела в сутки в три приема в течение 5—10 дней. Побочные явления возникают часто и проявляются тошнотой, головной болью, болями в животе, чувством отвращения к препарату (в настоящее время препарат в аптечную сеть России не поступает).
Вермокс (мебендазол) назначают по 200 —300 мг в сутки в течение 1—4 недель. Побочные реакции обычно не наблюдаются.
 |
Медамин применяют в дозе 10 мг/кг массы тела в сутки повторными циклами по 10 — 14 дней.
Диэтилкарбамазин назначают в дозах 2 — 6 мг/кг массы тела в сутки в течение 2 — 4 недель. (В настоящее время препарат в России не производится, не закупается за рубежом. — Прим. ред.)
Альбендазол назначают в дозе 10 мг/кг массы тела в сутки в два приема (утро — вечер) в течение 7 — 14 дней. В процессе лечения необходим контроль анализа крови (возможность развития агранулоцитоза) и уровня аминотрансфераз (гепатотоксическое действие препарата). Небольшое повышение уровня аминотрансфераз не является показанием к отмене препарата. В случае нарастающей гиперферментемии и угрозы развития токсического гепатита требуется отмена препарата.
Критерии эффективности лечения: улучшение общего состояния, постепенная регрессия клинических симптомов, снижение уровня эозинофилии и титров специфических антител. Следует отметить, что клинический эффект лечения опережает положительную динамику гематологических и иммунологических изменений. При рецидивах клинической симптоматики, стойкой эозинофилии и положительных иммунологических реакциях проводят повторные курсы лечения.
Прогноз для жизни благоприятный, однако при массивной инвазии и тяжелых полиорганных поражениях, особенно у лиц с нарушениями иммунитета, возможен летальный исход.
Включает соблюдение личной гигиены, обучение детей санитарным навыкам.
Важным профилактическим мероприятием является своевременное обследование и дегельминтизация собак. Наиболее эффективно преимагинальное лечение щенков в возрасте 4 — 5 недель, а также беременных сук. Для лечения собак используют противонематодозные препараты. Необходимо ограничение численности безнадзорных собак, оборудование специальных площадок для выгула собак.
Следует улучшить санитарно-просветительскую работу среди населения, давать информацию о возможных источниках инвазии и путях ее передачи. Особого внимания требуют лица, по роду деятельности имеющие контакты с источниками инвазии (ветеринарные работники, собаководы, землекопы и другие).