Turinadrol 10 что это lyka
Как повысить тестостерон в организме: естественные способы и препараты
Пик выработки тестостерона в организме мужчины приходится на период с 25 до 30 лет. Затем количество гормона начинает постепенно снижаться — на 1-2% каждый год. Но уровень тестостерона может уменьшаться не только по естественным причинам. На его содержание влияют стрессы, недостаток калорий и переедание, прием лекарств, перетренированность, а также болезни, недостаток сна и алкоголь.
Чтобы выяснить причину низкого тестостерона, запишитесь на прием к урологу, не занимайтесь самолечением!
В обоих случаях (и по естественным, и по другим причинам) мужчина может самостоятельно повысить естественный тестостерон. Для этого существуют простые и безопасные методы, относительно которых доказано, что они увеличивают выработку гормона. Далее подробно о том, что же делать для повышения тестостерона.
Ввести силовые тренировки
Один из первых и самых действенных способов повысить уровень тестостерона — это силовые тренировки, направленные на рост мышечной массы. Главное условие таких занятий — наличие отягощения. Тренировки проводятся с весом: штангами, гантелями, гирями, на тренажерах. Полезны такие упражнения, как приседания, жим, становая тяга.
Основные правила силовых тренировок для повышения тестостерона:
Важно! Если помимо пониженного тестостерона есть другие симптомы, например, боль в паху, физическая нагрузка запрещена до консультации с врачом.
Употреблять особые продукты и соблюдать калорийность
Следующий шаг к увеличению тестостерона — переход на рацион с нормальной калорийностью. Она должна быть слегка избыточной, поскольку низкокалорийная диета снижает активность ферментов семенников, которые выступают катализаторами выработки тестостерона.
Калорийность особенно важна, если у мужчины высокая физическая активность. Несмотря на положительное влияние спорта на выработку половых гормонов, он может столкнуться с обратным эффектом — снижением тестостерона. Это может быть связано с перетренированностью (повышает уровень кортизола) и недостатком калорий. В таком случае необходимо повысить калорийность рациона и уменьшить физические нагрузки.
Но с калорийностью важно не переусердствовать, поскольку набор жира ведет к тому, что активируется особый фермент — ароматаза, отвечающий за преобразование тестостерона в эстроген (женский половой гормон). Чтобы этого избежать, нужно употреблять больше продуктов, повышающих тестостерон:
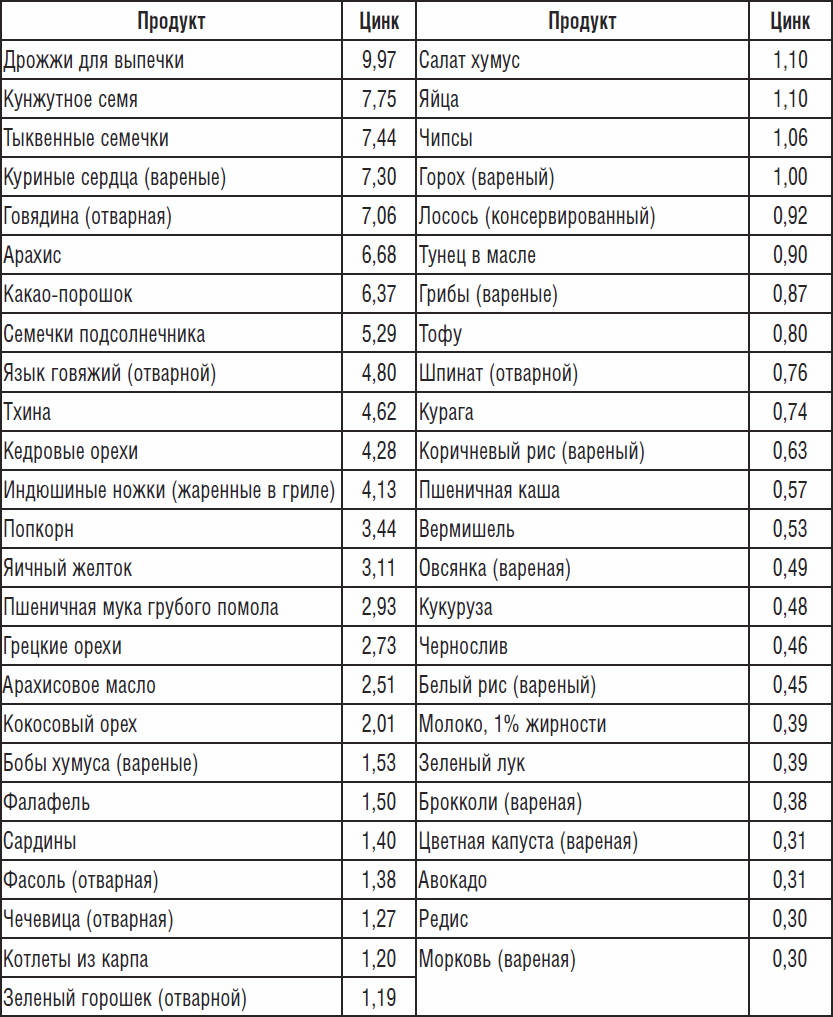
Повысить количество цинка в рационе
Количество цинка в организме и уровень тестостерона напрямую связаны между собой. Если наблюдается дефицит этого микроэлемента, то выработка полового гормона замедляется. В таблице приведены продукты, повышающие тестостерон у мужчин путем увеличения уровня цинка в организме.
Вести регулярную половую жизнь
При оргазме в кровь выбрасываются определенные биохимически активные вещества, которые обеспечивают нормальную работу репродуктивной системы. Отсюда легко понять, что при регулярных сексуальных контактах тестостерон вырабатывается более активно. Это особенно важно для мужчин старше 40 лет. Понятие нормы очень субъективное, но урологами установлена частота не менее 2 половых актов в неделю.
Обеспечить качественный сон
Большая часть тестостерона вырабатывается во время сна. Если спать недостаточно, то выработка полового гормона замедляется. Если в течение 7 дней спать менее 5 часов, то концентрация андрогена снизится на 15-25%. Важно не только количество сна, но и время. Необходимо ложиться в 10-11 часов вечера. Для качественного сна в комнате должно быть темно, поэтому стоит выключать все источники света и плотно зашторивать окна.
Исключить стрессы и депрессии
Сильные переживания повышают уровень кортизола в организме. Это гормон стресса, который мешает выработке тестостерона. Все потому, что кортизол — один из его прямых антагонистов (действует противоположным образом). Уровень гормона стресса повышается при умственном перенапряжении и длительных стрессах, вызванных разными ситуациями.
Что делать при пониженном тестостероне
Если естественные способы не приводят к положительному результату, то на смену им приходят препараты, повышающие тестостерон у мужчин. Но их может назначить только врач после обследования и исключения серьезных заболеваний вроде рака простаты или аденомы простаты. Поэтому при подозрении на сниженный тестостерон необходимо сначала обратиться к специалисту. В клинике урологии имени И.М. Сеченова вы можете записаться на прием в удобное время. Для этого напишите нам в онлайн-чате, заполните форму записи или позвоните по любому из контактных номеров.
Туринадрол 10
Turinadrol 10, выпускаемый фармакологической компанией Luka Labs, представляет собой стероид, проявляющий высокую анаболическую активность и достаточно слабое андрогенное действие. Его прием позволяет повысить силовые показатели в достаточно короткие сроки. В качестве действующего вещества стероида выступает дегидрохлорметилтестестерон.
Производится препарат на территории Индии, но сам активный компонент был открыт не в этой стране, а в Восточной Германии. Препарат, имеющий уникальную по своему составу формулу, разгоняет белковый обмен, что позволяет мышцам максимально быстро восстанавливаться, а, значит, и расти.
Turinadrol 10 от Luka Labs
Сильнодействующий стероид и на курсе соло отлично помогает новичкам повысить показатели силы. Он дает прирост и улучшение мускулатуры не из-за скапливания в тканях жидкости (воды), а исключительно благодаря тому, что волокна увеличиваются в толщине.
Препарат прекрасно подходит для периода сушки, когда атлету необходимо подготовиться к соревнованиям. Его прием увеличивает сухую мышечную массу, поскольку вода в организме не задерживается. Еще одни неоспоримым преимуществом является то, что из крови он выводится достаточно быстро. Это создает трудности в его обнаружении.
Стероид превосходит Тестостерон по двум характеристикам:
Принимать Туринадрол могут не только мужчины, но и женщины.
Какой эффект оказывает Turinadrol?
Прием этого анаболического стероида приводит к следующим положительным изменениям:
Препарат пользуется заслуженной популярность у спортсменов. Он зарекомендовал себя исключительно как качественный и надежный стероид.
Как принимать Туринабол
Культуристы профессионального уровня нередко принимают стероид совместно с Деканоатом, Сустаноном или Нандролоном. Точная дозировка определяется индивидуальными показателями спортсмена — весом и физикой. Подбирать курс нужно исключительно под себя, а начинать прием после консультации со специалистом.
Средняя дозировка составляет от 10 и до 25 миллиграммов в день. Не следует превышать рекомендованную суточную норму. Исключение могут позволить себе опытные атлеты с внушительной массой тела от 90 килограммов и больше, принимая по 40 и даже 45 миллиграммов в день.
Предосторожность никогда не бывает лишней. Дозировку нужно рассчитывать только под индивидуальные потребности и особенности физических показателей. Нельзя забывать и о послекурсовой терапии.
Возможные побочные эффекты от Туринадрола 10
Низкая эстрогенная активность препарата не гарантирует полное отсутствие негативных проявлений. Побочные действия возникают либо по причине индивидуальной непереносимости, либо из-за передозировки.
К негативным эффектам относятся:
Чтобы не столкнуться с нежелательными последствиями в погоне за быстрыми результатами, никогда нельзя пренебрегать инструкцией и рекомендациями по приему Turinadrol 10.
Отзывы о стероиде Туринадрол 10
Практически все атлеты отзываются о препарате исключительно в положительном контексте. Это является результатом того, что стероид обладает наиболее важными для каждого культуриста качествами. Он практически не вызывает никаких негативных влияний, если не превышать дозировки, является чистым, сильнодействующим и доступным по стоимости.
Проявив максимально грамотный подход к приему Туринадрола 10, следуя инструкции, советам специалистов и опытных атлетов, можно добиться стабильных и быстрых результатов.
Заместительная гормональная терапия для мужчин с возрастным андрогенным дефицитом
Специализация: урология, андрология
Синдром возрастного андрогенодефицита у мужчин — это нарушение биохимического баланса, возникающее в зрелом возрасте по причине недостаточности андрогенов в сыворотке крови, нередко сопровождающейся снижением чувствительности организма к андрогенам. Как правило, это приводит к значительному ухудшению качества жизни и неблагоприятно сказывается на функциях практически всех систем организма. Естественно, что огромный интерес вызывают вопросы терапии андрогенного дефицита, поскольку именно она ставит сложную задачу перед врачом-клиницистом: выбрать из широкого арсенала методов и препаратов гормональной терапии наиболее оптимальный, сочетающий в себе качество, эффективность, а также удобство в применении.
В настоящее время врачи-урологи и андрологи наиболее часто применяют заместительную терапию тестостероном. Данный метод позволяет решить целый ряд задач: снизить симптомы возрастного андрогенодефицита путем повышения либидо, общей сексуальной удовлетворенности, уменьшить выраженность либо полностью ликвидировать вегетососудистые и психические расстройства. Кроме того, если заместительная терапия тестостероном применяется более 1 года, у пациентов наблюдается повышение плотности костной массы, снижение выраженности висцерального ожирения, а также нарастание мышечной массы. Также после длительного курса лечения нормализуются лабораторные параметры: наблюдается повышение уровня гемоглобина или количества эритроцитов, снижение уровня ЛПОНП (липопротеинов очень низкой плотности) и ЛПНП (липопротеинов низкой плотности) при неизмененном уровне ЛПВП (липопротеинов высокой плотности). Многие авторы считают, что такого эффекта можно достичь, добившись восстановления концентрации тестостерона в крови до нормального уровня (10–35 нмоль/л). Следует также учитывать, что *17α-алкилированные препараты тестостерона флуоксиместеролон и метилтестостерон обладают выраженной гепатотоксичностью, оказывая токсическое и канцерогенное влияние на печень, а также отрицательно воздействуют на липидный спектр крови (резкое повышение уровня атерогенных и снижение уровня антиатерогенных липопротеидов). Поэтому применение этих производных тестостерона в клинической практике было прекращено.
В настоящее время из пероральных препаратов предпочтение отдается тестостерону ундеканоату (Андриол). Указанный эфир тестостерона не подвергается первичному печеночному метаболизму, так как всасывается в лимфатическую систему, минуя печень. После гидролиза тестостерона ундеканоата в лимфатической системе в системный кровоток поступает тестостерон, который оказывает лечебное действие как сам по себе, так и через свои основные метаболиты – дигидротестостерон (ДГТ) и эстрадиол, обусловливающие полный спектр андрогенной активности тестостерона. Таким образом, тестостерона ундеканоат сохраняет свою активность при пероральном применении. Вместе с этим, минуя систему воротной вены и прохождение через печень, тестостерона ундеканоат не оказывает гепатотоксического и гепатоканцерогенного действия. Период полувыведения препарата из плазмы составляет 3–4 часа. В связи с этим режимом дозировки тестостерона ундеканоата является 2-кратный прием в течение суток, это не всегда удобно для пациентов. Исходя из собственного опыта, мы считаем, что Андриол является достаточно мягким препаратом и помогает только в случаях начальных и минимальных проявлений возрастного андрогенного дефицита.
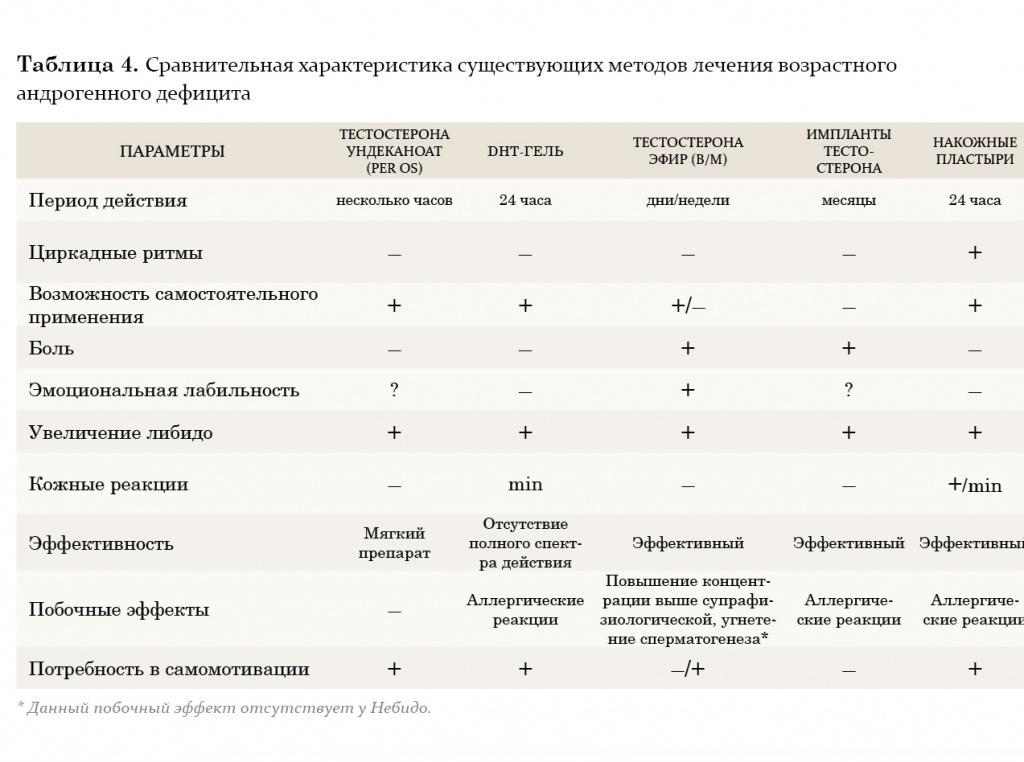
Внутримышечные инъекции пролонгированных эфиров тестостерона также являются широко применяемым методом заместительной терапии у мужчин с гипогонадизмом. Два наиболее известных эфира тестостерона – тестостерона ципионат и тестостерона энантат, имеют похожую фармакокинетику. При внутримышечном введении этих препаратов создается депо, из которого препарат высвобождается в кровеносное русло. В течение первых 2–3 дней после введения уровень тестостерона повышается до супрафизиологических цифр, а затем медленно снижается на протяжении последующих 2 недель до субнормальных значений. Положительной стороной этих препаратов является длительность терапевтического действия. Тем не менее резкие изменения в уровне тестостерона, зачастую ощущаемые самим пациентом в виде подъемов и снижения либидо, общего самочувствия, эмоционального статуса, являются нежелательными качествами данных препаратов. В связи с этим большие надежды возлагаются на новый препарат Небидо (Шеринг), фармакокинетика которого значительно отличается от других эфиров тестостерона. Небидо представляет собой тестостерона ундеканоат и является препаратом, не обладающим пиком повышения концентрации.
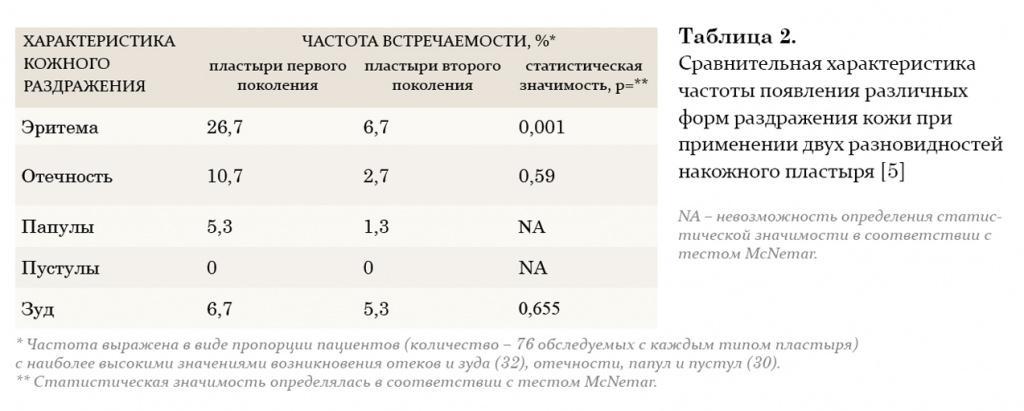
На протяжении двух последних десятилетий большое внимание уделяется исследованию преимуществ трансдермального применения препаратов тестостерона. Мошоночные пластыри обладают эффективным действием, и некоторые пациенты считают их наиболее удобным методом лечения. Накожные пластыри наиболее хорошо воспринимаются пациентами и дают эффективный уровень тестостерона в сыворотке крови. Тем не менее существуют некоторые различия между этими двумя разновидностями пластырей относительно их аллергогенного потенциала: при применении накожных пластырей отмечается гораздо большая частота возникновения аллергических реакций и раздражения кожи, чем при применении мошоночных пластырей.
Гель тестостерона обладает всеми преимуществами пластырей и не вызывает развития кожных реакций. Единственный его недостаток заключается в наличии возможности контакта геля с партнершей и недостаточном количестве долговременных исследований по его применению.
Трансдермальный путь введения тестостерона позволяет избежать его первичного метаболизма в печени и инактивации, как это происходит при применении пероральных андрогенных препаратов, а также позволяет имитировать циркадные ритмы высвобождения физиологического немодифицированного тестостерона и его естественных метаболитов, эстрадиола и ДГТ. К тому же терапию с использованием пластырей и геля в случае необходимости можно легко прервать. К положительным моментам этого метода лечения также относится низкий риск возникновения лекарственной зависимости.
Европейский препарат 5-α-дигидротестостерон-гель (ДГТ) хотя и признан эффективным, однако неизвестно, оказывает ли изолированное применение неароматизированного андрогена, каким является ДГТ, такое же действие, как тестостерон, в связи с тем, что метаболиты тестостерона включают эстрадиол. По мнению многих авторов, применение препарата не рекомендуется, так как ДГТ вследствие невозможности превращения в эстрадиол не обладает полным спектром терапевтических свойств тестостерона (например, влиянием на костную ткань и сердечно-сосудистую систему).
Некоторые из препаратов заместительной терапии, такие как тестостерона ундеканоат, ДГТ-гель и мошоночные пластыри, вызывают существенное увеличение концентрации ДГТ в сыворотке крови. ДГТ известен как главный андроген простаты, и в связи с этим проводилось много дискуссий по поводу способности его вызывать заболевания предстательной железы. Однако, несмотря на эти предположения, в последнее 10-летие не зафиксировано данных в пользу увеличения частоты возникновения патологии простаты при назначении препаратов ДГТ.
Таким образом, существует множество препаратов заместительной андрогенотерапии, однако все они имеют те или иные побочные эффекты, а также обладают угнетающим действием на сперматогенез. В последнее время появляется все больше работ, демонстрирующих вторичный характер возрастного андрогенного дефицита. Согласно материалам ВОЗ, получены данные о сохранении секретирующей функции клетками Лейдига у пожилых мужчин, что позволило ученым предложить принципиально новый подход в лечении возрастного андрогенного дефицита, основанный на стимуляции синтеза эндогенного тестостерона.
Однако не стоит забывать, что наряду с абсолютными противопоказаниями для заместительной терапии андрогенами (рак грудной и предстательной желез) существуют и дополнительные (доброкачественная гиперплазия предстательной железы с выраженной обструкцией, пролактинома, полицитемия). К относительным противопоказаниям относятся нарушения сна в виде апноэ, обструктивные заболевания легких, интенсивное курение.
К побочным эффектам андрогенов относятся усиление ночного апноэ, полицитемия, гинекомастия, приапизм, задержка жидкости, повышение АД, отеки, увеличение размеров простаты, торможение сперматогенеза.
То есть сегодня существуют методы лечения возрастного андрогенного дефицита, которые можно разделить на две группы, принципиально различающиеся по механизму действия:
заместительная терапия экзогенными андрогенными препаратами; терапия, стимулирующая синтез эндогенного тестостерона.
Таким образом, можно сказать, что оптимального для всех средства для лечения возрастного андрогенного дефицита у мужчин не существует. И к выбору препарата следует подходить строго индивидуально, учитывая возраст пациента, индекс массы тела, необходимость сохранения сперматогенеза, показатели гематокрита и сопутствующие заболевания.
Turinadrol 10 что это lyka
Последствия немедицинского использования анаболических стероидов
Журнал: Архив патологии. 2016;78(4): 48-53
Повзун С. А. Последствия немедицинского использования анаболических стероидов. Архив патологии. 2016;78(4):48-53.
Artificial illness as a result of non-medical use of anabolic androgenic steroids: A case report and a review of literature. Arkhiv Patologii. 2016;78(4):48-53.
https://doi.org/10.17116/patol201678448-53
42-летняя женщина-бодибилдер, в течение 18 лет применявшая для наращивания мышечной массы анаболические андрогенные стероиды (ААС), умерла от разрыва печени. Причиной разрыва послужили множественные актиномикотические абсцессы, развившиеся на фоне иммунодефицитного состояния. Обнаруженные на вскрытии изменения в различных органах были связаны с нарушением гормонального баланса в организме. Приведены данные литературы, посвященные анализу последствий воздействия на организм ААС в супрафизиологических дозах и немедицинскому использованию этих препаратов.
Патолого-анатомическое наблюдение. Профессиональная спортсменка, 42 года, занимавшаяся с 24 лет бодибилдингом и самостоятельно применявшая на протяжении всего этого периода времени с целью наращивания мышечной массы анаболические андрогенные стероиды (ААС) и белковые препараты, при поднятии штанги во время тренировки почувствовала себя плохо, была госпитализирована в ближайший стационар. При УЗИ и КТ-исследовании выявлено увеличение печени с крупным мультикистозным образованием, предположительно расцененным как проявление эхинококкоза (рис. 1). Отмечались гипербилирубинемия 74,6 ммоль/л, повышение активности АЛТ до 1340 ед., АСТ до 1005 ед. Для дальнейшего обследования и лечения через 2 дня больная в состоянии средней тяжести была переведена в НИИ скорой помощи им. И.И. Джанелидзе.

В НИИ в связи с наличием симптомов раздражения брюшины по правому фланку и подозрением на перитонит пациентке выполнена лапароскопическая операция, выявившая наличие в полости брюшины 250 мл лизированной крови, увеличение печени, нижний край которой располагался на 2 см ниже пупка, признаки внутрипеченочного холестаза. Видимых повреждений не найдено. Послеоперационный диагноз был сформулирован как «токсический гепатит, гематома печени (?), малый гемоперитонеум».
Проводилось симптоматическое лечение, состояние больной оставалось удовлетворительным, однако на 5-й день с момента госпитализации оно резко ухудшилось, по дренажной трубке из полости брюшины начала поступать неизмененная кровь, появилась перитонеальная симптоматика, в связи с чем больная была взята в операционную. В ходе лапаротомии в полости брюшины найдено и эвакуировано 1,5 л крови, на передней поверхности печени выявлены разрывы, при ревизии которых обнаружена полость диаметром около 10 см с подтекавшей из нее кровью. Гемостаз был достигнут прошиванием участков печени с элементами оментопексии, коагуляцией, использованием гемостатической губки и тампонированием участков разрыва пятью марлевыми тампонами. Фрагменты ткани из очага поражения взяты для биопсийного исследования. В послеоперационном периоде, несмотря на интенсивную терапию, состояние пациентки ухудшалось и на 10-е сутки с момента госпитализации в НИИ скорой помощи она скончалась.
На вскрытии при внешнем осмотре трупа, помимо хорошо выраженной мускулатуры и желтушности кожи и склер, обращали на себя внимание наличие следов бритой щетины на подбородке, увеличение половых губ и клитора, атрофия молочных желез, представленных практически одними сосками, невыраженность подкожной жировой основы, толщина которой в эпигастральной области составляла 1,2 см. В обеих плевральных полостях найдено по 100 мл геморрагической жидкости, в эпикарде, висцеральной плевре и париетальной брюшине точечные кровоизлияния. Резко увеличенная печень имела размер 34×28×19×13 см и массу 3700 г. В правой ее доле после удалении тампонов обнаружена округлая полость диаметром 8 см с неровным дном ярко-желтого цвета (рис. 2, а). На разрезе края полости на ширину 1,5-2 см имели такой же цвет, были суховатыми, с четкой границей с остальной тканью. Кроме этого, на латеральной поверхности правой доли имелся вертикальный неровный разрыв длиной около 10 см и глубиной до 4 см с немногочисленными свертками крови и грязно-желтыми полужидкими массами в глубине разрыва. Помимо описанных изменений, на разрезе (см. рис. 2, б) в VI-VIII сегментах имелось множество тесно расположенных полостей диаметром 1-1,5 см с мутным гноевидным содержимым. Дно и края полостей шириной около 0,5 см имели ярко-желтый цвет. Граница этих полостей с прилежащей тканью была четкой. В левой доле ткань на разрезе однородная, коричневая, глинистая.
Сердце упругое, размером 11×10×5 см и массой 280 г. В эндокарде левого желудочка выявлены точечные и сливные кровоизлияния в небольшом количестве. Толщина миокарда левого желудочка 1,2 см, правого желудочка 0,2 см. Миокард на разрезе коричневый, глинистый, тусклый, однородный. В легких имелась картина двусторонней нижнедолевой очаговой пневмонии, масса легких составляла 940 и 1020 г. Селезенка упругая, синюшная, масса 240 г и острый край разреза. В почках, масса которых составила 390 г, изменения соответствовали картине билирубинурийного нефроза.
Проявлением геморрагического синдрома, помимо точечных кровоизлияний в серозных оболочках и эндокарде, были следы измененной крови в желудке, 300 мл измененной крови в тонкой кишке и окрашенные кровью каловые массы в толстой кишке, хотя явного источника кровотечения обнаружить не удалось.
Изменения других органов заключались в атрофии эндометрия и яичников, истончении коркового вещества надпочечников до 0,1 см.
В биоптате печени, исследование которого произведено в день смерти больной, выявлен актиномикоз в виде множества полостей с нейтрофильными лейкоцитами и друзами актиномицетов (рис. 3).

При гистологическом исследовании секционного материала обнаружены множественные изменения, комплекс которых был обусловлен самостоятельным приемом (введением) пациенткой ААС.
Так, в печени, помимо описанного уже актиномикоза, имелись распространенные дисциркуляторные так называемые центролобулярные и мостовидные некрозы. Сохранившиеся гепатоциты были увеличены, имели средний диаметр 44 мкм (при норме 20-25), ядра в них также были крупными, с маргинацией хроматина, с одним, реже двумя ядрышками. В цитоплазме гепатоцитов содержались мелкие и средние жировые вакуоли. Миоциты поясничной мышцы имели средний диаметр 118 мкм (при норме 50-100), при этом в некоторых из них он достигал 190 мкм. В поджелудочной железе обращало на себя внимание резкое увеличение в диаметре островков Лангерганса, максимальный диаметр которых составлял 650 мкм при верхней границе нормы 225 мкм. Передняя доля гипофиза состояла исключительно из клеток с эозинофильной цитоплазмой. Щитовидная железа построена из средних и крупных фолликулов, выстланных однорядным кубическим эпителием, заполненных плотным, местами растрескавшимся в препарате эозинофильным коллоидом без вакуолей резорбции. В яичнике имелись многочисленные белые тела, одиночная мелкая киста, выстланная однорядным кубическим эпителием и заполненная слабоэозинофильной жидкостью. Дистальные канальцы почек обтурированы многочисленными билирубиновыми цилиндрами. Белая пульпа селезенки представлена редкими периартериолярными лимфоидными муфтами и единичными фолликулами без светлых центров. В парааортальном лимфатическом узле ткань была разреженной, без четкого рисунка фолликулов.
Таким образом, посмертное гистологическое исследование выявило рабочую гипертрофию скелетных мышц, дистрофические изменения и гипертрофию кардиомиоцитов, многочисленные дисгормональные изменения и признаки иммунодефицитного состояния, на фоне которого и возникло актиномикотическое поражение печени.
Патологоанатомический диагноз сформулирован следующим образом:
Актиномикоз печени, гнойно-некротическая форма с массивным поражением правой доли.
Вторичное иммунодефицитное состояние вследствие многолетнего самостоятельного приема анаболических гормонов.
Паренхиматозная желтуха. Билирубинурийный нефроз (масса почек 390 г). Операция 05.06.15: диагностическая лапароскопия. Разрыв правой доли печени с кровоизлиянием в полость брюшины 10.06.15. Операция 10.06.15: лапаротомия, остановка кровотечения из разрыва печени, тампонада печени, санация и дренирование полости брюшины. Массивные дисциркуляторные некрозы печени. Геморрагический синдром. Двусторонняя нижнедолевая пневмония. Двусторонний гидроторакс по 100 мл.
Практика немедицинского использования препаратов анаболического действия
Анализ зарубежной литературы показал, что для достижения высоких результатов указанные препараты в процессе тренировок используются главным образом бодибилдерами, тяжелоатлетами, армрестлерами и кикбоксерами. При этом бо́льшая часть этих препаратов оказывается запрещенной к применению у людей, производится подпольно и приобретается на «черном рынке». Вместе с тем в настоящее время в ряде стран, таких как США, Бразилия, страны Скандинавии, эти препараты все чаще используются не спортсменами, а любителями, занимающимися фитнесом. По данным H. Pope и соавт. [1], количество таких лиц в США, подавляющее большинство из которых мужчины, достигает 3 млн человек. По другим данным опроса, 2% студентов вузов США употребляли ААС в течение последних 12 мес [2]. Напротив, употребление ААС очень редко встречается среди жителей стран Восточной Азии, таких как Китай, Корея и Япония, возможно из-за того, что в их культурах меньше внимания обращается на состояние мускулатуры у мужчин [3].
Спортсмены и бодибилдеры-любители комбинируют различные стероиды циклами в виде нарастающих и снижающихся концентраций. Обычно это сочетание андрогенов и нестероидных препаратов. Последние выбираются с целью обеспечения дальнейшего анаболического эффекта (человеческий соматостатин, инсулиноподобный фактор роста-1 и инсулин) и чтобы уменьшить побочный эффект от ААС, усилить потерю жира и воды (диуретики, тироксин, и агонисты β2-адренергических рецепторов), реактивировать продукцию эндогенного тестостерона по окончании цикла (гонадотропины) и уменьшить риск обнаружения ААС в моче (диуретики) [4]. Бодибилдеры также сочетают ААС с эритропоэтином для интенсификации тренировок и более быстрого восстановления после них.
ААС применяют перорально, трансдермально или в виде внутримышечных инъекций. Сводный анализ результатов 10 исследований показал, что у 25,4-39,7% (в среднем 32,5) принимающих ААС развивается зависимость, причем это почти исключительно мужчины: из 363 человек с зависимостью от ААС были только 2 женщины. Число лиц с зависимостью от ААС среди жителей США составляет около 1 млн [1].
Потребители ААС часто сочетают их использование с опиатами [5]. Это позволяет им продолжать тренировку, несмотря на боль в мышцах и суставах. Естественно, у части их них возникает опиатная зависимость [6].
Механизм, за счет которого препараты тестостерона позволяют достигать более высоких спортивных результатов, недостаточно изучен. Использование ААС приводит к увеличению мышечной массы за счет гипертрофии волокон как 1-го, так и 2-го типа, при этом не меняется ни общее количество, ни процентное соотношение этих волокон [7].
Тестостерон повышает в крови уровень соматостатина и инсулиноподобного фактора роста-1, хотя циркулирующий в крови соматостатин не является важным медиатором влияния тестостерона на мышечную массу, а вот инсулиноподобный фактор роста-1, воздействуя на соответствующие рецепторы, является важным медиатором миогенного эффекта тестостерона [8]. Тестостерон также увеличивает количество митохондрий в миоцитах и доставку кислорода в ткани за счет увеличения количества эритроцитов в крови, расширения сети капилляров в мышцах. Он повышает в крови уровень 2,3-бифосфоглицерата, который облегчает передачу гемоглобином кислорода в ткани [9].
ААС стимулируют эритропоэз за счет повышения чувствительности костного мозга к эритропоэтину [10] и увеличения доступности железа для эритропоэза [11]. Они могут также повышать мотивацию и настроение, что косвенно может влиять на спортивные результаты.
Соматотропный гормон (СТГ) стимулирует липолиз и окисление жирных кислот, обеспечивая энергию и тем самым предотвращая катаболизм белков. На организменном уровне СТГ угнетает окисление глюкозы и ее утилизацию, хотя в то же время усиливает окисление глюкозы печенью. СТГ оказывает антагонистическое действие в отношении инсулина, обеспечивает анаболизм белков и уменьшает синтез мочевины, тормозит окисление белков, увеличивает общую массу тела (за счет внеклеточной жидкости и клеточной массы), уменьшает массу жировой ткани [14].
В Интернете кроме предложений о продаже рекомбинантного СТГ, предлагают пептиды, регулирующие синтез гипофизом СТГ, миметики гормона грелина и другие факторы роста.
Инсулин, применяемый наряду с ААС, усиливает синтез белков: его введение сопровождается повышением синтеза белка в миоцитах на 70% [15]. При этом авторы полагают, что инсулин непосредственно стимулирует синтез белков независимо от трансмембранного транспорта глюкозы или аминокислот.
Использование агонистов β-адренергических рецепторов основано на их способности влиять на увеличение мышечной массы за счет угнетения катаболизма белков и снижения общей массы жира в организме [16].
Негативные эффекты применяемых препаратов. Негативное влияние ААС реализуется одновременно по многим направлениям. На тканевом уровне оно заключается при применении их в супрафизиологических дозах в активации перекисного окисления липидов [17] и ускорении в различных тканях апоптоза [18, 19].
Одной из мишеней для ААС является миокард. У потребителей этих препаратов описываются развитие кардиомиопатии [20], инфаркта миокарда [21], нарушения проводимости [22]. Так, в исследовании H. Far и соавт. [23] при сравнении 87 аутопсийных наблюдений лиц, использовавших ААС, с контрольной группой из 173 умерших мужчин продемонстрировано значительное увеличение массы сердца даже в соотношении с общей массой тела. В другой работе на материале 4 летальных исходов у потребителей ААС продемонстрирована гипертрофия миокарда желудочков в сочетании с кардиосклерозом и миоцитолизом с развитием терминального состояния по сердечному типу [24]. Исследованиями с применением эхокардиографии [25] и магнитно-резонансной томографии [26] у потребителей ААС продемонстрированы признаки кардиомиопатии со снижением фракции выброса желудочков и диастолической дисфункцией, при этом если функциональные изменения рассматриваются как принципиально обратимые, то изменения, сопровождающиеся кардиосклерозом, уже нет.
Помимо непосредственного воздействия на миокард, ААС при длительном употреблении вызывают дислипидемию в виде снижения соотношения в крови липопротеидов высокой и низкой плотности [27], что сопровождается более выраженными проявлениями атеросклероза венечных артерий сердца, изменениями физиологических показателей, в том числе нарушениями ритма сердца [28]. Так, обследование 143 тяжелоатлетов, длительное время использовавших ААС, выявило у них большее количество известковых отложений в венечных артериях сердца, чем у мужчин их возраста в популяции [29].
Из числа описанных в литературе летальных исходов у лиц, употреблявших ААС, большинство летальных случаев обусловлено внезапной сердечной смертью [30].
В ряде исследований описано развитие психологических и психиатрических симптомов у лиц, использующих ААС. Эти отклонения заключаются в маниакальной или гипоманиакальной симптоматике, а также депрессивной симптоматике при отмене ААС, проявления представляются дозозависимыми и развиваются, как правило, у лиц, получающих более 1000 мг тестостерона в неделю [31]. Изменения поведения прослежены и у лабораторных животных, получавших супрафизиологические дозы ААС [32]. У лиц, применяющих ААС, отмечены склонность к криминальному поведению и насильственным действиям, в том числе к убийствам [33].
Показано, что у потребителей ААС частым симптомом является мышечная дисморфофобия [34]. Поскольку прием ААС по принципу обратной связи сопровождается картиной гипогонадизма, которая в случае отмены препаратов может длиться недели и даже месяцы и сопровождаться повышенной утомляемостью, утратой либидо и депрессией, для устранения этих явлений бывшие пользователи вновь начинают прием ААС.
В связи с тем что супрафизиологические дозы ААС влекут за собой ускорение апоптоза и в клетках центральной нервной системы [35], это сопровождается нарушением запоминания пространственных образов, продемонстрированным у получавших ААС тяжелоатлетов [36].
Заключение
Как свидетельствует практика, приобщение к западным ценностям, помимо прочего, влечет за собой и ряд негативных влияний. Не только профессиональное, но и «бытовое» использование ААС принимает характер эпидемии, с жертвами которой, по-видимому, все чаще придется сталкиваться врачам-патологоанатомам и судебно-медицинским экспертам, поэтому представления о мультиорганной патологии, возникающей при употреблении ААС, должны способствовать правильной оценке тех или иных клинических ситуаций.
Конфликт интересов отсутствует.
Заключение
Как свидетельствует практика, приобщение к западным ценностям, помимо прочего, влечет за собой и ряд негативных влияний. Не только профессиональное, но и «бытовое» использование ААС принимает характер эпидемии, с жертвами которой, по-видимому, все чаще придется сталкиваться врачам-патологоанатомам и судебно-медицинским экспертам, поэтому представления о мультиорганной патологии, возникающей при употреблении ААС, должны способствовать правильной оценке тех или иных клинических ситуаций.