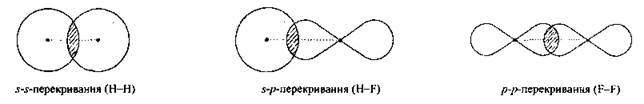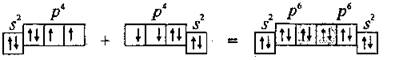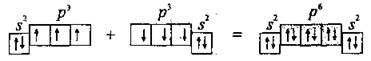у алканов какая связь пи или сигма
У алканов какая связь пи или сигма
РАЗДЕЛ И. ОБЩАЯ ХИМИЯ
В образовании σ-связи могут принимать участие как обычные, так и гібридизовані орбитали.
Два неспаренные р-электроны в атоме Кислорода могут образовать две совместные ковалентные пары с электронами второго атома Кислорода:
Одна пара идет на образование σ-связи:
которые размещаются в плоскости, которая является перпендикулярной к оси соединения атомов Карбона:
В результате образования трех общих электронных пар N≡N каждый атом Азота приобретает устойчивую электронную конфигурацию инертного элемента 2 s 2 2 p 6 (октет электронов).
С помощью π-связи формируется молекула бензену и других аренов. Длина связи (ароматического, «полуторного», сказывается 
1 Под длиной связи понимают расстояние между центрами ядер атомов Углерода, участвующих в связи.
Алканы
Органическая химия
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 😉
Номенклатура алканов
Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
Внимательно изучите составленные для различных веществ названия ниже.
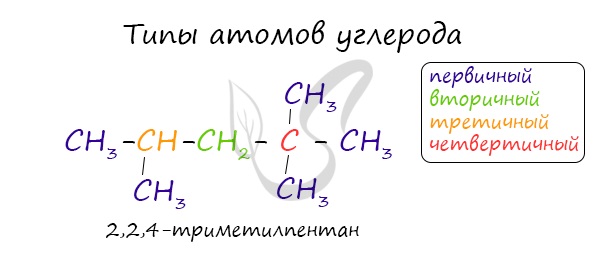
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
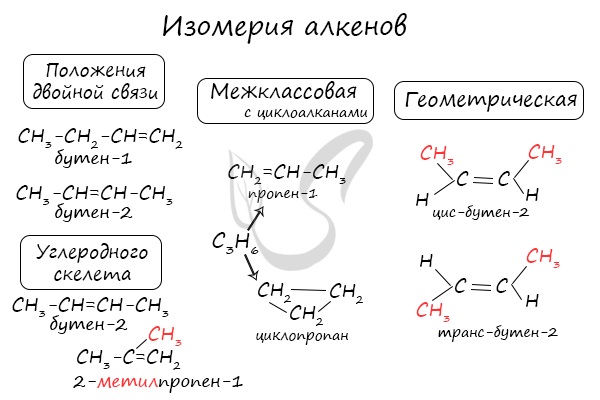
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.
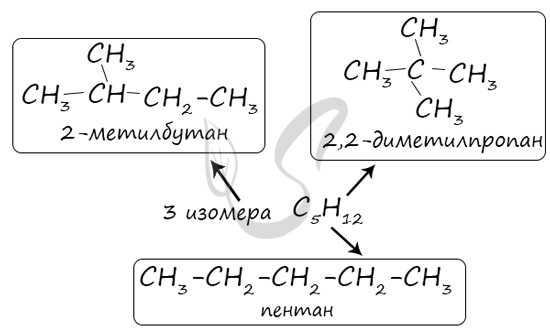
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.
Природный газ и нефть
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.
Получение алканов
В ходе крекинга нефти получается один алкан и один алкен.
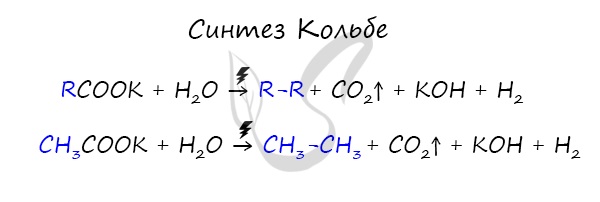
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.
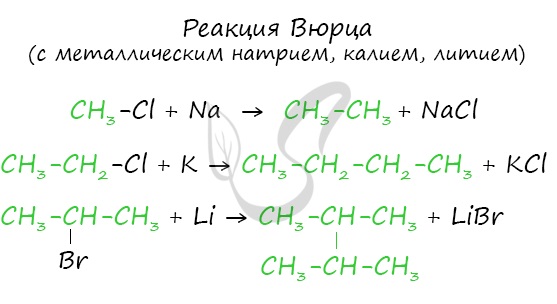
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).
На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.
В результате электролиза солей карбоновых кислот может происходить образование алканов.
Химические свойства алканов
Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
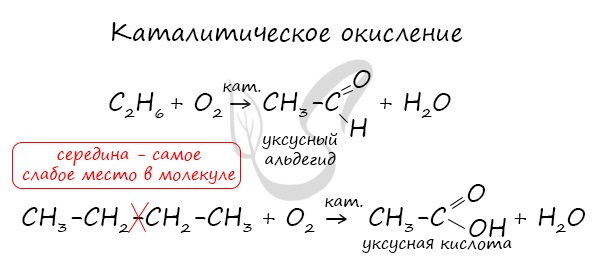
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
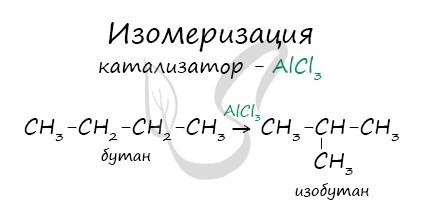
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Алкены
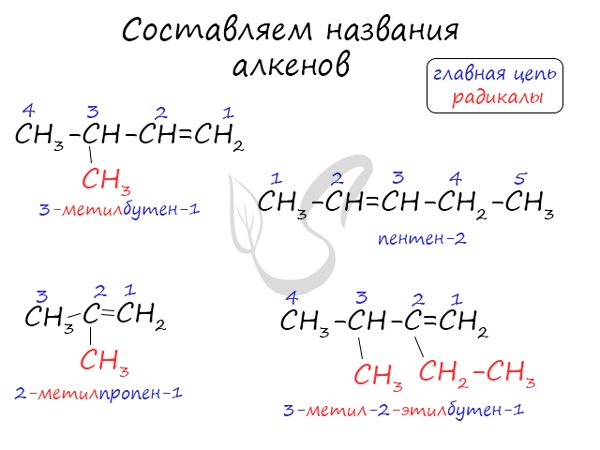
Номенклатура и изомерия алкенов
Названия алкенов формируются путем добавления суффикса «ен» к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
Получение алкенов
В результате крекинга нефти образуется один алкан и один алкен.
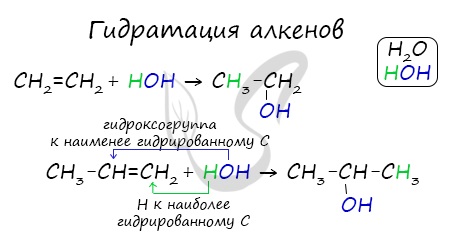
В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.
Химические свойства алкенов
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
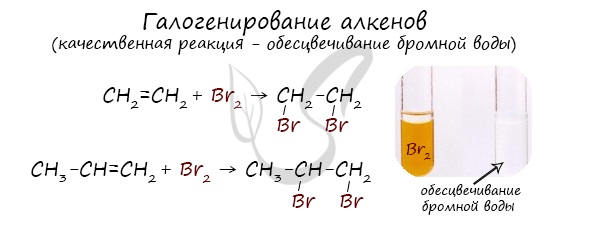
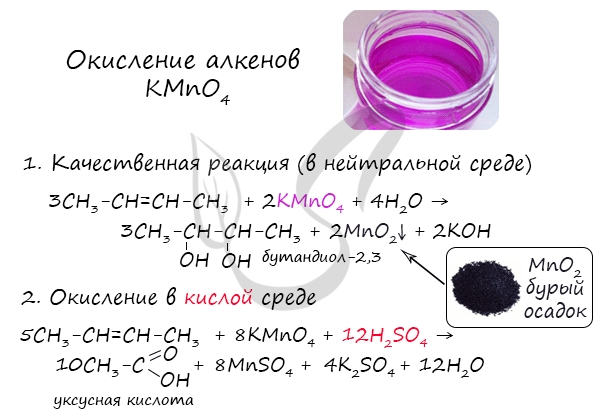
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
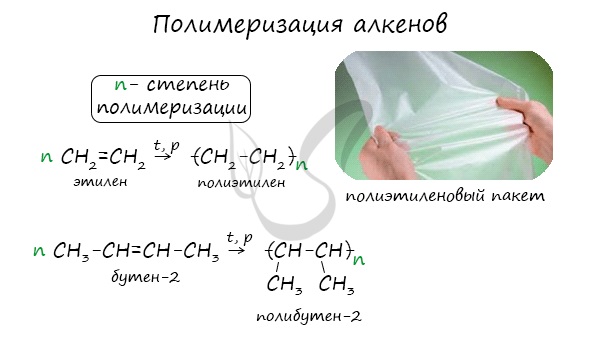
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Алкадиены
Номенклатура и изомерия алкадиенов
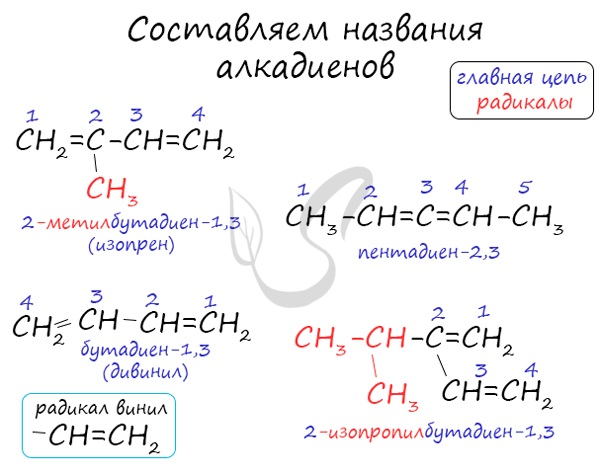
Названия алкенов формируются путем добавления суффикса «диен» к названию алкана с соответствующим числом: пропадиен, бутадиен, пентадиен и т.д.
При составления названия алкадиена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойные связи. Нумерация атомов углерода в ней начинается с того края, к которому ближе двойная связь. В конце названия указывают атомы углерода, у которых начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
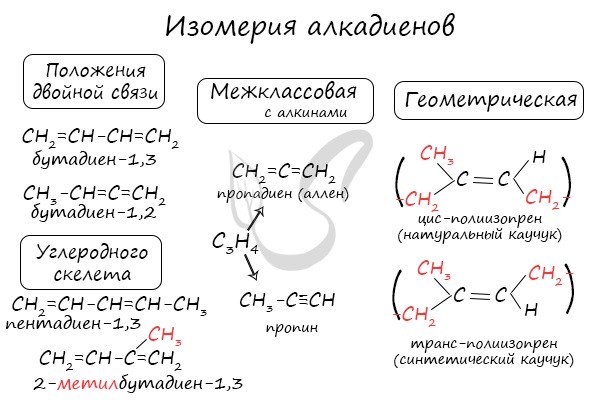
Для алкадиенов характерна изомерия углеродного скелета, положения двойных связей, межклассовая изомерия с алкинами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
Также к синтетическим каучукам относится бутадиен-1,3 (дивинил).
Классификация по положению двойных связей
В случае, если две двойные связи прилежат к одному и тому же атому углерода.
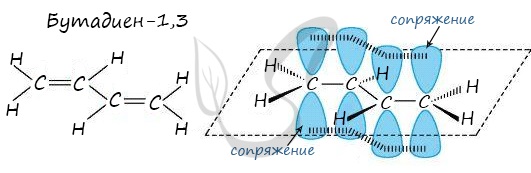
В случае, если две двойные связи разделены одной одинарной связью. В результате такого взаиморасположения в молекулах возникает сопряжение: формируется единое π-электронное облако.
Помните, что сигма-связи (σ-связи) перекрываются вдоль линии плоскости, а пи-связи (π-связи) над и под линией плоскости (линией, соединяющей центры атомов).
В случае, если две двойные связи разделены двумя и более одинарными связями.
Получение алкадиенов
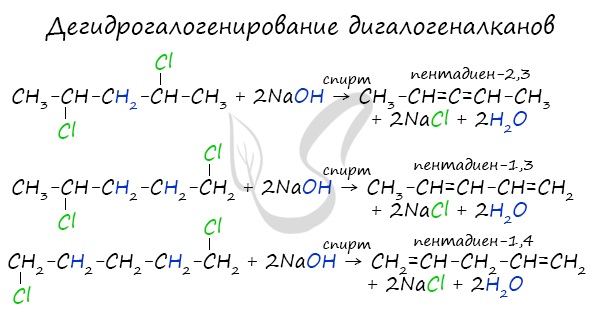
В результате реакции молекулы алкана, содержащей два атома галогена, со спиртовым (!) раствором щелочи получается алкадиен. В зависимости от положения галогенов возможны разные варианты.
Отщепление идет по правилу Зайцева: атом водорода отщепляется от соседнего, наименее гидрированного атома углерода.
Сергей Васильевич Лебедев в 1927 году разработал первый промышленный способ получения синтетического каучука из этилового спирта.
Каучук занимает важное место в промышленности благодаря своим свойствам: водонепроницаемости, эластичности и способности к электроизоляции. Путем вулканизации из каучука получают резину, используемую повсеместно.
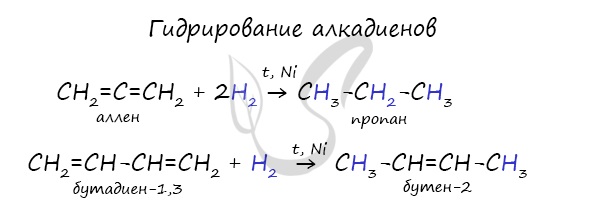
В результате отщепления водорода от молекулы алкана образуются двойные связи. Дегидрирование происходит при повышенной температуре и в присутствии катализатора.
Химические свойства алкадиенов
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение брома по кратным связям к органическому веществу.
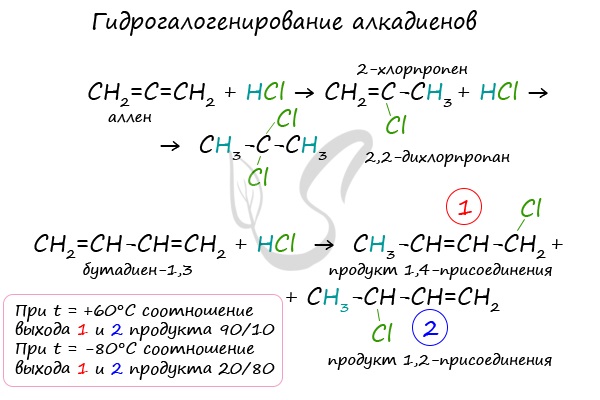
Алкадиены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Сигма и пи связи
Ковалентные связи. Пи- и сигма- связи
Основные объекты биохимии.
Объектами изучения биоорганической химии являются белки и пептиды, нуклеиновые кислоты, углеводы, липиды, биополимеры, алкалоиды, терпеноиды, витамины, антибиотики, гормоны, токсины, а также синтетические регуляторы биологических процессов: лекарственные препараты, пестициды и др.
Изомерия органических соединений, ее виды. Характеристика видов изомерии, примеры.
Различают два вида изомерии: структурную и пространственную (т.е. стереоизомерию). Структурные изомеры отличаются друг от друга порядком связи атомов в молекуле, стереоизомеры — расположением атомов в пространстве при одинаковом порядке связей между ними.
Выделяют следующие разновидности структурной изомерии: изомерию углеродного скелета, изомерию положения, изомерию различных классов органических соединений (межклассовую изомерию).
Изомерия углеродного скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы. Например: молекулярной формуле С4Н10 соответствуют два углеводорода: н-бутан и изобутан. Для углеводорода С5Н12 возможны три изомера: пентан, изо-пентан и неопентан. С4Н10 соответствуют два углеводорода: н-бутан и изобутан. Для углеводорода С5Н12 возможны три изомера: пентан, изо-пентан и неопентан.
Изомерия положения обусловлена различным положением кратной связи, заместителя, функциональной группы при одинаковом углеродном скелете молекулы
Межклассовая изомерия- изомерия веществ, принадлежащих к разным классам органических соединений.
Современная классификация и номенклатура органических соединений.
В настоящее время широко используется систематическая номенклатура- IUPAC- международная единая химическая номенклатура. Правила ИЮПАК основываются на несколько систем:
1) радикально-функциональная ( в основе названия лежит название функц-й группы),
2) соединительная (названия составляют из нескольких равноправных частей),
3) заместительная (основой названия служит углеводородный фрагмент).
Ковалентные связи. Пи- и сигма- связи.
Ковалентная связь являетсся основным типом связи в органических соединениях.
Это связь, образованная перекрытием пары валентных электронных облаков.
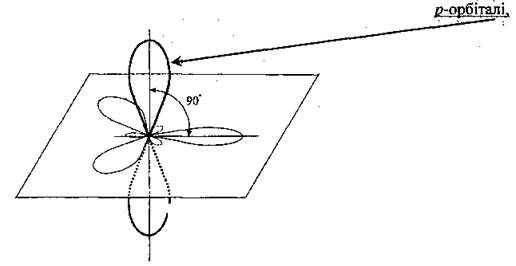
Пи-связь- это ковалентная связь, образующаяся путем перекрывания р-атомных орбиталей.
Сигма-связь- это ковалентная связь, образующаяся при перекрывании s-атомных орбиталей.
Если между атомами в молекуле образуются как s-, так и р-связи, то образуется кратная (двойная или тройная) связь.
6. Современные представления о структуре органических соединений. Понятие «химическое строение», «конфигурация», «конформация», их определение. Роль структуры в проявлении биологической активности.
В 1861 году А.М. Бутлеровым была предложена теория химического строения органических соединений, лежащая в основе современных представлений о структуре орг. соединений,которая состоит из следующих основных положений:
1.В молекулах веществ существует строгая последовательность химического связывания атомов, которая называется химическим строением.
2.Химические свойства вещества определяются природой элементарных составных частей, их количеством и химическим строением.
3.Если у веществ с одинаковым составом и молекулярной массой различное строение, то возникает явление изомерии.
4.Так как в конкретных реакциях изменяются только некоторые части молекулы, то исследование строения продукта помогает определить строение исходной молекулы.
5.Химическая природа (реакционная способность) отдельных атомов в молекуле меняется в зависимости от окружения, т.е. от того, с какими атомами других элементов они соединены.
Понятие «химическое строение» включает представление об определенном порядке соединения атомов в молекуле и об их химическом взаимодействии, изменяющем свойства атомов.
Конфигурация — относительное пространственное расположение атомов или групп атомов в молекуле химического соединения.
Конформация — пространственное расположение атомов в молекуле определенной конфигурации, обусловленное поворотом вокруг одной или нескольких одинарных сигма-связей
Сигма связь-ковалентная связь образованная при перекрывании атомных s-электронных облаков, происходит вблизи прямой, соединяющей ядра взаимодействующих атомов (т.е. вблизи оси связи)
В образовании сигма-связи могут принимать участие p-электронные облака, ориентированные вдоль оси связи. в молекуле HF ковалентная сигма-связь возникает вследствие перекрывание 1s-электронного облака атома водорода и 2p-электронного облака атома фтора.
Химическая связь в молекуле F2 тоже сигма связь, она образована 2p-элект. облаками двух атомов фтора.
Пи-связь — ковалентная связь, при взаимодействии p-электронных облаков, ориентированных перпендикулярно оси связи, образуются не одна, а две области перекрывания, расположенные по обе стороны от этой связи.
Примеры:
в молекуле N2 атомы азота связаны в молекуле тремя ковалентными связями, но связи неравноценны одна из них сигма, две другие пи-связи.
вывод о неравноценности связей в молекуле подтверждается тем, что энергия их разрыва различна; пи-связь является непрочной
Общая химия
3. Химическая связь
3.5. Сигма — и пи-связь
Пространственно различают два типа связи — сигма — и пи-связь.
1. Сигма-связь (σ-связь) — простой (одинарный) ковалентная связь, образующаяся перекрыванием электронных облаков по линии, соединяющей атомы.
Связь характеризуется осевой симметрией:
В образовании σ-связи могут принимать участие как обычные, так и гібридизовані орбитали.
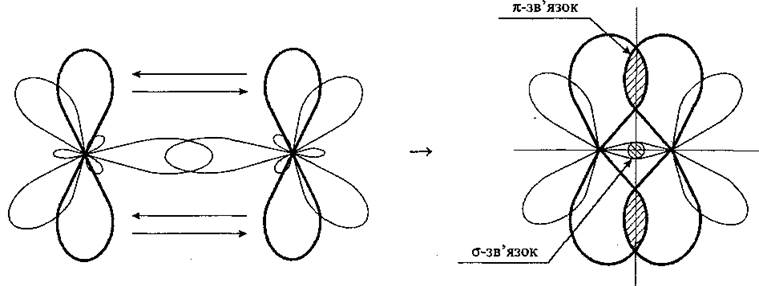
Пи-связь (π-связь). Если у атома после образования σ-связи остались неспаренные электроны, он может использовать их на образование второго типа связи, который называют π-связью. Рассмотрим его механизм на примере образования молекулы кислородаO2.
Два неспаренные р-электроны в атоме Кислорода могут образовать две совместные ковалентные пары с электронами второго атома Кислорода:
Одна пара идет на образование σ-связи:
Другая, перпендикулярная к ней, — на образование π-связи:
Еще однаp-орбиталь (рв), как иs-орбиталь, на которой находятся по две спаренные электроны, участия в связи не берут и не обобществляются.
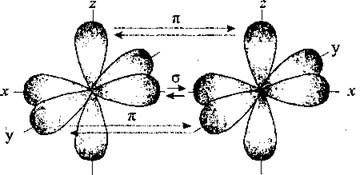
Аналогичным образом при образовании органических соединений (алкенов и алкадієнів) послеsp2-гибридизации у каждого из двух атомов Углерода (между которыми образуется связь) остается по одной негібридизованій р-орбитали.
которые размещаются в плоскости, которая является перпендикулярной к оси соединения атомов Карбона:
В сумме σ — и π-связи дают двойную связь.
Тройная связь образуется аналогично и состоит из одной σ-связи (рх) и двух я-связей, которые образованы двумя взаимноперпендикулярными парамиp-орбиталей (ру,pz):
Пример: образование молекулы азотаN2.
Электронная формула атома Азота-7N 1s22s22p3или
В результате образования трех общих электронных парN≡Nкаждый атом Азота приобретает устойчивую электронную конфигурацию инертного элемента 2s22p6(октет электронов).
Тройная связь возникает и при образовании алкінів (в органической химии).
В результатеsг-гибридизации внешней электронной оболочки атома Углерода образуется двеsр-орбитали, расположенные по оси 0Х. Одна из них идет на формирование в-связи с другим атомом Углерода (вторая — на формирование σ-связи с атомом Водорода). А две не гібридизовані р-орбитали (ру,pz) размещаются перпендикулярно друг к другу и к оси соединения атомов (0Х).
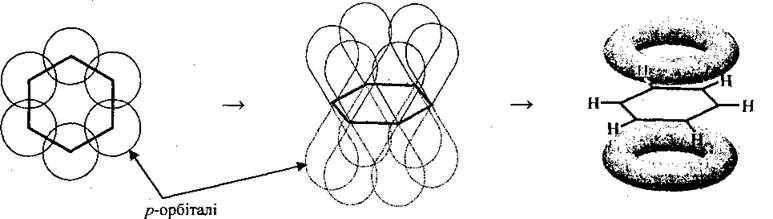
С помощью π-связи формируется молекула бензену и других аренов.
Длина связи (ароматического, «полуторного», сказывается
Все шесть атомов Углерода имеют общую π-электронное облако, плотность которой локализована над и под плоскостью ароматического ядра и равномерно распределена (делокалізована) между всеми атомами Углерода. По современным представлениям она имеет форму тороида:
Под длиной связи понимают расстояние между центрами ядер атомов Углерода, участвующих в связи.
π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи).
π-Связь слабее σ-связи из-за менее полного перекрывания р-АО.
Поэтому поляризуемость π-связи значительно выше, чем σ-связи.