у каких элементов нет возбужденного состояния
Атомы и электроны
Атомно-молекулярное учение
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
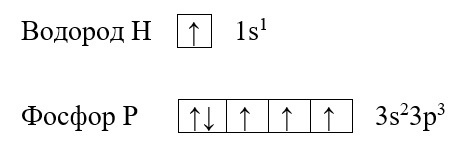
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
Правила заполнения электронных орбиталей и примеры
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Внешний уровень и валентные электроны
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
У каких элементов нет возбужденного состояния
Электронную конфигурацию в возбуждённом состоянии 1s 2 2s 2 2р 4 3s 1 имеет атом
Число электронов в данной частице равно 9, атом фтора содержит 9 электронов.
Разве атом фтора не имеет электронную конфигурацию 1s2 2s2 2p5?
В невозбужденном состоянии, да. Но здесь спрашивается про атом в возбужденном состоянии, при этом электроны распариваются и могут переходить на более высоколежащие орбитали.
Атом фтора в принципе не может переходить в подобное возбужденное состояние,хотя-бы из-за отсутствия 3s орбитали
Уважаемая Черепаха Тортилла, а кто Вам сказал, что у атома фтора нет 3s-орбитали? Она есть. И 3р-орбиталь есть, и 3d. и 4s и т.д. Просто в нормальном (невозбужденном) состоянии эти орбитали всегда пустые. А при поглощении энергии электроны переходят на более высокие орбитали (с более высокой энергией), что и называется возбужденным состоянием атома.
А если следовать вашей логике, то у атома водорода только один (первый) энергетический уровень, а как же тогда атом водорода поглощает, а потом излучает? Поищете на просторах интернета что-нибудь про серии Лаймана, Бальмера, Пашена.
Почему фтор, исходя из выше написанного, с таким же успехом может быть и кислород, и неон. У всех же есть вакантные орбитали.
Ирина Николаевна, у кислорода всего 8 (восемь) электронов, а у неона 10 (десять). Поэтому эти элементы не подходят под указанную электронную формулу, хотя вакантные орбитали у них действительно есть
Почему тогда у кислорода не возможно высшая степень окисления +6, раз у него есть вакантная орбиталь?
потому, что никто не может оттянуть от кислорода 6 электронов
мы учим, что количество энергетических уровней в атоме равно номеру периода, т.е. если фтор находится во 2 периоде,то и только 2 уровня.
Надежда, значит Вы неправильно учите.
Уважаемый Александр Иванов! Откройте, пожалуйста, школьные учебники по химии за 8 класс, можно и 9 с 11 посмотреть. Всегда твердят, что базовый уровень ЕГЭ можно сдать со школьным учебником.
Я регулярно открываю школьные учебники. И многое мне в них не нравится.
Но в школьных учебниках (и не только по химии, но и по физике) написано про модель атома водорода предложенную Бором. И о том, что электрон может «перескакивать» с одного электронного уровня на другой, при этом испуская или поглощая энергию. Так что информация о том, что электронных уровней даже у атома водорода много, в школьных учебниках есть.
Можно долго спорить о том, что твердят.
Еще твердят, что ЕГЭ убивает наше образование.
Что касается количества уровней, и того что оно равно номеру периода. То как быть с ионом натрия? Ведь натрий в третьем периоде, а электроны только на двух. Значит третий пустой? Тогда может и четвёртый есть? Просто он пустой.
А разве Вы не учите, что в подобных заданиях нужно посчитать количество электронов? И в данном задании оно равно девяти. А еще в задании написано, что это атом. Не анион, не катион, а именно АТОМ. В каком же атоме девять электронов?
Соглашусь, что задание непривычное, но может это и хорошо? Может именно такие задания будут способствовать развитию мышления у учеников?
И, наконец, задание придумали не мы, а в МИОО (Московский институт открытого образования)
Что может заставить так сильно возбудиться атом фтора, если он самый активный?
В смысле «возбудиться»? В атомарном состоянии он может существовать, например, при высоких температурах, которых хватает на разрыв химической связи.
Яна, в задании речь идёт об отдельном атоме, а не о соединении, поэтому ни о каких степенях окисления не может быть и речи.
Валентные возможности атомов
Атомы химических элементов и их валентные возможности
В начале прошлого века научная общественность была потрясена открытием британского физика Э. Резерфорда, который в своем докладе «Рассеяние α- и β-лучей и строение атома» говорил об открытии атомного ядра.
Данное открытие в тандеме со знанием о электронах сместило главенствующую тогда теорию о валентности, заменив ее на теорию о химических связях.
Однако понятие о валентности не пропало из научного мира. Вклад в научное развитие этого термина внесли Э. Франкленд, Ф. А. Кекуле и А. М. Бутлеров.
Согласно проделанным открытиям, атомы химических элементов состоят из:
Свойства атомов химических элементов определяет количество электронов на их последнем (внешнем) электронном слое. Именно они участвуют в образовании химических связей разных типов. Такие электроны называются валентными.
Валентность — количество связей образованных атомом при участии его валентных электронов.
Для определения валентных возможностей атома необходимо рассмотреть распределение электронов на его энергетических уровнях.
Только атомы образовавшие химические связи могут характеризоваться понятием валентности.
Валентность обозначают римскими цифрами от I до VIII.
Число валентных электронов или число общих электронных пар определяет валентность.
Понятие валентности сопряжено со степенью окисления и часто совпадает с его значением.
Чем определяются, какие факторы влияют
Валентность атома определяется количеством валентных электронов:
Атомы могут иметь основное и возбужденное состояние, из-за чего большинство химических элементов имеют переменную валентность.
В основном состоянии валентность зависит от неспаренных электронов последнего (иногда и предпоследнего) энергетических уровней. Обычное состояние фиксируется в Периодической таблице Менделеева.
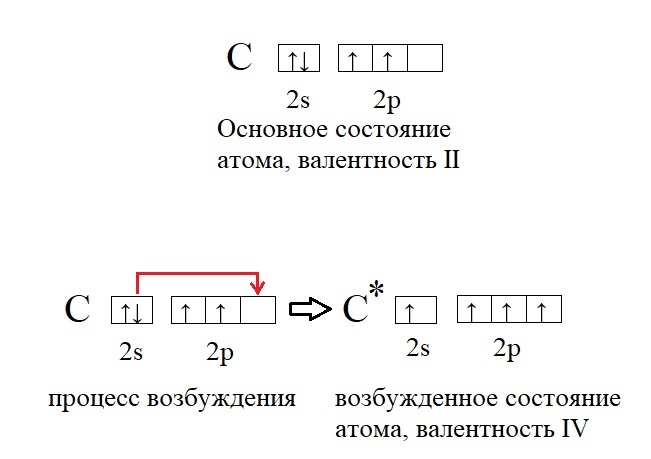
Например, валентность углерода в основном состоянии равна II из-за двух неспаренных электронов на 2p-орбитали.
Дополнительная энергия, которую может получать атом, приводит его в возбужденное состояние. В таком случае уже соединенные электроны могут распариваться и участвовать в образовании новых связей. Валентность повышается.
Валентность углерода в возбужденном состоянии может повышаться до четырех, так как в таком состоянии у него распариваются 2s-электроны.
В формуле возбужденное состояние атома обозначается звездочкой.
Определение валентности элемента по электронно-графическим формулам
Для определения количества электронов на энергетических уровнях необходимо полагаться на номер и место химического элемента в Периодической системе Д. И. Менделеева.
Определив количество электронов, необходимо распределить их по свободным орбиталям в порядке заполнения по шкале энергии:
В одной ячейке или на одной орбитали могут располагаться либо 1 электрон, либо 2 электрона с противоположными спинами — разными направлениями вращения.
Орбитали разных уровней могу размещать в своих свободных ячейках разное количество электронов:
По количеству электронов, оставшихся неспаренными в ячейках, можно узнать валентность атомов химических элементов. Электронные формулы обычно записываются не полностью, а в кратком варианте, указывая только крайние электронные уровни каждого слоя.
Можно сформулировать следующие закономерности электронного строения атома:
Селен, углерод, фосфор, сера, азот, хлор и другие примеры
Рассмотрим заполнение электронных уровней на примерах.
Углерод С обладает номером 6 в Периодической системе химических элементов Д. И. Менделеева, соответственно, он обладает 6 электронами.
Они полностью заполняют уровни 1s / 2s и частично уровень 2р. В обычном состоянии углерод обладает валентностью II. Свободная орбиталь 2р подуровня позволяет орбитали 2s распариваться. Тогда валентность углерода может изменяться на IV.
Азот N обладает номером 7 в ПСХЭ Менделеева и 7 электронами.
Они полностью занимают уровни 1s / 2s и частично 2р. В обычном состоянии азот обладает валентностью III. Перейти в возбужденное состояние путем распаривания 2s-электронов атом не способен, так как относится ко второму периоду, а на втором энергетическом уровне больше нет свободных подуровней и орбиталей, способных принять распарившиеся электроны. Максимальная валентность азота равна IV (за счет образования связи, не только по обменному, но и по донорно-акцепторному механизму), валентность V — не достигается.
Особенностью азота является несоответствие его валентности номеру группы ПС. Азот не обладает валентностью равной V, однако обладает соответствующей степенью окисления +5. НЕсоответствие значений валентностей и степеней окисления атомов азота в некоторых его соединениях является еще одной особенностью этого элемента.
Кислород О обладает номером 8 в ПСХЭ Менделеева и 8 электронами. Возбужденного состояния у кислорода так же нет.
Электроны полностью занимают уровни 1s / 2s и частично 2р. Валентность кислорода равна II — постоянная валентность.
Фтор F обладает номером 9 в ПСХЭ Менделеева и 9 электронами. Они полностью занимают уровни 1s / 2s и частично 2р. Фтор обладает только валентностью I, которая не меняется.
Алюминий Al обладает номером 13 в ПСХЭ Менделеева и 13 электронами. Они полностью занимают уровни 1s / 2s, 2p / 3s и частично уровень 3р. Несмотря на электронную конфигурацию основного (стационарного) состояния атома, валентность I практически не встречается. У алюминия постоянная валентность III (из этого следует что энергия перехода в возбужденное состояние для этого элемента не высока и атомы алюминия всегда пребывают именно в возбужденном состояние).
Фосфор P обладает номером 15 в ПСХЭ Менделеева и 15 электронами.
Они полностью заполняют уровни 1s / 2s, 2p / 3s и частично уровень 3р. В обычном состоянии фосфор обладает валентностью III. Распаривание 3s электронов создает возбужденное состояние, в котором пять валентных электронов занимают 5 ячеек, и валентность в таком случае поднимается до V.
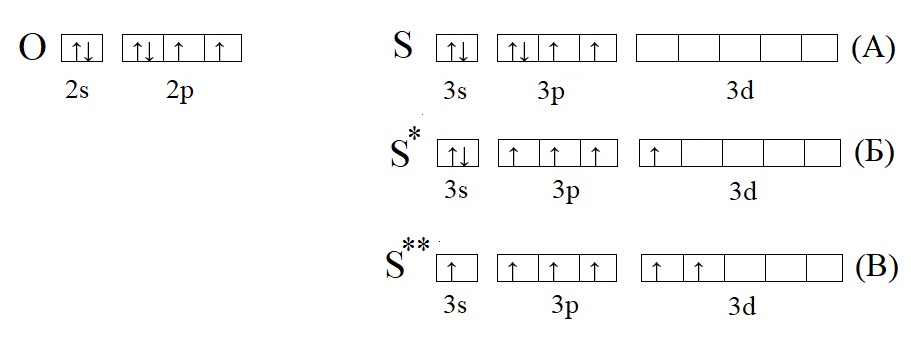
Сера S занимает 16 место в ПСХЭ Менделеева и обладает 16 электронами.
Они полностью занимают 1s / 2s, 2p / 3s и частично 3р. В обычном состоянии сера обладает валентностью II. Распаренные электроны могут занимать ячейки подуровня 3d, валентность поднимается до IV и VI.
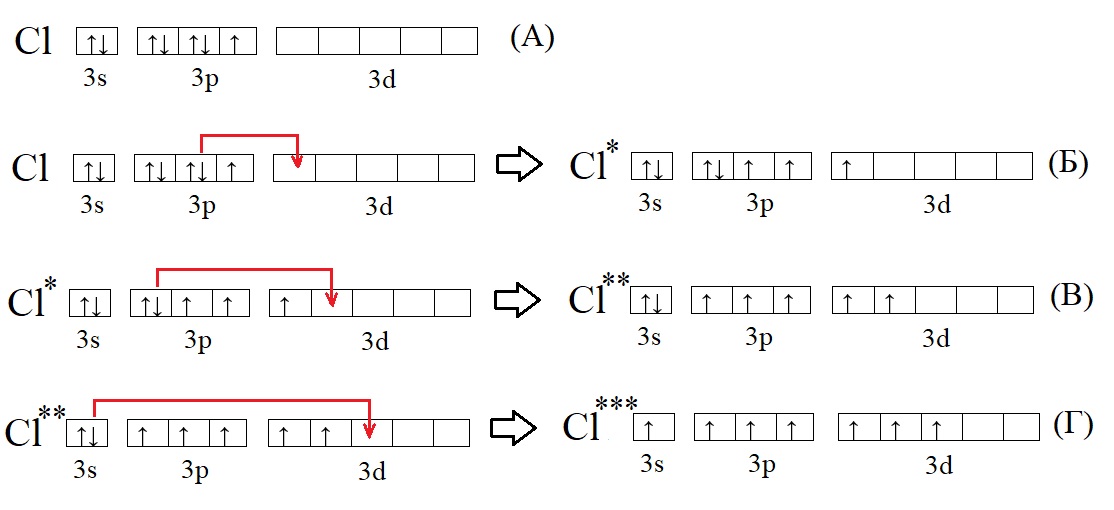
Хлор Cl обладает номером 17 в ПСХЭ Менделеева и 17 электронами.
Они полностью занимают уровни 1s / 2s, 2p / 3s и частично 3р. В обычном состоянии валентность хлора равна I. В возбужденном состоянии хлор может повышать свою валентность до III, V или VII. Формально данный ХЭ может обладать валентностью IV и VI.
Селен Se обладает номер 34 в ПСХЭ Менделеева, соответственно, он обладает 34 электронами.
Они полностью заполняют уровни 1s / 2s, 2p / 3s, 3p / 4s, 3d, отдав 30 электронов. Еще 4 заполняют орбиталь 4р — (1 ячейка занята полностью, еще 2 содержат по одному электрону). Валентность селена в обычном состоянии равна II.
Однако селен относится к элементам с переменной валентностью, поэтому также может обладать значением валентности IV и VI.
Элементы, имеющие несколько значений валентности
Значение валентности зависит от состояния атома — обычного или возбужденного.
Не все атомы химических элементов могут переходить в возбужденное состояние. По этому признаку они делятся на химические элементы с переменной и постоянной валентностью.
Постоянная валентность наблюдается у щелочных, щелочноземельных металлов, водорода, кислорода, фтора и алюминия.
Все остальные химические элементы обладают переменной валентностью, обусловленными существованием как возбужденных, так и обычных (стационарных) состояний.
Что такое степень окисления
Степень окисления — условная величина электрического заряда атома, входящего в состав химического соединения. Расчет значений этой величины основывается на предположении, что при образовании химической связи происходит полная передача электрона от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью. В результате таких представлений каждому атому можно приписать целочисленный электрический заряд. В неорганической химии степень окисления очень часто совпадает с валентностью.
Степень окисления зачастую не совпадает с реальным значением электрического заряда атома, (совпадение наблюдается только в случае ионных соединений). Она используется лишь для систематизации и классификации химических элементов. Степень окисления широко используется при составлении формул, международных названий элементов, объяснения их окислительно-восстановительных свойств.
СО обозначается арабскими цифрами (валентность римскими).
В чем отличие валентности и степени окисления
Валентность и степень окисления не являются равнозначными понятиями, хоть их числовое значение может совпадать.
Валентность используется для определения числа химических связей атома, причем как полярных, так и неполярных.
Степень окисления используется для выражения значения электрического заряда, сосредоточенного на атоме.
У каких элементов нет возбужденного состояния
Данные понятия стоит изучить для выполнения типовых тестовых заданий №1 и №3, так же это поможет понять тему «Ковалентные связи», которая часто встречается в задании №4 ЕГЭ по химии.
Валентность – это количество связей, которые способен образовать химический элемент за счёт объединения своих неспаренных электронов с неспаренными электронами других элементов.
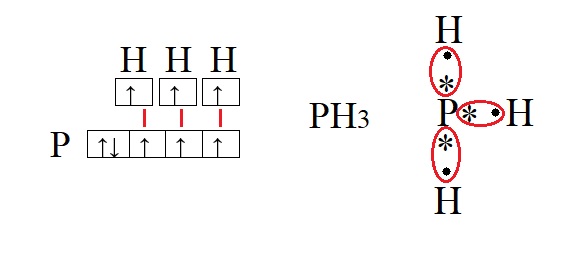
Для наилучшего понимания этой темы необходимо изобразить структуру атомов нескольких элементов, например, фосфора и водорода:
Обе предложенные схемы описывают образование химической связи между фосфором и водородом. Раз фосфору необходимо приобрести пару для целых трёх своих электронов. А водород может «предложить» только один электрон, то к одному атому фосфора может присоединиться три атома водорода. На рисунке справа знаком «*» обозначены неспаренные электроны фосфора, а точками – неспаренные электроны водорода, между которыми и образуется связь (обозначена красным цветом). Связь, при которой происходит объединение электронов в общие пары называется ковалентной, эта связь достаточно прочная и является одной из самых распространённых связей.
Водород содержит один неспаренный электрон, до завершения внешней электронной оболочки ему не хватает всего одного электрона (так как водород имеет только один энергетический уровень, его первый уровень одновременно является и последним, на первом уровне может поместиться только два электрона). Фосфору для полной внешней электронной оболочки не хватает трех электронов, на схеме выше видно, что у него три неспаренных электрона. В таких случаях элементы могут вступать в своеобразных химический «симбиоз»: объединять электроны в общее пользование. При этом неспаренные электроны будут принадлежать одновременно обоим элементам. Данный процесс можно изобразить следующим образом:
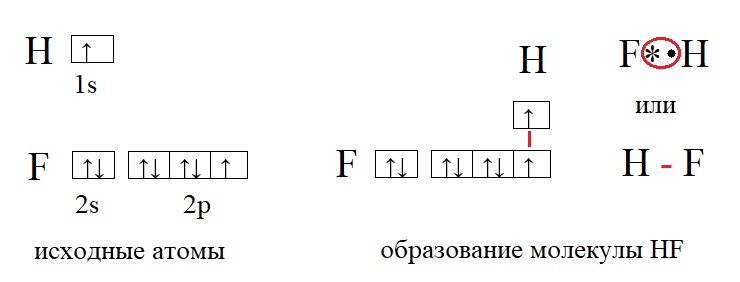
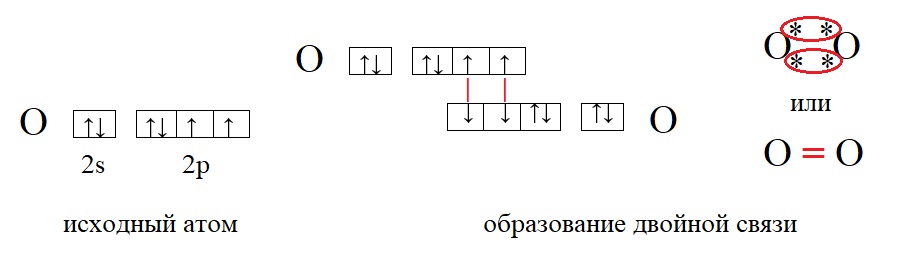
В качестве примеров образования таких связей приведём еще несколько молекул:
У фтора и у водорода по одному неспаренному электрону, поэтому их валентность равна единице. Валентность записывают римскими цифрами, она не имеет заряда, а отражает лишь количество связей, которые способен образовать элемент. Так валентность фтора I, валентность водорода тоже I. Между такими элементами образуется одна связь. Но есть элементы, способные образовывать гораздо большее количество связей, а значит иметь большую валентность, например:
У кислорода в данном примере валентность равна II, это значит, что каждый атом кислорода способен образовать две связи.
Возбуждённое состояние атома.
Углерод – один из самых важных элементов на планете Земля, без него невозможна жизнь. Каждая молекула органического вещества содержит четырехвалентный углерод. В чем же подвох? Дело в том, что в основном своём состоянии углерод содержит лишь два неспаренных электрона и способен проявлять валентность II, а не IV, как в органических молекулах или углекислом газе. Однако существует процесс «распаривания» электронов – перенос одного из электронов пары на другую орбиталь, при это валентность повышается:
Не только углерод, но и многие другие элементы способны переходить в возбужденное состояние. У большинства элементов, точнее у тех элементов, что имеют три и более энергетических уровня (то есть находятся ниже второго периода в ПС) на внешнем уровне есть свободная d-орбиталь, на ней в основном состоянии нет электронов, но она может принимать их при возбуждении:
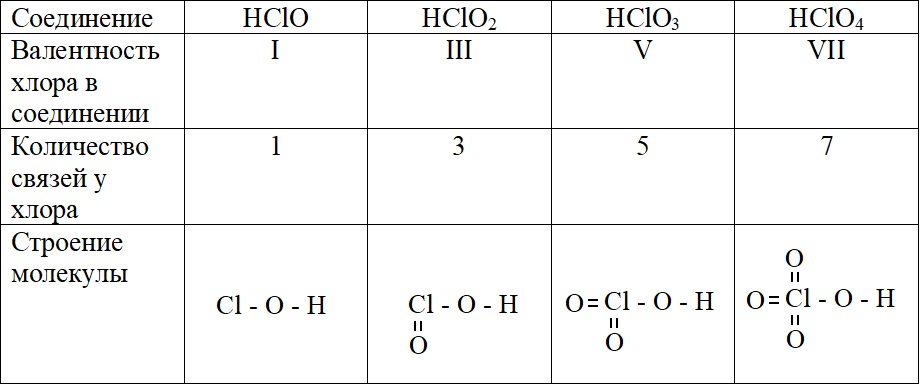
А – основное состояние атома хлора, есть один неспаренный электрон, такая структура соответствует валентности I. Первую валентность хлор имеет в соединениях HCl и HClO.
Б – первое возбужденное состояние хлора, есть три неспаренных электрона, это соответствует валентности III (HClO2).
В – второе возбужденное состояние, пять неспаренных электронов определяют способность проявлять в таком состоянии валентность V (HClO3).
Г – третье валентное состояние, есть семь неспаренных электронов, в таком состоянии хлор может образовывать семь ковалентных связей (HClO4)
Высшая валентность определяется номером группы, в которой стоит элемент, но есть исключения: азот, кислород и фтор. Для этих элементов не характерна высшая валентность, соответствующая номеру группы. Это объясняется тем, что у этих элементов электроны располагаются на двух энергетических уровнях, а свободная d-орбиталь, которая может принять электроны при их распаривании есть у элементов, имеющих три и более энергетических уровня.
Сравним кислород с серой, у которой есть свободная d-орбиталь:
Кислород из-за отсутствия свободной орбитали не способен проявлять валентность выше II, тогда как у серы есть три валентных состояния: основное, соответствует валентности II (H2S); первое возбужденное, соответствует валентности IV (H2SO3 и SO2); второе возбужденное состояние, соответствует валентности VI (H2SO4, SO3).
Решение задания №3 ЕГЭ по химии
Пример 1.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Решение: Электроны могут перераспределяться только внутри одного уровня, общая сумма электронов внешнего уровня, в приведенной в задании формуле, равно пяти, следовательно элемент относится к VА-группе. Это фосфор, азот и мышьяк. Азот не имеет свободную d-орбиталь (см. выше), поэтому выпадает из ответа.
Возбужденные атомы: 2. Быстротечная жизнь возбужденных атомов
Вверху: так в упрощенной картине обычно изображается излучение фотона при переходе атома из возбужденного состояния в основное.
Внизу: энергия излученного фотона равна разнице энергий электрона в возбужденном и основном состоянии. Поскольку возбужденных состояний много, водород может излучать свет на разных, но фиксированных длинах волн. Изображение с сайта hemi.nsu.ru
Самый главный факт про возбужденные состояния атомов таков:
 | возбужденные состояния неустойчивы. |
Раз атом можно возбудить каким-то воздействием, вложив в него дополнительную энергию, то возможен и обратный процесс — атом может сбросить эту энергию (например, излучив фотон) и вернуться в основное состояние. Поэтому всякое возбужденное состояние атома имеет какое-то определенное время жизни; вот про эти времена жизни возбужденных атомов мы и поговорим.
Мы уже договорились, что мы не будем пытаться по-настоящему вычислить длительность того или иного квантового процесса. Даже студенты-физики начинают этим заниматься лишь на третьем курсе университета. Мы лишь возьмем на вооружение главные руководящие правила, которые помогут нам почувствовать характерные временные масштабы явлений.
Для нашего класса явлений — возбужденный атом излучает фотон и возвращается в основное состояние — опорное время составляет наносекунды. Примерно столько времени живут возбужденные состояния атомов, когда излучению фотона не мешают ни квантовые особенности внутри атома, ни внешние условия. В университетском курсе квантовой механики расчет таких процессов начинают с простейшего классического примера — возбужденного состояния атома водорода, в котором электрон находится на p-орбитали (состояние 2P). Такой электрон может легко излучить фотон и спуститься в основное состояние (1S) — никаких особых препятствий для этого нет. Время жизни такого возбужденного состояния как раз составляет τ (2P → 1S) ≈ 1,6 нс.