у каких глистов яйца как кунжутное семя
«Глисты»: как выявить непрошенных гостей
Глистные инвазии в современных условиях многим кажутся чем-то казуистическим, и потому настороженности не вызывают. На деле же, «глисты» по-прежнему занимают видное место в структуре устойчивых дефицитных состояний (особенно часто железа), патологии печени, кожи, бронхолегочной системы. А их выявление требует понимания ряда особенностей.
«Глистные» симптомы
Стоит отметить, что паразитам «не выгодна» гибель хозяина. Поэтому их присутствие, как правило, долгое время не сопровождается какими-либо признаками.
1. На первый план может выходить снижение аппетита и немотивированное похудение.
2. Также характерны рецидивирующие дефицитные состояния, «пищевое» или какое-либо другое происхождение которых уже исключено. А наиболее часто «носители глистов» страдают от железодефицитной анемии.
3. Кроме того, паразиты раздражают иммунную систему, за счет могут провоцировать развитие аллергических (включая бронхиальную астму) и атопических заболеваний.
4. Если черви и личинки «выбрали» для обитания кишечник, среди первых признаков инвазии могут быть диспептические явления, как тошнота, нарушения стула, метеоризм, периодические боли в животе, а также непереносимость некоторых продуктов питания.
5. А, когда «под удар» попадает печень – чаще всего «находка» бывает случайной, в виде «необъяснимого» повышения маркеров печеночного воспаления (АЛТ, АСТ) или изменений на УЗИ.
Поэтому, в первую очередь обследование показано тем, кто уже имеет подобные патологии неясного происхождения, или высокий риск инфицирования (например, трихинеллез при употреблении недожаренного мяса свиней и кабанов или сала с прослойками мяса).
Когда «кал» не информативен
Самым известным исследованием, бесспорно, является «кал на яйца глист». Однако этот анализ имеет ряд объективных недостатков, ввиду которых не способен обеспечивать высокую выявляемость паразитов.
Во-первых, кал может помочь в выявлении только тех гельминтов, которые «остановились» на уровне кишечника. В то время как личинки способны мигрировать в ряд других органов, среди которых печень, мышцы, легкие и даже головной мозг.
Во-вторых, анализ рассчитан на выявление только яиц червей, то есть имеет сильную зависимость от жизненного цикла паразита.
«Угадать» в какой момент времени черви «решат» отложить яйца – задача, очевидно, невыполнимая. Ведь никаких наглядных признаков этого этапа их «жизни» не существует.
Поэтому исследование кала на гельминты рекомендуется сдавать несколько раз (не менее 3-х) с перерывами в несколько дней. И даже в этом случае, «шансы» на выявление паразитов остаются достаточно низкими.
Анализ крови на антитела к гельминтам такими недостатками не обладает, а чувствительность исследования к разным видам червей достигает высоких 75-90%.
При этом антитела IgG появляются в крови спустя 3-4 недели от инфицирования. Анализ можно проводить как прицельно к интересующему виду паразитов, так и комплексно, с учетом наиболее распространенных паразитозов.
Выявление в крови антител к паразитам – обоснованный повод для применения препаратов и углубленного обследования органа-мишени, даже в том случае, если обследуемого ничего не беспокоит.
А, помимо прочего, такой анализ успешно дополняет традиционную диагностику по анализу кала.
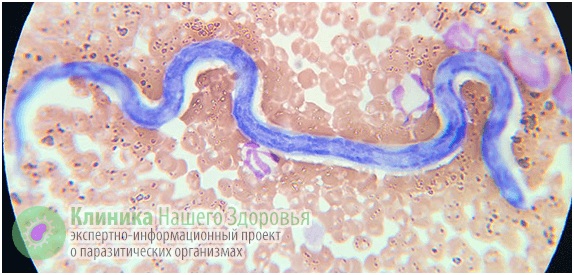
Дирофиляриоз: симптомы, подкожный и внутренний дирофиляриоз у человека, лечение и профилактика
Дирофиляриоз — один из гельминтозов, ранее считавшихся исключительно зооспецифическим и до недавнего времени бытовало мнение, что этому заболеванию подвержены исключительно животные. В первую очередь — собаки. Но в последние годы все чаще стали регистрироваться случаи заражения людей.
Дирофиляриоз: симптомы, подкожный и внутренний дирофиляриоз у человека, лечение и профилактика
Дирофиляриоз — один из гельминтозов, ранее считавшихся исключительно зооспецифическим и до недавнего времени бытовало мнение, что этому заболеванию подвержены исключительно животные. В первую очередь — собаки. Но в последние годы все чаще стали регистрироваться случаи заражения людей.
Дирофиляриоз (Dirofilariasis) — относится к ларвальным гельминтозам. То есть, при этом заболевании паразитирует не взрослая особь нематоды, а ее личинка, не достигшая половой зрелости. Разносчиками заразы являются комары, поэтому наиболее часто этот гельминт встречается в теплом климате: от Австралии, Южной Америки и Африки до Юга России и Средней Азии. На протяжении последних лет наибольшее количество заболевших дирофиляриозом регистрировалось в Иране и Греции. Но в последние годы все чаще регистрируют эту болезнь и в умеренном климате.
Так, на территории Российской Федерации на протяжении нескольких лет выявляют по 35-40 случаев дирофиляриоза ежегодно. Причем география заражения весьма обширна — от теплого Ростова, умеренных климатических зон Тулы и Рязани, до морозной Сибири. На самом же деле уровень заболеваемости может быть значительно выше. Поскольку этот вид гельминтоза долго считался присущим только животным, то медики его не изучали, и на сегодняшний день о нем мало знают и не сразу могут поставить верный диагноз.
Большинству инфицированных дирофилярией пациентов, при обращении за медицинской помощью первоначально ставят диагноз либо фурункулез, либо киста или опухоль. Первое описание заболевания человека дирофиляриозом относится к середине 19-го века, которое сделал врач из Португалии Лузитано Амато после того, как удалил гельминта из глазного яблока у ребенка. В России первым зарегистрированным случаем дирофиляриоза считается описанный земским доктором Владыченским в 1915 году.
Причины возникновения дирофиляриоза
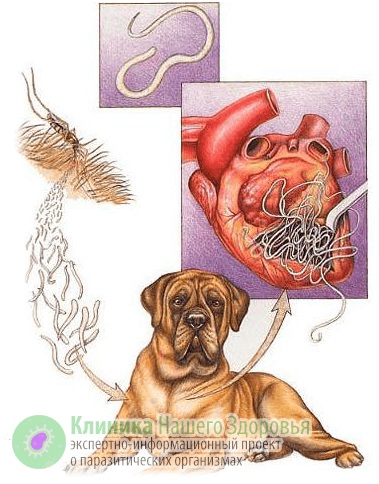
В буквальном смысле с латыни дирофилярия «diro, filium» переводится как «злая нить». Как уже упоминалось ранее, в человеческом организме может жить личиночная стадия глиста — микрофилярия. Наиболее часто люди инфицируются нематодами Dirofilaria repens и Dirofilaria immitis, которые живут в организме домашних любимцев — собак и кошек. Крайне редко дирофилярия может передаться человеку от дикого животного — эти нематоды паразитируют у всех представителей семейств псовых и кошачьих, у приматов, у медведей, у тигров, у выдр. Именно поэтому большая доля заболевших дирофиляриозом приходится на охотников.
Как происходит заражение дирофиляриозом?
Механизм заражения у людей — трансгемный, то есть инфицирование происходит через кровь. Передается болезнь, зачастую, через укусы комаров. Реже, через укусы блох, слепней и других видов кровососущих насекомых. А источником заразы, как это ни прискорбно, выступают наши домашние животные. В первую очередь собаки, изредка кошки. По данным ветслужбы до 30% собак, живущих в городах, страдают от упомянутой инвазии. В сельской местности этот показатель еще выше. В организме животного взрослые дирофилярии паразитируют в сердце, легких, бронхах и крупных кровеносных сосудах. Самки выделяют в кровь тысячи личинок-микрофилярий, которые имеют микроскопический размер — до 0,3 мм в длину. Именно поэтому они с кровотоком и лимфотоком разносятся по всему организму.
Микрофилярии так микроскопичны, что с кровью и лимфой попадают не только во все органы и ткани человека или животного, но даже преодолевают плацетнарный барьер и внутриутробно инфицируют плод. С кровью животного микрофилярия попадает к промежуточному хозяину — комару. Насекомое, в свою очередь, кусает инвазированное животное, личинки попадают в его брюшную полость, но часть из них остается в хоботке комара. Когда насекомое кусает следующую жертву — часть паразитов из хоботка попадает в кровоток следующего хозяина. Так дифиляриоз передается от животного к животному и к человеку.
У людей тотальная восприимчивость к дирофилриозу – то есть, если человека кусает инфицированный комар, то он заразится со 100% вероятностью. Но в наибольшей зоне риска заражения дирофиляриозом находятся некоторые категории людей, среди которых:
Этапы развития дирофиляриий
Когда комар (реже другое кровососущее насекомое) заглатывает личинку нематоды с кровью, та около суток остается у него в кишечнике. Затем микрофилярии мигрируют в обратном направлении — к хоботку комара, где дозревают до инвазивной стадии. В этот период, комар, кусает жертву и заражает ее дирофиляриозом.
У нового хозяина около трех месяцев личинки остаются в месте комариного укуса: в коже или в подкожной клетчатке. Именно тут микрофилярии линяет и уже более жизнеспособными попадают в кровоток и разносятся по организму. Паразитировать микрофилярия может около трех лет.
До половозрелости дирофилярия развивается только в организме животных. Человеческий организм для нее тупиковый вариант, так как большинство личинок все же гибнут в крови людей. Это значит, что человек не может быть источник заражения.
Воздействие дирофилярий на человека
Обычно, у больного дирофиляриозом обнаруживается только один паразит, а развитие этой особи проходит в течение 8-9 месяцев. Зачастую гельминт не покидает места внедрения — живет под кожей, где его оставил комар после укуса.
Главная опасность дирофиляриоза — первичные реакции на месте внедрения микрофилярии. Может возникнуть сильная аллергическая реакция. Кроме того, кожа воспаляется, образуются уплотнения (шишки) довольно большого диаметра. Внутри этих уплотнений находится серозная жидкость и/или гной, внутри этого содержимого и обитает какое-то время дирофилярия. Часто паразит погибает, тогда уплотнение постепенно может само рассосаться. Но чаще все же требуется хирургическое вмешательство.
Виды дирофиляриоза
Инвазионное заболевание вызывает червь-паразит. Личинки нитевидной нематоды, вызывающие болезнь, бывают нескольких разновидностей, и поэтому заражение ими приводит к разным формам заболевания.
Dirofilaria repens и Dirofilaria immitis — основные виды, поражающие собак и реже кошек. Именно эти разновидности гельминта являются самыми распространенными среди заболевших людей, ведь в подавляющем большинстве случаев дирофиляриоз у человека появляется при укусе комара-переносчика, контактировавшего до этого с данными животными.
В России и странах ближнего зарубежья встречается в основном подкожный дифиляриоз. Висцеральный дирофиляриоз распространен в жарких странах Азии, Японии, Индии, США, Африке, Канаде, Вьетнаме, Австралии, на юге Европы.
Симптомы и места распространения дирофиляриоза
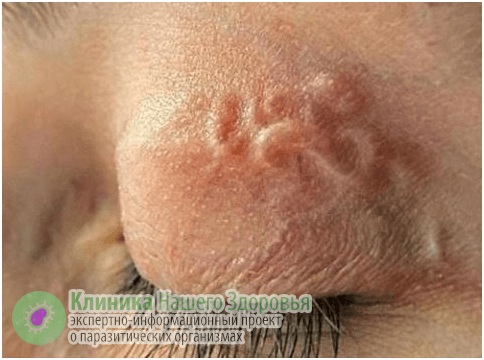
Скрытая форма дирофиляриоза у человека длится от 1 до 12 месяцев. Основным симптомом является появление под кожей или слизистой, болезненного уплотнения, с покраснением и зудом на месте внедрения. При этом гельминт под кожей может перемещаться (со скоростью до 15 мм в сутки), что может быть заметно для человека, как по ощущениям, так и визуально. Часто, заметив на теле уплотнение похожее на опухоль, пациенты обращаются к хирургу, а тот решает, что это липома, опухоль, фиброма, атерома и т.п., а затем уже в ходе операции обнаруживает гельминта.
У дирофилярий есть любимые места на теле человека — это органы зрения, ноги и руки, шея, лицо, грудь, мошонка. Могут появиться такие симптомы, как слабость, пассивность, тошнота, нервозность, бессонница, повышенная температура, боли в голове и в области поражения паразитом. В 50 % случаев обычно поражаются органы зрения. Человек жалуется на ощущение чего-то ползающего в глазу, у него наблюдается покраснение век и глаз, блефароспазм. При перемещении гельминта возникает боль, слезотечение и зуд. Иногда через конъюнктиву виден сам гельминт.
При нахождении дирофилярии в глазу вокруг нее образуется гранулема, что вызывает развитие экзофтальма и диплопии. Поражение глаз приводит к ослаблению зрения. Человек способен увидеть мигрирующего паразита. Наблюдения показали, что его перемещения усиливается под воздействием тепла.
Дифиляриоз обычно носит хронический характер, с рецидивами, характеризующимися периодами вспышек и затихания заболевания. Если вовремя не заняться лечением, вероятны воспаления тканей, и возникновение абсцесса.
Симптомы внутреннего дирофиляриоза
При этой разновидности паразитом поражаются легкие. Личинка живет в левом желудочке сердца и легочных артериях, образуя при этом фиброзную капсулу. Обычно болезнь протекает бессимптомно, реже вызывает боль в груди, кашель и кашель с кровью.
Заболевание часто выявляется случайно, например, при рентгене грудной клетки (видны узелки размером 1-2 см) или при оперировании легких.
Диагностика дирофиляриоза у человека
Диагностика заболевания представляет определенную сложность, так как её симптоматика схожа со многими другими заболеваниями, поэтому врачами часто ставится ложный диагноз и своевременное лечение затягивается. Основными жалобами пациентов являются появление мигрирующих подкожных узлов, ощущения перемещения паразита.
Диагноз дирофиляриоза можно подтвердить, сдав следующие анализы:
Кроме того, перед постановкой диагноза специалист проводит анализ условий проживания больного, времени года, его деятельности. Факторами риска являются наличие домашних и бездомных собак и кошек, комаров, выезд в лес, на рыбалку, на дачу или в сад.
Риск заболевания дирофиляриозом особенно увеличивается в период высокой активности комаров. В связи с чем важны профилактические меры, производимые санитарными службами по ликвидации насекомых на территории водоемов. Известно, что заболевание носит сезонный характер, поэтому основное количество заболевших фиксируется весной и летом. Пики заболеваемости приходятся на периоды июнь-июль и октябрь-ноябрь.
Диагностика дирофиляриоза у животных
Для профилактики заболевания домашним животным необходимо регулярно давать противоглистные препараты. Признаками заболевания паразитами служат различные высыпания, уплотнения, ранки, опухоли на коже.
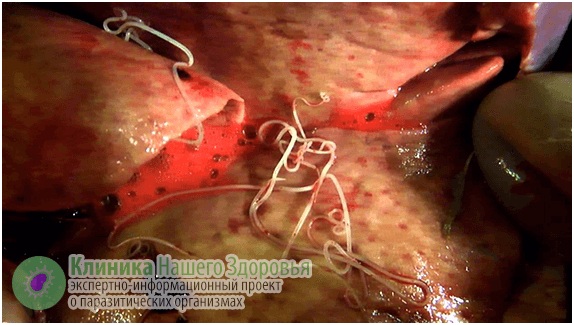
Больше всего при поражении страдает сердечно-сосудистая система животного. Поведение его становится пассивным, теряется аппетит, отмечается температура, кашель. Собака может прихрамывать и страдать от судорог.
Лечение дирофиляриоза
Форма болезни диктует методы лечения. Обычно у человека паразитирует одна неполовозрелая особь. Основной метод избавления от паразита — хирургический. Чтобы исключить перемещение паразита применяют дитразин. Редко применяется терапия медикаментами с использованием ивермектина или диэтилкарбамазина. Дополнительно при лечении используются успокаивающие и антигистаминные лекарства, нестероидные противовоспалительные средства, глюкокортикостероиды.
При глазном дирофиляриозе основным методом лечения будет удаление гельминта с помощью операции и последующие назначение дезинфицирующих и противовоспалительных препаратов для глаз, иногда также прописываются капли дексаметазона для уменьшения воспаления. Обязательно назначаются антигистаминные средства.
Профилактика дирофиляриоза
В России 4-30% (в зависимости от географии их проживания) домашних и уличных собак являются хозяевами-переносчиками микрофилярий. Самый большой процент зараженных животных в Греции и Иране- 25-60%.
Профилактика заболевания включает в себя истребление комаров и ограничение контакта с ними животных и человека, своевременное выявление дирофилярий животных и их лечение, борьба с бродячими животными, противоглистная профилактика у домашних питомцев.
Так как очагами дирофиляриоза являются водоемы около жилых районов, очевидна эффективность мер, применяемых санитарными органами по борьбе с кровососущими насекомыми. К тому же необходима борьба с комарами в подвалах жилых домов, ведь здесь эти паразиты могут с комфортом обитать весь год. Из подвалов жилых домов комары и другие насекомые попадают по вентиляционной системе в квартиры.
В лесу и около водоемов необходимо использовать репелленты и защищать участки тела с помощью одежды. Животным кроме репеллентов могут быть одеты специальные ошейники. По возможности старайтесь отказаться от прогулок в вечернее и ночное время суток.
Человек сам в ответе за собственное здоровье, а также за здоровье своих детей, родных и близких, поэтому отправляясь в отпуск в теплые страны, будьте бдительны! Легче предотвратить болезнь, соблюдая профилактические меры, чем лечить ее последствия!
Анизакидоз. Клинический случай из практики
Анизакидоз — заболевание, вызванное любым членом семейства Anisakidae. Нематоды инфицируют человека чаще всего там, где потребляют сырую, маринованную или плохо приготовленную рыбу или морепродукты. В статье приводится описание клинического случая анизаки
Anisakiasis is a disease caused by any member of the Anisakidae family. Nematodes infect humans most often in eating raw, pickled or undercooked fish or seafood. The article describes the clinical case of anisakiasis in a 11-year-old girl.
О таком заболевании, как анизакидоз, впервые стало известно в 60?е годы прошлого века после описания в Нидерландах желудочно-кишечной инфекции у больных, употреблявших сырую рыбу и маринованные рыбные продукты. В настоящее время анизакидоз — довольно распространенное заболевание, особенно в прибрежных регионах и у лиц, традиционно использующих такие блюда [1–3].
Анизакиз (Anisakis simplex) — паразит рыб, нематод семейства Anisakidae. Аnisakis simplex (А. simplex) и Pseudoterranova decipiens являются основными возбудителями, обнаруживаемыми при инфицировании человека [1–5]. Возбудитель анизакидоза — личиночная стадия А. simplex (селедочный червь), род Pseudoterranova — Pseudoterranova decipiens, род Phocanema (тресковый червь), род Contracaecum, род Hysterothylacium и другие объединены общим названием «анизакиды». Термин «анизакидоз» используют для обозначения заболевания, вызванного любым членом семейства Anisakidae, тогда как термин «анизакиаз» — представителями рода Anisakis и Pseudoterranova [1].
Жизненный цикл А. simplex
Жизненный цикл нематода включает несколько разных хозяев. При этом морские млекопитающие — китообразные (дельфины, морские свиньи и киты) — основные хозяева для А. simplex, тогда как ластоногие (тюлени, моржи, морские львы) являются источником обитания P. decipiens [1–3]. Взрослые черви откладывают яйца в слизистой оболочке желудка хозяина, которые затем через кал попадают в морскую воду. Впоследствии личинки поглощаются мелкими ракообразными (первый промежуточный хозяин), паразиты созревают, их поедают морские рыбы или кальмары (второй промежуточный хозяин), у которых личинки мигрируют во внутренние органы и брюшную полость (степень миграции в мышечную ткань рыб зависит от условий окружающей среды и/или видов паразитов и самих рыб). Личинки передаются от рыбы до рыбы по пищевой цепи, и, как результат, хищные рыбы могут накапливать их в большом количестве. В конечном счете, заглатывание инфицированной рыбы или кальмаров морскими млекопитающими (окончательный хозяин) приводит к развитию четвертой стадии личинки, а затем взрослых паразитов. Потребление человеком сырых или недоваренных рыб является основным путем попадания в слизисто-мышечную оболочку его желудка и кишечника личинок А. simplex, которые затем могут мигрировать в сальник, печень, поджелудочную железу или желчный пузырь. На дальнейшее развитие паразита влияют протеолитические ферменты слизистой оболочки желудка или кишечника. Кроме того, сами личинки секретируют или экскретируют белки, трипсин-подобные сериновые протеазы и другие вещества.
Эпидемиология
Еще одну группу риска представляют работники рыбной промышленности, которые могут инфицироваться нематодами при обработке загрязненных морских продуктов [1]. Случайное воздействие аллергенов рыб или моллюсков (в том числе скрытых) во время обработки представляет определенную опасность для здоровья сенсибилизированных лиц. Как показало исследование, недавно проведенное в Испании, А. simplex был наиболее частым скрытым аллергеном, провоцирующим серьезную аллергическую реакцию у больных [7].
Интересный факт: распространенность сенсибилизации к А. simplex среди населения различных регионов Италии характеризовалась резко выраженным колебанием: от 0,4% до 22% — с преобладанием у жителей прибрежных районов и крупных городов [8]. В Испании таковых было около 10% [9].
Диагностика
Ограниченная распространенность аллергии на анизакиз среди населения в целом подтверждает тот факт, что потребление маринованной и сырой рыбы — основная причина обнаружения сенсибилизации у обследованных лиц [1–5]. Однако остается важный вопрос, является ли высокий титр sIgE к А. simplex у лиц, не имеющих клинические симптомы, результатом перекрестной реактивности между аллергенами анизакиды и беспозвоночных (креветки, паразиты, тараканы, клещи). Действительно, у большинства больных с аллергией на анизакиз (по некоторым данным 64,7–86%) одновременно обнаруживают в крови sIgE к клещам и плесневым грибам [9–11]. Кроме того, общая антигенная структура между этими таксономически далекими источниками (вероятно, это — паналлергены парамиозин и тропомиозин) может стать также причиной ложноположительных результатов кожных проб и лабораторных исследований [3]. Не исключается и влияние ряда технических факторов на кросс-реактивность (используют ли нативный экстракт или метод иммуноблоттинга; имеет значение, когда определяют уровень sIgE на А. simplex, например, через 1 год после приема зараженной рыбы при асимптомном течении заболевания и т. п.) [1–3].
По данным норвежских исследователей, около 16–22% донорской крови содержало детектируемый уровень sIgE на анизакиз [12]. Хотя у некоторых больных с острой и хронической крапивницей обнаруживают sIgE к А. simplex, такую аллергию часто гипердиагностируют, особенно при хронической крапивнице [13]. Сенсибилизацию к анизакидам (по данным кожных проб и определения sIgE в сыворотке крови) иногда обнаруживают у лиц, которые никогда не ели сырую рыбу или анчоус, что подтверждает существование термостабильных молекул аллергенов, в том числе кросс-реактивных [1–5].
В каждой из вышеуказанных ситуаций врач рассматривает прежде всего «золотое правило» аллергологии: выявление только сенсибилизации еще не подтверждает причину заболевания — более того, часто сенсибилизация вовсе не связана с клинически проявляющейся аллергией [14].
Исследователи рассматривают следующие возможные причины сенсибилизации к анизакидам: 1) наличие самой инфекции после заражения; 2) контакт с термостойкими аллергенами при приготовлении или консервировании рыбных продуктов; 3) частый контакт с паразитом (особенно у работников рыбной промышленности); 4) паналлергены (например, тропомиозин) могут быть ответственны за перекрестную реактивность с другими нематодами или членистоногими; 5) кросс-реактивность из-за гликанов гликопротеидов других нематод (это может привести также к ложноположительным результатам аллергологического обследования) [1–6, 9]. У некоторых здоровых людей выявляют высокие уровни sIgG1?антител из-за кросс-реактивности с биотинилированными ферментами, широко распространенными у гельминтов, животных, бактерий и растений [15].
Разработаны лабораторные тест-системы по определению уровней антител IgM, IgA, IgE и IgG для диагностики в течение первого и последующих месяцев инфицирования человека. Хотя клинические симптомы анизакидоза появляются в основном в течение нескольких часов после заражения (максимально — в течение нескольких дней), гуморальный ответ достигает своего пика через 4–6 недель, когда в сыворотке человека обнаруживаются sIgE [1–3]. По данным M. Caballero и др., уровень sIgE к А. simplex класса 1 и 2 (ImmunoCap) с высокой вероятностью коррелирует с бессимптомной сенсибилизацией (66,7%), тогда как класса ≥ 4 — с высокой вероятностью указывает на аллергию на анизакиз (95,2%) [9].
На сегодня рекомбинантный rAni s 1, экспрессируемый на Escherichia coli, считается единственным аллергеном в диагностике анизакидоза, обладающим 100% чувствительностью и специфичностью в in vivo и in vitro тестах [1–4]. В то же время уровень sIgE к rAni s 1 в 90% случаев был отрицательным у больных с низким уровнем sIgE на Anisakis (≤ 0,6 кЕ/л) [3].
Определение отдельных молекул аллергенов имеет большое значение в разграничении и диагностике заболевания. Идентифицировано 9 аллергенов А. simplex, из которых Ani s 1 и Ani s 7 признаны лучшими маркерами и «золотым стандартом» для диагностики анизакидоза [2–4]. Специфичность обоих аллергенов очень высока (100%), а чувствительность составляет 61,1% и 93,9% для Аni s 1 и Ani s 7 соответственно [1]. У 86% пациентов с аллергией на анизакиды были обнаружены sIgE к Ani s 1 [1, 15]. С другой стороны, этот параметр имеет ограниченную диагностическую ценность у больных с гастроинтестинальным анизакидозом, однако в острых случаях крапивницы он проявляет 100% чувствительность [1]. Белки мышечной ткани Ani s 2 (парамиозин) и Ani s 3 (тропомиозин) также являются основными аллергенами А. simplex, которых характеризует широкая перекрестная реактивность с другими тропомиозинами нематод и беспозвоночных. Как известно, тропомиозин способен выдержать тепловую обработку всеми кулинарными методами приготовления пищи. Лица с sIgE к Ani s 3 распознают тропомиозин креветок, клещей домашней пыли, тараканов и улиток.
Еще один метод — тест трансформации базофилов с экстрактом А. simplex — продемонстрировал 100% специфичность [6].
Интересный факт: у некоторых обследованных больных результаты прик-тестов оставались положительными в течение более чем 10 лет [1].
В асцитической жидкости, полученной путем пункции, иногда находят преобладание эозинофилов [1]. Хотя эозинофилия периферической крови характерна для гельминтозов, при анизакидозе она встречается лишь в 30% случаев заболевания [1–3, 9]. Эозинофилия в сочетании с лейкоцитозом чаще присуща желудочной форме анизакидоза, чем кишечной (особенно если паразит остается в желудке) [9].
Современный подход к диагностике аллергии на А. simplex включает следующие основные критерии: анамнестически — наличие у пациента аллергических или других неблагоприятных реакций после употребления рыбных продуктов или контакта с морепродуктами; отрицательные результаты кожных проб на коммерческие экстракты рыб, но положительные — на аллергены анизакиз по прик-тесту и/или повышенный уровень sIgE к А. simplex [1–5]. Разумеется, обнаружение паразитов при эндоскопии желудочно-кишечного тракта — самый точный метод диагностики заболевания. Их находят, по крайней мере, в течение 6 дней после употребления морепродуктов. Личинки А. simplex белые или молочного цвета, 19–36 мм в длину и 0,3–0,6 мм в ширину, с тупым хвостом, длинным желудком и Y-образными боковыми шнурами. Напротив, личинки P. decipiens желто-коричневого цвета, они длиннее (25–50 мм) и шире (0,3–1,2 мм) [2]. Помимо видимых паразитов, эндоскопически в местах внедрения гельминтов обнаруживают отек слизистой оболочки с множественными точечными эрозиями, эритему, иногда сильный выраженный эрозивный гастрит, опухолевидное образование или изъязвления [1, 16]. Оболочка и подслизистый слой могут быть инфильтрированы эозинофилами и лимфоцитами. Иногда формируется флегмона, а при хронической инфекции — абсцесс и/или гранулема. Рентгенографические данные зависят от очага инфекции: нитеобразные дефекты наполнения и отек слизистой выявляют при исследовании барием в случае желудочной инфекции. Кишечные инфекции могут сопровождаться утолщением стенки, отеком слизистой и сужением просвета кишечника [1, 16]. Компьютерной томографией выявляют лимфаденопатию, очаговые образования и/или асцит [16]. При копроскопии личинки или яйца анизакид не обнаруживаются.
Клиника
Употребление в пищу контаминированных морских продуктов может обусловить у больных четыре основных клинических проявления анизакидоза: желудочное, кишечное, внематочное и аллергическое [1–4].
Желудочный анизакидоз характеризуется острым началом (как правило, в течение 1/2–24 ч после приема в пищу рыбы) в виде сильной боли в эпигастрии, тошноты, рвоты, субфебрильной температуры; иногда у пациента появляется сыпь, реже — кровавая рвота и кровохарканье [1, 17].
Острые симптомы проходят в течение нескольких дней, однако у некоторых инфицированных лиц сохраняются жалобы на постоянные неопределенные боли в животе, тошноту и рвоту в течение недель и месяцев после заражения нематодом [2]. Если у пациента нелеченная язвенная болезнь, она может обостриться.
Кишечный aнизакидоз характеризуется перемежающейся или постоянной болью в животе, которая начинается через 5–7 дней после приема зараженного личинками продукта. У инфицированных больных появляется нерегулярный стул, иногда — перитонеальные симптомы и асцит [1, 5]. В последующем развивается воспалительная реакция главным образом в подвздошной и толстой кишках (реже в тощей кишке). Редкие осложнения включают кишечную непроходимость, стеноз подвздошной кишки, перфорацию кишечника и пневмоперитонеум [16].
Внематочный, или внутрибрюшинный, aнизакидоз — менее распространенное осложнение, которое развивается в результате миграции паразита из желудка или кишечника в брюшную полость (реже — в плевральную), брыжейку, печень, поджелудочную железу, яичники и подкожную клетчатку (после перфорации) [1].
Аллергическая форма анизакидоза является частой причиной пищевой аллергии в местах, где традицией считается потребление сырых или иных рыбных продуктов или имеющих профессиональный контакт (работники рыбной промышленности). Чаще всего аллергию вызывает А. simplex, особенно при употреблении анчоусов [1–5]. Как правило, через 0,5–24 ч после приема в пищу зараженного рыбного продукта у пациента появляются генерализованная крапивница и/или изолированный отек Квинке, анафилаксия, которые иногда сопровождаются гастроинтестинальными симптомами. Описан случай анафилаксии у 61-летней женщины после потребления сырой скумбрии [18]. Серологически у пациента был выявлен повышенный уровень sIgE к А. simplex, тогда как на скумбрию результаты были отрицательными.
У некоторых пациентов IgE-опосредованная пищевая аллергия на анизакиз может проявиться в виде общих аллергических симптомов (зуд, жжение, покалывание, отек в полости рта), которые развиваются в течение первых 2 ч после потребления продукта.
Заражение P. decipiens характерно только для желудочной формы. Иногда такие инфицированные пациенты жалуются на «покалывание в горле». Бессимптомные инфекции, вызванные видом Pseudoterranova, сначала могут проявиться даже в виде кашля или рвотой живым или мертвым паразитом (часто в течение ≤ 48 ч после употребления зараженной рыбы).
Дифференциальный диагноз
Подробный эпидемиологический анамнез (указание факта употребления в пищу морской рыбы (сельдь, треска и другие) и морепродуктов (кальмары, ракообразные), термически недостаточно обработанных или в сыром и полусыром виде; пребывание на географически эндемичной территории по анизакидозу и потребление там морепродуктов) в сочетании с гастроинтестинальными и аллергическими проявлениями — ключевой момент при проведении дифференциальной диагностики анизакидоза у пациентов с подозрением на аллергию на рыбу [1, 17]. Еще одна клиническая ситуация — это пациенты с идиопатической анафилаксией: для исключения возможных причин анафилаксии их также следует обследовать на уровень sIgE к А. simplex [17]. За рубежом в обязательном порядке рассматривают эту паразитарную инвазию у каждого пациента, поступившего в отделение неотложной помощи по поводу острого живота [1]. Желудочный aнизакидоз иногда ошибочно диагностируют как язвенную болезнь, гастрит или опухоль желудка. Описаны редкие случаи аллергических реакций, вызванных загрязнением пищевых продуктов нематодом А. simplex [19]. Так, у пациентки с аллергическими симптомами, которые появились после употребления салата из курицы и рыбы (ранее хорошо переносимых), после отрицательных результатов аллергологического обследования (кожные пробы и определение sIgE на курицу и рыбу) обнаружен высокий уровень sIgE к А. simplex (паразитом был инфицирован корм для птиц) [19].
Правильная диагностика кишечной формы aнизакидоза может быть затруднена из-за длительного промежутка времени, прошедшего между потреблением рыбных продуктов и появлением симптомов заболевания. Кишечный анизакидоз дифференцируют с аппендицитом, дивертикулитом, эозинофильным гастроэнтеритом (при системных васкулитах и гиперэозинофильном синдроме), холециститом, опухолью толстой кишки и воспалительными заболеваниями кишечника. Внекишечные инфекции схожи с острым перитонитом, туберкулезным перитонитом и раком поджелудочной железы.
Лечение
Эндоскопическое удаление паразита является радикальным методом лечения желудочного aнизакидоза. Замедление удаления может привести к проникновению личинки в подслизистый слой, поэтому эндоскопию необходимо проводить в течение 12 ч после потребления зараженной рыбы. Хирургическое удаление паразита иногда требуется также при кишечной или внекишечной инфекциях, особенно когда они осложняются кишечной непроходимостью, аппендицитом или перитонитом. Если диагноз «кишечный анизакидоз» может быть установлен без проведения инвазивных процедур, пациенту назначают консервативную терапию. Ограниченные данные свидетельствуют, что у взрослых альбендазол (400–800 мг ежедневно в течение 6–21 дня) является наиболее эффективным методом лечения анизакидоза [1, 5].
Профилактика
Учитывая популярность суши и растущую доступность специфических сырых/копченых рыбных блюд (например, севиче и гравлакс), заболеваемость aнизакидозом существенно увеличилась за последнее десятилетие во всем мире.
Лучшая профилактика aнизакидоза — просвещение общественности об опасности употребления в пищу морепродуктов слабосоленой обработки, а иногда в сыром и полусыром виде [1–5]. Риск инфицирования человека может быть уменьшен путем визуального осмотра рыбы и уничтожения пораженных рыб [1]. Если рыбу употребляют в пищу в сыром виде, в США обязательной ее является глубокая заморозка при –20 °C в течение 7 дней (в ЕС — до 4 дней) или при –35 °C на ≥ 15 ч [1]. Длительная засолка при высокой концентрации соли также поможет предотвратить заражение паразитом. Хотя эти профилактические меры могут свести к минимуму аллергию на анизакиз, определенные аллергены нематода очень устойчивы к денатурации под воздействием тепла или холода. По литературным данным, стандартные меры предосторожности не могут обеспечить защиту от аллергических реакций примерно у 20% сенсибилизированных лиц [1, 17].
Приводим описание клинического случая. Девочка, 11 лет, обратилась к аллергологу-иммунологу с жалобами на боль в животе, тошноту, урчание в животе, метеоризм. Болеет с лета, после приезда из Испании, где девочка проживала в течение 6 месяцев. Со слов мамы, там девочка часто потребляла несколько блюд из сырой или маринованной в уксусе рыбы, в том числе анчоусы. В общем анализе крови отмечалась гиперэозинофилия до 32–28%. Наследственность по атопии не отягощена. Пищевую и лекарственную аллергию отрицают. При проведении ультразвукового исследования брюшной полости выявлены незначительная гепатомегалия, перегиб в желчном пузыре. В биохимическом анализе крови — без отклонений от нормы. По данным гастроскопии — эндоскопические признаки локального гастродуоденита. Гастроинтестинальные симптомы после лечения, назначенного гастроэнтерологом, улучшились, однако в общем анализе крови у пациентки сохранялась гиперэозинофилия. Осмотр аллерголога-иммунолога не выявил физическую крапивницу. По данным серологических исследований были исключены паразитарные заболевания, в том числе стронгилоидоз, а также другие причины вторичной (реактивной) гиперэозинофилии. При копроскопии личинки или яйца гельминтов не обнаружены. Учитывая эпидемиологический анамнез — пребывание на географически эндемичной территории по анизакидозу и потребление там полусырых морепродуктов, было сделано предположение о том, что основным фактором риска заражения ребенка стали анизакиды. Серологический анализ выявил повышенный уровень IgG-антител к А. simplex (1,8 у.е.). Определение уровня специфических IgE и рекомбинантных антител к A. simplex не проводили. Назначенное лечение мебендазолом в течение 10 дней привело к нормализации уровня эозинофилов в крови. Наблюдение в динамике: жалоб нет, уровень эозинофилов в крови — 4%.
Литература
* ФГБОУ ВПО РУДН, Москва
** «Медионика», Москва
*** «Фидес-Лаб», Москва