у какого минерала химическая формула caco3
Кальцит — ракушки, кораллы, сталактиты…
Вы встретите его в музеях, любуясь мраморными скульптурами; в карстовых пещерах в виде сталактитов и сталагмитов; на речном или морском берегу — и это будет самая обычная ракушка. Кальцит входит в состав жемчуга и кораллов, и нашенского, ульяновского симбирцита.
Формула:
CaCO3
Твердость по Моосу:
Плотность(г/см³):
| Категория: Карбонатные минералы | Цвет: Бесцветный, белый, розовый, жёлтый, коричневый |
| Примесь: Mg, Fe, Mn, Zn, Co, Sr, Ba, … | Цвет черты: Белый |
| Сингония: Тригональная | Блеск: Стеклянный |
| Спайность: Совершенная | Прозрачность: Прозрачный |
| Расщепление: Идеально подходит для <10 1>трех направлений с углом 74 ° 55 ‘ [1] | Излом: Раковистый |
| Двулучепреломление: δ = 0,154–0,174 | Показатель преломления: nω = 1,640—1,660, nε = 1,486 |
От раковин до шедевров мирового искусства
Из кальцита состоит известняк. А он, в свою очередь, образовался из раковин морских животных.
Кораллы на 85% состоят из кальцита.
Метаморфизм превращает известняк в мрамор.
Каррарский мрамор был главным материалом для работ художников Возрождения. Микеланджело, который чувствовал мрамор, как никто, создал свои знаменитые скульптуры «Давид», «Моисей», «Пьета». Эти шедевры всегда будут точкой недосягаемой высоты мастерства и таланта.
Прелестные тосканские виллы, солидные особняки в Ломбардии не были бы так хороши без облицовки мрамором. Коттеджи и виллы Лазурного берега немыслимы без мраморной отделки.
Сейчас мраморные изделия в интерьере — символ богатых преуспевающих людей.
А ведь все это — обычный кальцит. 🙄
Мраморные вуали
Со времен Возрождения все великие скульпторы были родом из Италии. Почему так — не знает никто, однако и спорить с этим бесполезно.
А Монти решил поиграть в войну и поучаствовал в первой попытке объединения Италии.
Одновременно (все-таки он скульптор) Монти создает «Сон скорби и радость мечты», «Сестры милосердия».
Рафаэль Монти был последним скульптором, владеющим тайнами мраморной вуали…
Кроме Монти мраморными вуалями покрывали свои работы Джованни Страцца, Джованни Бенцони, Антонио Коррадини, Джузеппе Санмартино.
Объяснение официальных искусствоведов о технологии изготовления мраморных вуалей не выдерживает никакой критики, я даже не стану его приводить. Захотите — найдете в сети.
Происхождение названия
Его могут называть:
Происхождение
Разновидности
При всем желании перечислить их не смогу. Вроде бы, их насчитывается более 700.
Различаются они по цвету, по форме выделения.
Зависимые от примесей:
Множество разновидностей кальцита я не назвала, просто в статье нет для этого места…
Месторождения
На Урале открыто более 20 месторождений мрамора, в Западной Сибири и на Алтае более полусотни. Серые, черные, зеленые, розовые, бежевые, оранжевые…. На любой вкус. Только добывай и продавай. 😀
Ищите кальциты в областях:
Есть множество стран, где можно добывать кальцит: Англия, Германия, Румыния и Мексики, США…
Свойства
Карбонат кальция. Соль угольной кислоты и кальция. Calcite.
Фотография кальцита с характерным оптическим поведением при двулучепреломлении.
Физико-химические
Разные виды кальцита содержат разные примеси:
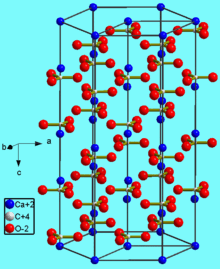
Кристаллическая структура кальцита
Этот список можно продолжить.
Демонстрация двойного лучепреломления в кальците с помощью лазера 445 нм.
Лечебник литотерапевта
Применяют народные лекари кальцит при болезнях:
Магия кальцита
Сферы применения
Кому подходит
Знаки Зодиака
Хорошо подходит Тельцам III декады.
В принципе, не приносит вреда никакому знаку Зодиака. Разве что черным магам, причем конкретно тем, кто родился под знаком Скорпиона.
В черной магии камень не используют, разве что опосредованно (ясновидение, поиск на расстоянии и прочие загадочные вещи).
Стихия
Энергия
В основном — энергия Инь.
Оранжевые и желтые разновидности обладают энергией Ян.
Пестрая смесь
Встретили на упаковке товара Е-170? Это наш кальцит. Зарегистрирован как пищевой краситель…
Камень очень привязчив к владельцу. Это «собака» в мире минералов. Потерянный или выброшенный камень долго отказывается служить новому владельцу. И по наследству его нужно передавать особым способом.
Самое большое природное образование из кальцита — Большой Барьерный риф. Его видно из космоса. А состоит он из крошечных организмов — кораллов.
Вопросы/ответы
Ясно, что всего про кальцит рассказать невозможно. Появились конкретные вопросы — задавайте, мы на связи.
Почему не у нас?
Я про фестиваль камня Петоски, который проводится на берегах озера Мичиган.
Сами камни — галька или булыжники, в которые превратились вымершие кораллы.
Необработанный камень напоминает булыжник. Но если его отполировать или хотя бы намочить — на нем проступает шестиугольные узоры. Камень является официальным символом штата Мичиган.
Оборотливые американцы устраивают ежегодный фестиваль камней.
Что входит в программу:
Ну, если кому-то будет мало этой демонстрации, посмотрите фильм «К-9. Собачья работа» с великолепным псом (между прочим, настоящим полицейским) и его напарником, которого играет Джеймс Белуши.
Ну, вот чего я рекламирую их фестиваль? А потому, что у нас в России полно мест, где можно было бы устраивать фестивали не хуже. Тот же симбирцит (наш кальцит!) свободно находят в Ульяновской области. А где наш фестиваль симбирцита?! 😉
Наследство юрского периода
Первое упоминание о минерале мы встречаем в 1765 году, в рапорте подполковника А. Свечина:
«…близ Симбирска на берегу Волги находятся немалой величины чёрные камни, имеющие жёлтые проросли, или жилы, которые столь прозрачны и чисты, что по шлифовке малую разницу от янтаря имеют, но… это по незнанию жителей пропадает втуне».
Это наша гордость, наш «янтарь» — симбирцит. Хотя от янтаря там только солнечный, сочный медовый цвет. А состоит он в основном из кальцита.
Образовался минерал, когда на русской равнине плескались теплые, мелководные моря, где жизнь била ключом. Плезиозавры и ихтиозавры царили в этом мире, зато аммонитов всевозможных размеров было множество. Их раковины, где пустоты заполнены кальцитом (симбирцитом), пиритом, перламутром, арагонитом, до сих пор находят в окрестностях Ульяновска. Эта симбирцитовая полоса тянется до Татарстана.
Название камню дал В.М. Ефимов — палеонтолог, археолог, геолог. И получил минерал название в 1985 года. Так что, несмотря на преклонный возраст самого минерала, в мире минералогии он сущий младенец. Название дано в честь прошлого названия Ульяновска — Симбирск.
Что в нем необычного? Встречается он там, где мы сказали. Недавно небольшие залежи были найдены в Аргентине. И больше нигде.
Это уже интересно. 🙂 Но, наверное, не всем. Потому, что запасы камня до сих пор точно не определены. Но есть сведения, что мелкие предприятия добывают симбирцит для камнерезных работ. Делают из минерала сувениры, женские украшения, аксессуары для мужчин. Дизайнеры с удовольствием используют симбирцит в отделке внутренних помещений. Камень нежный и «уличной жизни» не выносит.
Минерал имеет две разновидности:
Карбонат кальция, характеристика, свойства и получение, химические реакции
Карбонат кальция, характеристика, свойства и получение, химические реакции.
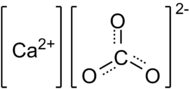
Карбонат кальция – неорганическое вещество, имеет химическую формулу СаСО3.
Краткая характеристика карбоната кальция:
Карбонат кальция – неорганическое вещество белого цвета.
Химическая формула карбоната кальция СаСО3.
Карбонат кальция при прокаливании разлагается. Однако при избыточном давлении углекислого газа (СО2) плавится без разложения.
Встречается в виде трех кристаллических модификаций:
– кальцита (известняк, мел, мрамор);
– фатерита или ватерита.
Кальцит и арагонит являются устойчивыми кристаллическими модификациями. Фатерит является наименее стабильной разновидностью карбоната кальция, и очень быстро превращается в воде либо в кальцит, либо в арагонит. Фатерит в природе встречается относительно редко.
Зарегистрирован как белый пищевой краситель E170.
Физические свойства карбоната кальция:
| Наименование параметра: | Значение: |
| Химическая формула | СаСО3 |
| Синонимы и названия иностранном языке | calcium carbonate (англ.) |
углекислый кальций (рус.)
Получение карбоната кальция:
Промышленный способ получения карбоната кальция заключается в разработке его месторождений в природе.
В лаборатории карбонат кальция получают гашением негашеной извести и последующим продуванием углекислого газа.
Так как гидроксид кальция растворяется в воде в небольшом количестве, то после отфильтровывания известкового молока получается прозрачный раствор – известковая вода, которая мутнеет при пропускании через неё диоксида углерода (углекислого газа). В результате образуется карбонат кальция, который выпадает в осадок.
Химические свойства карбоната кальция. Химические реакции карбоната кальция:
Карбонат кальция – это средняя соль, образованная сильным основанием (гидроксид кальция Ca(OH)2) и слабой кислотой (угольная кислота H2CO3).
Водные растворы CaCO3 имеют слабую щелочную реакцию.
1. реакция термического разложения карбоната кальция – обжиг известняка:
В результате реакции образуются оксида кальция и оксид углерода (IV). Обжиг известняка – это промышленный способ получения углекислого газа. Технологически этот процесс в промышленности реализуют в специальных шахтных печах.
2. реакция карбоната кальция и углерода (графита, кокса):
CaCO3 + C → CaO + 2CO (t = 800-850 °C).
В результате реакции образуются оксид кальция и оксида углерода (II).
3. реакция карбоната кальция и фтороводорода:
4. реакция взаимодействия карбоната кальция и сероводорода:
В результате реакции образуются сульфид кальция, вода и оксид углерода (IV).
Аналогичные реакции протекают и с другими галогеноводородами.
5. реакция взаимодействия карбоната кальция и азотной кислоты:
6. реакция взаимодействия карбоната кальция и угольной кислоты:
В результате реакции образуется гидрокарбонат кальция.
7. реакция взаимодействия карбоната кальция и бромной кислоты:
В результате реакции образуются бромат кальция, вода и оксид углерода (IV).
Аналогично проходят реакции карбоната кальция и с другими кислотами.
8. реакция взаимодействия карбоната кальция, оксида углерода (IV) и воды:
В результате реакции образуется гидрокарбонат кальция. Реакция протекает при комнатной температуре.
9. реакция взаимодействия карбоната кальция и оксида кремния:
В результате реакции образуются метасиликат кальция и оксида углерода (IV).
10. реакция взаимодействия карбоната кальция и оксида титана:
В результате реакции образуются титанат кальция и оксида углерода (IV). Реакция протекает при сплавлении реакционной смеси.
11. реакция взаимодействия карбоната кальция, оксида серы и кислорода:
В результате реакции образуются сульфат кальция и оксида углерода (IV). Данная реакция представляет собой метод очистки смеси газов от SO2.
12. реакция взаимодействия карбоната кальция, оксида свинца и кислорода:
13. реакция взаимодействия карбоната кальция и гидроксида натрия:
В результате реакции образуются карбонат натрия и гидроксид кальция. При этом гидроксид натрия в качестве исходного вещества используется в виде водного раствора.
14. реакция взаимодействия карбоната кальция и хлорида аммония:
В результате реакции образуются хлорид кальция, аммиак, вода и оксид углерода (IV). Реакция протекает при кипении.
15. реакция взаимодействия карбоната кальция и сульфида калия:
В результате реакции образуются карбонат калия и сульфид кальция.
16. реакция взаимодействия карбоната кальция и сульфида натрия:
В результате реакции образуются карбонат натрия и сульфид кальция.
Применение и использование карбоната кальция:
Карбонат кальция используется во множестве отраслей промышленности и для бытовых нужд:
– для письма на досках;
– в быту для побелки потолков, покраски стволов деревьев;
– в целлюлозно-бумажной промышленности – в производстве бумаги в качестве отбеливателя, наполнителя, а также раскислителя;
– в качестве пищевой добавки в пищевой промышленности;
– при производстве предметов гигиены (например, зубной пасты) и лекарственных средств;
– при производстве силикатного стекла ;
– в качестве наполнителя при производстве шпаклёвок и герметиков,
Карбонат кальция
| Карбонат кальция | |
 | |
  | |
| Общие | |
|---|---|
| Систематическое наименование | карбонат кальция |
| Традиционные названия | углекислый кальций |
| Химическая формула | CaCO3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдые белые кристаллы |
| Молярная масса | 100.0869 г/моль |
| Плотность | (кальцит) 2.74 г/см³ (арагонит) 2.83 г/см³ |
| Термические свойства | |
| Температура плавления | (кальцит) 825 °C, (арагонит) 1339 °C |
| Температура разложения | 900−1000 °C |
| Химические свойства | |
| pKa | 9.0 |
| Растворимость в воде | (25 °C) 0.00015 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,60 |
| Структура | |
| Кристаллическая структура | тригональная, пространств. гр. 3 2/m |
| Безопасность | |
| Токсичность | |











 . В природе встречается в виде минералов — кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора. Нерастворим в воде и этаноле.
. В природе встречается в виде минералов — кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора. Нерастворим в воде и этаноле.