укажите на какой стадии митоза лучше всего определить кариотип человека
Укажите на какой стадии митоза лучше всего определить кариотип человека
Цитогенетическое исследование – кариотипирование – является основным методом диагностики хромосомных нарушений и проводится в целях выявления нарушений количества и структуры хромосом. Используется для пренатальной диагностики.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Кариотипирование – цитогенетическое исследование, изучение хромосомного набора человека, позволяющее обнаружить отклонения в структуре и числе хромосом. Оно помогает выявить нарушения хромосом, вероятно, не влияющие на здоровье человека, но тем не менее важные для планирования будущей беременности и для здоровья будущего ребенка (патологии плода, аномалии развития).
Кариотип – это полный хромосомный набор клетки человека. В норме он состоит из 46 хромосом, из них 44 аутосомы (22 пары), имеющих одинаковое строение и в мужском, и в женском организме, и одна пара половых хромосом (XY у мужчин и XX у женщин). Каждая хромосома несет гены, ответственные за наследственность. Кариотип 46, ХХ – соответствует нормальному женскому кариотипу, а кариотип 46, XY – это нормальный мужской кариотип. Кариотип остается неизменным в течение всей жизни.
Нарушения хромосомного набора могут являться причиной наследственной патологии, бесплодия, невынашивания беременности, рождения ребенка с различными пороками развития.
Для цитогенетического исследования хромосом чаще всего используют препараты кратковременной культуры крови, реже клетки костного мозга и культуры фибробластов.
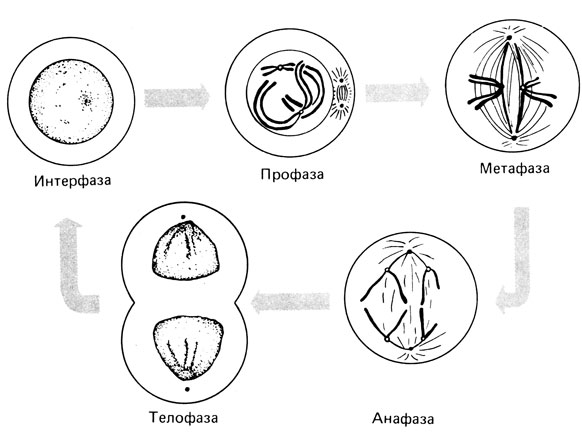
Кариотипирование культуры лимфоцитов периферической крови человека – сложное многоступенчатое цитогенетическое исследование, проводится, когда клетки входят в фазу митоза – непрямого деления с тождественным распределением генетического материала между дочерними клетками. Оно включает в себя следующие этапы:
Различают несколько видов нарушений структуры хромосом:
Хромосомные нарушенияразличаются также по принципу регулярности. Регулярные мутации присутствуют при делении каждой клетки или большинства клеток. Они проявляются в момент зачатия плода либо в первые несколько дней беременности. Нерегулярные аберрации появляются в результате негативного воздействия радиации, химических средств и т.д.
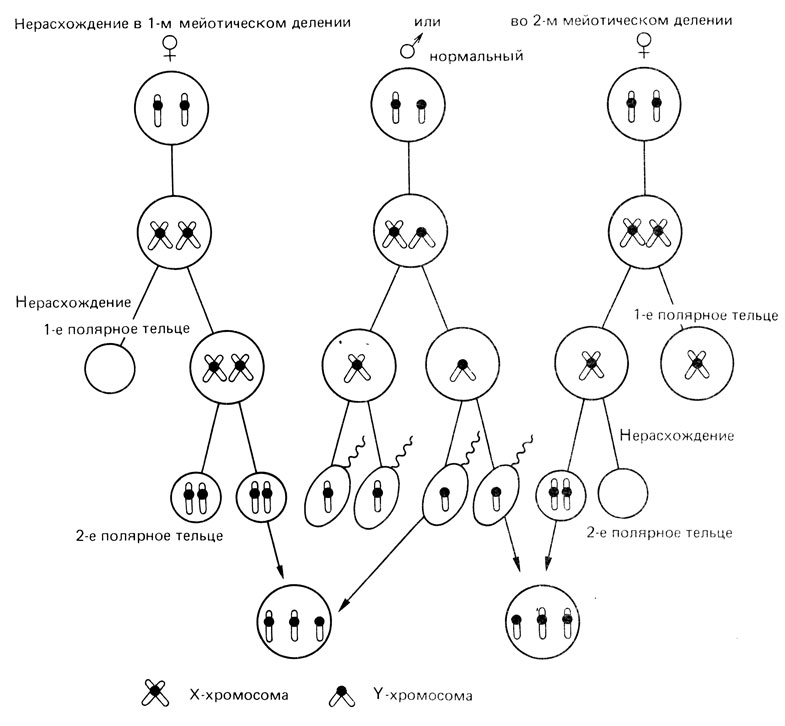
Нарушение расхождения хромосом может произойти во время клеточного деления (мейоза). Если такое нарушение происходит в процессе образования сперматозоидов или яйцеклеток, то в половой клетке появляется лишняя хромосома, которая при зачатии будет передана ребенку. В результате она будет присутствовать во всех клетках организма ребенка. Примером трисомии может служить синдром Дауна (лишняя 21-я хромосома) или синдром Патау (трисомия 13-й хромосомы). Также нарушение расхождения хромосом может произойти при первых делениях оплодотворенной яйцеклетки. Например, утрата Х-хромосомы приводит к развитию Х0-синдрома, или синдрома Шерешевского – Тернера. Аномалии, связанные с нарушением расхождения хромосом, встречаются не так часто, поэтому вероятность их повторения в одной и той же семье достаточно мала.
Структурные же нарушения хромосом передаются по наследству, при этом степень семейного риска и дальнейшая передача дефекта от поколения к поколению становится значительно высокой.
Кариотипирование также рекомендуют проводить в тех семьях, где есть высокая вероятность рождения ребенка с болезнью, сцепленной с Х-хромосомой.
Когда назначается исследование?
Показания для кариотипирования супружеских пар:
Показания для кариотипирования детей:
Что означают результаты?
Для мужчин нормальным считается кариотип 46,XY. Это означает, что определено 46 нормальных хромосом, в том числе X и Y хромосома.
Для женщин нормальным считается кариотип 46,XX. Это означает, что определено 46 нормальных хромосом, в том числе две X хромосомы.
В случае выявления патологического кариотипа, необходима консультация медицинского генетика по результатам исследования для правильной его интерпретации.
Укажите на какой стадии митоза лучше всего определить кариотип человека
2.1.2. Нормальный кариотип человека в митозе и мейозе
2.1.2.1. Митоз
Рис. 2.5. Сестринские хроматидные обмены в нормальной метафазе человека. Локализация обменов указана стрелками. (Courtesy of Dr. T. M. Schroeder-Kurth)
Рис. 2.6. Митоз. Изображены только 2 хромосомы из 46. (Buselmaier, 1976.)
2.1.2.2. Приготовление и окрашивание препаратов метафазных хромосом [201; 88; 406]
В крови здоровых людей (или больных, но не лейкозами) нет делящихся клеток. Однако митоз этих клеток можно стимулировать искусственно, например обработав их фитогемагглютинином ФГА). Спустя один час после инкубации с ФГА в малых (Т-) лимфоцитах отмечается синтез РНК, а через 24 ч начинается синтез ДНК. Суспензию лейкоцитов выращивают в культуральной среде 72 ч и затем готовят препараты хромосом. Чтобы остановить клетки в прометафазе, подавляют образование веретена деления веществами с колхициноподобным действием, предпочтительно колцемидом. В специальных условиях время культивирования можно сократить до 48 ч. Для свободного распределения хромосом в плоскости препарата клетки обрабатывают в течение 10-30 мин гипотоническим раствором, а затем фиксируют смесью этанола и уксусной кислоты. Каплю такой суспензии наносят на стекло, высушивают на воздухе и окрашивают.
Препараты клеток костного мозга получают из материала пункции грудины или подвздошной кости. Клетки культивируют только 2 ч с колцемидом. Процедура приготовления препаратов несколько отличается от процедуры, описанной выше. Культуру фибробластов получают из материала биопсии кожи. Ее измельчают и выращивают в культуральной среде таким образом, чтобы кусочки были прикреплены к поверхности культурального сосуда. Через 10 дней клетки начинают расти по этой поверхности, через 21 день готовят суспензию и делают препараты.
Дифференциальное окрашивание. Многие исследователи отмечали в хромосомах, окрашенных по обычной методике, некоторую неоднородность в плотности окрашивания отдельных участков. Этот факт оставался без внимания, пока Касперсон с сотр. (1968) [320] не обнаружили, что после обработки акрихин-ипритом флуоресценция по длине хромосомы распределена не равномерно, а в виде сегментов. Затем Касперсон с сотр. показали, что каждую хромосому человека можно надежно идентифицировать с помощью такого метода окрашивания. Вскоре после этого стало ясно, что очень сходный рисунок сегментации можно получить и с помощью красителя Гимза, если дополнить процедуру окрашивания некоторыми приемами. Многие исследователи предложили методики для окрашивания прицентромерных районов. Было показано, что частичная тепловая денатурация также приводит к выявлению сегментов в хромосомах. На Парижской конференции по стандартизации и номенклатуре хромосом человека в 1971 г. [468] полученные к тому времени данные были сопоставлены, и оказалось, что все методы выявляют в принципе одни и те же структуры, но каждый из них специфичен в отношении определенных хромосомных сегментов.
Общепринятые методы [341; 200]. Различные типы сегментов обозначают по методам, с помощью которых они выявляются наиболее отчетливо:
б) G-сегменты (Giemsa, Гимза) выявляются при окрашивании красителем Гимза в сочетании с дополнительными процедурами, которые способствуют тому, что краситель адсорбируется наиболее интенсивно на определенных участках. Q- и G-сегменты идентичны. В большинстве лабораторий в повседневной работе предпочитают G-метод, поскольку он не требует использования флуоресцентного микроскопа и окрашенные препараты можно длительно хранить. Однако специфическое преимущество Q-метода состоит в том, что он позволяет даже в интерфазном ядре идентифицировать Y-хромосому человека по яркой флуоресценции.
в) R-сегменты (reverse, обратные) окрашиваются после контролируемой тепловой денатурации. Они располагаются между Q- (или G-) сегментами.
г) C-сегменты (constitutive heterochromatin, конститутивный гетерохроматин) ограничивают прицентромерные районы в обоих плечах хромосомы.
д) Т-сегменты (telomeric, теломерные) расположены в теломерных районах хромосом. Детальное описание этих методов можно найти в многочисленных публикациях. Многие лаборатории используют свои собственные модификации.
а) Q-сегменты соответствуют участкам, богатым А-Т-парами.
б) R-сегменты соответствуют участкам, богатым G-С-парами, которые более устойчивы к тепловой денатурации, чем А-Т-богатые участки.
Эта гипотеза не объясняет, однако, все особенности рисунка сегментации. С другой стороны, белковая гипотеза исходит из данных о том, что протеолитическая обработка индуцирует появление G-сегментов. Но поскольку разные ДНК связаны в хромосомах с разными белками, можно полагать, что рисунок сегментации тем или иным образом зависит от особенностей целостного комплекса ДНК-белок.
Окрашивание серебром районов ядрышкового организатора (ЯОР) [363, 511, 518]. Метод серебрения специфичен для ядрышкообразующих районов. Они видны как темные пятна на желто-коричневом фоне хромосом (рис. 2.7). При этом окрашиваются только те ЯОР, которые функционировали в предшествующей интерфазе.
Рис. 2.7. Окрашивание серебром (стрелки) районов ядрышковых организаторов акроцентрических хромосом. (Courtesy of Dr. T. M. Schroeder-Kurth.)
Хромосомы в сперматозоидах человека. Несколько лет назад был предложен метод приготовления препаратов хромосом непосредственно из сперматозоидов человека. Для этого сперму сначала инкубировали с ооцитами золотистого хомячка, лишенными блестящей оболочки, чтобы индуцировать митозы [489]. Этот метод весьма важен для прямого определения хромосомных аномалий в сперматозоидах человека. Однако его воспроизводимость очень плохая [431]. В одном исследовании частота хромосомных аномалий в сперматозоидах оказалась равной 8,5% [432].
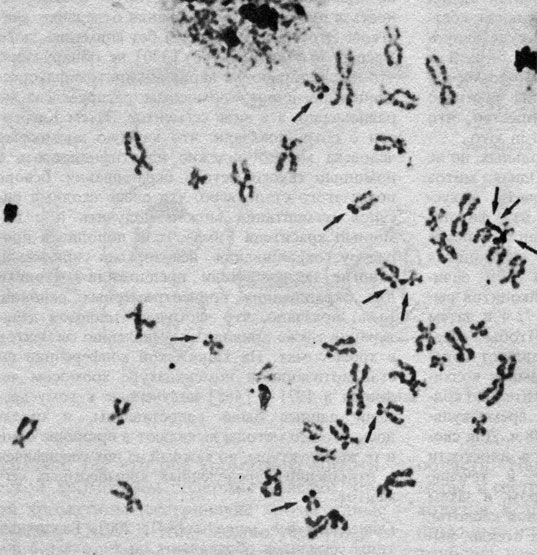
2.1.2.3. Нормальный кариотип человека в метафазе митоза
Стандартное окрашивание. Хромосомы располагаются и нумеруются в зависимости от их длины. Согласно Денверской классификации, предложено нумеровать пары хромосом от 1 до 23 (1960). Патау (1960) [471] показал, однако, что в некоторых группах хромосомы нельзя однозначно классифицировать, и предложил идентифицировать пары на основании относительной длины и положения центромеры. В соответствии с этой последней характеристикой различают метацентрические, субметацентрические и акроцентрические хромосомы. Патау предложил разбить 23 пары на восемь групп от A до G. Это предложение было принято в качестве альтернативной процедуры. Все три пары метацентрических хромосом группы А можно идентифицировать. В группе E обычно легко выделить хромосому 16, а хромосомы 17 и 18 поддаются идентификации, только если препараты высокого качества. Y-хромосому обычно можно отличить от других хромосом группы G. Все остальные хромосомы групп B, C (включая X-хромосому), D, F и G не идентифицируются. Важным параметром является центромерный индекс, который отражает отношение (в %) длины короткого плеча к длине всей хромосомы.
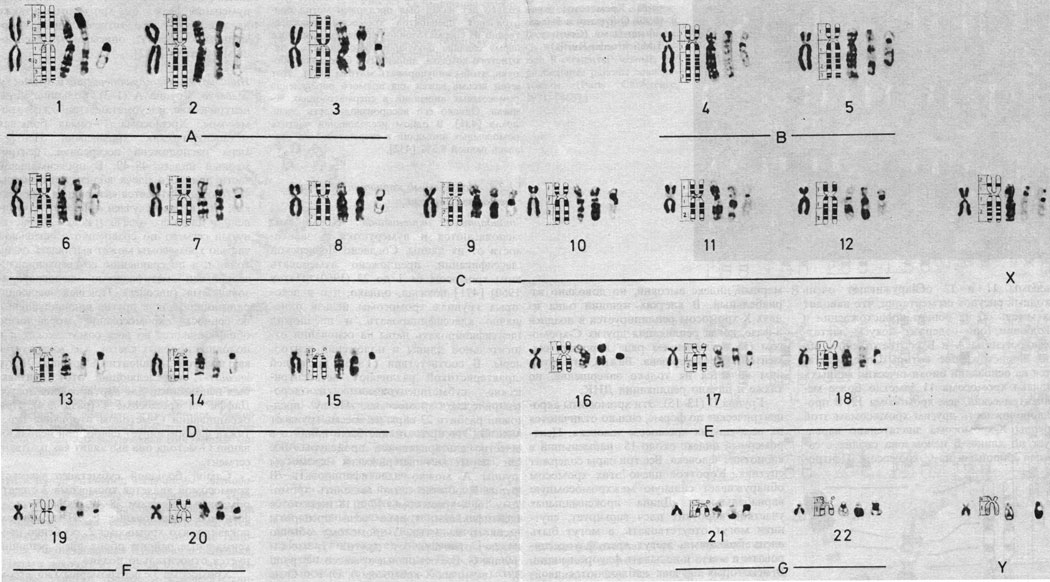
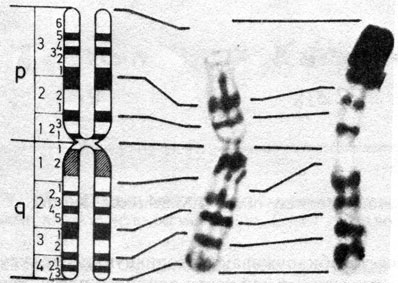
Дифференциальное окрашивание. Кариотип человека представлен на рис. 2.8-2.10, использованы различные методы. В настоящее время каждую хромосому можно идентифицировать. На рис. 2.11 изображены схема распределения G- и Q-сегментов и их нумерация. Отдельные хромосомы, а также их наиболее часто встречающиеся «нормальные» варианты описываются следующим образом [392].
Рис. 2.8. Кариотип мужчины: хромосомы окрашены стандартным методом и методами, выявляющими характерную сегментацию. Слева направо: стандартное окрашивание; схематическое изображение рисунка сегментации; G-метод; R-метод; C-метод. (Courtesy of Dr. T. M. Schroeder-Kurth.)
Рис. 2.10. Хромосома 1: сравнение реальной G- и R-сегментации со схематическим изображением G- и R-сегментов. (Courtesy of T. M. Schroeder-Kurth.)
Рис. 2.12. Гетероморфизм конститутивного гетерохроматина во вторичной перетяжке хромосом 1, 9, и 16; C-метод [406]
Самой большой субметацентрической хромосомой является хромосома 2 с центромерным индексом 38-40. Радиоавтографическое исследование с 3 Н-тимидином показало, что хромосома 2, особенно проксимальные районы обоих плеч, реплицируется относительно поздно.
Хромосома 3 с центромерным индексом 45-46 почти на 20% короче хромосомы 1 и, следовательно, легко идентифицируется. При окрашивании Q-методом в проксимальном районе ее длинного плеча часто выявляется ярко флуоресцирующий сегмент. Интенсивность флуоресценции значительно варьирует у разных индивидов, но постоянна во всех клетках для одного и того же хромосомного варианта.
Группа B (4 и 5). Большие субметацентрические хромосомы (центромерный индекс 24-30) не различаются между собой без радиоавтографии или дифференциального окрашивания. Согласно данным радиоавтографических исследований, хромосома 4 является поздно реплицирующейся по всей своей длине, в то время как в хромосоме 5 поздно реплицируется только короткое плечо. Рисунки распределения R- и G-сегментов у этих хромосом совершенно различны.
Группа C (6-12). Хромосомы среднего размера, субметацентрические. При стандартном окрашивании X-хромосому нельзя отличить от других хромосом этой группы. Хромосомы 6, 7, 8, 11 и 12 являются относительно субметацентрическими, их центромерный индекс 27-35. В хромосоме 9 часто обнаруживают вторичную перетяжку в проксимальной части длинного плеча. Все эти хромосомы легко идентифицируются с помощью Q- и G-окрашивания. Вторичная перетяжка хромосомы 9 не окрашивается ни акрихином, ни красителем Гимза. Хромосомы 11 и 12 обнаруживают очень сходный рисунок сегментации, что наводит на мысль об их общем происхождении и эволюции (они содержат локусы лактатдегидрогеназы A и B соответственно, общее происхождение которых предполагается на основании биохимических данных). Однако хромосома 11 заметно более метацентрическая, чем хромосома 12. В противоположность другим хромосомам этой группы X-хромосома значительно варьирует по длине. В целом она сходна с самыми длинными из С хромосом. Центромерный индекс высокий, но довольно вариабельный. В клетках женщин одна из двух X-хромосом реплицируется в поздней S-фазе, когда репликация других C-хромосом (за исключением ряда коротких сегментов) уже завершена. Важно, что поздним является не только завершение, но также и начало репликации ДНК.
Рис. 2.13. Наследование C-хромосомы, содержащей особенно большой блок конститутивного гетерохроматина (C-сегмент), от отца дочери. (Courtesy of Dr. T. M. Schroeder-Kurth)
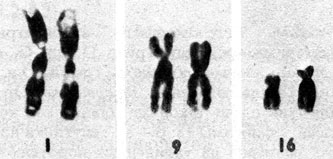
Группа E (16-18). Относительно короткие метацентрические или субметацентрические хромосомы. Хромосома 16 имеет центромерный индекс около 40. В среднем ее длина составляет чуть более одной трети длины хромосомы 1, но обнаруживает значительную изменчивость. В длинном плече примерно в 10% случаев выявляется вторичная перетяжка. Длина проксимального G-сегмента варьирует в зависимости от выраженности этой перетяжки. Хромосома 18 примерно на 5-10% короче хромосомы 17 и имеет более короткое длинное плечо (у хромосомы 17 центромерный индекс составляет 31 по сравнению с 26 у хромосомы 18). Хромосома 17 реплицируется рано, хромосома 18-поздно.
Группа F (19-20). Эти две хромосомы имеют центромерный индекс в пределах 36-46. В стандартных препаратах они выглядят одинаково, но при дифференциальном окрашивании резко различаются.
Группа G (21 и 22). У этих маленьких акроцентрических хромосом центромерный индекс варьирует в пределах 13-33. Они легко различаются по рисунку сегментации. Изменчивость их коротких плеч так же значительна, как и в хромосомах группы D. Здесь классифицируют такие же варианты, как и в группе D (рис. 2.14). Флуоресценция спутников и коротких плеч может быть слабой, умеренной и сильной, так же как и интенсивность окрашивания при использовании G-метода. В выборке из 2444 новорожденных 3,5% обнаруживают удлиненные короткие плечи. Другие варианты, такие, как гигантские спутники, удлиненные или укороченные короткие плечи, встречаются намного реже. По данным некоторых исследователей, общая частота вариантов хромосом группы G составляет 1,8% по препаратам с дифференциальным окрашиванием и 1,6% в стандартных препаратах. Короткие плечи хромосом группы D и G содержат ядрышковый организатор и специфично окрашиваются методом серебрения.
Y-хромосома обычно (но не всегда) больше, чем хромосомы группы G, и хроматиды ее длинного плеча, как правило, лежат параллельно одна другой. Этим она отличается от хромосом группы G, у которых хроматиды длинных плеч часто образуют широкий угол. Центромера видна менее четко, спутники отсутствуют, размер длинного плеча сильно варьирует, и некоторые варианты его длины наследуются. Центромерный индекс варьирует от 0 до 26 (в среднем
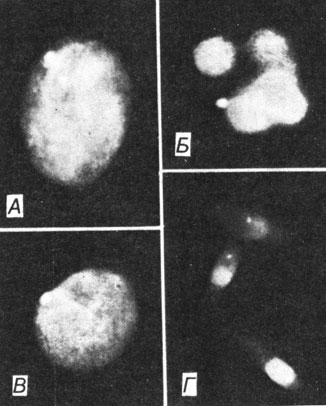
Хроматин [201, 516]. В интерфазных ядрах дистальный интенсивно флуоресцирующий участок длинного плеча Y-хромосомы выявляется как яркое пятно диаметром 0,3-1,0 мкм. На рис. 2.15 показан Y-xpoматин в эпителиальных клетках, гранулоцитах, больших лимфоцитах и в сперматозоидах.
Рис. 2.15. Окрашивание акрихин-ипритом ядер из клеток мужчины с нормальным кариотипом. А. Слизистая оболочка рта, соскоб. Y-хроматин виден как двойная структура. Б. Гранулоцит периферической крови, мазок. Y-хроматин выдается из ядра. В. Большой лимфоцит периферической крови, мазок. Г. Сперматозоиды. Y-хроматин обнаруживается на краю сильно флуоресцирующей области головки (X 2400). [201]
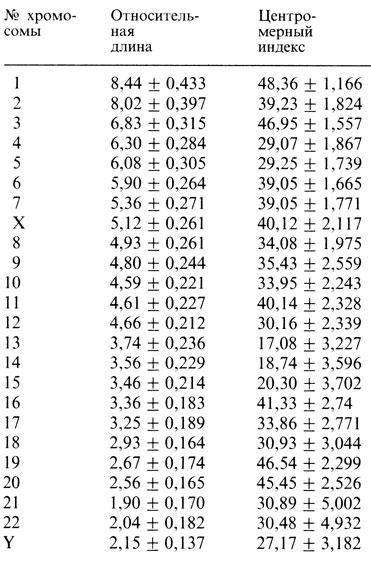
Измерения хромосом. Измерения митотических хромосом сопряжены с определенными трудностями, так как положение центромеры не всегда можно определить достаточно точно. Парижская конференция (1971) [468] разработала рекомендации относительно измерений хромосом. В табл. 2.1 представлены усредненные данные о размерах митотических хромосом человека.
Таблица 2.1. Относительная длина (в процентах от длины гаплоидного набора аутосом) и центромерный индекс (отношение длины короткого плеча к общей длине хромосомы × 100). Хромосомы окрашены орсеином или методом Гимза 9 и предварительно идентифицированы с помощью Q-метода. (Парижская конференция, 1971 [468].)
Данные получены H. A. Lubs, T. Hostetter, L. Ewing при исследовании 95 клеток от 11 нормальных индивидов (6-10 клеток от каждого). Средняя общая длина хромосом на клетку: 176 мкм. Стандартное отклонение представляет собой среднее от стандартных отклонений для каждого из 11 индивидов (6-10 клеток от каждого).
Гетероморфизм хромосом. Морфология отдельных хромосом не всегда одинакова у разных индивидов. Гетероморфизм особенно выражен в отношении размера спутничной области акроцентрических хромосом, длины Y-хромосомы, особенно ее гетерохроматического участка, и «вторичных перетяжек» хромосом 1 и 9. Характерен он и для гетерохроматических сегментов других хромосом (о гетерохроматине см. разд. 2.3.14). При анеуплоидии гетероморфизм гомологов по гетерохроматическим районам можно использовать для выяснения происхождения данной хромосомы от одного из родителей (разд. 5.1.2.3).
Во многих хромосомах обнаруживаются фрагильные (ломкие) участки, т. е. участки, подверженные хромосомным и хроматидным разрывам (разд. 2.2.2). Такие разрывы относительно просто индуцировать удалением фолиевой кислоты из питательной среды [390а]. Недавно обнаружена ассоциация фрагильного участка в дистальном районе длинного плеча Х-хромосомы с характерной формой умственной отсталости (разд. 8.2.1.2).
Высокоразрешающее дифференциальное окрашивание. Хромосомы в профазе и прометафазе конденсированы не столь сильно, как метафазные хромосомы. При обработке культуры лимфоцитов метотрексатом (для частичной синхронизации клеточного цикла) можно накопить достаточное число клеток, находящихся в профазе и прометафазе. Сокращение времени инкубации с колцемидом позволяет избежать сильной конденсации. В препаратах таких хромосом отдельные сегменты, выявляемые стандартными методами, можно подразделить на субсегменты. Степень разрешения зависит от стадии, на которой клетки были зафиксированы. Некоторые авторы описывают свыше 2000 сегментов [550]. Обычно в поздней профазе можно увидеть 800-1200 сегментов (рис. 2.16). Хотя этот метод не заменяет стандартный, используемый при рутинной диагностике, однако он полезен для более точной идентификации точек разрывов и мелких аберраций, например в случае наследуемых сбалансированных и несбалансированных транслокаций или особенно в цитогенетике опухолей.
Рис. 2.16. Схема, иллюстрирующая сегментацию хромосом человека (1700 сегментов). Широки темные и белые полосы это G-позитивные и G-негативные сегменты, видимые в прометафазе (стадия 850 сегментов), пунктирные линии соответствуют сегментам, различимым в средней профазе (стадия 1700 сегментов). (По Yunis, Hum. Genet., 56, p. 296, 1980.)
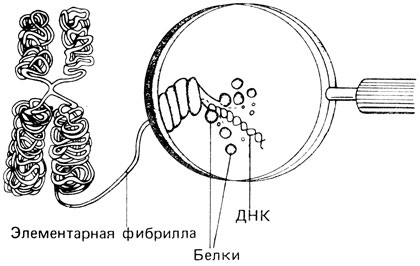
20 Å, следовательно, фибриллы 30-50 Å соответствуют диаметру нити ДНК вместе с белками (гистонами и негистонами). Фибриллы диаметром 100 Å отражают, по-видимому, вторичную спирализацию фибрилл 30-50 Å, а нити 250 Å могут отражать третичный уровень спирализации. В метафазной хромосоме эти «третичные спирали» могут иметь примерно такую укладку, как указано на рис. 2.17. Примерно девять фибрилл 250 Å, вероятно, каким-то образом связаны вместе, и два таких пучка образуют различимую на электронно-микроскопических изображениях спиральную структуру, характерную для каждой хромосомы [490]. В отдельных препаратах обнаруживаются остатки мембраны, предположительно ядерной. Некоторые исследователи считают этот факт доказательством того, что интерфазные хромосомы в разных точках прикреплены к мембране. Следует учесть, однако, что процесс приготовления препаратов для электронной микроскопии хромосом включает целый ряд процедур, и потому трудно решить, существуют ли эти или другие структуры in vivo или они являются попросту артефактами.
Рис. 2.17. Схематическое изображение хромосомы на стадии метафазы. (Buselmaier, Biologie für Mediziner, 1985.)
2.1.2.4. Мейоз
Биологическая функция мейоза. Благодаря митозу поддерживается постоянство числа хромосом в ряду клеточных поколений. В отличие от митоза мейотический процесс обеспечивает уменьшение (редукцию) диплоидного числа хромосом (46 у человека) наполовину до гаплоидного (23 у человека). При оплодотворении в результате слияния двух гаплоидных половых клеток в зиготе восстанавливается диплоидное число 46, которое сохраняется во всех последующих митотических делениях. В мейозе расхождение гомологичных хромосом в разные половые клетки происходит случайно, что увеличивает генетическую изменчивость. Соматические клетки являются диплоидными (2n), они содержат обе гомологичные хромосомы одной пары, в то время как половые клетки гаплоидны (n) и несут только один гомолог из каждой пары. Последний цикл регулярного синтеза ДНК происходит в интерфазе непосредственно перед первым мейотическим делением и предшествует фазам мейоза, показанным на рис. 2.18.
Анафаза I. Начинается «терминализация» хиазм, т. е. они перемещаются к концам хромосом и затем исчезают. Гомологичные хромосомы окончательно разделяются и перемещаются к противоположным полюсам. Образуются дочерние ядра (интеркинез).
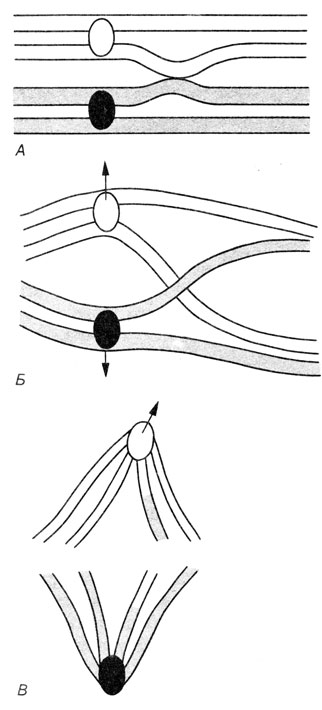
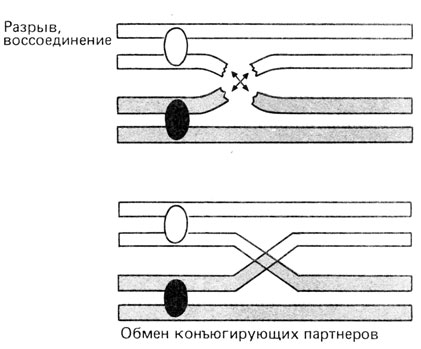
Рис. 2.20. Кроссинговер и образование хиазм. А. Гомологичные хроматиды соединены между собой. Б. Происходит кроссинговер с образованием хиазм. В. Разделение хиазм
Рис. 2.21. Разрыв и воссоединение несестринских хроматид при кроссинговере
Сперматогенез. С наступлением половой зрелости сперматоциты мужчины постоянно претерпевают мейотические деления. После второго мейотического деления происходит плотная упаковка ДНК и митохондрий и завершается формирование спермиев, которые приобретают способность активно двигаться. Препараты хромосом на стадии сперматогониальных митозов или на стадии мейотического деления можно получить из материала биопсии тестикул, удаленных при хирургической операции.
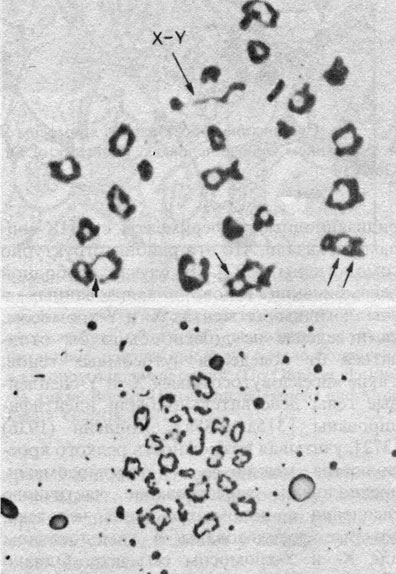
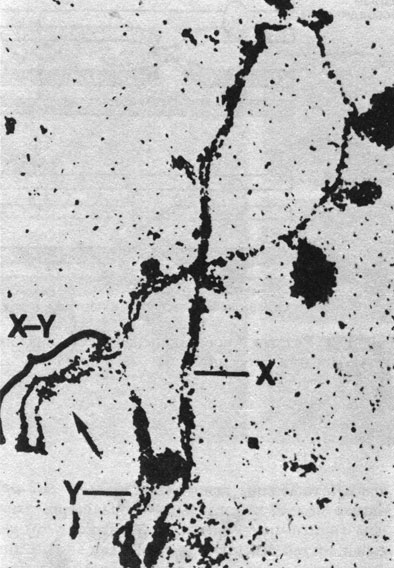
Хромосомы на стадии диакинеза в мейозе у мужчины показаны на рис. 2.22. Гомологи еще тесно прилежат один к другому в их теломерных районах, в то время как центромерные районы уже начали перемещаться к полюсам. Половой бивалент четко отличается от всех остальных благодаря тому, что X- и Y-хромосомы ассоциируют «конец в конец» и хиазмы в нем не обнаруживаются. Во время пахитены половой бивалент начинает конденсироваться раньше других и находится в «половом пузырьке». Часть района короткого плеча X-хромосомы и короткое плечо Y-хромосомы конъюгируют (рис. 2.23). Гибридизационные эксперименты с ДНК-зондами показали, что эти районы структурно гомологичны [502]. В случае свободной рекомбинации генов, локализованных в гомологичных сегментах X- и Y-хромосом, их поведение не должно было бы отличаться от поведения аутосомных генов. Такие «псевдоаутосомные» X- и Y-сцепленные гены действительно были идентифицированы [315а; 488а]. Холдейн (1936) [372], учитывая возможность редкого кроссинговера между X- и Y-хромосомами, предположил существование частичного сцепления с полом тех генов человека, которые локализованы в гомологичном для X- и Y-хромосом сегменте. Однако удовлетворительные доказательства такого частичного сцепления с полом у человека пока не получены. Более того, локусы стероид-сульфатазы и эритроцитарного антигена Xg, расположенные очень близко к псевдоаутосомному району Х-хромосомы, сегрегируют в соответствии с классическим Х-сцепленным наследованием.
Рис. 2.22. Мейоз у мужчины. Стадия диакинеза. Ясно виден бивалент XY [405]. Стрелки указывают на хиазмы
Рис. 2.23. Спаривание коротких плеч хромосом X и Y в раннем мейозе человека. (Courtesy of Dr. Goetz.)
Таблица 2.2. Число хиазм в мейозе у мужчины (1-е деление) [88]
Исследование мейотических хромосом в оогенезе сопряжено с большими трудностями. Было опубликовано лишь несколько удовлетворительных микрофотографий (рис. 2.26). Анализ генетического сцепления показывает, что кроссинговер у женщин происходит чаще, чем у мужчин (разд. 3.4), следовательно, и хиазм у женщин должно быть больше.
Рис. 2.26. Нерасхождение X-хромосомы в первом (слева) и во втором (справа) делении мейоза у женщины. Оплодотворение нормальным сперматозоидом. Индивид с набором XXY может появиться в результате нерасхождения как в первом, так и во втором мейотическом делении
Половые различия в мейозе. Две основные особенности отличают мейоз у мужчин и женщин: