устойчивость бактерий к антибиотикам какой отбор
Устойчивость бактерий к антибиотикам какой отбор
Устойчивость к действию антибиотиков отмечают в случае, когда ранее восприимчивые микроорганизмы теряют свою чувствительность к антибактериальному препарату при использовании клинически безопасной дозы. Это происходит в результате генетических изменений, часто возникающих в быстро делящихся клетках с гаплоидным набором хромосом.
Кроме того, микроорганизмы могут обмениваться генетической информацией внутри и между видами. Развитие устойчивости происходит в результате случайной «генетической лотереи», т.е. спонтанных мутаций. Назначение антибиотиков приводит к выживанию и размножению организмов, у которых случайно возникли механизмы защиты.
Факторы определяющие устойчивость бактерий к антибиотикам
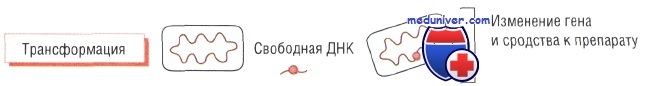
Трансформация бактерий и утойчивость к антибиотикам. Трансформация — процесс захвата бактериями свободной цепи ДНК и встраивания её в собственный геном.
Например, Streptococcus pneumoniae способен захватывать у близкородственных видов часть генов, кодирующих пенициллинсвязывающие белки (обладают меньшим сродством к лекарственному препарату). При продукции изменёнными генами этих белков чувствительность к действию пенициллина заметно снижается, т.е. бактерии продолжают синтезировать пептидогликан, сохраняя структуру клеточной стенки, даже в присутствии препарата.
Устойчивость к действию бензилпенициллина у Neisseria gonorrhoeae развивается по такому же механизму.
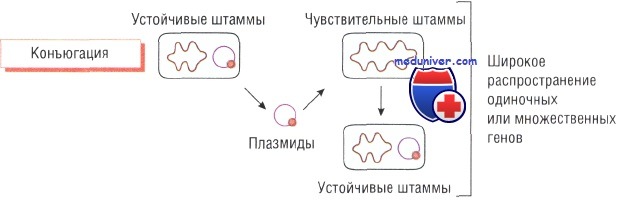
Конъюгация бактерий и утойчивость к антибиотику
Плазмиды — кольцевые структуры ДНК, расположенные в цитоплазме бактерий. Их может быть достаточно много. Именно поэтому при делении клеток одни и те же плазмиды обнаруживают у всех дочерних микроорганизмов. Плазмиды содержат информацию о различных генах бактерии, в том числе о генах, кодирующих метаболические ферменты, и факторах, определяющих вирулентность и устойчивость к действию антибиотиков.
Конъюгация — процесс передачи плазмид от одной бактерии к другой. В этом случае гены, кодирующие устойчивость, быстро распространяются среди бактерий, находящихся в одной среде обитания (например, в кишечнике). Комбинированное воздействие отдельных антибиотиков (например, в госпитальных условиях) приводит к появлению мультирезистентных штаммов.
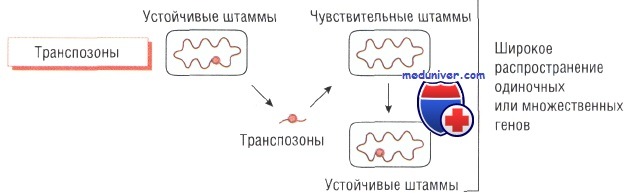
Транспозоны и интегроны бактерий и утойчивость к антибиотику
Транспозоны и интегроны — подвижные гены, способные кодировать транспозицию (внутрихромосомную транслокацию). Они могут перемещаться как между хромосомами и плазмидами, так и между бактериями и содержат большое количество генетической информации (например, антибиотикорезистентность).
Считают, что в основе развития устойчивости к метициллину у Staphylococcus aureus и к тетрациклину у Neisseria gonorrhoeae лежит передача именно этих генетических структур. Интегроны играют важную роль в передаче мультирезистентности у грамположительных микроорганизмов. Кроме того, передачу генов резистентности могут осуществлять бактериофаги.
Механизмы возникновения утойчивости к антибиотикам
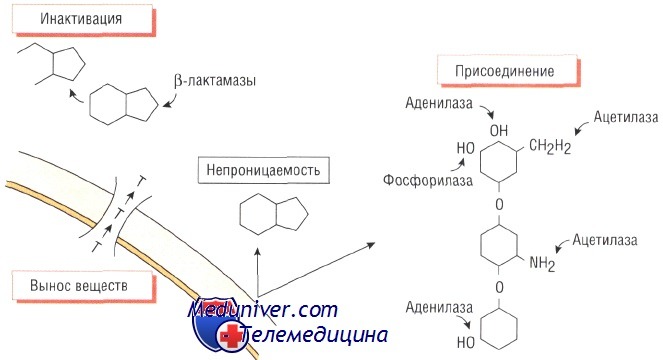
Изменение структуры антибактериального препарата. Ферментативная инактивация. Наиболее распространённый механизм развития устойчивости к действию антибиотика — спонтанное продуцирование фермента, разрушающего препарат.
Большинство штаммов Staphylococcus aureus продуцирует экстрацеллюлярный фермент бета-лактамазу, которая инактивирует пенициллины, разрушая бета-лактамное кольцо в их структуре. Ферменты, разрушающие пенициллины и цефало-спорины, синтезируют многие микроорганизмы, в том числе Escherichia coli, Haemophilus influenzae и некоторые представители рода Pseudomonas.
Гены, кодирующие эти ферменты, обычно расположены в подвижных генетических элементах (транспозонах) и могут передаваться как между бактериями одного вида, так и между видами. Распространение различных видов бета-лактамаз расширенного спектра (например, CTXm или АтрС) среди представителей семейства энтеробактерий приводит к возникновению устойчивости к эффектам пенициллинов и цефалоспоринов широкого спектра действия и возникновению внутрибольничных инфекций. Кроме того, эти микроорганизмы могут вызывать опасные внебольничные заболевания.
Ферментативное присоединение. Бактерии могут вырабатывать ферменты, способные угнетать активность антибиотиков путём присоединения к последним различных химических групп. Например, устойчивость к действию аминогликозидов возникает в результате присоединения ацетилового, аминового или аденозинового радикала к молекуле препарата.
Влияние такой модификации на эффективность лекарственных средств группы аминогликозидов различно. Так, амикацин наименее восприимчив к этому способу инактивации. Присутствие ферментов, обусловливающих устойчивость к действию аминогликозидов, характерно как для грамположительных (Staphylococcus aureus), так и для грамотрицательных (микроорганизмы рода Pseudomonas) возбудителей.
Непроницаемость клеточной стенки и утойчивость к антибиотику
Устойчивость некоторых бактерий к действию антимикробных средств связана с непроницаемостью их клеточной стенки для молекул препарата. Например, клеточная стенка грамо-трицательных микроорганизмов (особенно рода Pseudomonas) непроницаема для некоторых бета-лактамов.
В то же время аминогликозиды проникают внутрь бактерии посредством кислородозависимой транспортной системы (а потому анаэробы к ним невосприимчивы), в связи с этим анаэробы обладают небольшой чувствительностью к аминогликозидам.
Механизмы выведения веществ из бактериальной клетки и утойчивость к антибиотику
Некоторые бактерии, например Е. coli, становятся невосприимчивыми к действию тетрациклинов, когда приобретают внутримембранный белок, активно выводящий антибиотик из клетки. Устойчивость стрептококков к действию макролидов обусловлена подобным механизмом.
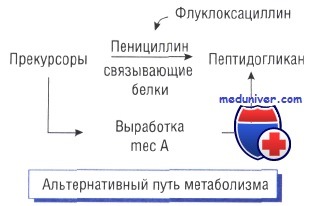
Альтернативные пути метаболизма и утойчивость к антибиотикам
Один из наиболее распространённых механизмов возникновения устойчивости к действию антибактериальных препаратов — развитие альтернативных путей метаболизма, помогающих обходить метаболический блок, вызываемый антибиотиком. Так, Staphylococcus aureus становится невосприимчивым к метициллину или флуклоксациллину, когда у него появляется ген тесА, кодирующий альтернативный пенициллинсвязывающий белок (РВР2), не чувствительный к метициллину.
Несмотря на то что состав бактериальной клеточной стенки изменяется, микроорганизм сохраняет способность к делению. Снижение восприимчивости к бензилпенициллину у Streptococcus pneumoniae также вызвано наличием пенициллинсвязывающих белков.
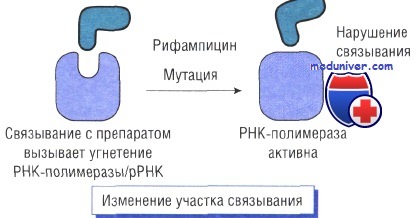
Изменение участка связывания антибиотика
В основе механизма действия рифампицина лежит угнетение бета-субъединицы РНК-полимеразы. Устойчивость возникает при изменении гена РНК-полимеразы в результате точечных мутаций, инсерции или делеции.
При этом новая РНК-полимераза невосприимчива к рифампицину.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Как бактерии развивают устойчивость к антибиотикам и почему это так важно
Врачи предупреждают, что если не принимать меры, к 2050 году 10 000 000 человек в мире будут умирать от бактерий, которые стали устойчивыми к антибиотикам.
Именно по этой причине ВОЗ призывает все страны участвовать в борьбе с ростом резистентности к антибиотикам. Что касается России, то у нас уже разработан план мероприятий на 2019–2024 годы, в котором предусмотрены соответствующие шаги.
Но что еще важно знать о проблеме? «Аргументы и Факты» пригласили известных врачей, экспертов и ученых для обсуждения — и вот к каким выводам они пришли.
Как бактерии становятся устойчивыми
Заведующий кафедрой фармакологии Института клинической медицины Первого МГМУ им. И. М. Сеченова, доктор медицинских наук Владимир Фисенко рассказал, что бактерии, как и любые микроорганизмы, стремятся избежать гибели, используя разные механизмы для этого.
Создание новых антибиотиков направлено во многом на преодоление этих механизмов защиты бактерий.
С чего все началось
Генеральный секретарь Российского научного медицинского общества терапевтов, заместитель начальника управления науки ГБОУ ВПО «МГМСУ им. А. И. Евдокимова» Минздрава России, главный внештатный специалист-пульмонолог Министерства здравоохранения РФ по ЦФО Андрей Малявин заострил внимание на двух проблемах, которые привели к существенному росту антибиотикорезистентности.
Например, во Франции из-за этого синтетические антибактериальные средства – фторхинолоны — стали неэффективны при лечении пневмонии (воспаление легких). В России при этой инфекции активно использовали антибиотики из группы макролидов, и к ним пневмококки стали устойчивы. В новых рекомендациях для врачей по лечению пневмонии, снова советуем начинать лечение с пенициллинов, они сохранили свою эффективность.
Какие меры будут предпринимать
«Проблема устойчивости к антибиотикам имеет глобальное значение, — подчеркнула представитель ВОЗ в РФ, доктор Мелита Вуйнович. — Это очень важные и полезные лекарства, но только тогда, когда применяются рационально и по назначению. Сегодня в мире каждый год из-за инфекций, вызванных микроорганизмами, резистентными к антибиотикам, погибает 700 тысяч человек.
Важно, что стратегия «Единого здоровья» — единственно возможная мера для сохранения эффективности антибиотиков. Она охватывает сферы защиты здоровья людей, животных и окружающей среды, и разработана ВОЗ, FAO (Продовольственная организация ООН) и OIE (Всемирная организация по охране здоровья животных).
Один из эффективных способов защиты человека от резкого роста устойчивых бактерий, запрет на использование антибиотиков в качестве стимуляторов роста в животноводстве и применение их для лечения в сельском хозяйстве только в исключительных случаях. Конечно, необходимо правильное и рациональное использование антибиотиков в лечении человека».
Антибиотики: современная точка зрения
Рисунок 1. Впервые вовремя не разработан новый тип препаратов, способных сдержать уровень резистентности к антибиотикам Насколько актуальна проблема резистентности? Можно ли (и если можно, то как) контролировать резистентность?
 |
| Рисунок 1. Впервые вовремя не разработан новый тип препаратов, способных сдержать уровень резистентности к антибиотикам |
Насколько актуальна проблема резистентности?
Можно ли (и если можно, то как) контролировать резистентность?
Так ли уж неотвратима эра «постантибиотиков»?
Повышение резистентности различных патогенных микроорганизмов к антибиотикам является серьезной проблемой, чреватой такими неприятными последствиями, как грядущая эра «постантибиотиков».
Кризис, наблюдаемый сегодня, не похож на предыдущие. Его особенность прежде всего в количестве вовлеченных микроорганизмов и в отсутствии немедленного ответа на антибактериальную терапию. В прошлом фармацевтическая промышленность решала проблему резистентности путем производства нового, более эффективного антибиотика. Однако на сегодняшний день не существует никакого принципиально нового класса антибиотиков, приемлемого для клинического применения, а разработка новых препаратов может занять 10 — 15 лет.
Расширение спектра используемых в популяции антибиотиков поддерживает выборочное воздействие на целый ряд микроорганизмов, и, в частности, на те из них, которые в настоящее время являются резистентными к большинству антибиотиков (см. табл. 1). Но растет и перечень антибактериальных препаратов, к которым вырабатывается резистентность.
Таблица 1. Бактерии, проявляющие резистентность к антибиотикам
В целом в Англии наблюдалось 45%-ное увеличение случаев назначения антибиотиков за период между 1980 и 1991 гг., что составляет 5%–ное увеличение в год и связано с использованием антибиотиков для лечения респираторных заболеваний.
Следует отметить участившиеся случаи назначения цефалоспоринов, макролидов и хинолонов. Повышение резистентности к этим препаратам вызывает особое беспокойство, так как они используются для лечения очень опасных заболеваний, причем ситуация может усугубиться в случае, если резистентность будет расти.
Последствиями возросшей резистентности микроорганизмов являются увеличение сроков госпитализации, большие затраты на лечение, растущий уровень заболеваемости и смертности.
При современных масштабах международного туризма проблема резистентности к антибиотикам носит не только локальный, но и глобальный характер. Например, путешествия в развивающиеся страны обычно связаны с риском приобретения резистентной бактерии — Escherichia coli.
Структура восприимчивости имеет свои географические особенности, так как показатели резистентности в разных странах разные, что само по себе отражает уровень использования антибиотиков. Например, если взять Европу, то к югу от Скандинавии, в сторону стран Средиземноморья, наблюдается увеличение резистентности патогенных микроорганизмов к антибиотикам.
Степень проявления резистентности зависит не только от географических условий, но и от типа патогенных микроорганизмов, которые теоретически попадают под воздействие антибиотиков. Например, резистентность к пенициллину очень быстро возникла у Staphylococcus aureus, но понадобилось целых 50 лет, чтобы ее обрела Streptococcus pneumoniae, а у Streptococcus pyogenes это явление вообще начало проявляться лишь недавно. В настоящее время никто не может адекватно объяснить такой временной разницы.
В целом существует несколько резервуаров формирования резистентности к антибиотикам, к примеру животноводческие фермы, человеческая облигатная и условно-патогенная флора, клиническая изоляция. Степень значимости каждого из резервуаров не выявлена.
Основными условиями существования упомянутых выше резервуаров является плохое качество питьевой воды, антисанитарные условия, бесконтрольное применение антибиотиков, продающихся без рецептов, и их использование на животноводческих фермах для лечения животных, а также в малых дозах для ускорения роста молодняка.
Таблица 2 Новые подходы к борьбе с инфекциями
Например, известно, что использование триметоприма для лечения скота является одной из вероятных причин появления триметоприм-резистентной сальмонеллы. Кроме того, вызывает тревогу лицензирование таких ветеринарных препаратов, как квинолон и энрофлоксацин, поскольку хинолины могут потерять свою эффективность как основные препараты для лечения инвазивного сальмонеллеза.
Каковы бы ни были причины резистентности Salmonella, фактически зафиксировано 4-кратное увеличение мультирезистентности к антибиотикам за последние 13 лет. Существует предположение, что использование авопарцина (в ветеринарии — гликопептида) могло спровоцировать появление ванкомицин-резистентных энтерококков, микроорганизмов, которые могут соперничать с метициллин-резистентными Staphylococcus aureus по возможному отрицательному воздействию на макроорганизм.
Настораживает увеличение резистентности у ряда часто встречающихся микроорганизмов. Одним из наиболее устойчивых к антибиотикам патогенных микроорганизмов является пенициллин-резистентный пневмококк, впервые выявленный в 1967 г., а в настоящее время являющийся мультирезистентным. Штаммы этого пневмококка в настоящее время распространены во всем мире, особенно часто они встречаются в Испании, Южной Африке и Болгарии.
В Великобритании масштабы бедствия не столь велики: резистентность к пенициллину здесь повысилась с 1,5% в 1990 до 4% в 1995 г. Следует особо отметить появление резистентности пневмококков к эритромицину (до 9 % в 1995 г.), что делает бессмысленным использование этого препарата у пациентов с аллергической реакцией на пенициллин.
 |
| Рисунок 2. Антибиотики используются для ускорения роста домашних животных и в терапевтических целях |
Механизм, формирующий устойчивость к эритромицину, вызывает перекрестную резистентность к азитромицину и кларитромицину, что означает способность данного патогенного микроорганизма противостоять двум наиболее часто используемым антибиотикам первейшей необходимости.
Сегодняшний уровень резистентности пневмококков пока не может повлиять на основные направления лечения инфекционных заболеваний. Но при непрерывном повышении устойчивости к антибиотикам ситуация в будущем может измениться. Пневмонию, вызванную пневмококком, резистентным к пенициллину, сейчас можно лечить с помощью больших доз пенициллина (порядка 18 мегаединиц), но в случае менингита, вызванного тем же микроорганизмом, целесообразно использовать цефалоспорины.
В 70-х годах с Haemophilus influensae успешно боролись с помощью ампициллина. Однако приобретение данным патогенным микроорганизмом бета-лактамазы, способной ферментативно расщеплять бета-лактамное кольцо пенициллина, привело к тому, что 23% H. Influenzae стало ампициллин-резистентным.
С резистентностью можно справиться, если использовать бета-лактамазные ингибиторы, такие как клавулановая кислота. Однако наблюдается повышение устойчивости к ко-амоксиклаву благодаря измененным пенициллин-связывающим белкам, что привело к появлению 14% резистентных H. Influenzae. При столь распространенной резистентности к бета-лактамазе новые макролиды могут стать главным средством для лечения заболеваний, вызванных H. Influenzae.
Недавно в Великобритании и во всем остальном мире были зарегистрированы вспышки туберкулеза. Туберкулез — «капитан смерти» — стал теперь резистентным ко многим противотуберкулезным препаратам, поэтому в настоящее время рекомендуется множественная терапия.
Согласно исследованиям британских ученых, примерно в 10% случаев туберкулезная палочка резистентна хотя бы к одному противотуберкулезному препарату, хотя в США ситуация еще хуже, там нормой становится резистентность, равная 30%. Эти мультирезистентные штаммы не менее вирулентны и плохо поддаются лечению — иногда требуется длительная (в некоторых случаях многолетняя) терапия нового типа.
Работники больниц, где на патогенные микроорганизмы оказывается мощное селективное воздействие при помощи антибиотиков, много сил отдают борьбе с метициллин-резистентным Staphylococcus aureus, ванкомицин-резистентным enterococcus, мультирезистентными Escherichia coli и мультирезистентными Pseudomonas.
В 60-х годах главный хирург США объявил победу над инфекционными заболеваниями. Конечно, он был не прав, но действительно ли мы стоим на пороге эры постантибиотиков?
Терапевтические возможности для лечения ряда заболеваний сейчас сильно ограничены.
Таблица 3. Схема приобретения резистентности организмов к антибиотикам
Энтерококки стали серьезным источником внутрибольничной инфекции, главным образом из-за того, что пациенты в больницах представляют из себя наиболее ослабленную часть населения, требующую серьезной защиты от инфекций. Энтерококки являются резистентными ко многим антибиотикам, таким как цефалоспорины, хинолоны, аминогликозиды и некоторые пенициллины. К тому же недавно они обрели способность вырабатывать бета-лактамазу, стали устойчивыми к повышенным дозам аминогликозидов и, самое главное, у них появилась резистентность к ванкомицину и тейкопланину.
В настоящее время микробиологи заняты исследованием гипотетической ситуации, при которой ванкомицин-резистентные гены от мультирезистентных энтерококков могут перейти в популяцию метициллин-резистентных стафилококков, что станет причиной появления нового микроорганизма «Судного Дня» — S. аuraeus, устойчивого ко всем известным антибиотикам и вызывающего неизлечимые заболевания.
Возможен ли такой сценарий? Уже известно, что гены, ответственные за резистентность к ванкомицину, способны в лабораторных условиях передаваться к S. aureus, хотя полученная резистентность нестабильна.
Также известно, что резистентность энтерококков к гентамицину была приобретена от стафилококка. Если это так, то генетические элементы у них совместимы и генетический барьер может быть легко перейден.
Как снизить вероятность формирования резистентности к антибиотикам? Главное — устранение селективного воздействия антибиотиков на бактерии путем. Для этого необходимо соблюдение следующих условий.
Привлечение к работе местной микробиологической лаборатории, которая располагает информацией о чувствительности к антибиотикам в данном регионе. Строгий контроль за применением антибактериальных препаратов в каждом конкретном регионе.
Время бездумного использования антибиотиков прошло. Сейчас особенно важен ответственный подход к назначению антибиотиков, позволяющий контролировать резистентность микроорганизмов в лечебных учреждениях и в обществе в целом.
1. Service R. F. Antibiotics that resist resistance. Science 1995; 270:724-727.
2. Davey P. G., Bax R. P., Reeves D., Rutherford D., Slack, et al. Growth in the use of antibiotics in the community in England and Scotland in 1980-93. Br Med J 1996; 312:613
3. Holmberg SSSSD, Solomon S. L, Blake P. A. Health and economic aspect of antimicrobial resistance. Rev Inf Dis 1987; 9:1065-1078.
4. Hughes V. M., Datta N. Conjugative plasmids in bacteria of the ‘pre-antibiotic’ era. Nature 1983; 302:725-726.
5. Shanahan P. M. A., Thomson C. J., Amyes S. G. B. The global inpact of antibiotic-resistant bacteria: their sources and reservoirs. Rev Med Micro 1994; 5:1740-1782.
6. Frost J. A, Threfall E. J., Rowe B. Antibiotic resistance in salmonellas from humans in England and Waales: the situation in 1994. PHLS Microbiologi Digest 1996; 12: 131-133.
7. Johson A. P., Speller D. C. E., George R. C., Warner M., Domingue G., Efstratiou A. Prevalence of antibiotic resistance and serotypes in pneumococci in England and Wales:: results of observational surveys in 1990 and 1995. Br Med JJ 1996; 312:: 1454-1456.
8. James P. A., Lewis D. A., Cribb J., Dawson S. J., Murray S. A. The incidence and epidemiology of Beta-lactam resistance in Haemophilus influenzae. J Antimicrobial Chemo 1996; 37: 737-746.
9. Warburton A. R. E., Jenkins P. A., Waight P. A., Watson J. M. Drug resistance in initial isolates of Mycobacterium tuberculosis in England and Wales 1982-1991. CDR Rev 1993; 13:175-179.
10. Young L. Mycobacterial disease in the 1990’s. J Antimicrobial Chemo 1993; 32:179-174.
11. Report of the Expert Group on animal feeding stuffs. HMSO 1992.
12. Noble W. C., Virani Z., Cree R. G. A. Co-transfer of vancomycin and other resistance genes from E faecalis NCCTTC 12201 to S aureus. FEMS Microbiol Lett 1992; 93:195-198.
Природа резистентности
Как удалось бактериям всего за 60 лет научиться противостоять всем известным антибактериальным препаратам? Антибиотики являются естественными субстанциями (или химически модифицированными), вырабатываемыми рядом микроорганизмов.
Эти микроорганизмы экскретируют антибиотикоподобные вещества в окружающую среду, чтобы получить преимущество в условиях естественного отбора. Однако сам микроорганизм должен обладать защитными механизмами против собственного токсина. Таким образом, механизмы, позволяющие ликвидировать воздействие антибиотиков, появились в природе задолго до того, как они стали широко использоваться человеком. Поэтому можно утверждать, что резистентность к антибиотикам является предвестником эры постантибиотиков.
Механизмы резистентности (см. табл. 3) получают все более широкое распространение и укрепляют прежде восприимчивые популяции микроорганизмов.
Распространение резистентности обусловлено не только способностью микроорганизмов развивать устойчивость и существовать в определенной экологической нише (клональная экспансия), но и возможностью независимого переноса механизмов резистентности между различными видами бактерий с помощью мобильных генетических элементов.
В качестве примера можно привести следующий факт: пенициллин-резистентные пневмококки развивались клонально, и рассеивание плазмидов (мобильных генетических элементов) обусловило появление способности вырабатывать бета-лактамазу у таких разных организмов, как E. coli и H. influenzae.
Мероприятия против бактериальной инфекции
Возможно ли контролировать резистентность? Главным условием сдерживания резистентности является улучшение качества питьевой воды и санитарных условий. Антибиотики, используемые для лечения людей, не должны применяться в ветеринарной практике, что и было рекомендовано 5 лет назад экспертной группой по питанию животных.
В ряде стран следует ввести жесткий контроль за безрецептурной продажей антибиотиков. Селективное воздействие антибактериальных препаратов, связанное с неправильным назначением, можно и следует свести до минимума.
Фармацевтическая промышленность ищет принципиально новые химические структуры, нуклеотиды, способные ингибировать клеточные функции микроорганизмов, а также стремится разработать препараты, основное назначение которых — ликвидация механизмов резистентности путем блокирования ферментов и создание условий, исключающих удаление антибиотиков при помощи клеточных насосов.
Многие актуальные на сегодня методы лечения потеряют свою эффективность в будущем. Таким образом, крайне необходим постоянный контроль на международном, национальном и региональном уровнях за использованием антибиотиков и формированием к ним бактериальной резистентности.