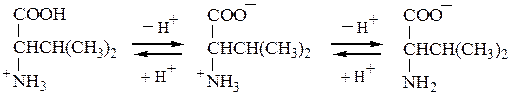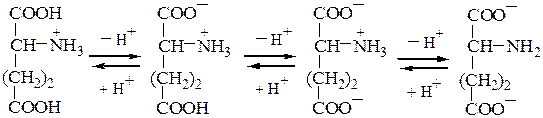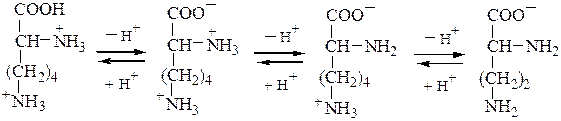В чем заключается амфотерность свойств аминокислот приведите доказательства
Для аминокислот характерна амфотерность
Амфотерность является основным физико-химическим свойством аминокислот.
Понятие амфотерность означает, что вещество сочетает в себе свойства как кислот, так и оснований. В водном растворе аминокислоты одновременно ведут себя как кислоты – доноры протонов и как основания – акцепторы протонов. Данное свойство аминокислот напрямую связано со амфотерными свойствами белков, благодаря которому они участвуют в регуляции кислотно-основного состояния крови.
Амфотерность аминокислот
Если общий заряд аминокислоты равен 0, то это ее состояние называют изоэлектрическим.
Величина рН, при которой заряд аминокислоты равен 0, называется изоэлектрической точкой (ИЭТ, pI). Значение изоэлектрической точки зависит от строения радикала аминокислоты:
Изоэлектрическая точка гистидина позволяет ему использоваться в буферной системе гемоглобина. Гемоглобин легко принимает и легко отдает ионы водорода при малейших сдвигах физиологической рН крови (в норме 7,35-7,45).
Заряд аминокислот зависит от величины рН среды и от строения их радикала.
При снижении концентрации ионов водорода в растворе (защелачивание среды) повышается их отрыв от аминогруппы и карбоксигруппы аминокислот. Иными словами, от аминокислоты уходит положительный заряд и она становится отрицательно заряженной. Когда рН снижается (закисление среды), то имеющиеся в растворе ионы Н + присоединяются к амино- и карбоксигруппам – заряд аминокислоты становится положительным.
Амфотерные свойства аминокислот. Ответ подтвердите реакциями с цистеином.



(не те реакции)
65. Заменимые и незаменимые аминокислоты. Приведите примеры. Напишите уравнения реакции образования цистина и цистеина.
Аланин способствует восстановлению после травм. Регулирует уровень сахара в крови. Участвует в энергообразовании. Способствует запасанию гликогена мышцами и печенью.
Аспарагин участвует в метаболизме нервной системы. Участвует в синтезе аминокислот в печени. Способствует выработке аспарагиновой кислоты, которая участвует в синтезе ДНК и РНК.
Аспарагиновая кислота активизирует иммунную систему. Снижает утомляемость. Способствует превращению углеводов в мышечную энергию. Образует лизин и метионин.
Глутамин стимулирует память и мышление. Участвует в синтезе протеина. Повышает выносливость. Нейтрализует токсические соединения в организме. Снижает тягу к алкоголю и сладостям.
Глутаминовая кислота участвует в метаболизме аминокислот. Выполняет функции нейромедиатора в ЦНС. Играет важную роль в углеводном обмене.
Пролин укрепляет суставы и связки. Участвует в выработке энергии. Способствует заживлению ран.
Серин укрепляет иммунную систему. Необходим для нормального обмена жиров и жирных кислот. Участвует в биосинтезе глицина, метионина, цистеина, и триптофана.
Цистеин ускоряет заживление тканей. Стимулирует рост волос. Активизирует иммунную систему. Улучшает мозговую деятельность. Переносит аминокислоты по организму. Антиоксидант.
Валин содержится в моркови, свекле, зерновых, мясе, грибах, молочных продуктах, арахисе. Валин метаболизируется в мышечную ткань, стимулирует умственную деятельность. Валин необходим организму для поддержания нужного уровня обмена азота.
Изолейцин содержится в рыбе, курином мясе, печени, миндале, кешью, в соевых белках. Изолейцин регулирует уровень сахара в крови. Участвует в синтезе гемоглобина. Повышает выносливость организма. Участвует в синтезе метаболизма в мышцах. Расщепляет холестерин.
Лейцин содержится в бобах, буром рисе, пшеничной муке и орехах. Лейцин является источником энергии, способствует восстановлению мышц и костей. Снижает повышенный уровень сахара в крови при диабетах.
Лизин содержат сельдерей, зеленые овощи, молоко, яйца, дрожжевые продукты, мясо. Лизин необходим для роста костной ткани, поддержания женской половой функции. Поддерживает обмен азота в организме. Оказывает противовирусное действие. Стимулирует умственную деятельность.
Метионин содержат в себе яйца, бобовые, лук, чеснок, мясо, йогурты. Метионин улучшает пищеварение, помогает перерабатывать жир. Расщепляет холестерин. Предотвращает выпадение волос. Антиоксидант.
Треонин содержится в листовых овощах, моркови. Треонин активизирует иммунную систему. Детоксикатор. Способствует росту тканей. Помогает усваивать пищевой белок.
Триптофан есть в бананах, помидорах, редьке, фенхеле.
Триптофан регулирует функции иммунной и центральной нервной системы. Способствует хорошему сну. Стимулирует рост кожи и волос. Улучшает пищеварение.
Фенилаланин можно найти в свекле, моркови, яблоках и шпинате. Фенилаланин стимулирует ЦНС. Антидепрессант. Улучшает память и внимание. Повышает работоспособность. Снижает аппетит.
Амфотерность аминокислот



Физические свойства
a-Аминокислоты – кристаллические вещества белого или сероватого цвета. Они хорошо растворяются в воде с образованием электролитов, плохо – в спирте, не растворяются в эфире. Аминокислоты в твердом и растворенном состоянии имеют биполярное строение, на что указывает отсутствие в ИК-спектрах отдельных полос поглощения, характерных для – NН2 и –СООН групп, они обладают высокой температурой плавления (См. Приложение 3).
Амфотерность
– способность a-аминокислот диссоциировать в водном растворе по типу кислоты и основания из-за наличия в их составе групп кислотного (-СООН) и основного (-NH2) характера. Аминокислоты существует в виде равновесной смеси биполярного иона (цвиттериона) катионной и анионнойформ, равновесие которых зависит от рН среды:
Катионная форма Биполярный ион Анионная форма
Сильнокислая среда Сильнощелочная среда

Значение рН, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионных и анионных форм a-аминокислоты равны, называется изоэлектрической точкой (pI).
n — максимальное число положительных зарядов в протонированной a-аминокислоте
В изоэлектрической точке суммарный заряд молекулы a-аминокислоты равен нулю. Биполярные ионы не перемещаются в электрическом поле. При значениях рН ниже рI катион a-аминокислоты (аммониевая форма) движется к катоду; при рН выше, чем pI, карбоксилат-анион аминокислоты перемещается к аноду. На этом основано разделение аминокислот методом электрофореза.
катион биполярный ион анион
pKa 1 = 2,3 СOOH-группы pI = 6,0 рКа2 = 9,6 + NH3-группы
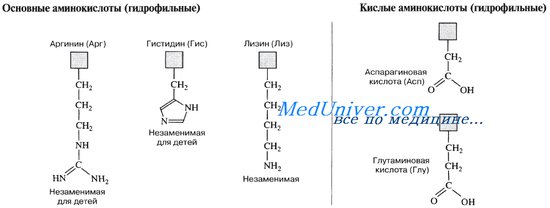
Кислые а-аминокислоты, имеющие в радикале дополнительную карбоксильную группу, в сильнокислой среде находятся в полностью протонированной форме. Они являются трехосновными кислотами (по Бренстеду), характеризующимися тремя значениями рКа, как это видно на примере глутаминовой кислоты (рI = 3,2):
катион биполярный ион анион дианион
рКа1= 2,2 (a-СOOH) pI=3,2 pKa2=4,3 (COOH в pKa3=9,7 + NH3— радикале группы
Основные а-аминокислоты имеют изоэлектрическую точку выше рН 7. В сильнокислой среде они также представляют собой трехосновные кислоты, этапы ионизации которых выглядят следующим образом:
Дикатион катион биполярный ион анион
Свойство аминокислот диссоциировать на ионы в кислой или щелочной среде лежит в основе методов разделения и идентификации их ионообменной хроматографией и электрофорезом (см. главу 6 ).
В чем заключается амфотерность свойств аминокислот приведите доказательства
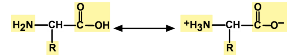
Соединения, которые подобно аминокислотам содержат в своей молекуле как основную, так и кислотную группы, называют амфотерными. Они существуют главным образом в виде ионов, у которых основная часть несет положительный заряд, а кислотная — отрицательный.
Это так называемые биполярные ионы, или цвиттерионы. Амфотерность объясняет способность аминокислот и белков перемещаться в электрическом поле, что используется, например, для их разделения методов электрофореза.
Заряд аминокислоты может изменяться под влиянием среды. Так, при подкислении раствора, с возрастанием концентрации ионов водорода, растет и положительный заряд аминокислоты, отрицательный же соответственно нейтрализуется.
Связи, встречающиеся в молекулах белков
Молекулы белков строятся из соединяющихся друг с другом аминокислот. Соединение происходит в результате образования так называемой пептидной связи. Возникшая белковая молекула затем свертывается и принимает свойственную ей форму благодаря образованию четырех других видов связей — ионных, дисульфидных, водородных связей и гидрофобных взаимодействий. Знакомство с природой этих связей необходимо для понимания структуры и поведения белков.
Пептидная связь
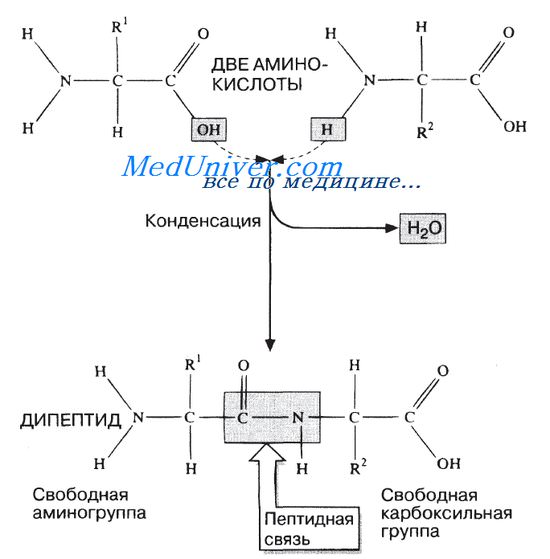
Эта связь образуется в результате выделения молекул воды при взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой. Реакция, идущая с выделением воды, называется реакцией конденсации, а возникающая ковалентная азот-углеродная связь — пептидной связью.
Соединение, образующиеся в результате конденсации двух аминокислот, представляет собой дипептид. На одном конце его молекулы находится свободная аминогруппа, а на другом — свободная карбоксильная группа. Это позволяет ему присоединять к себе другие аминокислоты. Если таким образом соединяется много аминокислот, то образуется полипептид.
Конспект лекции по теме «Аминокислоты как амфотерные бифункциональные соединения»
Тема: Аминокислоты как амфотерные бифункциональные
Аминокислоты — это органические соединения, содержащие две функциональные группы — аминогруппу (— NH 2 ) и карбоксилъную группу (- СООН).
Их можно рассматривать как производное карбоновых кислот, в радикале которых атом водорода замещен на аминогруппу рис.
уксусная кислота аминоуксусная кислота
Количество функциональных групп, которые могут входить в состав аминокислот, различно.
Простейшими аминокислотами являются одноосновные моноаминокислоты, состав которых выражают общей формулой
Номенклатура. Названия аминокислот образуют от названий соответствующих карбоновых кислот с добавлением слова «амино-» и указанием места расположения аминогруппы:
по рациональной номенклатуре атом углерода, расположенный рядом (соседний) с карбоксильной группой, обозначают буквой а;
по систематической номенклатуре нумеруют углеродную цепь, начиная с атома углерода карбоксильной группы. Многие аминокислоты имеют тривиальное название. На практике чаще используют тривиальную номенклатуру. Наибольшее значение имеют а-аминокислоты, так как они участвуют в построении белковых молекул.
Состав а-аминокислот можно выразить общей формулой:
Физические свойства. Аминокислоты представляют собой бесцветные кристаллические вещества, хорошо растворимые в воде и малорастворимые в органических растворителях. Многие кислоты имеют сладкий вкус. При температуре 250—300 °С они разлагаются.
Химические свойства. Аминокислоты содержат в своем составе две функциональные группы противоположного характера. Аминогруппа обуславливает основные свойства аминокислот, а карбоксильная группа — кислотные. Следовательно, по аналогии с неорганическими веществами (гидроксиды алюминия, цинка), аминокислоты — это органические амфотерные соединения.
основные свойства кислотные свойства
(свойства аминов) (свойства карбоновых кислот)
Как кислоты они взаимодействуют с активными металлами, оксидами и гидроксидами металлов, солями слабых летучих кислот, а также со спиртами (реакция этерификации):
Реакции с участием аминогруппы
Как основания аминокислоты реагируют с кислотами
гидрохлорид (хлороводородная соль)
Особые свойства аминокислот. Наличие в молекуле аминокислоты двух функциональных групп приводит к появлению новых свойств.
Взаимодействие внутри молекулы. Водные растворы аминокислот могут иметь нейтральную, щелочную или кислую среду в зависимости от того, сколько они содержат амино- и карбоксильных групп. Это объясняется тем, что при растворении в воде карбоксильная группа отщепляет ион водорода, который присоединяется к аминогруппе, т. е. протекает внутримолекулярная нейтрализация (кислота + основание). Это приводит к образованию внутренней соли, молекула которой представляет собой биполярный ион:
внутренняя соль (биполярный ион)
Взаимодействие аминокислот друг с другом (реакции конденсации). Молекулы аминокислот могут реагировать друг с другом. При этом происходит взаимодействие карбоксильной группы одной молекулы и аминогруппы другой молекулы. Реакция конденсации сопровождается отщеплением молекулы воды и образованием пептида. При конденсации двух молекул аминокислоты образуется дипептид:
Пептиды — это органические соединения, состоящие из остатков а-аминокислот, соединенных между собой пептидными (амидными) связями — CO — NH — и имеющие невысокие значения относительных молекулярных масс (до 10000).
Например, природный пептид окситоцин (стимулирует выделение молока молочными железами) имеет относительную молекулярную массу 1007, а инсулин (регулирует содержание сахара в крови) — 5734.
Пептиды являются продуктами частичного гидролиза белков, т. е. это простейшие полипептиды. Они, в кислой или щелочной среде, а также под действием ферментов, подвергаются дальнейшему гидролизу с образованием пептидов с меньшей относительной молекулярной массой или а-аминокислот.
Пептиды, как и белки, играют важную роль в процессах жизнедеятельности. Пептидами являются многие гормоны, некоторые антибиотики и токсины, ферменты. Многие пептиды применяют в медицине и сельском хозяйстве.
Получение аминокислот. Биологически важные (природные) а-аминокислоты получают гидролизом белков.
Значение аминокислот. Биологическое значение а-аминокислот определяется тем, что они являются структурными единицами («кирпичиками»), из которых построены все растительные и животные белки. Поступая вместе с пищей в организм, белки расщепляются на составные а-аминокислоты, которые используются организмом для синтеза белков, свойственных данному организму.
В связи с этим аминокислоты делят на заменимые и незаменимые.
Заменимые — это аминокислоты, которые синтезируются в организме . К ним относятся: глицин, аланин, глутаминовая кислота, серин, аспарагиновая кислота и др.
Незаменимые — это аминокислоты, которые не синтезируются в организме и поступают только с пищей . Это лизин, валин, фенилаланин, триптофан, лейцин и др. Их недостаток в пище приводит к нарушению многих функций организма и может быть причиной прекращения роста организма, истощения, несмотря на достаточную калорийность питания.
Например, белок кукурузы зеин не содержит лизина. В опытах с животными, которые получали с пищей один только этот белок, наблюдалась, несмотря на обильное кормление, потер веса. Отсутствие в пище триптофана может быть причиной тяжелого заболевания глаз — катаракты.
Поэтому эти аминокислоты нужно добавлять в пищу, так как организм может усваивать их в свободном виде. Необходимо добавлять недостающие аминокислоты и в корм животным. Даже малые их дозы позволяют ускорить рост животных и снизит расход кормов.
Аминокислоты находят применение и в пищевой промышленности. Например, глутаминовую кислоту добавляют в консервы и пищевые концентраты для улучшения вкуса.
Напишите уравнение реакции поликонденсации этой кислоты.
Отличие этих полимеров от белков (полипептидов) заключается в том, что здесь цепь образована не а-аминокислотами.
1. Составьте структурные формулы изомерных аминокислот состава C 4 H 9 О 2 N назовите их.
2. Докажите амфотерность а-аминопропионовой кислоты (напишите не мене трех уравнений).
4. Напишите уравнения реакций получения:
а) хлороводородной соли а-аминомасляной кислоты;
б) аминоуксусной кислоты из ацетилена.
5. При взаимодействии четырех молекул аминокислот выделяется молекул воды:
а) три; б) две; в) четыре; г) одна.
6. Определите формулу одноосновной моноаминокарбоновой кислоты, входящей в состав белков, для полной нейтрализации которой потребовался раствор, содержащий 16,2 г бромоводородной кислоты.
7. Для полной нейтрализации смеси уксусной и аминоуксусной кислот требуется 150 мл 2М раствора гидроксида натрия. Исходная смесь может прореагировать с 73 г 10%-ного раствора соляной кислоты. Определите массовые доли (%) веществ в исходной смеси.