В чем заключается главная особенность внутреннего строения кристаллов физика 7 класс
Поверхность кристаллов ограничена плоскостями, которые носят название граней.
Места соединения граней называются рёбрами, точки пересечения которых называются вершинами или углами.
В чём заключается причина броуновского движения?
В чём заключается причина броуновского движения.
В чём заключается смысл «золотого правила механики»?
В чём заключается смысл «золотого правила механики».
4 основные особенности строения вещества?
4 основные особенности строения вещества.
2). В чём заключается принцип Гюйгенса?
В чём разница между внутренней энергией системы и энтальпией системы?
В чём разница между внутренней энергией системы и энтальпией системы?
Обясните на основании внутреннего строения электрическое мопротивление?
Обясните на основании внутреннего строения электрическое мопротивление?
Каково внутреннее строение жидкости и газов?
Каково внутреннее строение жидкости и газов?
В чём заключается одна из трудностей при осуществлении термоядерных реакций?
В чём заключается одна из трудностей при осуществлении термоядерных реакций?
Какова особенности строения кристаллических твердых тел?
Какова особенности строения кристаллических твердых тел.
Здесь будет правильный ответ 16 Ом.
См. прикрепленный файл.
Объем = массу / плотность плотность стекла = 2500кг / м3 объём = 12, 5 / 2500 = 0, 005м3.
Внутреннее строение кристаллов
Давно предполагали, что внешняя форма кристалла является лишь отображением его скрытого внутреннего строения и обусловлена правильным расположением частиц — молекул или атомов, составляющих кристалл, в строго определенных точках пространства.
Вся совокупность таких точек образует так называемую пространственную (кристаллическую) решетку той или иной формы, служащую геометрическим выражением структуры кристаллического вещества (рис. 2); точки, в которых расположены частицы, называются узлами решетки.
Доказать правильность этих представлений удалось сравнительно недавно, лишь после того, как было установлено, что рентгеновы лучи отклоняются при прохождении сквозь кристалл и что по величине отклонения можно судить о расположении частиц кристалла.
Вслед за тем были разработаны очень точные И удобные методы исследования кристаллов при помощи рентге новых лучей, получившие в настоящее время широкое распространение не только в научных лабораториях, но и на производствах, особенно в металлургии.
Рентгеновские лучи в изучении строения кристаллов
Применение для изучения кристаллов рентгеновых лучей дало возможность определить характер пространственной решетки многих кристаллов. Важным результатом этих исследований явилось открытие, что в узлах решетки многих сложных веществ (например, солей) находятся не молекулы, а отдельные положительно и отрицательно заряженные ионы.
В связи с этим различают четыре основных вида решеток: молекулярные, атомные, ионные и металлические.
Молекулярные решетки характеризуются тем, что в узлах их находятся молекулы. Такие решетки образуют соединения неполярного или малополярного типа и вообще соединения с атомной связью.

Структурными единицами атомной решетки являются нейтральные атомы, ковалентно связанные друг с другом. Решетки такого рода свойственны некоторым простым веществам, например алмазу.
Ионные решетки с чередующимися в узлах положительными и отрицательными ионами характерны для соединений, построенных по ионному типу; к ним относятся почти все соли, многие окислы и некоторые другие вещества.
Наконец, особое строение имеют решетки металлов. Узлы таких решеток заняты не нейтральными атомами, а положительными ионами, в промежутках между которыми находятся свободные, легкоподвижные электроны. Подробнее о металлических решетках будет сказано при описании металлов.
Различие решетками
Различие между молекулярными, атомными и ионными решетками обусловливается не только типом образующих их частиц, но и характером взаимодействия последних. Кулоновские силы, действующие между положительно и отрицательно заряженными ионами в ионных структурах, создают значительно более прочную связь между частицами, чем силы, связывающие-электронейтральные атомы или молекулы.
Поэтому температура плавления и твердость ионных соединений обычно гораздо выше, чем у веществ, образованных полярными или неполярными молекулами.
Прочность связи между частицами, образующими кристалл, характеризуется величиной работы, которую нужно затратить для разрушения решетки и удаления составляющих ее частиц на такие расстояния, на которых уже можно пренебречь их взаимодействием. Эта работа носит название энергии кристал лической решетки. Ее относят к одному молю вещества и выражают в больших калориях.
Так, например, для разложения 1 моля NaCl на свободные газообразные ионы надо затратить 185 ккал
[NaCl] = [Na] + + [Cl] — — 185 ккал
Очевидно, что при образовании 1 моля NaCl из свободных газообразных ионов должно выделиться такое же количество энергии.
Физические свойства кристаллов
Физические свойства твердого вещества находятся в теснейшей зависимости от вида кристаллической решетки, т. е. от вида и характера связи между ее структур ными единицами.
По своей структуре решетки могут быть чрезвычайно разнообразны. Наименьшая часть решетки, которая еще передает все характерные особенности ее структуры, называется элементарной ячейкой. В общем случае ячейка имеет форму параллелепипеда и содержит определенное число частиц. Весь кристалл состоит из огромного числа таких ячеек, приложенных друг к другу.
Как при укладке кирпичей вплотную друг к другу совершенно не обязательно, чтобы внешняя форма сооружения повторяла форму кирпича, так и в случае кристалла форма его отнюдь еще не определяет форму кристаллической ячейки. Однако о форме ячейки можно судить по характеру кристаллографических осей.

Наиболее простое строение имеют решетки кристаллов правильной системы, элементарная ячейка которых представляет собой куб.
На рис. 3 изображена часть кубической решетки хлористого натрия NaCl, а именно ее элементарная ячейка, выделенная из целого кристалла, чтобы показать, как она заполнена ионами внутри кристалла.
В узлах решетки находятся ионы хлора и ионы натрия, расположенные так, что каждый ион хлора окружен шестью ионами натрия и каждый ион натрия шестью ионами хлора. В этом легко убедиться, если представить решетку продолженной во все стороны.
Характерно, что ионы натрия и хлора не связаны здесь попарно друг с другом: в кристалле нет ничего, что соответствовало бы молекуле NaCl. Подобное же строение имеют кристаллы других солей. Отсюда следует, что строго установленное в химии понятие о молекулах газообразных веществ не применимо к твердым кристаллическим веществам, образующим ионные решетки.
Структура солей кристаллов
При рассмотрении структуры солей и других соединений, образующих ионные решетки, невольно возникает вопрос: могут ли вообще существовать молекулы этих соединений, раз их кристаллы состоят из ионов? На этот вопрос надо ответить утвердительно, так как определение плотности паров различных солей при высоких температурах показывает, что эти пары состоят из молекул, а не из ионов.
Очень важной величиной, характеризующей кристалл. является константа его решетки d, указывающая наименьшее расстояние между центрами двух соседних частиц в элементарной ячейке и определяемая обычно рентгенометрическим путем. Для кубической решетки константа может быть легко вычислена, если известна длина ребер элементарного куба.
Так, например, у кристаллов хлористого натрия длина ребра куба а,определенная рентгенометрическим путем, равна 5,628 ангстрема, а кратчайшее расстояние между ионами натрия и хлора равно половине этой величины, т. е. d= 2,814 ангстрема.
Статья на тему Внутреннее строение кристаллов
Похожие страницы:
Понравилась статья поделись ей
 masterok
masterok
Мастерок.жж.рф
Хочу все знать
Всем специалистам в области кристаллографии или физики твердого тела совершенно ясно, что в случае кристалла мы имеем дело с упорядоченным расположением в пространстве атомов или ионов. В некоторых случаях, например в кристаллах льда или отвержденных газов, речь может идти о молекулах. Для краткости далее будем говорить только об атомах, в том числе ионизированных (ионах), если не оговаривается что-нибудь другое.
Итак, кристалл — это упорядоченная в пространстве система атомов. Они расположены правильным образом и чаще всего так, чтобы максимально плотно заполнить объем пространства. Попытавшись расположить вплотную друг к другу стальные шарики от шарикоподшипника, мы получим вполне приличную модель кристаллического строения и быстро убедимся, что число способов, которыми можно разместить шарики, ограничено. В зависимости от того, как расположены относительно друг друга атомные ряды и атомные плоскости, могут быть получены разные типы кристаллов. В свою очередь тип расположения атомов определяется их взаимодействием между собой, природой связи между частицами.
Аккуратное разламывание кристаллов приводит к появлению необычных структур с интересными свойствами. Сначала появляются крупные области с положительным или отрицательным поверхностным зарядом, создающие мощное электрическое поле, а затем они переходят в лабиринты шириной всего в несколько атомов.
Многие свойства ионных кристаллов обусловлены их структурой на атомарном масштабе: положительно и отрицательно заряженные атомы притягиваются друг к другу и образуют прочную периодическую решетку. Однако на поверхности кристалла заряды должны быть скомпенсированы. «Если расщепить кристалл с кубической решеткой вдоль определенных направлений, то можно получить заряды только одного типа, — поясняет один из авторов работы Ульрих Дибольд из Венского университета. — Такая конфигурация крайне нестабильна». Потенциально такой слой мог бы на крошечном образце создавать поле с напряжением в миллионы вольт. Такую ситуацию ученые называют «поляризационной катастрофой».
В новом исследовании физики пытались понять, как именно атомы реорганизуются, чтобы не допустить поляризационной катастрофы. «Поверхность может по-разному измениться в ответ на разлом, — говорит первый автор статьи Мартин Сетвин. — Электроны могут начать накапливаться в определенных местах, кристаллическая решетка может исказиться или молекулы из воздуха могут налипнуть на поверхность, меняя ее свойства».
Ученые раскалывали кристаллы танталата калия KTaO3 при низких температурах и получали сколы, при которых половина атомов из слоя с одинаковыми зарядами оставалось на одном обломке, а вторая — на другом. Области с ионами одинакового заряда формировали «островки», хотя в среднем поверхность оказывалась нейтральной. «Тем не менее, островки достаточно велики, поэтому поляризационной катастрофы не удается полностью избежать — создаваемое ими поле настолько велико, что оно меняет свойства нижележащих слоев», — рассказал Сетвин.
При небольшом повышении температуры островки распались на лабиринт из ломаных линий, причем его «стены» были высотой всего в один атом и шириной в 4-5 атомов.
«Лабиритнообразные структуры не только прекрасны, но и потенциально полезны, — подытожил Дибольд. — Этот как раз то, что нужно — сильные электрические поля на атомном масштабе». Одним из возможных применений авторы называют проведение химических реакций, которые не проходят в других условиях, например, расщепление воды для получения водорода.
Основные свойства кристаллов – анизотропность, однородность, способность к самоогоранению и наличие постоянной температуры плавления определяются их внутренним строением.
Анизотропность
Это свойство называется еще неравносвойственностью. Выражается она в том, что физические свойства кристаллов (твердость, прочность, теплопроводность, электропроводность, скорость распространения света) неодинаковы по разным направлениям. Частицы, образующие кристаллическую структуру по непараллельным направлениям, отстоят друг от друга на разных расстояниях, вследствие чего и свойства кристаллического вещества по таким направлениям должны быть различными. Характерным примером вещества с ярко выраженной анизотропностью является слюда. Кристаллические пластинки этого минерала легко расщепляются лишь по плоскостям, параллельным его пластинчастости. В поперечных же направлениях расщепить пластинки слюды значительно труднее.
Анизотропность проявляется и в том, что при воздействии на кристалл какого-либо растворителя скорость химических реакций различна по различным направлениям. В результате каждый кристалл при растворении приобретает свои характерные формы, носящие название фигур вытравливания.
Аморфные вещества характеризуются изотропностью (равносвойственностью) – физические свойства по всем направлениям проявляются одинаково.
Однородность
Выражается в том, что любые элементарные объемы кристаллического вещества, одинаково ориентированные в пространстве, абсолютно одинаковы по всем своим свойствам: имеют один и тот же цвет, массу, твердость и т.д. таким образом, всякий кристалл есть однородное, но в то же время и анизотропное тело.
Однородность присуща не только кристаллическим телам. Твердые аморфные образования также могут быть однородными. Но аморфные тела не могут сами по себе принимать многогранную форму.
Способность к самоогранению
Способность к самоогранению выражается в том, что любой обломок или выточенный из кристалла шарик в соответствующей для его роста среде с течением времени покрывается характерными для данного кристалла гранями. Эта особенность связана с кристаллической структурой. Стеклянный же шарик, например, такой особенностью не обладает.
Кристаллы одного и того же вещества могут отличаться друг от друга своей величиной, числом граней, ребер и формой граней. Это зависит от условий образования кристалла. При неравномерном росте кристаллы получаются сплющенными, вытянутыми и т.д. Неизменными остаются углы между соответственными гранями растущего кристалла. Эта особенность кристаллов известна как закон постоянства гранных углов. При этом величина и форма граней у различных кристаллов одного и того же вещества, расстояние между ними и даже их число могут меняться, но углы между соответствующими гранями во всех кристаллах одного и того же вещества остаются постоянными при одинаковых условиях давления и температуры.
Закон постоянства гранных углов было установлен в конце XVII века датским ученым Стено (1699) на кристаллах железного блеска и горного хрусталя, впоследствии этот закон был подтвержден М.В. Ломоносовым (1749) и французским ученым Роме де Лиллем (1783). Закон постоянства гранных углов получил название первого закона кристаллографии.
Закон постоянства гранных углов объясняется тем, что все кристаллы одного вещества тождественны по внутреннему строению, т.е. имеют одну и ту же структуру.
Согласно этому закону кристаллы определенного вещества характеризуются своими определенными углами. Поэтому измерением углов можно доказать принадлежность исследуемого кристалла к тому или иному веществу. На этом основан один из методов диагностики кристаллов.
Для измерения у кристаллов двугранных углов были изобретены специальные приборы – гониометры.
Постоянная температура плавления
Выражается в том, что при нагревании кристаллического тела температура повышается до определенного предела; при дальнейшем же нагревании вещество начинает плавиться, а температура некоторое время остается постоянной, так как все тепло идет на разрушение кристаллической решетки. Температура, при которой начинается плавление, называется температурой плавления.
Аморфные вещества в отличие от кристаллических не имеют четко выраженной температуры плавления. На кривых охлаждения (или нагревания) кристаллических и аморфных веществ, можно видеть, что в первом случае имеются два резких перегиба, соответствующие началу и концу кристаллизации; в случае же охлаждения аморфного вещества мы имеем плавную кривую. По этому признаку легко отличить кристаллические вещества от аморфных.
Прочность кристаллов
Проблема прочности кристаллов была и остается одной из самых важных в современных технике. Дело в том, что широко используемые конструкционные материалы в большей части представляют собой сплавы железа (сталь), алюминия (силумин, дюралюминий), меди (латунь, бронза) и некоторых других металлов, и все они имеют кристаллическое строение. В случае металлов мы редко имеем дело с такими правильными и красивыми кристаллами, о которых шла речь раньше. Металлические сплавы имеют так называемое поликристаллическое строение, то есть состоят из отдельных зерен — кристаллов, несколько развернутых друг относительно друга.
Шаг за шагом человек переходил от менее прочного материала к более прочному, это вело к совершенствованию всей используемой техники и расширению ее возможностей. Сейчас в борьбе за прочность счет идет уже только на проценты; из технических материалов выжато практически все, что можно, и каждый последующий шаг дается со все большим трудом.
Лет двадцать назад казалось, что если научиться выращивать бездефектные кристаллы большого размера, то проблема прочности будет полностью решена, а расход металла в сотни раз сократится. К сожалению, эти надежды не сбылись. Вырастить идеальный кристалл большого размера или очень дорого, или невозможно. Только в таких областях, как радиоэлектроника, это можно себе позволить. Например, полупроводниковые кристаллы Ge и Si выращиваются практически бездефектными. Такими же являются и рубиновые кристаллы для лазеров. Что же касается конструкционных материалов, то здесь пока приходится достигать высоких значений прочности, идя традиционным путем.
И еще одно важное заключение. Оказывается, что многие физические свойства кристаллов, в первую очередь их прочность, определяются не идеальной кристаллической решеткой, а отклонениями от идеальности — дефектной структурой. Умелое использование таких пороков кристалла позволяет управлять его свойствами и приспосабливать их к разнообразным требованиям современной техники. Для физика или инженера дефекты являются очень важной составной частью кристалла, без которой он практически не может существовать. Но тема дефектов в кристаллах заслуживает более глубокого и всестороннего обсуждения, чем то, которое возможно в этой статье.
Внутреннее строение кристаллов и основные типы
Кристаллических решеток
Весьма тонкие современные методы исследования кристаллического состояния вещества подтвердили, что частицы в кристаллах (атомы, молекулы, ионы) располагаются закономерно, образуя так называемую пространственную решетку кристалла. Внешняя геометрическая форма кристалла теснейшим образом связана с его внутренней структурой. В кристаллической решетке любого тела можно выделить определенную часть, которая носит название элементарной ячейки. Она представляет собой наименьший объем кристаллической решетки вещества, который точно отражает его химический состав и все особенности внутренней структуры данного кристалла.
Важнейшей особенностью кристаллических образований является их способность самоограняться. Так, при выделении кристаллического вещества из раствора или из расплавленной массы оно принимает геометрическую форму определенных кристаллов с явно выраженными плоскими гранями. При достаточно сильном ударе крупные кристаллы распадаются на ряд более мелких кристаллов, которые ограничены плоскостями, пересекающимися между собой под определенным углом. Эта способность кристаллов раскалываться на слои по определенным плоскостям носит название спайности.Как известно, у аморфных тел это свойство отсутствует – поверхность излома их бывает неровной, раковистой.
Во внутреннем строении кристаллов выполняется принцип плотнейшей упаковки частиц, из которых состоит данный кристалл. Под действием сил взаимного притяжения частицы стремятся разместиться как можно ближе друг к другу (следует иметь в виду, что при чрезмерном сближении частиц в кристалле проявляются силы отталкивания). Поэтому наиболее энергетически выгодно такое взаимное расположение частиц в кристалле, которое, отвечает их наиболее плотной упаковке. Промежутки между ними достигают минимума. При этом могут иметь место два случая.
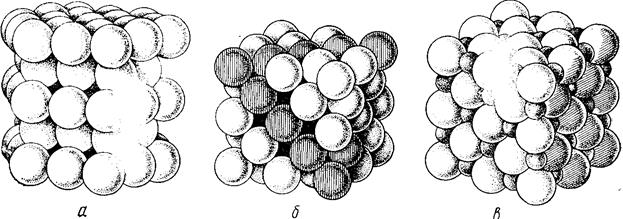
1. Радиусы частиц, из которых состоит кристалл, равны или очень близки по величине. Этому условию отвечают два типа кристаллических решеток: гексагональная (рис. 3.6 а) и гранецентрированная кубическая (рис. 3.6 б). В таких решетках степень заполнения объема кристалла частицами составляет 74%. Это максимально плотная упаковка частиц одинакового или близких по величине радиусов. Подобный тип решеток свойствен большинству металлов.
2. Радиусы частиц, образующих кристаллы, сильно различаются. Принцип плотнейшей упаковки применим и в этом случае. Частицы, более крупных размеров в основном образуют кубическую или гексагональную сетку, а более мелкие частицы занимают свободное пространство между ними. Этот тип решетки характерен для ионных кристаллов, поскольку разные ионы довольно резко отличаются друг от друга по радиусам; например, такова структура кристалла хлорида натрия (рис. 3.6 в).
Рис. 3.6 Плотная упаковка одинаковых сфер
Следует отметить, что наряду с соотношением размеров частиц на структуру кристалла оказывают известное влияние и поляризационные взаимодействия между ними.
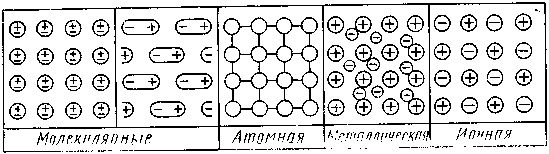
С точки зрения структурных элементов и действующих между ними сил различают четыре типа кристаллов: молекулярные, атомные, ионные и металлические.
Молекулярная решетка.Молекулярные кристаллы имеют в углах пространственной решетки полярные или неполярные молекулы, связанные между собой силами Ван-дер-Ваальса. В качестве примера можно указать на твердую двуокись углерода (сухой лед), нафталин, лед. На рисунке 3.7 показано строение элементарной ячейки твердого диоксида углерода. Как видим, атомы углерода образуют кубическую решетку с центрированными гранями: атомы кислорода расположены по обе стороны от углерода на отрезках прямых, ориентированных определенным образом относительно ребер элементарной ячейки.
Поскольку силы взаимодействия между молекулами сравнительно слабы, то и вещества с данным типом решетки обладают малой твердостью, низкими температурами плавления и кипения. Растворы этих веществ, как правило, имеют сравнительно малую электрическую проводимость.
Атомная решетка.В узлах кристаллических решеток этого типа расположены нейтральные атомы, определенным образом ориентирован-ные в пространстве и связанные ковалентными связями. К числу веществ с атомной решеткой относятся, например, кремний, графит, алмаз, бор и др. Ковалентная связь, как известно, очень прочная, поэтому все связи в кристалле равноценны и очень прочны. Вещества, образованные атомными решетками, имеют большую твердость, высокую температуру плавления, малую растворимость и малую летучесть.
Рис. 3.7. Элементарная ячейка кристалла СО2
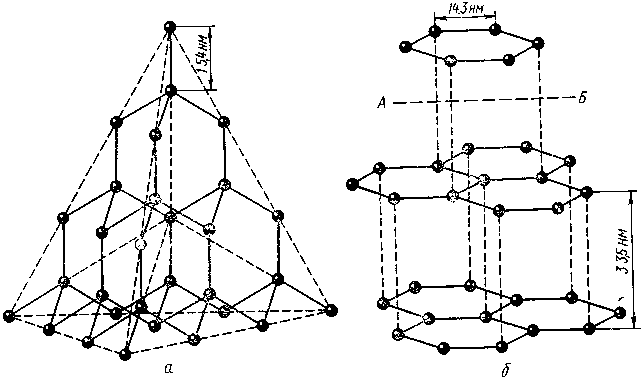
На рисунке 3.8 приведены схемы строения атомных решеток алмаза и графита. В силу своеобразия структуры графит имеет очень малую прочность связи по плоскостям спайности кристалла, тогда как алмаз обладает огромной твердостью, поскольку все атомы углерода в его кристаллической решетке расположены друг от друга на одинаковом расстоянии.
Ионная решетка. Ионные кристаллы имеют в узлах пространственных решеток положительно и отрицательно заряженные ионы, которые связаны между собой электростатическими силами притяжения разно-именных зарядов. Силы взаимодействия в ионных кристаллах весьма значительны, благодаря чему вещества с ионным типом решетки обладают высокой прочностью, высокими температурами плавления и малой летучестью.
Рис. 3.8. Кристаллические решетки: а – алмаза; б – графита;
АБ – направление расположения плоскости спайности
Ионные решетки характерны для большинства неорганических соединений (соли, оксиды и другие классы соединений). Многие минералы также имеют ионное строение. Так, кристаллы, имеющие ионную решетку, как правило, хорошо растворимы в воде, а растворы их обладают высокой электрической проводимостью. В твердом виде ионные кристаллы не проводят электрический ток, так как в них электроны прочно удерживают-ся в атомных орбиталях отдельных ионов. В расплавленном состоянии кристаллические вещества проводят электрический ток, причем проводимость осуществляется за счет переноса ионов. Электрическая проводимость расплавов является характерным свойством любых ионных структур.
Металлическая решетка. Этот тип кристаллических решеток отличается от всех рассмотренных выше типов структур. Согласно современным представлениям, в узлах пространственной решетки типич-ных металлов в основном находятся положительно заряженные ионы, упакованные по принципу плотнейшей упаковки шаров, а в промежутках между ними находятся электроны в свободном состоянии. Последние образуют своеобразный «электронный газ», который как бы скрепляет одноименно заряженные ионы металла в плотнейшую кристаллическую решетку. С другой стороны, и сами электроны удерживаются катионами металла, в силу чего они не могут свободно покинуть кристаллическую решетку.
Рис. 3.9. Плоскостные схемы кристаллических решеток различных типов
Именно наличием свободных электронов объясняется хорошая электрическая проводимость и теплопроводность, а также многие химические свойства металлов.
Металлы, как известно, от всех известных природных материалов отличаются высокой прочностью наряду с хорошей пластичностью как в холодном, так и в горячем состоянии. Высокая температура плавления металлов указывает на значительную прочность металлической решетки и также объясняется наличием «электронного газа» в нем.
Под влиянием разности потенциалов электроны в металле начинают передвигаться в определенном направлении, что является причиной возникновения электрического тока.
На рисунке 3.9 приведены плоскостные схемы всех рассмотренных типов кристаллических решеток. Однако, принимая такую классификацию кристаллов, всегда нужно иметь в виду, что характер разных связей даже в одном и том же кристалле может быть не одинаковым и классифи-кационные признаки не всегда четко и хорошо выражены. Наряду с кристаллами, относящимися к одному из четырех рассмотренных видов связи, существуют кристаллы с различными переходными и смешанными формами связи. Это, например, целиком относится к кристаллогидратам, в которых встречаются одновременно ионный тип связи между катионами и анионами соли, ковалентная связь между атомами, входящими в состав аниона, а также полярные связи внутри молекул воды и ионоди-польная связь молекул с ионами.
Значительный интерес представляют кристаллы, образующие так называемые слоистые решетки, которые характерны для графита, слюд и глинистых минералов.








 masterok
masterok