В чем заключается отличие конъюгированных и субъединичных вакцин ответ
Различные типы вакцин против COVID-19
Данная статья входит в серию публикаций, посвященных разработке и распределению вакцин. Узнайте больше о вакцинах, о принципах их действия и о том, как обеспечивается их безопасность и справедливое распределение, в серии публикаций ВОЗ «Все о вакцинах».
По состоянию на декабрь 2020 г. разрабатывается более 200 вакцин-кандидатов против COVID-19. Из них по меньшей мере 52 вакцины-кандидата проходят исследования с участием людей. Несколько других вакцин в настоящее время находятся на этапах I/II и в ближайшие месяцы перейдут на этап III (для получения дополнительной информации об этапах клинических исследований см. третью часть нашего обзора Как разрабатывают вакцины?).
Зачем разрабатывать так много вакцин?
Как правило, все многочисленные вакцины-кандидаты, прежде чем какие-либо из них будут признаны безопасными и эффективными, должны пройти тщательные клинические исследования. Например, из всех вакцин, которые исследуются в лабораториях и испытываются на лабораторных животных, достаточно эффективными и безопасными для того, чтобы перейти к их клиническим исследованиям с участием людей, будут признаны примерно семь из ста. Из вакцин, которые достигают стадии клинических исследований, успешной оказывается только одна из пяти. Наличие большого количества различных вакцин в разработке повышает вероятность того, что одна или несколько вакцин будут признаны безопасными и эффективными для иммунизации приоритетных групп населения.
Различные типы вакцин
Различают три основных подхода к разработке вакцин в зависимости от того, что используют для иммунизации: цельный вирус или бактерию; фрагменты микроорганизма, вызывающие иммунный ответ; только генетический материал, содержащий код для синтеза конкретных белков, а не цельный вирус.
Инактивированная вакцина
В первом способе создания вакцины используются болезнетворные вирус или бактерия, или очень похожие на них микроорганизмы, которые инактивируют (убивают) с помощью химических реагентов, тепла или радиации. Этот метод основывается на технологиях, которые, как было доказано, эффективно защищают человека, – они применяются для изготовления вакцин против гриппа и полиомиелита – и позволяет наладить достаточно масштабное производство вакцин.
Однако для его применения требуются специальные лабораторные помещения, в которых можно безопасно выращивать вирус или бактерию, цикл производства может быть относительно длительным, а для иммунизации, скорее всего, потребуется введение двух или трех доз.
Живая ослабленная вакцина
В живой вакцине используется ослабленный или очень похожий вирус. Примеры вакцин этого типа – вакцина против кори, эпидемического паротита и краснухи (КПК) и вакцина против ветряной оспы и опоясывающего лишая. В этом способе используется технология, аналогичная получению инактивированной вакцины, и он может применяться для массового производства. Однако вакцины этого типа могут оказаться неприемлемыми для людей с ослабленной иммунной системой.
Вирусная векторная вакцина
В этом виде вакцины используется безопасный вирус, который доставляет специфические субэлементы (белки) соответствующего микроорганизма, благодаря чему вакцина способна активировать иммунный ответ, не вызывая болезни. С этой целью в безопасный вирус вводится код для формирования определенных частей соответствующего патогена. Такой безопасный вирус затем используется в качестве платформы или вектора для доставки в клетки организма белка, который активирует иммунный ответ. Примером этого типа вакцин, которые могут быть разработаны в короткие сроки, является вакцина против Эболы.
Субъединичные вакцины
В субъединичных вакцинах используются только специфические фрагменты (субъединицы) вируса или бактерии, которые иммунная система должна распознать. Они не содержат цельных микроорганизмов или безопасных вирусов в качестве вектора. В качестве субъединиц могут использоваться белки или сахара. Большинство вакцин, применяемых в календаре детских прививок, являются субъединичными и защищают от таких болезней, как коклюш, столбняк, дифтерия и менингококковый менингит.
Вакцины на основе генетического материала (нуклеиновых кислот)
В отличие от вакцин на основе ослабленных или нежизнеспособных цельных микроорганизмов или их фрагментов, в вакцине на основе нуклеиновых кислот используется участок генетической структуры, содержащий программу для генерации специфических белков, а не цельный микроорганизм. ДНК и РНК содержат код, который используется клетками нашего организма для выработки белков. При этом ДНК сначала превращается в информационную РНК, которая затем используется в качестве программы для продуцирования специфических белков.
Вакцина на основе нуклеиновой кислоты доставляет в клетки нашего организма определенный набор инструкций в виде ДНК или мРНК, побуждая их синтезировать нужный специфический белок, который иммунная система нашего организма должна распознать и дать на него иммунный ответ.
Технология с использованием генетического материала представляет собой новый способ получения вакцин. До пандемии COVID-19 ни одна из них еще не прошла через все стадии процесса одобрения для введения людям, хотя некоторые ДНК-вакцины, в том числе для определенных видов рака, проходили исследования с участием людей. Из-за пандемии исследования в этой области продвигались очень быстро, и на некоторые вакцины против COVID-19 на основе мРНК выдаются разрешения для использования в чрезвычайных ситуациях; а это означает, что теперь они могут вводиться людям, а не только использоваться в клинических исследованиях.
Виды вакцин
Открытие метода вакцинации дало старт новой эре борьбы с болезнями.
В состав прививочного материала входят убитые или сильно ослабленные микроорганизмы либо их компоненты (части). Они служат своеобразным муляжом, обучающим иммунную систему давать правильный ответ инфекционным атакам. Вещества, входящие в состав вакцины (прививки), не способны вызвать полноценное заболевание, но могут дать возможность иммунитету запомнить характерные признаки микробов и при встрече с настоящим возбудителем быстро его определить и уничтожить.
Производство вакцин получило массовые масштабы в начале ХХ века, после того как фармацевты научились обезвреживать токсины бактерий. Процесс ослабления потенциальных возбудителей инфекций получил название аттенуации.
Сегодня медицина располагает более, чем 100 видами вакцин от десятков инфекций.
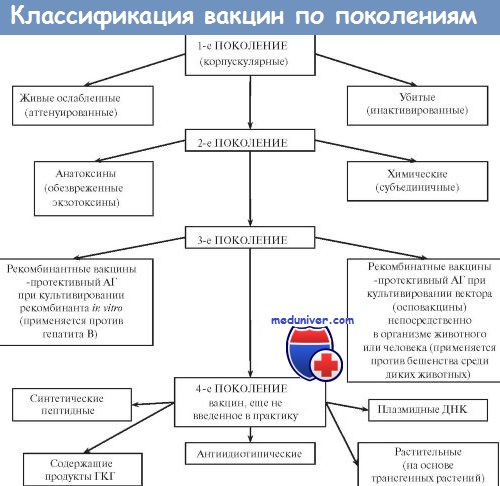
Препараты для иммунизации по основным характеристикам делятся на три основных класса.
В последние годы появился еще один вид вакцин — молекулярные. Материалом для них становятся рекомбинантные белки или их фрагменты, синтезированные в лабораториях путем применения методов генной инженерии (рекомбининтная вакцина против вирусного гепатита В).
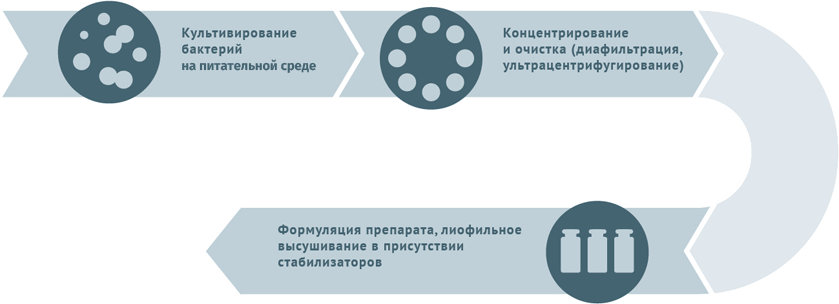
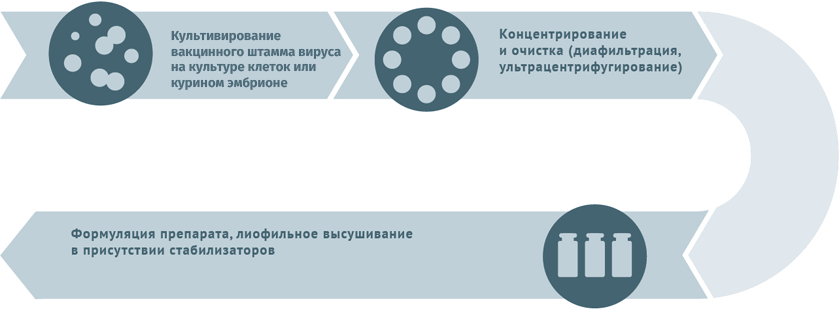
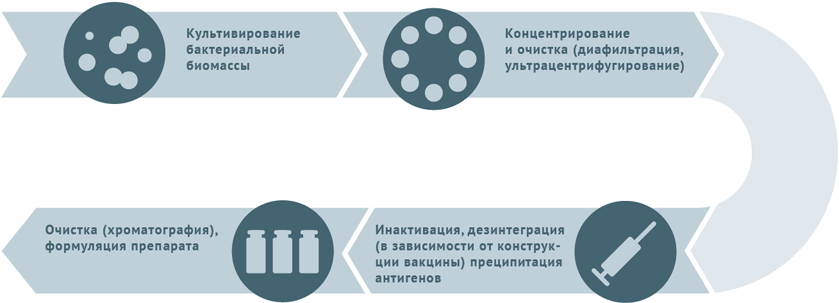
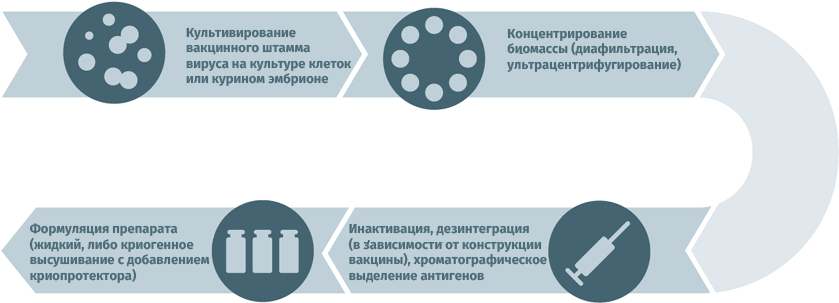
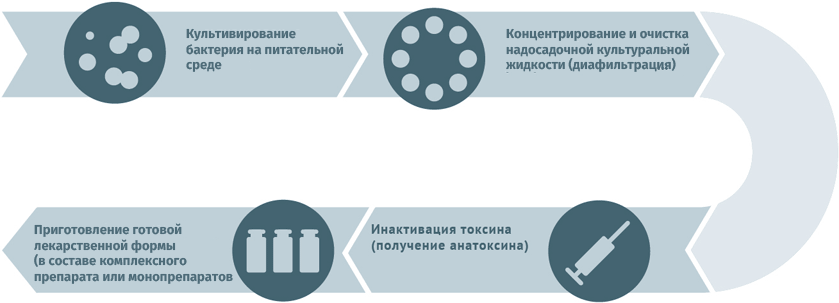
Схемы изготовления некоторых видов вакцин
Живые бактериальные
Схема подходит для вакцины БЦЖ, БЦЖ-М.
Живые противовирусные
Схема подходит для производства вакцин от гриппа, ротавируса, герпеса I и II степеней, краснухи, ветряной оспы.
Субстратами для выращивания вирусных штаммов при производстве вакцин могут становиться:
Первичный сырьевой материал очищают от клеточного дебриса в центрифугах и с помощью сложных фильтров.
Инактивированные антибактериальные вакцины
Инактивированные противовирусные вакцины
Схема подходит для производства прививочного материала против гепатита А, желтой лихорадки, бешенства, гриппа, полиомиелита, клещевого и японского энцефалитов.
Анатоксины
Для дезактивации вредного воздействия токсинов используют методы:
Схема подходит для производства вакцин против столбняка и дифтерии.
По данным Всемирной Организации Здравоохранения (ВОЗ), на долю инфекционных заболеваний приходится 25 % от общего количества смертей на планете ежегодно. То есть инфекции до сих пор остаются в списке главных причин, обрывающих жизнь человека.
Одним из факторов, способствующих распространению инфекционных и вирусных заболеваний, являются миграция потоков населения и туризм. Перемещение человеческих масс по планете влияет на уровень здоровья нации даже в таких высокоразвитых странах, как США, ОАЭ и государства Евросоюза.
По материалам: «Наука и жизнь» № 3, 2006, «Вакцины: от Дженнера и Пастера до наших дней», академик РАМН В. В. Зверев, директор НИИ вакцин и сывороток им. И. И. Мечникова РАМН.
Задать вопрос специалисту
Вопрос экспертам вакцинопрофилактики
Вопросы и ответы
Я много лет вакцинируюсь от гриппа вакциной французского производителя. В этом году терапевт предложила мне сделать прививку российской вакциной. Я ничего не знаю об отечественных вакцинах, какая из них качественная?
Отвечает Полибин Роман Владимирович
Российские препараты, которыми проводится вакцинацию в рамках ОМС, эффективны и безопасны. Для массовой иммунизации населения Минздравом используются вакцины Совигрипп (НПО «Микроген»), Ультрикс (ООО ФОРТ), УльтриксКвадри (ООО «ФОРТ» иФлю-М (СПбНИИВС ФМБА России). Препараты доказали высокий профиль безопасности и эффективности в ходе полного объема обязательных доклинических и клинических исследований, проведенных в соответствии с требованиями, предъявляемыми регуляторными органами РФ и Европы, а также длительного опыта успешного применения в России и динамики снижения заболеваемости. Подробнее о вакцинах можно узнать на официальных сайтах разработчиков.
Вакцина «Менюгейт» зарегистрирована в России? С какого возраста разрешена к применению?
Отвечает Харит Сусанна Михайловна
Да, зарегистрирована, вакцина – от менингококка С, сейчас также есть вакцина конъюгированная, но уже против 4 типов менингококков – А, С, Y, W135 – Менактра. Прививки проводят с 9 мес.жизни.
Муж транспортировал вакцину РотаТек в другой город.Покупая ее в аптеке мужу посоветовали купить охлаждающий контейнер,и перед поездкой его заморозить в морозильной камере,потом привязать вакцину и так ее транспортировать. Время в пути заняло 5 часов. Можно ли вводить такую вакцину ребенку? Мне кажется,что если привязать вакцину к замороженному контейнеру, то вакцина замерзнет!
Отвечает Харит Сусанна Михайловна
Моему сыну сейчас 7 месяцев.
В 3 месяца у него случился отек Квинке на молочную смесь Малютка.
Прививку от гепатита сделали в роддоме, вторую в два месяца и третью вчера в семь месяцев. Реакция нормальная, даже без температуры.
Но вот на прививку АКДС нам устно дали медотвод.
Я за прививки!! И хочу сделать прививку АКДС. Но хочу сделать ИНФАНРИКС ГЕКСА. Живем в Крыму. В крыму ее нигде нет. Посоветуйте как поступить в такой ситуации. Может есть зарубежный аналог? Бесплатную делать категорически не хочу. Хочу качественную очищеную, что бы как монжно меньше риска.
Отвечает Полибин Роман Владимирович
В Инфанрикс Гекса содержится компонент против гепатита В. Ребенок полностью привит против гепатита. Поэтому в качестве зарубежного аналога АКДС можно сделать вакцину Пентаксим. Кроме того, следует сказать, что отек Квинке на молочную смесь не является противопоказанием к вакцине АКДС.
Подскажите, пожалуйста, на ком и как тестируют вакцины?
Отвечает Полибин Роман Владимирович
Как и все лекарственные препараты вакцины проходят доклинические исследования (в лаборатории, на животных), а затем клинические на добровольцах (на взрослых, а далее на подростках, детях с разрешения и согласия их родителей). Прежде чем разрешить применение в национальном календаре прививок исследования проводят на большом числе добровольцев, например вакцина против ротавирусной инфекции испытывалась почти на 70 000 в разных странах мира.
Почему на сайте не представлен состав вакцин? Почему до сих пор проводится ежегодная реакция Манту (зачастую не информативна), а не делается анализ по крови, например, квантифероновый тест? Как можно утверждать реакции иммунитета на введенную вакцину, если еще ни кому не известно в принципе, что такое иммунитет и как он работает, особенно если рассматривать каждого отдельно взятого человека?
Отвечает Полибин Роман Владимирович
Состав вакцин изложен в инструкциях к препаратам.
Реакция Манту. По Приказу № 109 «О совершенствовании противотуберкулезных мероприятий в Российской Федерациии» и Санитарным правилам СП 3.1.2.3114-13 «Профилактика туберкулеза», несмотря на наличие новых тестов, детям необходимо ежегодно делать реакцию Манту, но так как этот тест может давать ложноположительные результаты, то при подозрении на тубинфицирование и активную туберкулезную инфекцию проводят Диаскин-тест. Диаскин-тест является высоко чувствительным (эффективным) для выявления активной туберкулезной инфекции (когда идет размножение микобактерий). Однако полностью перейти на Диаскин-тест и не делать реакцию Манту фтизиатры не рекомендуют, так как, он не «улавливает» раннее инфицирование, а это важно, особенно для детей, поскольку профилактика развития локальных форм туберкулеза эффективна именно в раннем периоде инфицирования. Кроме того, инфицирование микобактерией туберкулеза необходимо определять для решения вопроса о ревакцинации БЦЖ. К сожалению, нет ни одного теста, который бы со 100% точностью ответил на вопрос, есть инфицирование микобактерией или заболевание. Квантифероновый тест также выявляет только активные формы туберкулеза. Поэтому при подозрении на инфицирование или заболевание (положительная реакция Манту, контакт с больным, наличие жалоб и пр.) используются комплексные методы (диаскин-тест, квантифероновый тест, рентгенография и др.).
Ребёнку 1 год и 8 месяцев, все прививки ставились в соответствии с календарем прививок. В том числе 3 пентаксима и ревакцинация в полтора года тоже пентаксим. В 20 месяцев надо ставить от полиомиелита. Очень всегда переживаю и отношусь тщательно к выбору нужных прививок, вот и сейчас перерыла весь интернет, но так и не могу решить. Мы ставили всегда инъекцию (в пентаксиме). А теперь говорят капли. Но капли-живая вакцина, я боюсь различных побочек и считаю, что лучше перестраховаться. Но вот читала, что капли от полиомиелита вырабатывают больше антител, в том числе и в желудке, то есть более эффективные, чем инъекция. Я запуталась. Поясните, инъекция менее эффективна (имовакс-полио, например)? Отчего ведутся такие разговоры? У каплей боюсь хоть и минимальный, но риск осложнения в виде болезни.
Отвечает Полибин Роман Владимирович
В настоящее время Национальный календарь прививок России предполагает комбинированную схему вакцинации против полиомиелита, т.е. только 2 первых введения инактивированной вакциной и остальные – оральной полиовакциной. Это связано с тем, чтобы полностью исключить риск развития вакциноассоциированного полиомиелита, который возможен только на первое и в минимальном проценте случаев на второе введение. Соответственно, при наличии 2-х и более прививок от полиомиелита инактивированной вакциной, осложнения на живую полиовакцину исключены. Действительно, считалось и признается некоторыми специалистами, что оральная вакцина имеет преимущества, так как формирует местный иммунитет на слизистых кишечника в отличие от ИПВ. Однако сейчас стало известно, что инактивированная вакцина в меньшей степени, но также формирует местный иммунитет. Кроме того, 5 введений вакцины против полиомиелита как оральной живой, так и инактивированной вне зависимости от уровня местного иммунитета на слизистых оболочках кишечника, полностью защищают ребенка от паралитических форм полиомиелита. В связи с вышесказанным вашему ребенку необходимо сделать пятую прививку ОПВ или ИПВ.
Следует также сказать, что на сегодняшний день идет реализация глобального плана Всемирной организации здравоохранения по ликвидации полиомиелита в мире, которая предполагает полный переход всех стран к 2019 году на инактивированную вакцину.
Виды вакцин
Страх перед прививками во многом вызван устаревшими представлениями о вакцинах. Конечно, общие принципы их действия остались неизменными со времен Эдварда Дженнера, который в 1796 году первым применил вакцинацию от оспы. Вот только медицина с тех пор шагнула очень далеко вперед.
Так называемые «живые» вакцины, в которых используется ослабленный вирус, применяются и в наши дни. Но это лишь одна из разновидностей средств, призванных предупредить опасные болезни. И с каждым годом – в частности, благодаря достижениям генной инженерии – арсенал врачей-иммунологов пополняется все новыми видами и даже типами вакцин.
Живые вакцины
Требуют специальных условий хранения, зато обеспечивают стойкий иммунитет к болезни после одной, как правило, вакцинации. По большей части их вводят парентерально, то есть с помощью инъекций; исключение – вакцина от полиомиелита. При всех преимуществах живых вакцин, их использование связано с некоторым риском. Всегда остается шанс, что штамм вируса окажется достаточно вирулентным и станет причиной заболевания, от которого вакцинация должна была защитить. Поэтому живые вакцины не применяют на людях с иммунодефицитом (например, носителях ВИЧ, онкологических больных).
Инактивированные вакцины
Анатоксины
Конъюгированные вакцины
Некоторые бактерии имеют антигены, которые плохо распознаются незрелой иммунной системой младенцев. В частности, это бактерии, вызывающие такие опасные заболевания, как менингиты или пневмонию. Конъюгированные вакцины призваны обойти эту проблему. В них используется микроорганизмы, хорошо распознаваемые иммунной системой ребенка и содержащие антигены, схожие с антигенами возбудителя, к примеру, менингита.
Субъединичные вакцины
Эффективны и безопасны – в них используются лишь фрагменты антигена патогенного микроорганизма, достаточные для того, чтобы обеспечить адекватный иммунный ответ организма. Могут содержать частицы самого микроба (вакцины против Streptococcus pneumoniae и против менингококка типа А). Другой вариант – рекомбинантные субъединичные вакцины, создаваемые с использованием генно-инженерной технологии. Например, вакцину от гепатита B получают путем введения части генетического материала вируса в клетки пекарских дрожжей.
Рекомбинантные векторные вакцины
В чем заключается отличие конъюгированных и субъединичных вакцин ответ
Что такое расщепленная или СПЛИТ–вакцина («split» – расщеплять)?
Выделенные вирусы (вирионы) очищают, а затем разрушают каким–нибудь химическим веществом (например, диэтиловым эфиром). Такая вакцина содержит все вирусные белки: гемагглютинин, нейраминидазу и белки нуклеопротеида вируса. За счет дополнительной очистки в такой вакцине еще меньше токсичных субстанций, в т.ч. липидов, по сравнению с любой цельновирионной вакциной. Следовательно, она значительно менее реактогенная, при этом сплит–вакцина сохраняет максимальную иммуногенность.
Типичными представителями сплит–вакцин являются французский «Ваксигрип».
Наличие в вакцине внутренних антигенов вируса (нуклеокапсида и матриксного белка), по мнению создателей вакцины «Ваксигрип», защищает не только от ежегодных вариантов вируса гриппа, но частично и от всех возможных разновидностей вируса, поскольку внутренние антигены не особенно подвержены мутациям.
Итак, теоретически сплит–вакцины выигрывают в иммуногенности, которая напрямую связана с эффективностью вакцины, за счет наличия внутренних антигенов вируса.
Сплит–вакцины разрешено применять у детей с 6–ти месячного возраста, а также у пожилых людей, страдающих хроническими заболеваниями, в том числе у больных бронхиальной астмой.
Что лучше – сплит–вакцина или субъединичная вакцина?
Современные инактивированные вакцины мало отличаются между собой по иммуногенности, т.е. способности вызывать выработку антител и создавать иммунитет против гриппа.
Один из основных доводов в пользу сплит–вакцин – внутренние антигены вируса гриппа имеют определенное, но не основное, значение в формировании противогриппозного иммунитета. Встречаются утверждения, что ввиду отсутствия в субъединичных вакцинах внутренних антигенов вируса, защитная эффективность субъединичных вакцин несколько ниже, чем у сплит–вакцин (на 10–15%). Таким образом, скорее теоретически, сплит–вакцины имеют некоторый «запас» профилактической эффективности по сравнению с субъединичными вакцинами. Исследования, проведенные в Италии, показали, что в группе сплит–вакцин одни обладают достаточно высокой реактогенностью по сравнению с другими.
Сравнивая реактогенность, т.е. переносимость Сплит– и субъединичных вакцин, исследователи показали очень хорошую безопасность для всех сравниваемых вакцин, но результат был лучше у поколения субъединичных вакцин (0,9–1,3% против 1–1,8% для Сплит–вакцин; результаты исследования SVEVA, Италия). Вероятно, Сплит–вакцины проигрывают в безопасности, поскольку все таки содержат некоторое количество липидов вируса.
В чем заключается отличие конъюгированных и субъединичных вакцин ответ
Вакцины — иммунобиологические препараты, предназначенные для активной иммунопрофилактики, то есть для создания активной специфической невосприимчивости организма к конкретному возбудителю. Вакцинация признана ВОЗ идеальным методом профилактики инфекционных заболеваний человека. Высокая эффективность, простота, возможность широкого охвата вакцинируемых лиц с целью массового предупреждения заболевания вывели активную иммунопрофилактику в большинстве стран мира в разряд государственных приоритетов. Комплекс мероприятий по вакцинации включает отбор лиц, подлежащих вакцинации, выбор вакцинного препарата и определение схемы его использования, а также (при необходимости) контроль эффективности, купирование возможных патологических реакций и осложнений. В качестве Аг в вакцинных препаратах выступают:
• цельные микробные тела (живые или убитые);
• отдельные Аг микроорганизмов (наиболее часто протективные Аг);
• токсины микроорганизмов;
• искусственно созданные Аг микроорганизмов;
• Аг, полученные методами генной инженерии.
Большинство вакцин разделяют на живые, инактивированные (убитые, неживые), молекулярные (анатоксины) генно инженерные и химические; по наличию полного или неполного набора Аг — на корпускулярные и компонентные, а по способности вырабатывать невосприимчивость к одному или нескольким возбудителям — на моно- и ассоциированные.
Живые вакцины
Живые вакцины — препараты из аттенуированных (ослабленных) либо генетически изменённых патогенных микроорганизмов, а также близкородственных микробов, способных индуцировать невосприимчивость к патогенному виду (в последнем случае речь идёт о так называемых дивергентных вакцинах). Поскольку все живые вакцины содержат микробные тела, то их относят к группе корпускулярных вакцинных препаратов.
Иммунизация живой вакциной приводит к развитию вакцинального процесса, протекающего у большинства привитых без видимых клинических проявлений. Основное достоинство живых вакцин— полностью сохранённый набор Аг возбудителя, что обеспечивает развитие длительной невосприимчивости даже после однократной иммунизации. Живые вакцины обладают и рядом недостатков. Наиболее характерный — риск развития манифестной инфекции в результате снижения аттенуации вакцинного штамма. Подобные явления более типичны для противовирусных вакцин (например, живая полиомиелитная вакцина в редких случаях может вызвать полиомиелит вплоть до развития поражения спинного мозга и паралича).
Ослабленные ( аттенуированные ) вакцины
Ослабленные (аттенуированные) вакцины изготавливают из микроорганизмов с пониженной патогенностью, но выраженной иммуногенностью. Введение вакцинного штамма в организм имитирует инфекционный процесс: микроорганизм размножается, вызывая развитие иммунных реакций. Наиболее известны вакцины для профилактики сибирской язвы, бруцеллёза, Ку-лихорадки, брюшного тифа. Однако большая часть живых вакцин — противовирусные. Наиболее известны вакцина против возбудителя жёлтой лихорадки, противополи-омиелитная вакцина Сэйбина, вакцины против гриппа, кори, краснухи, паротита и аденовирусных инфекций.
Дивергентные вакцины
В качестве вакцинных штаммов используют микроорганизмы, находящиеся в близком родстве с возбудителями инфекционных болезней. Аг таких микроорганизмов индуцируют иммунный ответ, перекрёстно направленный на Аг возбудителя. Наиболее известны и длительно применяются вакцина против натуральной оспы (из вируса коровьей оспы) и БЦЖ для профилактики туберкулёза (из микобактерий бычьего туберкулёза).