В чем заключается прогностическая функция периодического закона химия
Периодическая система элементов. Периоды, группы, подгруппы. Периодический закон и его обоснование
Прогностическая (предсказательная) функция Периодического закона получила самое яркое подтверждение в открытии неизвестных элементов с порядковыми номерами 21, 31 и 32. Их существование сначала было предсказано на интуитивном уровне, но с формированием системы Менделеев с высокой степенью точности смог рассчитать их свойства. Хорошо известная история открытия скандия, галлия и германия я
вилась триумфом менделеевского открытия. Он все предсказания делал на основе им же самим открытого всеобщего закона природы.
Всего же Менделеевым были предсказаны двенадцать элементов.
С самого начала Менделеев указал, что закон описывает свойства не только самих химических элементов, но и множества их соединений. Для подтверждения этого достаточно привести такой пример. С 1929 г., когда академик П. Л. Капица впервые обнаружил неметаллическую проводимость германия, во всех странах мира началось развитие учения о полупроводниках. Сразу стало ясно, что элементы с такими свойствами занимают главную подгруппу IV группы. Со временем пришло понимание, что полупроводниковыми свойствами должны в большей или меньшей мере обладать соединения элементов, расположенных в периодах равно удаленной от этой группы (например, с общей формулой типа АзВ). Это сразу сделало поиск новых практически важных полупроводников целенаправленным и предсказуемым. На таких соединениях основывается практически вся современная электроника.
Важно отметить, что предсказания в рамках Периодической системы делались и после ее всеобщего признания. В 1913г. Мозли обнаружил, что длина волн рентгеновских лучей, которые получены от антикатодов, сделанных из разных элементов, изменяется закономерно в зависимости от порядкового номера, условно присвоенного элементам в Периодической системе. Эксперимент подтвердил, что порядковый номер элемента имеет прямой физический смысл. Лишь позднее порядковые номера были связаны со значением положительного заряда ядра. Зато закон Мозли позволил сразу экспериментально подтвердить число элементов в периодах и вместе с тем предсказать места еще не открытых к тому времени гафния (№ 72) и рения (№ 75).
Долгое время шел спор: выделять инертные газы в самостоятельную нулевую группу элементов или считать их главной подгруппой VIII группы.
Исходя из положения элементов в Периодической системе, химики-теоретики во главе с Лайнусом Полингом давно сомневались в полной химической пассивности инертных газов, напрямую указывая на возможную устойчивость их фторидов и оксидов. Но только в 1962 г. американский химик Нил Бартлетт впервые осуществил в самых обычных условиях реакцию гексафторида платины с кислородом, получив гексафтороплати-нат ксенона XePtF^, а за ним и другие соединения газов, которые теперь правильнее называть благородными, а не инертными.
Свою предсказательную функцию периодический закон сохраняет и до наших дней.
Нужно отметить, что предсказания неизвестных членов любого множества могут быть двух видов. Если предсказываются свойства элемента, находящегося внутри известного ряда себе подобных, то такое предсказание носит название интерполяции. Можно предположить, что эти свойства будут подчинены тем же закономерностям, что и свойства соседних элементов. Так были предсказаны свойства недостающих элементов внутри периодической таблицы. Гораздо труднее предвидеть характеристики новых членов множеств, если они находятся за пределами описанной части. Экстраполяция — предсказание значений функции, находящихся за пределами ряда известных закономерностей, — всегда носит менее определенный характер.
Искусственно синтезированный Еиенном Теодором Сиборгом и его сотрудниками элемент № 101 получил название «менделевий». Сам Сиборг об этом сказал так: «Особенно существенно отметить, что элемент 101 назван в честь великого русского химика Д. И. Менделеева американскими учеными, которые всегда считали его пионером в химии».
Открытие периодического закона и разработка периодической системы химических элементов Д.И. Менделеевым явились вершиной развития химии ХIX века, стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях. Обширная сумма знаний о свойствах 63 элементов, известных к тому времени, была приведена в стройный порядок.
Так же можно сказать, что периодический закон является началом эпохи современной химии. Изучение строения атомов вскрывает физический смысл периодического закона и объясняет закономерности изменения свойств элементов в периодах и в группах периодической системы. Знание строения атомов явилось необходимым для понимания причин образования химической связи, а природа химической связи в молекулах определила свойства веществ.
Периодическую систему по праву называют «компасом для исследователя, путеводной нитью в области химии, физики, минералогии, технике, таблицей истории и мироздания».
Академик Ферсман неоднократно подчёркивал, что периодический закон помогает поискам и разведке полезных ископаемых, так как место химического элемента в периодической системе тесно связано с местом того же элемента в самой природе, его реальным местом нахождением.
Возможность предсказания свойств элементов и их соединений по положению элемента в периодической системе широко использовалась и используется в различных областях промышленности техники для решения разнообразных проблем, связанных с созданием новых материалов с определёнными, заранее заданными свойствами. Таким образом: появление периодической системы открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях появилась стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть.
Периодический закон и сделанные на его основе открытия в различных областях естествознания и техники являются величайшим триумфом человеческого разума, свидетельством всё более глубокого проникновения в самые сокровенные тайны природы, успешного преобразования природы на благо человека.
«Редко бывает, чтобы научное открытие оказалось чем-то совершенно неожиданным, почти всегда оно предчувствуется, однако последующим поколениям, которые пользуются апробированными ответами на все вопросы, часто нелегко оценить, каких трудностей это стоило их предшественникам». Д.И. Менделеев.
4. Список используемой литературы:
2. Ахметов Н.С. «Актуальные вопросы курса неорганической химии», Москва, изд. «Просвещение», 1991 г.
3. Макареня А.А., Рысев Ю.В, «Д.И. Менделеев», Москва, изд. «Просвещение», 1988 г.
4. Ред. Егорова А.С. «Репетитор по химии», Ростов-на-Дону, изд. «Феникс», 2006 г.
5. Кузьменко Н.Е., Ерёмин В.В., Попков В.А. «Начала химии», Москва, изд. «Экзамен», 2004 г.
6. Кошель П.А. «Большая школьная энциклопедия. 6-11 кл., Т. 2., Москва, изд. «ОЛМА – Пресс», 1999 г.
В чем заключается прогностическая функция периодического закона химия
Ранее было неоднократно показано [2, 3], что периодичность вообще и периодичность свойств в частности, носит ярко выраженный полиномиальный характер. Предложен общий алгоритм прогноза на основе кубического полинома и вариант формулировки ПЗ, ему соответствующий.
Обратные свойства элементов, простых тел и их соединений находятся в полиномиальной периодической зависимости от обратных значений номеров периодов, в которых эти объекты расположены.
Т.е., если n-номер периода (главное квантовое число), а P-произвольное свойство, то
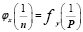
Если использовать главное квантовое число n, появляется возможность выявить общую генетическую основу периодичности, что и было сделано [5]. Отметим, что совершенно независимо от наших исследований, проблемой математизации Периодического закона занимались и другие авторы [2, 4, 7 и др.]. По нашему мнению, среди прочих следует особо выделить работу [4], в которой гносеология периодичности также выведена ab initio, предложены оригинальная концепция нуклонных блоков в строении атомов и формулы для определения Z конечных элементов периодов, их массовых чисел А, дефиниция числа нейтронов N в атомах на основе полинома.
В качестве рабочей таблицы химических элементов принят наш вариант модификации лестничной формы Бора-Томсена: секториально-слоевая система со смещениями элементов-аналогов, в которой благородные газы и параллельные им элементы расположены в слоях, а s – элементами и им параллельные – в лучах [1, 5].
Решение уравнения (1) получено в рамках естественных рядов элементов, причём необходимо учитывать неравнозначность чётного и нечётного начал, присущее свершениям Природы. Данный феномен затрагивает самые основы организации материи и уже только вследствие этого не может не вызывать различий в свойствах чётно-(е-) и нечётнопериодных (0-) объектов, подтверждением чему служит явление вторичной периодичности (ВП), открытое ещё Е.В. Бироном [1].
Поэтому поделив естественные ряды на е-о- подмножества и выбрав естественный ряд s- элементов, как наиболее изученный и содержащий наибольшее число известных членов, получаем решения в виде полиномов третьей степени. В качестве испытуемого свойства выберем заряд ядра Z, поскольку эта характеристика абсолютна, целочисленна, не содержит экспериментальных ошибок, она характеризует количество носителей свойств и известна на всём протяжении натурального ряда элементов. В качестве аргумента выбираем n- номер периода, главное квантовое число. Имеем общее решение в виде:
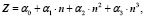
которое для семейства благородных газов принимает форму
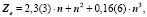
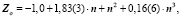
Уравнения любого слоя, параллельного благородным газам, аналогичны, за исключением свободного члена αо, который при движении вверх по рисунку [5] с каждым шагом уменьшается на единицу. Например, для галогенов получим:
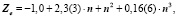
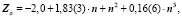
Подмножества щелочных элементов описываются уравнениями:
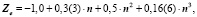
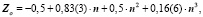
Таким образом, для щёлочноземельных имеем:
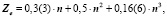
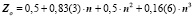
Коэффициенты уравнения (2) для разных совокупностей элементов
Значение коэффициентов в уравнении (2)
Средние элементы семейств
Средние элементы периодов
Примечание. Показано в [5, 6].
Зависимости для параллельных им лучей отличаются лишь величиной члена αо, который возрастает на единицу при переходе от луча к лучу вниз по рисунку. Уравнения (2)÷(10) являются математическим оправданием ПЗ, которые получают статус обязательного атрибута периодичности.
Ранее было показано [5,6], что коэффициенты αi связаны с теорией чисел, а значение α3 = 0,1666666… присуще исключительно феномену периодичности (табл. 3). Вообще же каждый член системы является пунктом, в котором пересекается множество полиномиальных маршрутов и именно полином в сочетании с явлением чётного – нечётного есть основа структуры генерального множества – Периодической системы (табл. 1).
Следует обратить внимание на несомненную связь коэффициентов уравнения Z = f(n) с константами периодической системы и теорией чисел. Обратившись к табл. 1, отметим следующее:
● разница между αo чёт и нечет в каждом семействе при последовательном движении по ним есть число членов семейства в этом периоде (за исключением s – элементов, для которых она равна – 1);
● разница между α1 чёт и нечет в тех же условиях представляет собой арифметическую прогрессию нечётных натуральных чисел (1, 3, 5, 7, 9…);
● коэффициент α2 для любого семейства равен числу членов этого семейства в периоде; исключение составляют опять – таки s – элементы, у которых α2 = 1;
● в рамках каждого семейства, за исключением s-, коэффициенты α2 одинаковы как в чётных, так и в нечётных последовательностях, поскольку представляют собой число членов данного семейства в периоде;
● суммы коэффициентов α3 в пределах каждого семейства также равны в е- и о- совокупностях, так как являются произведением числа членов семейства в периоде на 0,16(6) – характеристическую константу кубического полинома;
● сумма коэффициентов α3 от семейства к семейству возрастает на одну и ту же величину 0,66(6)…, которая представляет собою произведение характеристической константы кубической параболы на 4 – приращение числа элементов от семейства к семейству [2] и т.д.
Перейдём к прогнозу конкретных свойств веществ (Рх). При этом сразу возникает вопрос, насколько такие оценки будут близки к истине. Для контроля результатов следует прибегнуть к независимым методам, арсенал которых довольно скуден. Во – первых, это различные системы термохимических инкрементов либо чисто эмпирического характера, либо имеющих в своей основе некие модельные представления; среди последних стоит выделить работы Г. Пинаева [3]. Системам инкрементов присущ общий недостаток – необоснованная универсализация, в результате чего на одну прямую пытаются уложить в принципе все катионы при постоянном анионе и наоборот, т.е. пренебрежение о-е- феноменом. Во – вторых, это группа сравнительных методов, основанных на использовании разного рода корреляций в двух рядах свойств или соединений – эталонном (х) и искомом (у). Наибольшее распространение здесь получили параболическое и линейное соответствия. Первое вытекает из классической концепции электроотрицательности Л. Полинга и для энтальпий образования бинарных соединений может быть записано в виде
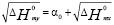
Недостатки – очень высокие погрешности при коррелировании свойств оксидов, сульфатов, тройных соединений.
Линейные корреляции лежат в основе метода сравнительной термодинамики Карапетьянца-Киреева в котором предполагается наличие приближённых линейных регрессий в рядах однотипных или сходных соединений:
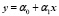
Однако, в подобной трактовке обсуждаемый приём имеет массу исключений. Авторы сами предостерегают от распространения его на разнотипные соединения вследствие увеличения средней дисперсии регрессии (12), а также из-за отсутствия теоретического обоснования как самой возможности, так и границ расширения способа. Вследствие эффекта кайносимметрии соблюдение формальной однотипности ещё не является гарантией низкой дисперсии регрессии (12), что и имеет место при сопоставлении оксидов с сульфидами, карбонатов с силикатами и тому подобное. Особенно резко это проявляется в сфере обратных задач прогнозирования, когда по заданной характеристике надо подобрать наиболее подходящее вещество. Кроме того, прямая непригодна для графической интерпретации всего разнообразия свойств веществ в широком интервале значений. Она описывает некоторый ограниченный участок, пределы которого указать точно не представляется возможным, поскольку для этого нет чётких критериев.
Поэтому, как стало ясным по мере накопления экспериментального материала, указанный приём в большинстве случаев давал чересчур приближённые оценки, что и стало основной причиной утраты им востребованности. В то же время идея сопоставления характеристик вещества для целей количественного прогноза неизвестных ещё свойств элементов представляется весьма привлекательной. Это побудило нас провести модификацию метода сравнительной термодинамики, согласовав его с концепцией полиномиальности.
Примем во внимание, что поскольку для эталонного ряда в этом случае справедливо
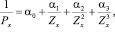
то для определяемого мы вправе ожидать
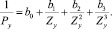
Их отношение при αi отличном от bi, или (и) Zx, не равном Z0, будет полиномом того же порядка. Таким образом, вместо (12) мы предлагаем
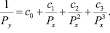
Преимущества подхода очевидны: вместо линейки – лекало с гораздо большими возможностями, нежели (12), при его использовании снимаются требования к однотипности или сходности сопоставляемых рядов соединений, и сохраняется лишь условие совместимости. В качестве эталона свойства примем первые потенциалы ионизации щелочноземельных элементов, которые измерены с высокой точностью.
Результаты расчётов по (15) приведены в табл. 2, нижняя строка. Учитывая то, что точность табличных данных для Fr в той или иной мере снижена из-за работы с микроколичествами вещества (
10-13М), совпадение с результатами наших расчётов следует признать хорошим. Ход вычислений был следующим. Выбиралось свойство для определения, например, первый потенциал ионизации I1 в ряду 1-11-37-87 и предпринималось сопоставление этого ряда (у) и эталонной последовательности (х). Однако здесь возникает проблема, связанная с тем, что в маршруте H, Na, Rb, Fr четвёртый член сам является определяемым и для установления кубической зависимости недостаёт одной пары х-у. Обойдём это затруднение следующим образом. Воспользуемся тем обстоятельством, что полиноминальные соотношения I1 – Pi, и φ (n) – f(Pi) для одного и того же свойства конкретного элемента должны давать одинаковые результаты. Выбрав в качестве эталона первый потенциал в качестве которого принят ряд для I1 в последовательности 2-12-38-88…, будем приближённо назначать I1 франция до тех пор, пока после нескольких итераций для произвольно выбранного контрольного элемента (мы, в частности, вели сравнение по 169) определяемого ряда он не совпадёт с необходимой точностью по обоим полиномам. Полученная при этом величина и будет являться искомой. Аналогичные операции выполним и для других свойств Fr (табл. 2).
Малюгина О. В. Лекция Значение периодического закона Д. И. Менделеева
Главная > Документ
| Информация о документе | |
| Дата добавления: | |
| Размер: | |
| Доступные форматы для скачивания: |
Малюгина О.В. Лекция 5. Значение периодического закона Д.И. Менделеева.
Периодический закон и периодическая система химических элементов Д. И. Менделеева обобщают сведения о химических элементах и образованных ими веществах и объясняют периодичность в изменении их свойств и причину сходства свойств элементов одной и той же группы.
Прогностическая сила периодического закона
Яркими примерами прогностической силы закона Д.И.Менделеева явились последующие открытия элементов учеными: в 1875 г. французом Лекоком де Буабодраном — галлий, предсказанный Д. И. Менделеевым пятью годами раньше как элемент под названием «экаалюминий» (эка — следующий за. ); в 1879 г. шведом Л. Нильсоном был открыт «экабор» по Менделееву; в 1886 г. Немецким химиком К. Винклером — «экасилиций» по Менделееву (определите по таблице Д. И. Менделеева со-временные названия этих элементов). Насколько точен был в своих предсказаниях русский химик, иллюстрируют данные таблицы 2.
Ученые-первооткрыватели новых элементов высоко оценили открытие русского ученого: «Вряд ли может существовать более яркое доказательство справедливости учения о периодичности элементов, чем открытие до сих пор гипотетического экасилиция; оно составляет, конечно, более чем простое подтверждение смелой теории, — оно знаменует собою выдающееся расширение химического поля зрения, гигантский шаг в области познания» (К. Винклер).
Задания для самопроверки
Перечислите важнейшие значения периодического закона.
В чем прогностичность периодического закона?
Свойства каких химических элементов предсказал Д.И. Менделеев?
Открываются ли новые элементы в современное время и каким способм это делается?
Периодический закон обобщает сведения о химических элементах и их соединениях. Объясняет сходства и различия химических элементов и образуемых ими соединений, дает возможность прогнозировать свойства неизвестных еще элементов.
Дает возможность предсказывать свойства и характеристики неоткрытых элементов.
Да. Синтезируются новые элементы. Синтезирован 119 элемент ПСХЭ. Для этого используются реакции ядерного синтеза.
Итоговая проверка знаний по теме «Периодический закон и периодическая система химических элементов Д.И. Менделеева»
Значение периодического закона : Лекция 5
Периодический закон и периодическая система химических элементов обобщают сведения о химических элементах и образованных ими веществах и объясняют периодичность в изменении их свойств и причину сходства свойств элементов одной и той же группы.
Эти два важнейших значения периодического закона и периодической системы дополняет еще одно, которое заключается в возможности прогнозировать, т. е. предсказывать, описывать свойства и указывать пути открытия новых химических элементов. Уже на этапе создания периодической системы сделал ряд прогнозов о свойствах еще неизвестных в то время элементов и указал пути их открытия.
Прогностическая сила периодического закона
Яркими примерами прогностической силы закона явились последующие открытия элементов учеными: в 1875 г. французом Лекоком де Буабодраном — галлий, предсказанный пятью годами раньше как элемент под названием «экаалюминий» (эка — следующий за. ); в 1879 г. шведом Л. Нильсоном был открыт «экабор» по Менделееву; в 1886 г. Немецким химиком К. Винклером — «экасилиций» по Менделееву (определите по таблице со-временные названия этих элементов). Насколько точен был в своих предсказаниях русский химик, иллюстрируют данные таблицы 2.
Ученые-первооткрыватели новых элементов высоко оценили открытие русского ученого: «Вряд ли может существовать более яркое доказательство справедливости учения о периодичности элементов, чем открытие до сих пор гипотетического экасилиция; оно составляет, конечно, более чем простое подтверждение смелой теории, — оно знаменует собою выдающееся расширение химического поля зрения, гигантский шаг в области познания» (К. Винклер).
Задания для самопроверки
1. Перечислите важнейшие значения периодического закона.
2. В чем прогностичность периодического закона?
4. Открываются ли новые элементы в современное время и каким способм это делается?
1. Периодический закон обобщает сведения о химических элементах и их соединениях. Объясняет сходства и различия химических элементов и образуемых ими соединений, дает возможность прогнозировать свойства неизвестных еще элементов.
2. Дает возможность предсказывать свойства и характеристики неоткрытых элементов.
3. Галлия и германия.
4. Да. Синтезируются новые элементы. Синтезирован 119 элемент ПСХЭ. Для этого используются реакции ядерного синтеза.
Итоговая проверка знаний по теме «Периодический закон и периодическая система химических элементов »
Современная формулировка периодического закона Д. И. Менделеева
Химические элементы, которых на данный момент насчитывается 118, подчиняются периодическому закону, сформулированному Дмитрием Ивановичем Менделеевым во второй половине XIX века.
Периодический закон Менделеева — в чём суть
Химические элементы, существующие в нашем мире, созданные самой природой или человеком, подчиняются правилу — Периодическому закону, который является основой химической науки.
Периодический закон — закон, который заключается в сопоставлении свойств химических элементов и их атомных масс (в современной формулировке — зарядов ядер).
После открытия в 1869 году Д. И. Менделеевым Периодического закона химических элементов данная наука перестала быть исключительно описательной. Стало возможным научное предвидение.
Суть закона Менделеева заключается в том, что свойства химических элементов, расположенных в таблице, а также свойства образуемых ими соединений находятся в периодической зависимости от зарядов ядер их атомов.
Периодический закон Менделеева был выражен в форме периодической системы элементов.
Периодическая система химических элементов — упорядоченное расположение в таблице химических элементов и их естественная классификация.
Периодическая система химических элементов Д. И. Менделеева состоит из 7 периодов — они представляют собой элементы, расположенные по горизонтали в порядке возрастания атомного номера (заряда ядра), и восьми групп (столбцов).
Периоды делятся на:
Каждый, кроме первого, период начинается со щелочного металла, а заканчивается благородным газом. Слева направо в каждом периоде ослабевают металлические и усиливаются неметаллические свойства, что связано с возрастанием числа электронов на внешнем уровне каждого химического элемента и увеличением прочности их связи с атомом.
Группы делятся на подгруппы:
Сверху вниз в главных подгруппах усиливаются металлические и слабевают неметаллические свойства.
В главных подгруппах вместе с усилением металлических свойств увеличивается устойчивость соединений элементов в низких степенях окисления. В побочных подгруппах с ослабеванием металлических свойств увеличивается устойчивость соединений с высокими степенями окисления.
История открытия, какое имело значение
Первооткрывателем периодического закона является Д. И. Менделеев. Днем, когда был открыт периодический закон, считается 1 марта (17 февраля) 1869 г., когда ученый закончил работу над основным трудом, описавшим данный закон — «Опыт системы элементов, основанной на их атомном весе и химическом свойстве». Тогда с ним за звание первооткрывателя боролся Юлиус Лотар Мейер, который также создал свою систему химических элементов.
Существует легенда о том, что Дмитрий Иванович Менделеев увидел Периодическую систему химических элементов во сне. Однако сам ученый ответил так:
«Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово».
За основу своей классификации Д. И. Менделеев взял два свойства — химическое сходство элементов и их атомную массу. Ученый расписал на карточках основные свойства каждого элемента, после чего начал многократно переставлять их, чтобы найти закономерность.
Менделеев утверждал, что с ростом атомной массы элементов их свойства меняются, но не монотонно, как считали исследователи до него, а периодически. Свойства начинают повторяться после определенного количества элементов, однако они делают это не точь-в-точь, а с определенными изменениями.
Вторая версия Периодической системы появилась в 1870 году в статье «Естественная система элементов» в «Основах химии». Эта система больше похожа на современную: горизонтальных столбцов стало восемь, периоды остались в изначальном количестве, а каждый период был разбит на 2 ряда — для элементов основной и побочной подгрупп.
Для соблюдения периодичности химических элементов Д. И. Менделеев переписал атомные массы некоторых элементов, расставив их вопреки общим представлениям, а также оставил пустые клетки для неоткрытых элементов.
Первое определение химического закона звучало следующим образом:
Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, состоят в периодической зависимости от их атомного веса.
С помощью составленной периодической системы Д. И. Менделеев смог предсказать открытие новых элементов, а также целый ряд их химических и физических свойств. Подтверждение правильности систематизации появилось уже в 70-80-х годах XIX века, когда были открыт галлий, скандий и германий, которые точно встали в установленные Менделеевым места в Периодической таблице.
Формулирование Периодического закона имело большое значение для развития химии. С открытием Периодической системы химических элементов Д. И. Менделеева мир химической науки перестал быть исключительно описательным, но получил возможность прогнозирования будущих результатов.
Попытки систематизации до него
В середине XIX века научный мир знал о существовании 63 химических элементов. Исследователи предпринимали постоянные попытки систематизирования этих элементов для возможности дальнейшего прогнозирования в химической науке. Это было необходимо для преодоления определенного кризиса — невозможности открывать новые элементы и неимения твердой научной почвы для проведения опытов.
Первым установленную попытку систематизирования химических элементов предпринял Александр Эмиль Шанкуртуа — французский химик, который в 1862 году создал свою систему химических элементов, основанную на закономерности их атомных масс.
Он разместил элементы вдоль винтовой линии — «земной спирали» — которая обращала внимание на циклическую повторяемость свойств элементов.
Данная модель не привлекла внимания общественности, но стала существенным шагом к открытию Периодической системы. Александр Эмиль Шанкуртуа первым обратил внимание на закономерности между атомными массами химических элементов, но не учитывал многих других свойств. Поэтому претензии Шанкуртуа на приоритет в открытии Периодической системы, которые появились у химика после открытия Менделеева, нельзя считать обоснованными.
Джон Александр Ньюлендс в 1866 году предложил свой вариант Периодического закона, который назвал «законом октав». Модель закона напоминала менделеевскую, но при этом в формулировке существовали настойчивые попытки Ньюлендса найти взаимосвязь между химическими элементами и музыкальной гармонией.
По мнению Джона Александра Ньюлендса следовало размещать элементы по порядку возрастания атомных масс, при этом каждый восьмой элемент, как и каждая восьмая нота, должен был стать началом новой строчки. Элементы с одинаковым атомным весом, которые были установлены в то время, располагались под одним номером.
Главной ошибкой ученого был факт того, что некоторые элементы еще не были открыты. Из-за этого система рушилась.
Наиболее близкой к менделеевской системе был вариант Юлиуса Лотара Мейера, который был опубликован в 1864 году. За основу классификации химических элементов ученый взял валентность элементов. В то время еще не было установлено, что валентность не является постоянной для отдельно взятого элемента, из-за чего система не могла быть достоверно точной.
В 1869 году Мейер изменил свою таблицу на сходную с системой Менделеева, из-за чего в западной литературе считается одним из первооткрывателей Периодического закона, либо же ученым, открывшим его независимо от Менделеева.
Современная формулировка
В начале XX века в связи с проводимыми опытами по изучению строения атома было выявлено, что заряд ядра, а не атомная масса, влияет на периодичность изменений свойств элементов. Заряд ядра также влияет на атомный номер и число электронов, распределённых по электронным оболочкам химического элемента.
Современная формулировка в связи с этим отличается от первоначальной:
Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений, находятся в периодической зависимости от величин зарядов ядер их атомов.
В современной химии главным вопросом остается проблема верхней границы Периодической системы химических элементов Д. И. Менделеева. Последним элементом в таблице на данный момент является элемент номер 118, синтезированный в Дубне в 2002 и 2005 годах, и получивший название Оганесон в 2016 году.
Развитие периодического закона Д. И. Менделеева
В 1869 году, когда был сформулирован Периодический закон, научный мир знал только о 63 элементах. На 2021 год известно 118 элементов, продолжаются попытки получения новых.
Формулировка Периодического закона означала лишь начало развития химии и знаний о периодичности свойств химических элементов. Несмотря на то, что изначально предсказания Менделеева были встречены со скепсисом, в итоге они стали основой для целого ряда химических открытий.
В развитии периодического закона принято выделять 2 периода:
Химический этап связан с открытием элементов Периодической системы, которые предсказал Менделеев:
Данное преобразование завершило химический этап развития Периодической системы.
Физический этап развития Периодического закона был начат в связи с тем, что химия не могла в полной мере объяснить причину периодичности свойств химических элементов. Физический этап развития Периодического закона привел к изменениям в естествознании, которые оказали на науку революционное влияние.
Дальнейшее изменение Периодической системы было связано с открытиями физики.
Физический этап можно условно разделить на периоды:
В связи с открытиями физики таблица начала менять свой изначальный облик.
Как изменяются свойства элементов в Периодической таблице
Свойства химических элементов в Периодической таблице зависят от положения каждого элемента в ряду (периоде) и столбце (группе).
Главной характеристикой химического элемента является заряд ядра его атомов.
Главными свойствами химических элементов, являются:
Слева направо в периоде происходит:
Сверху вниз в группе в главной подгруппе происходит:



