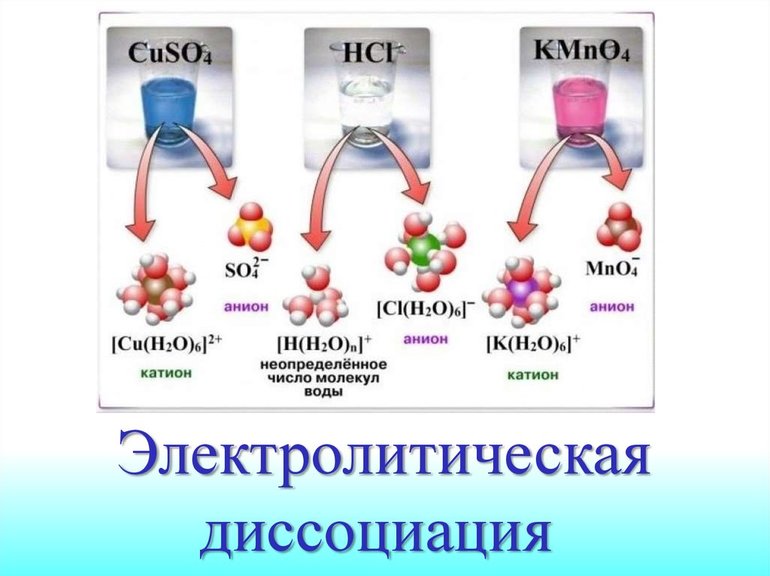
В чем заключается процесс электрической диссоциации
Теория электролитической диссоциации
Темы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты.
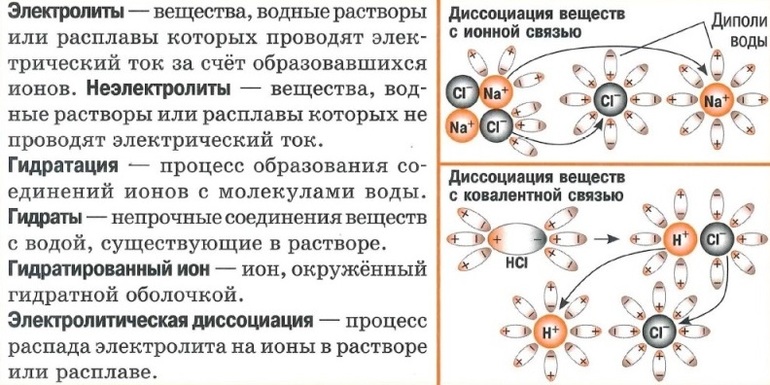
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
NaCl = Na + + Cl –
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na + и PO4 3– :
Диссоциация слабых электролитов : многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
HCO3 – ↔ H + + CO3 2–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K + + HCO3 – (α=1)
HCO3 – ⇄ H + + CO3 2– (α + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α 1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
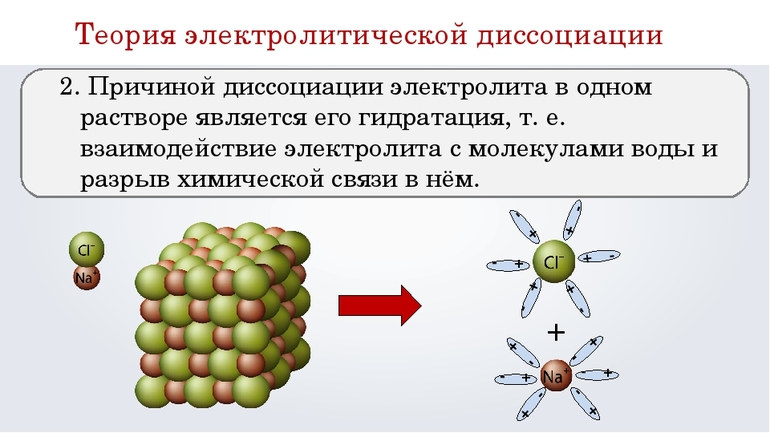
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
Урок №7. Сущность процесса электролитической диссоциации
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Растворы всех веществ можно разделить на две группы: проводят электрический ток или проводниками не являются.
С особенностями растворения веществ можно познакомиться экспериментально, исследуя электропроводность растворов этих веществ с помощью прибора, изображённого на рисунке 1.
Рис. 1. Прибор для испытания растворов на электрическую проводимость
Рис. 2 . Направленное движение ионов в водных растворах и расплавах электролитов
1. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют) на ионы – положительно (катионы) и отрицательно (анионы) заряженные частицы.
Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. Например, уравнение диссоциации молекулы электролита КA на катион К + и анион А — в общем виде записывается так:
КА ↔ K + + A —
Процесс растворения электролитов в воде
В целом молекула воды не заряжена. Но внутри молекулы Н 2 О атомы водорода и кислорода располагаются так, что положительные и отрицательные заряды находятся в противоположных концах молекулы (рис. 3). Поэтому молекула воды представляет собой диполь.
Какой процесс называется электролитической диссоциацией
Чистая вода не является проводником тока. Проводимость у нее появляется благодаря растворенным примесям. Происходит это в случае, когда растворенное вещество является электролитом, т.е. способно распадаться на ионы — разноименно заряженные частицы.
Электролитическая диссоциация — что это в химии, теория
С давних времен люди обращали внимание на способность некоторых растворов проводить электрический ток. Этим свойством обладают не все растворы. Например, раствор поваренной соли в воде является отличным электропроводником; растворы уксусной кислоты, как и растворы углекислого и сернистого газов, проводят ток немного хуже. А растворы спирта, сахара и ряда прочих веществ не проводят ток вовсе.
М. Фарадей в XIX веке (30-е годы) изучал эти процессы. Он ввел термин «электролит», в значение которого вложил понятие о веществе, способном к электропроводности в растворенном или расплавленном виде. Его авторству принадлежат также термины «катион», «анион», «ион», «электролиз».
Электролит — вещество, способное проводить электрический ток в растворе и расплаве. Такая возможность обуславливается наличием в растворах и расплавах частиц, имеющих заряд — ионов.
Электролитическая диссоциация — физический процесс, при котором в растворе или при плавлении происходит распад веществ на ионы.
Однако о том, что именно ионы являются причиной проводимости, стало известно гораздо позже. Тогда считали, что молекулы распадаются на частицы вследствие воздействия электрического тока, после чего эти частицы приобретают электрический заряд.
В 1887 году Сванте Аррениус (шведский ученый) выдвинул гипотезу, что в растворе молекулы распадаются на ионы, которые притягиваются и двигаются к двум разноименно заряженным электродам — катоду и аноду. По его мнению, в этом заключалась причина появления электропроводности у растворов.
С. Аррениус был сторонником физической теории растворов. Он считал, что в растворе содержатся ионы в свободном виде. Не мог согласиться с Аррениусом Д.И.Менделеев. По его «химической» теории растворов, в них происходят химические реакции, в которых задействованы растворенные вещества и растворители. А в 1889 году Менделеев написал «Заметку о диссоциации растворенных веществ», где высказывал сомнения о протекании процессов распада электролитов в растворах.
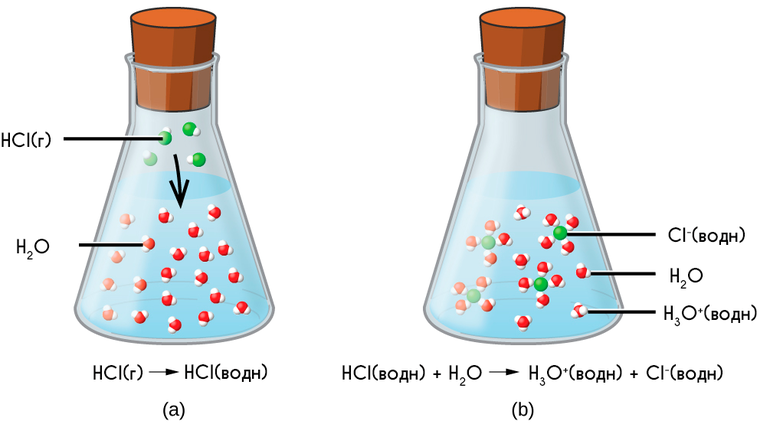
Согласно современным представлениям при растворении вещества диссоциируют, т.е. распадаются на ионы. При этом также протекает процесс гидратации — взаимодействия ионов с водой, в результате которого образуются ассоциаты ионов с молекулами Н 2 О (гидратированные ионы).
Аналогичные процессы протекают в растворах, к примеру, серной кислоты.
Виды электролитов, какие бывают
В химии существует классификация электролитов в зависимости от их способности к диссоциации и типа образующихся ионов. Различают виды:
Беря за основу силу электролита, различают сильные (неассоциированные) и слабые (ассоциированные) электролиты. Сильные — вещества с ионным или ковалентным сильно полярным типом связи, растворимые соли, щелочи (растворимые основания), сильные кислоты. Они легко необратимо распадаются на ионы, их степень диссоциации более 0,5 (50%). Слабые — вещества с ковалентной слабополярной связью, распадаются с трудом, степень диссоциации составляет менее 0,1 (10%).
Cуществуют также вещества, имеющие промежуточное значение степени диссоциации — от 10 до 50%. Их можно назвать электролитами средней силы.
Для ассоциированных электролитов, в свою очередь, существует классификация на типы, а именно:
Как определить степень диссоциации, уравнение
В растворах электролитов могут содержаться как ионы, так и недиссоциированные частицы. Соотношение продиссоциировавших и недиссоциированных частиц получило название степени диссоциации. Обозначение — α (альфа).
Степень диссоциации — величина, показывающая отношение количества электролита, который распался на ионы, к его общему количеству электролита в растворе.
Величина степени диссоциации конкретных веществ определяется экспериментальным путем. Единицей для измерения этой величины является доля единицы или процент. Каждый электролит характеризуется различной степенью диссоциации, которая определяется:
Для сильных электролитов свойственен практически полный распад на ионы, их степень диссоциации в разбавленных растворах стремится к единице. В растворах слабых электролитов степень диссоциации незначительна и стремится к нулю.
Уравнение диссоциации сильного электролита выглядит следующим образом:
Для слабых электролитов уравнение их распада на ионы будет выглядеть так:
Рассмотрим пример решения задач на определение степени диссоциации электролита:
Для решения задачи составляем уравнение диссоциации:
Константа диссоциации не зависит от концентрации раствора, однако находится во взаимосвязи с температурой и природой самого растворителя. По закону Оствальда можно записать:
Классификация и некоторые особенности диссоциации кислот, оснований, солей
Кислотный остаток — это отрицательные ионы (анионы), образующиеся при диссоциации кислот.
В зависимости от числа атомов водорода в молекуле кислоты выделяют кислоты различной основности. Примеры:
При этом в случае многоосновных кислот процесс отделения катионов Н+ не происходит одномоментно. Сначала отщепляется один ион водорода, следом — второй и третий (в зависимости от количества атомов водорода в молекуле).
Таким образом, диссоциация двухосновной кислоты происходит в две ступени:
Аналогично в три ступени проходит диссоциация трехосновной кислоты. При этом степень диссоциации максимальна для первой ступени. Каждая последующая стадия протекает хуже, чем предыдущая.
Диссоциация слабых многокислотных оснований, аналогично кислотам, протекает ступенчато:
Соли распадаются в водном растворе на катионы (металлы) и анионы (кислотные остатки). Существует классификация солей по составу:
В чем заключается процесс электрической диссоциации
Ключевые слова конспекта: электролитическая диссоциация, теория, электролиты, неэлектролиты, определения основаниям, кислотам и солям как электролитам, степень диссоциации, степень электролитической диссоциации.
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Электрический ток – это направленное движение заряженных частиц. В металлах такое направленное движение осуществляется за счёт относительно свободных электронов. Но проводить электрический ток могут не только металлы.
Вещества, растворы или расплавы которых проводят электрический ток, называются электролитами. Вещества, растворы или расплавы которых не проводят электрический ток, называются неэлектролитами.
Почему же электролиты проводят электрический ток?
В 1887 г. шведский учёный Сванте Аррениус сформулировал положения теории электролитической диссоциации. Основная идея этой теории заключается в том, что электролиты под действием растворителя самопроизвольно распадаются на ионы. Электропроводность электролитов обусловлена именно наличием в растворе свободных ионов, которые и являются носителями зарядов.
В дальнейшем теория электролитической диссоциации совершенствовалась. Современная теория водных растворов электролитов, кроме теории С. Аррениуса, включает в себя представления о гидратации ионов (И. А. Каблуков, В. А. Кистяковский) и теорию сильных электролитов (П. Й. Дебай, Э. А. Хюккель, 1923 г.).
Основными положениями теории электролитической диссоциации являются следующие:
ОПРЕДЕЛЕНИЯ ОСНОВАНИЙ, КИСЛОТ И СОЛЕЙ
В свете теории электролитической диссоциации можно дать определения основаниям, кислотам и солям как электролитам.
Основания – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид анионов – гидроксид-анионы OH – :
КОН = К + + OH –
Са(ОН)2 = Са 2+ + 2 OH –
Кислоты – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид катионов – катионы водорода Н + (точнее – катионы гидроксония H3O + ).
Катион гидроксония образуется при взаимодействии Н + с молекулой H2O. В результате образуется ещё одна ковалентная связь кислорода с водородом по донорно-акцепторному механизму:
Примеры диссоциации кислот:
НCl = Н + + Cl – или НCl + H2O = H3O + + Cl –
НСlO4 = Н + + СlO4 – или НСlO4 + H2O = H3O + + СlO4 –
Многоосновные кислоты диссоциируют ступенчато:
Соли – это электролиты, диссоциирующие в водном растворе на катионы металлов и анионы кислотного остатка.
Средние соли диссоциируют с образованием только катионов металла и анионов кислотного остатка. Например:
Соли аммония вместо катиона металла содержат катион аммония. Например:
NH4Cl = NH4 + + Cl –
Основные соли диссоциируют с образованием катионов металла, анионов ОН– и анионов кислотного остатка:
Суммарное уравнение: AlOНCl2 = Al 3+ + ОН – + 2Cl –
Кислые соли диссоциируют с образованием катионов металла, катионов водорода (гидроксония) и анионов кислотного остатка. Например:
Суммарное уравнение: Са(НСO3)2 + 2H2O = Са 2+ + 2H3O + + 2СО3 2–
Двойные соли – соли, в результате диссоциации которых образуются катионы нескольких металлов (или аммония и какого–либо металла) и анионы одного кислотного остатка. Например, сульфат калия–хрома (хромокалиевые квасцы):
Смешанные соли – соли, в результате диссоциации которых образуются катионы какого-либо металла и анионы нескольких кислотных остатков. Например, хлорид-гипохлорит кальция (хлорная известь):
СаСlOCl = Са 2+ + Cl – + СlO –
При растворении одних электролитов диссоциация происходит практически полностью. Такие электролиты называют сильными. При растворении других электролитов диссоциация происходит в незначительной мере, их называют слабыми.
СТЕПЕНЬ ДИССОЦИАЦИИ
Для количественной оценки силы электролита введено понятие степени электролитической диссоциации.
Степень электролитической диссоциации (α) – отношение количества вещества электролита, распавшегося на ионы (nрасп.), к количеству вещества электролита, поступившего в раствор (nобщ.):
Степень диссоциации также выражают в процентах, тогда 0%
Конспект урока «Электролитическая диссоциация. Степень диссоциации».
Электролитическая диссоциация
К соединениям, что отлично пропускают через себя ток, причисляют сильные кислоты, основания и соли, способные активно растворяться в H2O. Примеры веществ, водные соединения которых не в состоянии проводить электрический ток:
Причина электропроводности открыта в 1877 году шведским учёным С. Аррениусом. Он долго изучал свойства разнообразных соединений и наконец обнаружил, что в некоторых из них наличествуют ионы. Именно они проводят электрический ток. Частицы образуются, когда в воде растворяются определённые ингредиенты. Этот процесс называется электролитической диссоциацией.
С. Аррениус полагал, что частицы изначально находятся в растворах. Он не учитывал, что при взаимодействии электролита и воды происходит химическая реакция. Пытаясь объяснить процесс диссоциации, этот учёный опирался на физическую теорию растворов.
В отличие от него, русские физикохимики Вадимир Александрович Кистяковский и Иван Алексеевич Каблуков применили подход Д. И. Менделеева. Опираясь на химическую теорию, они сумели разработать доказательство того, что реакция является ступенчатой. Когда компонент растворяется в воде, сначала образуются гидраты. Следующая ступень — высвобождение ионов. Атомы водорода в молекуле воды расположены под углом 104,5°. При этом они как бы окутывают элемент, который впоследствии переходит в свободное состояние.
Обратимость реакции
Вещества, имеющие ионную кристаллическую решётку, диссоциируют активнее. Они уже состоят из мельчайших элементов, среди которых есть положительно и отрицательно заряженные. Молекула воды представляет собой диполь — 2 противоположно заряженных полюса. К ним притягиваются частицы вещества при растворении. Одновременно ослабевают связи в кристаллической решётке. Кристалл распадается и раствор насыщается элементами. Схематично процесс электролитической диссоциации можно представить так:
Диссоциация электролитов, состоящих из молекул с ковалентной связью, происходит аналогично. Диполи воды оказывают влияние на молекулы вещества. При этом ковалентная связь преобразуется в ионную. Механизм диссоциации выглядит так:
В естественных условиях частицы в растворе перемещаются хаотично. При этом некоторые из них сталкиваются и объединяются. Такой процесс называется ассоциацией. Отображая эти реакции в виде формулы или уравнения электролитической диссоциации, ставят знак обратимости. Он показывает, что противоположно направленные реакции происходят одновременно. Гидроокиси, обладающие подобным свойством, называют амфотерными.
Некоторые слабые электролиты диссоциируют обратимо и ступенчато. К таким относятся угольная и сероводородная кислоты, гидроксид магния. Гидратированные и негидратированные частицы имеют разные свойства. Например, подвергаясь гидратации, катион или анион меди приобретает голубой цвет. Будучи негидратированным — белый.
В гидратированном элементе количество молекул воды может быть как постоянным, так и изменчивым.
Определение степени
В водном растворе вещества одновременно присутствуют ионы и молекулы. Их количество различается. Для понимания, сколько частиц в растворе в текущий момент, в химии стали использовать специальный показатель — степень диссоциации. Его принято обозначать буквой «альфа» (a). Определение этого показателя выглядит так: с. д. — это отношение ионов к общему количеству частиц, растворившихся в жидкости. Степень д. выражается в процентах (%) или долях.
Когда a=100% или 1, это означает, что электролит целиком распался на ионы. Если a=0, реакция отсутствует. Степень диссоциации неодинакова у разных жидкостей. Она обусловлена тем, каким свойствами обладает электролит изначально. Также интенсивность распада обусловлена тем, сколько в растворе электролита и воды. Чем концентрированнее соединение, тем ниже показатель степени, и наоборот.
Типы электролитов
По способности диссоциировать на ионы жидкости с электролитическим компонентом делят на сильные и слабые. К первым относят те, что полностью вступают в реакцию. Их степень диссоциации равна единице или 100%. Список электролитов, относящихся к сильным:
У слабых электролитов показатель степени диссоциации почти всегда минимален или стремится к нулю. Такие вещества практически не распадаются на элементарные частицы. Категории соединений, отнесённых к слабым электролитам:
Динамическое равновесие
Слабые электролиты диссоциируют не полностью. Когда они находятся в растворе, процесс диссоциации происходит до определённого момента, потом прекращается. Устанавливается динамическое равновесие. Это явление можно выразить в виде уравнения. Способность вещества диссоциировать на мельчайшие частицы называют константой диссоциации или равновесия.
Чем активнее электролит образует ионы, тем он сильнее, а значит, константа выше. У слабых этот показатель будет ниже. Значения констант диссоциации для разных элементов, из которых состоит таблица Менделеева, приводятся в справочной литературе. Эти показатели применимы только к водным растворам. В неводных химические элементы ведут себя иначе.
Кроме воды, вещества могут растворяться в ацетоне, эфире, бензоле, спирте и многих других жидкостях.
Основные положения теории
Электролитической диссоциации посвящена научная теория, состоящая из 5 постулатов. Первый гласит, что электролиты, растворяясь в воде, распадаются на 2 категории ионов — положительно и отрицательно заряженные. Этот вид частиц представляет собой одну из форм, в которой может существовать химический элемент.
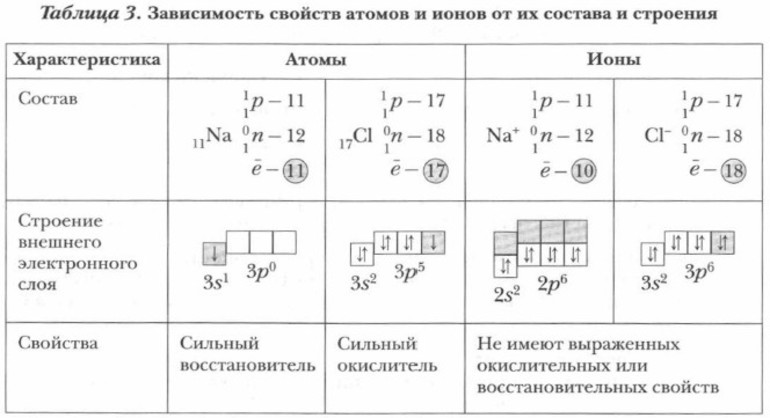
Свойства атомов и ионов различаются. Например, ионы натрия не образуют соединений с водой, а атомы этого же элемента вступают с ней в реакцию. Результатом взаимодействия становятся водород и щёлочь. Атомы и ионы хлора различаются по свойствам: первые токсичны, окрашены в жёлто-зелёный цвет и издают резкий запах, а вторые не пахнут, бесцветны и неядовиты.
Когда один или группа атомов присоединяют или отдают электроны, образуются ионы, несущие отрицательный или положительный заряд. По составу они подразделяются на простые и сложные. Находясь в растворе, эти частицы хаотично и непрерывно движутся.
Суть следующего положения теории заключается в том, что причиной диссоциации является взаимодействие молекул воды и электролита, сопровождающееся разрывом химической связи в последнем. В результате гидратации образуются ионы, связанные с молекулами H2O. По-другому эти частицы называют гидратированными. От негидратированных их отличает наличие водной оболочки.
Третье положение объясняет, как образуются катионы и анионы. Под воздействием электротока отрицательные ионы перемещаются к аноду. Он представляет собой положительный полюс. Эти ионы называют анионами.
Положительно заряженные частицы движутся к катоду — отрицательному полюсу источника электротока. Эти частицы называются катионами. Таким образом, ионы могут классифицироваться по знаку заряда. Растворы электролитов всегда электронейтральны, потому что суммы зарядов катионов и анионов равны.
Согласно четвёртому положению теории, электролитическая диссоциация, происходящая с участием слабых электролитов, является обратимым процессом. Одновременно с распадом вещества на ионы происходит соединение последних.
Согласно пятому положению, степень электролитической диссоциации отличается у разных элементов. Она зависит от природы вещества и его концентрации в растворе.
Ионный обмен
В процессе распада кристаллической решётки образуются ионы и молекулы. Состояние, в котором они пребывают, называют динамическим равновесием. Жидкость, содержащая растворившийся сильный электролит, имеет свойства, обусловленные ионами, а та, в которой присутствует слабый, — ещё и молекулами. Например, уксусная кислота обладает характерными вкусом и запахом. Первое свойство объясняется присутствием ионов, второе — содержанием молекул.
Есть ряд характеристик, общих для всех растворов, содержащих сильный электролитический компонент. Так, щёлочи мыльные на ощупь, при этом они способны изменять цвет индикаторов. Эти характеристики объясняются наличием гидроксид-ионов. Растворимые соли приобретают свои характеристики в связи с тем, что в растворенном виде они распадаются на анионы и катионы. Идентичные характеристики кислот обусловлены тем, что в их составе присутствуют ионы оксония H3O.
Некоторые реакции в электролитных растворах протекают с высокой скоростью. Это обусловлено тем, что в них участвуют ионы. Формулы, описывающие эти процессы, называют ионными. Так же именуют и реакции, при этом их классифицируют на обратимые, протекающие до конца, и необратимые. Во втором случае процесс одновременно протекает в прямом и обратном направлениях. Когда ионы вступают в необратимую реакцию, они соединяются и образуют следующие типы элементов и соединений:
Будет ли реакция обратимой, зависит от того, какие химические элементы есть среди исходных. Если это малорастворимые компоненты или слабые электролиты, диссоциация протекает одновременно с ассоциацией. Следовательно, наблюдается обратимое явление. Для него характерно смещение равновесия. Образуется слабый электролит, при этом остаются гидроксид-ионы и недиссоциированные молекулы.
Если исходные компоненты представляют собой сильные электролиты, диссоциация не происходит. При взаимодействии образуется смесь ионов, при этом реакция не протекает. Сильные электролиты не образуют газов, малодиссоциирующих или нерастворимых веществ. Сколько и какого вещества образуется в результате реакции, определяют с помощью уравнений. Например, при распаде 1 моль нитрата аммония возникает 2 моль анионов и катионов.