В чем заключается взаимодействие блоков мозга
Нейроны и нейромедиаторы
Химические цепочки
Все чувства и эмоции, которые испытывают люди, возникают путем химических изменений в головном мозге. Прилив радости, который человек ощущает после получения положительной оценки, выигрыша в лотерею или при встрече с любимым, происходит вследствие сложных химических процессов в головном мозге. Мы можем испытывать огромное количество эмоций, например таких, как печаль, горе, тревога, страх, изумление, отвращение, экстаз, умиление. Если мозг дает телу команду на осуществление какого-либо действия, например, сесть, повернуться или бежать, это также обусловлено химическими процессами. «Химический язык» нашей нервной системы состоит из отдельных «слов», роль которых исполняют нейромедиаторы (их еще называют нейротрансмиттерами).
Любой нейрон может получать большое количество химических сообщений, как положительных, так и отрицательных («работай» или «стоп»), от других нейронов, которые его окружают. Эти сообщения могут конкурировать или «сотрудничать», между собой, заставляя нейрон отвечать специфическим образом. Поскольку все эти события происходят в течение очень короткого времени (считаные доли секунды), очевидно, что медиатор должен быть удален из синаптического пространства очень быстро, чтобы те же самые рецепторы могли работать снова и снова. И это удаление может происходить тремя способами. Молекулы нейромедиатора могут быть захвачены назад в то нервное окончание, из которого они были выделены, и этот процесс получил название «обратный захват» («reuptake»); нейромедиатор может быть разрушен специфическими ферментами, находящимися в готовности недалеко от рецепторов на поверхности нейрона; или активное вещество может просто рассеяться в окружающую область мозга, и быть разрушено там.
Изменение нейротрансмиссии с помощью лекарств
Рассмотрим, что происходит при изменении уровней нейромедиаторов мозга на примере трех из них (серотонин, дофамин и гамма-аминомасляная кислота (ГАМК).
Серотонин
Многие исследования показывают, что низкий уровень серотонина в головном мозге приводит к депрессии, импульсивным и агрессивным формам поведения, насилию, и даже самоубийствам. Лекарственные вещества под названием антидепрессанты создают блок на пути обратного захвата серотонина, тем самым несколько увеличивая время его нахождения в пространстве синапса. Как итог, в целом увеличивается количество серотонина, участвующего в передаче сигналов с нейрона на нейрон, и депрессия со временем проходит.
В последние годы ведутся бурные дискуссии вокруг психического расстройства, носящего название «синдром дефицита внимания с 
Наркотическое вещество, известное как «экстази» или МДМА, также изменяет уровень серотонина в мозге, но намного более радикально. Он заставляет выделяющие серотонин нейроны выплескивать все содержимое сразу, затапливая этим химикатом весь мозг, что, конечно, вызывает ощущение чрезвычайного счастья и гиперактивность (чрезмерную двигательную активность). Однако, за это приходится расплачиваться позже. После того как экстази израсходовал весь мозговой запас серотонина, включаются компенсаторные механизмы, быстро разрушающие избыток нейромедиатора в мозге. После того, как спустя несколько часов действие наркотика заканчивается, человек, вероятно, будет чувствовать себя подавленным. Этот период «депрессии» продлится до тех пор, пока мозг не сможет восполнить запасы и обеспечить нормальный уровень медиатора. Повторное использование на этом фоне экстази может привести к глубокой депрессии или другим проблемам, которые будут тянуться в течение долгого времени.
Дофамин
Ученые обнаружили, что люди с расстройством психики, известным как шизофрения, фактически чрезмерно чувствительны к дофамину в мозге. Как следствие, при лечении шизофрении используются лекарства, которые блокируют дофаминовые в головном мозге, таким образом, ограничивая воздействие этого нейромедиатора.
С другой стороны, вещества, известные как амфетамины, увеличивают уровень дофамина, заставляя нейроны его высвобождать, и препятствуя его обратному захвату. В некоторых странах врачи используют разумные дозы этих препаратов при лечении некоторых заболеваний, например, синдрома гиперактивности с дефицитом внимания. Тем не менее, иногда люди абсолютно необдуманно неправильно используют эти вещества, пытаясь обеспечить себе повышенный уровень бодрствования и способность решать любые задачи.
Гамма-аминомасляная кислота
Гамма-аминомасляная кислота, или ГАМК, является главным медиатором, чья роль заключается в передаче нейронам команды «стоп». Исследователи полагают, что определенные типы эпилепсии, которые характеризуются повторными припадками, затрагивающими сознание человека и его двигательную сферу, могут являться результатом снижения содержания ГАМК в головном мозге. Передающая система мозга, не имея адекватного «тормоза», входит в состояние перегрузки, когда десятки тысяч нейронов начинают сильно и одновременно посылать свои сигналы, что приводит к эпилептическому приступу. Ученые полагают, что за разрушение слишком большого количества ГАМК могут быть ответственны мозговые ферменты, в связи с чем появились лекарства, которые помогают остановить этот процесс. Время показало их эффективность в лечении не только эпилепсии, но и некоторых других нарушений работы мозга.
Гормоны
Химическое взаимодействие
В чем заключается взаимодействие блоков мозга
Ожидайте
Перезвоните мне
Ваш персональный менеджер: Маргарита
Ответственная и отзывчивая! 😊
Аннотация: 3 блока мозга как структурно-функциональная модель.
Статья:
3 блока мозга как структурно-функциональная модель. Признаки нарушения в развитии блоков мозга
В начале 20 века А.Р. Лурия разделил (условно) мозг человека на 3 функциональных блока, взаимодействие которых необходимо для любой психической деятельности.
1-й блок мозга преимущественно ответствен и за эмоциональное «подкрепление» психической деятельности (переживание успеха – неуспеха).
Этот блок мозга участвует в организации внимания, памяти, эмоционального состояния (особенно страх, боль, удовольствие, гнев), перерабатывает разнообразную информацию о состоянии внутренних органов и регулирует эти состояния, а так же поддерживает общий тонус ЦНС.
Все, что происходит с мамой во время беременности (болезни, психотравмы, прием лекарств и т.д.) откладывает свой отпечаток на формирование 1 блока мозга.
2 блок – приема, переработки и хранения информации – формируется от 3х до 7 лет и включает в себя основные анализаторные системы: зрительную, слуховую и кожно-кинестетическую, корковые зоны которые расположены в задних отделах больших полушарий головного мозга.
Поражение третичных зон приводит к нарушению комплексного синтеза раздражений, поступающих от разных анализаторов, что проявляется в нарушении ориентировки в пространстве.
Основные принципы функциональной организации мозга. Концепция А.Р. Лурия о трех блоках мозга
Основные принципы функциональной организации мозга. Концепция А.Р. Лурия о трех блоках мозга.
Три функциональных блока мозга (А.Р. Лурия):
Верхние, «ассоциативные», слои мозговой коры играют важную роль в осуществлении наиболее сложных форм психической деятельности, становление которых происходит на поздних ступенях филогенеза и на поздних этапах развития человека.
Важным анатомическим фактом, является неравномерность распределения отдельных слоев коры в топографически различных участках коры головного мозга.
Факты показывают, что над каждой первичной областью мозговой коры, в которой преобладают низшие (афферентные или эфферентные) слои коры, надстраиваются вторичные области, в которых преобладают верхние (проекционно-ассоциационные) слои, играющие, существенную роль в функциональной организации работы отдельных анализаторов.
Концепция структурно-функциональных блоков мозга А. Р. Лурия
А. Р. Лурия предложил структурно-функциональную модель мозга как субстрата психической деятельности. Эта модель характеризует наиболее общие закономерности работы мозга как единого целого и позволяет объяснить его интегративную функцию (Е. Д. Хомская).
Согласно этой модели, весь мозг можно разделить на три структурно-функциональных блока:
а) Энергетический блок,
б) Блок приема, переработки и хранения экстероцептивной информации,
в) Блок программирования, регуляции и контроля сложных форм деятельности.
Первый функциональный блок мозга
Первый блок — это блок регуляции энергетического тонуса и бодрствования.
Было доказано (И. П. Павлов, А. Р. Лурия, М. Н. Ливанов), что для нормальной психической деятельности организм должен находиться в состоянии бодрствования (иными словами, кора больших полушарий должна находиться в состоянии тонуса, т. е. иметь определенный уровень возбуждения).
Только в условиях оптимального бодрствования человек может наилучшим образом принимать и перерабатывать информацию, вызывать в памяти нужные системы связей, программировать деятельность, осуществлять контроль над ней.
Было установлено, что аппараты, обеспечивающие и регулирующие тонус коры, находятся не в самой коре, а в лежащих ниже стволовых и корковых отделах мозга.
Таким аппаратом являются неспецифические структуры разных уровней:
Ретикулярная формация представляет собой нервную сеть, в которую вкраплены тела нейронов с короткими аксонами.
Ретикулярная формация имеет ряд особенностей строения и функционирования, благодаря которым обеспечиваются ее основные функции:
Наличие многочисленных связей в самой ретикулярной формации, конвергенция всех нервных путей на большей части ее нейронов создают дополнительные возможности широкого и одновременного распространения волн возбуждения в первичные, вторичные и третичные зоны коры, а также другие структуры мозга.
Как известно, нервная система всегда находится в состоянии определенной активности и для любого проявления жизнедеятельности обязательно ее наличие.
Принято выделять несколько источников активности: в первую очередь, обменные процессы организма, лежащие в основе гомеостаза (белковый, углеводный и т. д.). Затем непосредственный приток информации, поступающей в организм из внешнего мира (от экстерорецепторов).
Известно, что в состоянии сенсорной депривации человек впадает в сон, из которого его может вывести лишь поступление новой информации.
Перечисленные источники активности свойственны и человеку, и животным. Но у человека помимо этого значительная часть активности обусловлена его планами, намерениями, программами. Формируясь в процессе сознательной жизни, они являются социальными по своему заказу и осуществляются при ближайшем участии сначала внешней, а потом внутренней речи.
Функциональное значение первого блока в обеспечении психических функций заключается,
При поражении ретикулярной формации снижается продуктивность всех ВПФ (в первую очередь — непроизвольного внимания и памяти), нарушается активность, сон.
В случае массивных поражений ретикулярной формации стирается грань между сном и бодрствованием, человек находится в полусонном состоянии, у него страдает ориентировка во времени и месте.
Отличительными диагностическими признаками поражения ретикулярной формации является одновременное снижение продуктивности абсолютно всех психических процессов, а также возможность частичной компенсации дефекта за счет усложнения задания.
Вовлечение произвольных процессов и специальная мотивация позволяют ненадолго повысить эффективность психических процессов.
Таким образом, первый блок мозга участвует в обеспечении психической деятельности, в первую очередь в организации внимания, памяти, эмоционального состояния и сознания в целом.
Кроме того, первый блок мозга участвует в регуляции эмоциональных (страх, боль, удовольствие, гнев) и мотивационных состояний.
Лимбические структуры мозга, входящие в этот блок, занимают центральное место в организации эмоциональных и мотивационных состояний.
В связи с этим первый блок мозга воспринимает и перерабатывает разнообразную интероцептивную информацию о состоянии внутренних органов и регулирует эти состояния.
Второй функциональный блок мозга
Второй блок — блок приема, переработки и хранения информации – расположен в наружных отделах новой коры (неокортекса) и занимает ее задние отделы, включая в свой состав аппараты затылочной, височной и теменной коры.
Структурно-анатомической особенностью этого блока мозга является шестислойное строение коры.
Отличительной особенностью аппаратов второго блока является модальная специфичность.
Эксперименты по регистрации активности отдельных нейронов показали, что нервные клетки первичных зон отличаются высокой модальной специфичностью и узкой специализацией.
Первое означает, что они реагирует на возбуждение только одной модальности (одного вида), например, только зрительное или только слуховое.
Второе предполагает, что эти нейроны реагируют лишь на отдельный признак раздражителя одного вида (например, только на ширину линии или угол наклона и т. п.).
Благодаря этому аппараты второго функционального блока мозга выполняют функции приема и анализа информации, поступающей от внешних рецепторов и синтеза этой информации.
Основные законы построения коры, входящей в состав второго блока мозга
А. Р. Лурия выделяет основные законы построения коры, входящей в состав второго блока мозга.
1. Закон иерархического строения корковых зон.
Согласно этому закону соотношение первичных, вторичных и третичных зон коры осуществляет все более сложный синтез информации.
Более сложно организованные зоны коры обеспечивают более сложные функции.
А. Р. Лурия подчеркивает, что соотношение первичных, вторичных и третичных зон у взрослого и у ребенка различно.
Для нормального развития вторичных зон у ребенка необходимо, чтобы были сформированы первичные, а для развития третичных — вторичные зоны.
Поэтому поражение первичных зон в раннем детстве может приводить к грубым нарушениям в развитии вторичных и, тем более, третичных зон.
У взрослого же человека, при сформированных зонах коры, третичные, наиболее организованные, управляют функцией ниже лежащих вторичных и первичных зон. Поэтому у взрослого человека взаимодействие зон коры осуществляется сверху вниз.
В данном случае поражение первичных зон не приводит к заметным нарушениям психических функций и может компенсироваться работой расположенных рядом структур.
2. Закон убывающей модальной специфичности иерархически построенных корковых зон.
Этот закон предполагает, что по мере перехода от первичных зон к третичным снижается проявление их модальной специфичности.
Первичные зоны каждой из долей мозга, входящих во второй блок мозга, обладают максимальной модальной специфичностью (благодаря громадному числу нейронов с высокодифференцированной, модально-специфической функцией).
Вторичные зоны, в которых преобладают верхние слои с ассоциативными нейронами, обладают модальной специфичностью в значительно меньшей степени.
Еще меньше модальная специфичность характерна для третичных зон описываемого блока («зоны перекрытия» корковых концов различных анализаторов).
Таким образом, этот закон описывает переход от дробного отражения частных, модально-специфических признаков к синтетическому отражению более общих схем воспринимаемого мира.
3. Закон прогрессивной латерализации функций.
Закон прогрессивной латерализации функций объясняет связь функций с определенным полушарием (по мере перехода от первичных зон к третичным зонам).
Первичные зоны обоих полушарий мозга равноценны. На уровне вторичных зон часть функций, выполняемых левым и правым полушариями, остаются одинаковыми, но часть функций левого полушария уже отличаются от функций, выполняемых правым полушарием мозга.
Функции же третичных зон левого полушария уже коренным образом отличаются от функций аналогичных зон правого полушария мозга.
При поражении аппаратов второго блока мозга нарушение функций зависит от того, какие именно зоны пострадали.
При поражении первичных зон возникает нарушение восприятия отдельных признаков воспринимаемого раздражителя одной модальности (слепое пятно, гемеанопсия, нарушение тон-шкалы, анестезия и т. д.).
При поражении вторичных зон коры наблюдается нарушение синтеза отдельных признаков воспринимаемого раздражителя в целостный образ одной модальности (агнозии, афазии).
Поражение третичных зон приводит к нарушению комплексного синтеза раздражений, поступающих от разных анализаторов, что проявляется в нарушении ориентировки в пространстве.
Причем, согласно закону прогрессивной латерализации, при поражении третичных зон правого полушария нарушается предметная ориентировка в пространстве, а при поражении аналогичных зон левого полушария — страдает символическая ориентировка в пространстве.
Третий функциональный блок мозга
Третий функциональный блок мозга — блок программирования, регуляции и контроля сложных форм деятельности.
Он связан с организацией целенаправленной, сознательной психической активности, которая включает в свою структуру цель, мотив, программу действий по достижению цели, выбор средств, контроль за выполнением действий, коррекцию полученного результата. Обеспечению этих задач и служит третий блок мозга.
Аппараты третьего функционального блока мозга расположены кпереди от центральной лобной извилины и включают в свой состав моторные, премоторные и префронтальные отделы коры лобных долей мозга.
Лобные доли отличаются очень сложным строением и большим числом двусторонних связей со многими корковыми и подкорковыми структурами.
Отличительной особенностью этого блока является:
По своей структуре и функциональной организации моторная кора относится к первичным, премоторная — к вторичным, а префронтальная — к третичным зонам коры больших полушарий.
Поэтому они выполняют функции, характерные для этих зон.
Нейроны моторной коры передают возбуждение к мышцам, отсюда начинается большой пирамидный путь. Именно эти зоны имеют ярко выраженную соматотопическую организацию, что наглядно проиллюстрировал Пенфилд («двигательный человечек»).
Премоторная кора обеспечивает двигательные программы, т. е. объединяет отдельные движения в единую кинетическую мелодию.
Префронтальные отделы играют решающую роль в формировании намерений, программ, в регуляции и контроле наиболее сложных форм поведения человека. Они состоят из мелкозернистых клеток с короткими аксонами и обладают мощными пучками восходящих и нисходящих связей с ретикулярной формацией.
Поэтому могут выполнять ассоциативную функцию, получая импульсы от первого блока мозга и оказывать интенсивное модулирующее влияние на образования ретикулярной формации, приводя ее активирующие импульсы в соответствие с динамическими схемами поведения, которые формируются непосредственно в префронтальной (лобной) коре.
Префронтальные отделы фактически надстроены над всеми отделами мозговой коры, выполняя функцию общей регуляции поведения.
При поражении третьего функционального блока мозга характер нарушения функций связан с тем, какой именно аппарат поврежден.
При поражении моторной коры затрудняется проведение возбуждения к конкретным мышцам (наблюдаются парезы и параличи отдельных групп мышц).
Поражение премоторной коры приводит к нарушению синтеза отдельных движений в единое целое (распад двигательных навыков), поражение префронтальных отделов проявляется в нарушении сознательной целенаправленной деятельности.
Исследования А. Р. Лурия показали, что в этом случае целенаправленное поведение заменяется «полевым» поведением, нарушается программа выполняемой деятельности, лобный больной не может подобрать адекватные средства деятельности, отсутствует контроль за ее выполнением и коррекция ошибок. При этом наблюдается персеверация (повторяемость) и стереотипизация движений.
Анализ особенностей строения и функционирования трех функциональных блоков мозга позволяет предположить, что каждая форма сознательной деятельности всегда является сложной функциональной системой и осуществляется, опираясь на совместную работу всех трех блоков мозга, каждый из которых вносит свой вклад в обеспечение всего психического процесса в целом.
Выделение этих блоков достаточно условно.
Аппараты первого блока мозга обеспечивают необходимый уровень активации остальных блоков, второй блок отвечает за прием, анализ и переработку информации, поступающей из внешней среды, от экстерорецепторов.
С одной стороны, эта информация составляет основу для интегративной деятельности третьего блока, а с другой — является одним из источников активности первого блока.
Роль третьего блока проявляется в его интегрирующей, регулирующей, модулирующей функции. Обеспечивая важный этап в переработке информации, аппараты третьего блока оказывают модулирующее влияние и на первый и на второй блоки, что приводит как к изменению уровня активации коры, с одной стороны, так и к изменению порогов ощущения и восприятия — с другой.
Анализируя взаимодействие блоков мозга с точки зрения деятельности, следует отметить, что первый блок участвует в формировании мотивов любой сознательной деятельности, второй — обеспечивает операциональную сторону деятельности, а третий — отвечает за формирование целей и программ деятельности.
Нарушение работы каждого из этих блоков обязательно приводит к дезинтеграции психической деятельности в целом, но каждый раз по-разному, так как приводит к нарушению соответствующих стадий деятельности.
Мозг, общение нейронов и энергетическая эффективность
По всей видимости, в эволюции сформировались энергетически эффективные механизмы кодирования и передачи информации в мозге. Подпись: «Усердно пытаюсь минимизировать энергозатраты».
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Клеточные процессы, обеспечивающие обмен информацией между нейронами, требуют много энергии. Высокое энергопотребление способствовало в ходе эволюции отбору наиболее эффективных механизмов кодирования и передачи информации. В этой статье вы узнаете о теоретическом подходе к изучению энергетики мозга, о его роли в исследованиях патологий, о том, какие нейроны более продвинуты, почему синапсам иногда выгодно не «срабатывать», а также, как они отбирают только нужную нейрону информацию.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Происхождение подхода
С середины ХХ века известно, что головной мозг потребляет значительную часть энергоресурсов всего организма: четверть всей глюкозы и ⅕ всего кислорода в случае высшего примата [1–5]. Это вдохновило Уильяма Леви и Роберта Бакстера из Массачусетского технологического института (США) на проведение теоретического анализа энергетической эффективности кодирования информации в биологических нейронных сетях (рис. 1) [6]. В основе исследования лежит следующая гипотеза. Поскольку энергопотребление мозга велико, ему выгодно иметь такие нейроны, которые работают наиболее эффективно — передают только полезную информацию и затрачивают при этом минимум энергии.
Это предположение оказалось справедливым: на простой модели нейронной сети авторы воспроизвели экспериментально измеренные значения некоторых параметров [6]. В частности, рассчитанная ими оптимальная частота генерации импульсов варьирует от 6 до 43 имп./с — почти так же, как и у нейронов основания гиппокампа. Их можно подразделить на две группы по частоте импульсации: медленные (
40 имп./с). При этом первая группа значительно превосходит по численности вторую [7]. Аналогичная картина наблюдается и в коре больших полушарий: медленных пирамидальных нейронов (
4—9 имп./с) в несколько раз больше, чем быстрых ингибиторных интернейронов (>100 имп./с) [8], [9]. Так, видимо, мозг «предпочитает» использовать поменьше быстрых и энергозатратных нейронов, чтобы те не израсходовали все ресурсы [6], [9–11].
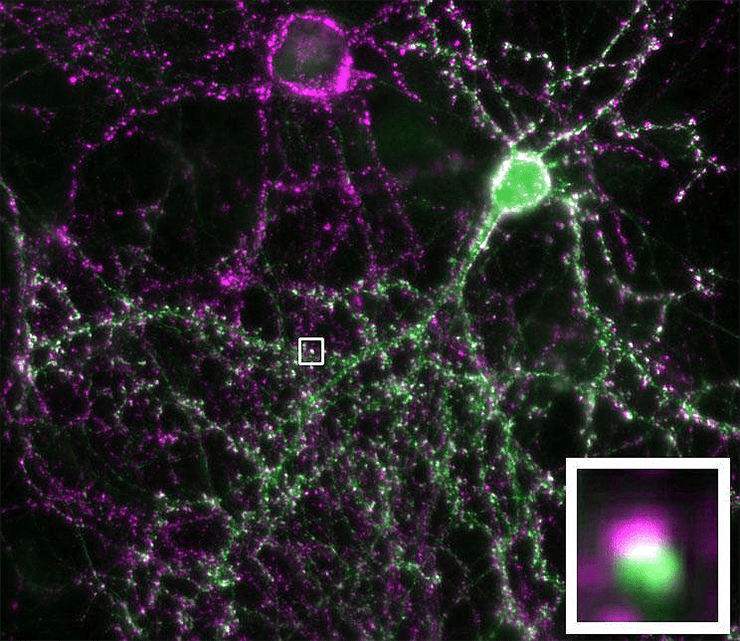
Рисунок 1. Представлены два нейрона. В одном из них фиолетовым цветом окрашен пресинаптический белок синаптофизин. Другой нейрон полностью окрашен зеленым флуоресцентным белком. Мелкие светлые крапинки — синаптические контакты между нейронами [12]. Во вставке одна «крапинка» представлена ближе.
Группы нейронов, связанных между собой синапсами, называются нейронными сетями [13], [14]. Например, в коре больших полушарий пирамидальные нейроны и интернейроны образуют обширные сети. Слаженная «концертная» работа этих клеток обусловливает наши высшие когнитивные и другие способности. Аналогичные сети, только из других типов нейронов, распределены по всему мозгу, определенным образом связаны между собой и организуют работу всего органа.
Что такое интернейроны?
Нейроны центральной нервной системы разделяются на активирующие (образуют активирующие синапсы) и тормозящие (образуют тормозящие синапсы). Последние в значительной степени представлены интернейронами, или промежуточными нейронами. В коре больших полушарий и гиппокампе они ответственны за формирование гамма-ритмов мозга [15], которые обеспечивают слаженную, синхронную работу других нейронов. Это крайне важно для моторных функций, восприятия сенсорной информации, формирования памяти [9], [11].
Интернейроны отличаются способностью генерировать значительно более высокочастотные сигналы, чем другие нейроны. Они также содержат больше митохондрий, главных органелл энергетического метаболизма, «фабрик» по производству АТФ. Последние к тому же содержат большое количество белков цитохром-с оксидазы и цитохрома-с, являющихся ключевыми для метаболизма. Так, интернейроны являются крайне важными и, в то же время, энергозатратными клетками [8], [9], [11], [16].
Работа Леви и Бакстера [6] развивает концепцию «экономии импульсов» Горация Барлоу из Университета Калифорнии (США), который, кстати, является потомком Чарльза Дарвина [17]. Согласно ей, при развитии организма нейроны стремятся работать только с наиболее полезной информацией, фильтруя «лишние» импульсы, ненужную и избыточную информацию. Однако эта концепция не дает удовлетворительных результатов, так как не учитывает метаболические затраты, связанные с нейрональной активностью [6]. Расширенный подход Леви и Бакстера, в котором внимание уделено обоим факторам, оказался более плодотворным [6], [18–20]. И энергозатраты нейронов, и потребность в кодировании только полезной информации являются важными факторами, направляющими эволюцию мозга [6], [21–24]. Поэтому, чтобы лучше разобраться в том, как устроен мозг, стоит рассматривать обе эти характеристики: сколько нейрон передает полезной информации и сколько энергии при этом тратит.
За последнее время этот подход нашел множество подтверждений [10], [22], [24–26]. Он позволил по-новому взглянуть на устройство мозга на самых разных уровнях организации — от молекулярно-биофизического [20], [26] до органного [23]. Он помогает понять, каковы компромиссы между выполняемой функцией нейрона и ее энергетической ценой и в какой степени они выражены.
Как же работает этот подход?
Положим, у нас есть модель нейрона, описывающая его электрофизиологические свойства: потенциал действия (ПД) и постсинаптические потенциалы (ПСП) (об этих терминах — ниже). Мы хотим понять, эффективно ли он работает, не тратит ли неоправданно много энергии. Для этого нужно вычислить значения параметров модели (например, плотность каналов в мембране, скорость их открывания и закрывания), при которых: (а) достигается максимум отношения полезной информации к энергозатратам и в то же время (б) сохраняются реалистичные характеристики передаваемых сигналов [6], [19].
Поиск оптимума
Эти «оптимальные» значения параметров затем нужно сравнить с измеренными экспериментально и определить, насколько они отличаются. Общая картина отличий укажет на степень оптимизации данного нейрона в целом: насколько реальные, измеренные экспериментально, значения параметров совпадают с рассчитанными. Чем слабее выражены отличия, тем нейрон более близок к оптимуму и работает энергетически более эффективно, оптимально. С другой стороны, сопоставление конкретных параметров покажет, в каком конкретно качестве этот нейрон близок к «идеалу».
Далее, в контексте энергетической эффективности нейронов рассмотрены два процесса, на которых основано кодирование и передача информации в мозге. Это нервный импульс, или потенциал действия, благодаря которому информация может быть отправлена «адресату» на определенное расстояние (от микрометров до полутора метров) и синаптическая передача, лежащая в основе собственно передачи сигнала от одного нейрона на другой.
Потенциал действия
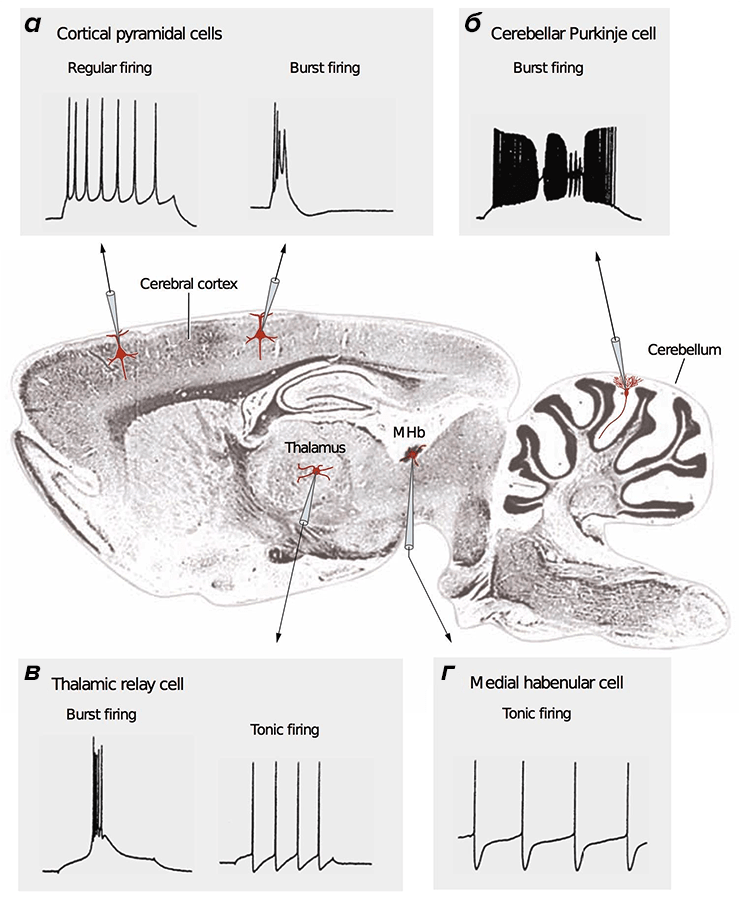
Потенциал действия (ПД) — сигнал, которые отправляют друг другу нейроны. ПД бывают разные: быстрые и медленные, малые и большие [28]. Зачастую они организованы в длинные последовательности (как буквы в слова), либо в короткие высокочастотные «пачки» (рис. 2).
Большое разнообразие сигналов обусловлено огромным количеством комбинаций разных типов ионных каналов, синаптических контактов, а также морфологией нейронов [28], [29]. Поскольку в основе сигнальных процессов нейрона лежат ионные токи, стоит ожидать, что разные ПД требуют различных энергозатрат [20], [27], [30].
Что такое потенциал действия?
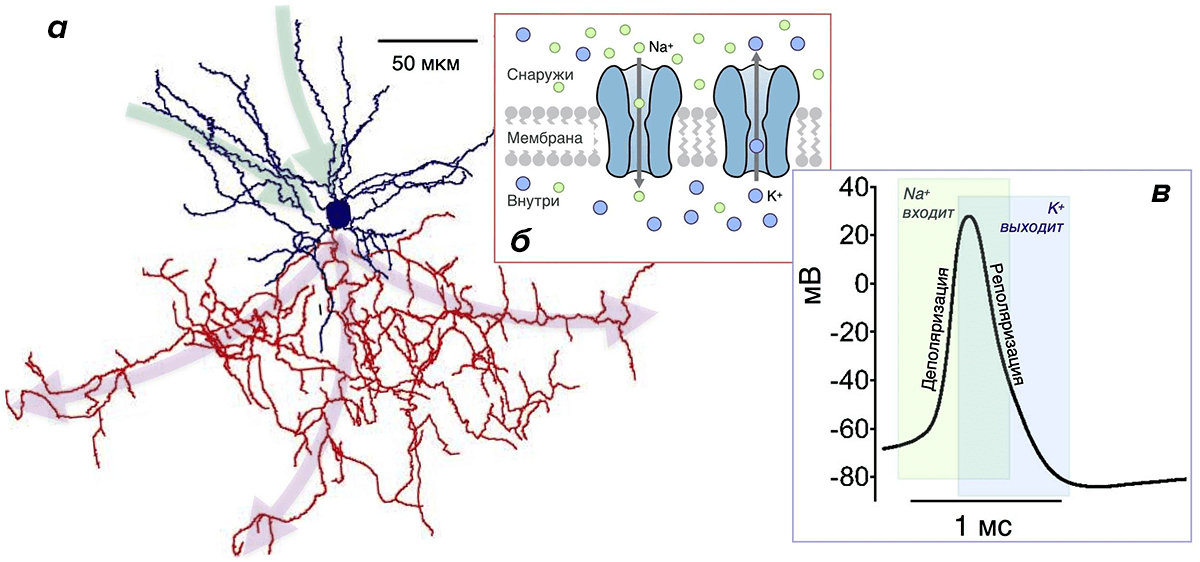
ПД — это относительно сильное по амплитуде скачкообразное изменение мембранного потенциала.
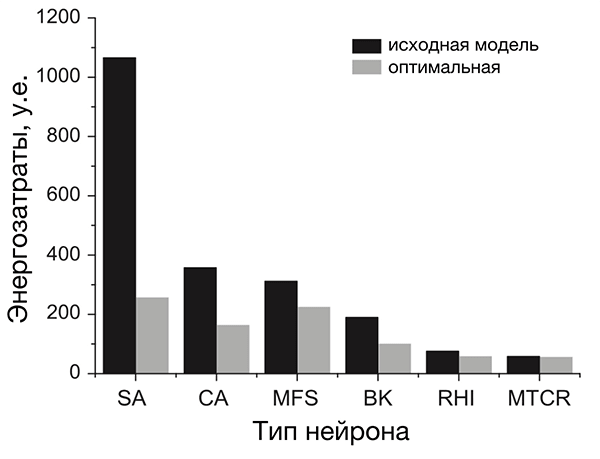
Анализ разных типов нейронов (рис. 4) показал, что нейроны беспозвоночных не очень энергоэффективны, а некоторые нейроны позвоночных почти совершенны [20]. По результатам этого исследования, наиболее энергоэффективными оказались интернейроны гиппокампа, участвующего в формировании памяти и эмоций, а также таламокортикальные релейные нейроны, несущие основной поток сенсорной информации от таламуса к коре больших полушарий.
Рисунок 4. Разные нейроны эффективны по-разному. На рисунке представлено сравнение энергозатрат разных типов нейронов. Энергозатраты рассчитаны в моделях как с исходными (реальными) значениями параметров (черные столбцы), так и с оптимальными, при которых с одной стороны нейрон выполняет положенную ему функцию, с другой — затрачивает при этом минимум энергии (серые столбцы). Самыми эффективными из представленных оказались два типа нейронов позвоночных: интернейроны гиппокампа (rat hippocampal interneuron, RHI) и таламокортикальные нейроны (mouse thalamocortical relay cell, MTCR), так как для них энергозатраты в исходной модели наиболее близки к энергозатратам оптимизированной. Напротив, нейроны беспозвоночных менее эффективны. Условные обозначения: SA (squid axon) — гигантский аксон кальмара; CA (crab axon) — аксон краба; MFS (mouse fast spiking cortical interneuron) — быстрый кортикальный интернейрон мыши; BK (honeybee mushroom body Kenyon cell) — грибовидная клетка Кеньона пчелы.
Почему они более эффективны? Потому что у них малó перекрывание Na- и К-токов. Во время генерации ПД всегда есть промежуток времени, когда эти токи присутствуют одновременно (рис. 3в). При этом переноса заряда практически не происходит, и изменение мембранного потенциала минимально. Но «платить» за эти токи в любом случае приходится, несмотря на их «бесполезность» в этот период. Поэтому его продолжительность определяет, сколько энергетических ресурсов растрачивается впустую. Чем он короче, тем более эффективно использование энергии [20], [26], [30], [43]. Чем длиннее — тем менее эффективно. Как раз в двух вышеупомянутых типах нейронов, благодаря быстрым ионным каналам, этот период очень короткий, а ПД — самые эффективные [20].
Кстати, интернейроны гораздо более активны, чем большинство других нейронов мозга. В то же время они крайне важны для слаженной, синхронной работы нейронов, с которыми образуют небольшие локальные сети [9], [16]. Вероятно, высокая энергетическая эффективность ПД интернейронов является некой адаптацией к их высокой активности и роли в координации работы других нейронов [20].
Синапс
Передача сигнала от одного нейрона к другому происходит в специальном контакте между нейронами, в синапсе [12]. Мы рассмотрим только химические синапсы (есть еще электрические), поскольку они весьма распространены в нервной системе и важны для регуляции клеточного метаболизма, доставки питательных веществ [5].
Чаще всего, химический синапс образован между окончанием аксона одного нейрона и дендритом другого. Его работа напоминает. «переброс» эстафетной палочки, роль которой и играет нейромедиатор — химический посредник передачи сигнала [12], [42], [44–48].
На пресинаптическом окончании аксона ПД вызывает выброс нейромедиатора во внеклеточную среду — к принимающему нейрону. Последний только этого и ждет с нетерпением: в мембране дендритов рецепторы — ионные каналы определенного типа — связывают нейромедиатор, открываются и пропускают через себя разные ионы. Это приводит к генерации маленького постсинаптического потенциала (ПСП) на мембране дендрита. Он напоминает ПД, но значительно меньше по амплитуде и происходит за счет открывания других каналов. Множество этих маленьких ПСП, каждый от своего синапса, «сбегаются» по мембране дендритов к телу нейрона (зеленые стрелки на рис. 3а) и достигают начального сегмента аксона, где вызывают открывание Na-каналов и «провоцируют» его на генерацию ПД.
Такие синапсы называются возбуждающими: они способствуют активации нейрона и генерации ПД. Существуют также и тормозящие синапсы. Они, наоборот, способствуют торможению и препятствуют генерации ПД. Часто на одном нейроне есть и те, и другие синапсы. Определенное соотношение между торможением и возбуждением важно для нормальной работы мозга, формирования мозговых ритмов, сопровождающих высшие когнитивные функции [49].
Как это ни странно, выброс нейромедиатора в синапсе может и не произойти вовсе — это процесс вероятностный [18], [19]. Нейроны так экономят энергию: синаптическая передача и так обусловливает около половины всех энергозатрат нейронов [25]. Если бы синапсы всегда срабатывали, вся энергия пошла бы на обеспечение их работы, и не осталось бы ресурсов для других процессов. Более того, именно низкая вероятность (20–40%) выброса нейромедиатора соответствует наибольшей энергетической эффективности синапсов. Отношение количества полезной информации к затрачиваемой энергии в этом случае максимально [18], [19]. Так, выходит, что «неудачи» играют важную роль в работе синапсов и, соответственно, всего мозга. А за передачу сигнала при иногда «не срабатывающих» синапсах можно не беспокоиться, так как между нейронами обычно много синапсов, и хоть один из них да сработает.
Еще одна особенность синаптической передачи состоит в разделении общего потока информации на отдельные компоненты по частоте модуляции приходящего сигнала (грубо говоря, частоте приходящих ПД) [50]. Это происходит благодаря комбинированию разных рецепторов на постсинаптической мембране [38], [50]. Некоторые рецепторы активируются очень быстро: например, AMPA-рецепторы (AMPA происходит от α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid). Если на постсинаптическом нейроне представлены только такие рецепторы, он может четко воспринимать высокочастотный сигнал (такой, как, например, на рис. 2в). Ярчайший пример — нейроны слуховой системы, участвующие в определении местоположения источника звука и точном распознавании коротких звуков типа щелчка, широко представленных в речи [12], [38], [51]. NMDA-рецепторы (NMDA — от N—methyl-D—aspartate) более медлительны. Они позволяют нейронам отбирать сигналы более низкой частоты (рис. 2г), а также воспринимать высокочастотную серию ПД как нечто единое — так называемое интегрирование синаптических сигналов [14]. Есть еще более медленные метаботропные рецепторы, которые при связывании нейромедиатора, передают сигнал на цепочку внутриклеточных «вторичных посредников» для подстройки самых разных клеточных процессов. К примеру, широко распространены рецепторы, ассоциированные с G-белками. В зависимости от типа они, например, регулируют количество каналов в мембране или напрямую модулируют их работу [14].
Различные комбинации быстрых AMPA-, более медленных NMDA- и метаботропных рецепторов позволяют нейронам отбирать и использовать наиболее полезную для них информацию, важную для их функционирования [50]. А «бесполезная» информация отсеивается, она не «воспринимается» нейроном. В таком случае не приходится тратить энергию на обработку ненужной информации. В этом и состоит еще одна сторона оптимизации синаптической передачи между нейронами.
Что еще?
Энергетическая эффективность клеток мозга исследуется также и в отношении их морфологии [35], [52–54]. Исследования показывают, что ветвление дендритов и аксона не хаотично и тоже экономит энергию [52], [54]. Например, аксон ветвится так, чтобы суммарная длина пути, который проходит ПД, была наименьшей. В таком случае энергозатраты на проведение ПД вдоль аксона минимальны.
Снижение энергозатрат нейрона достигается также при определенном соотношении тормозящих и возбуждающих синапсов [55]. Это имеет прямое отношение, например, к ишемии (патологическому состоянию, вызванному нарушением кровотока в сосудах) головного мозга. При этой патологии, вероятнее всего, первыми выходят из строя наиболее метаболически активные нейроны [9], [16]. В коре они представлены ингибиторными интернейронами, образующими тормозящие синапсы на множестве других пирамидальных нейронов [9], [16], [49]. В результате гибели интернейронов, снижается торможение пирамидальных. Как следствие, возрастает общий уровень активности последних (чаще срабатывают активирующие синапсы, чаще генерируются ПД). За этим немедленно следует рост их энергопотребления, что в условиях ишемии может привести к гибели нейронов.
При изучении патологий внимание уделяют и синаптической передаче как наиболее энергозатратному процессу [19]. Например, при болезнях Паркинсона [56], Хантингтона [57], Альцгеймера [58–61] происходит нарушение работы или транспорта к синапсам митохондрий, играющих основную роль в синтезе АТФ [62], [63]. В случае болезни Паркинсона, это может быть связано с нарушением работы и гибелью высоко энергозатратных нейронов черной субстанции, важной для регуляции моторных функций, тонуса мышц. При болезни Хантингтона, мутантный белок хангтингтин нарушает механизмы доставки новых митохондрий к синапсам, что приводит к «энергетическому голоданию» последних, повышенной уязвимости нейронов и избыточной активации. Все это может вызвать дальнейшие нарушения работы нейронов с последующей атрофией полосатого тела и коры головного мозга. При болезни Альцгеймера нарушение работы митохондрий (параллельно со снижением количества синапсов) происходит из-за отложения амилоидных бляшек. Действие последних на митохондрии приводит к окислительному стрессу, а также к апоптозу — клеточной гибели нейронов.
Еще раз обо всем
В конце ХХ века зародился подход к изучению мозга, в котором одновременно рассматривают две важные характеристики: сколько нейрон (или нейронная сеть, или синапс) кодирует и передает полезной информации и сколько энергии при этом тратит [6], [18], [19]. Их соотношение является своего рода критерием энергетической эффективности нейронов, нейронных сетей и синапсов.
Использование этого критерия в вычислительной нейробиологии дало существенный прирост к знаниям относительно роли некоторых явлений, процессов [6], [18–20], [26], [30], [43], [55]. В частности, малая вероятность выброса нейромедиатора в синапсе [18], [19], определенный баланс между торможением и возбуждением нейрона [55], выделение только определенного рода приходящей информации благодаря определенной комбинации рецепторов [50] — все это способствует экономии ценных энергетических ресурсов.
Более того, само по себе определение энергозатрат сигнальных процессов (например, генерация, проведение ПД, синаптическая передача) позволяет выяснить, какой из них пострадает в первую очередь при патологическом нарушении доставки питательных веществ [10], [25], [56]. Так как больше всего энергии требуется для работы синапсов, именно они первыми выйдут из строя при таких патологиях, как ишемия, болезни Альцгеймера и Хантингтона [19], [25]. Схожим образом определение энергозатрат разных типов нейронов помогает выяснить, какой из них погибнет раньше других в случае патологии. Например, при той же ишемии, в первую очередь выйдут из строя интернейроны коры [9], [16]. Эти же нейроны из-за интенсивного метаболизма — наиболее уязвимые клетки и при старении, болезни Альцгеймера и шизофрении [16].
В общем, подход к определению энергетически эффективных механизмов работы мозга является мощным направлением для развития и фундаментальной нейронауки, и ее медицинских аспектов [5], [14], [16], [20], [26], [55], [64].
Благодарности
Искренне благодарен моим родителям Ольге Наталевич и Александру Жукову, сестрам Любе и Алене, моему научному руководителю Алексею Браже и замечательным друзьям по лаборатории Эвелине Никельшпарг и Ольге Слатинской за поддержку и вдохновение, ценные замечания, сделанные при прочтении статьи. Я также очень благодарен редактору статьи Анне Петренко и главреду «Биомолекулы» Антону Чугунову за пометки, предложения и замечания.