Vena contracta что это
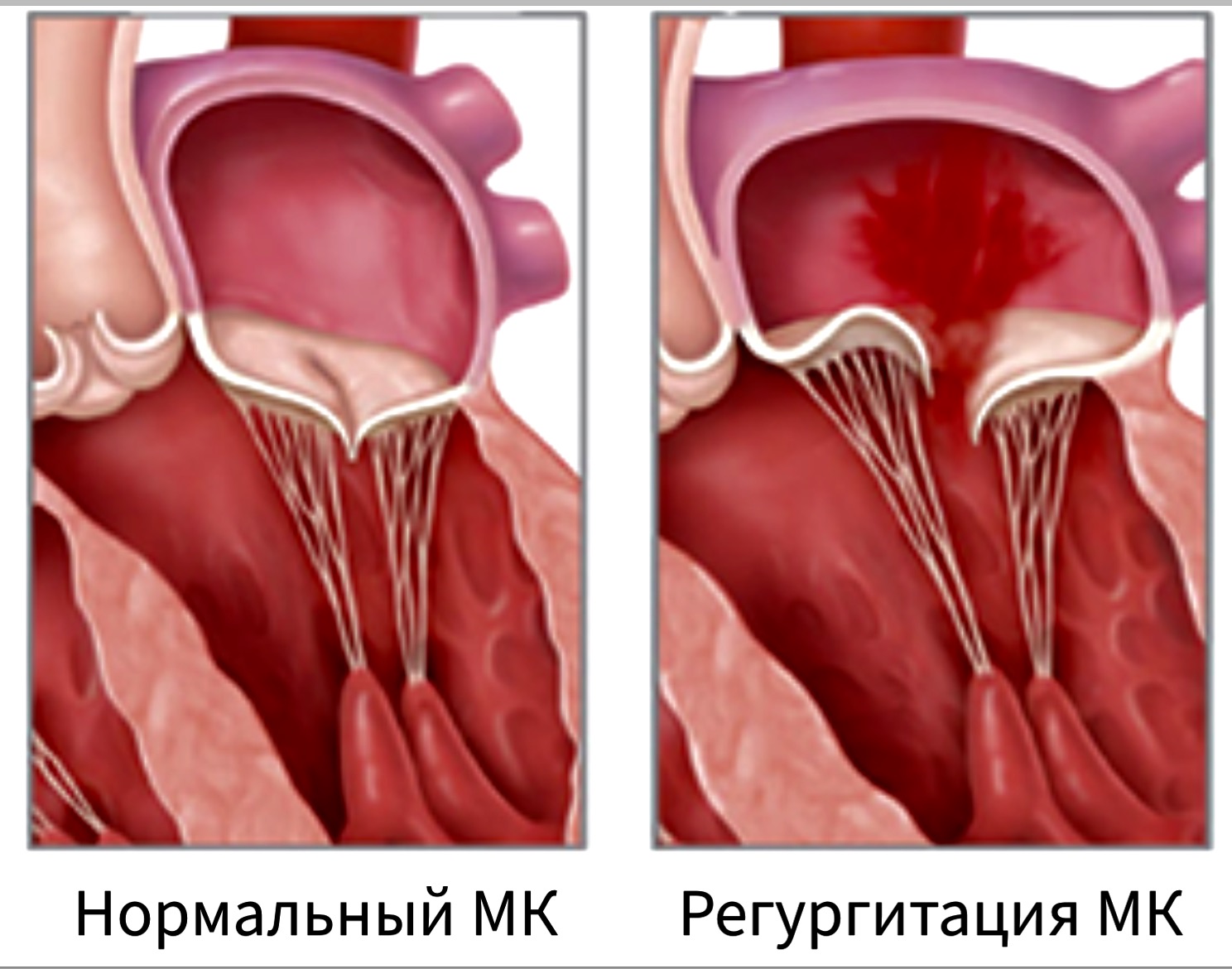
Митральная регургитация
Регургитация митрального клапана (митральная недостаточность, недостаточность митрального клапана, митральная регургитация (МР)) — неспособность митрального клапана предотвратить обратный ток крови из ЛЖ в его систолу в левое предсердие. Термин «митральная регургитация» подразумевает именно обратный ток крови из ЛЖ в левое предсердие, т.е. последствие митральной недостаточности.Тем не менее термины стали практически синонимами.
Этиология
Аппарат митрального клапана представлен створками митрального клапана, сухожильными хордами, папиллярными мышцами и фиброзным кольцом митрального клапана. Патология любой из этих структур может привести к развитию МР.
Наиболее частыми причинами МР служат:
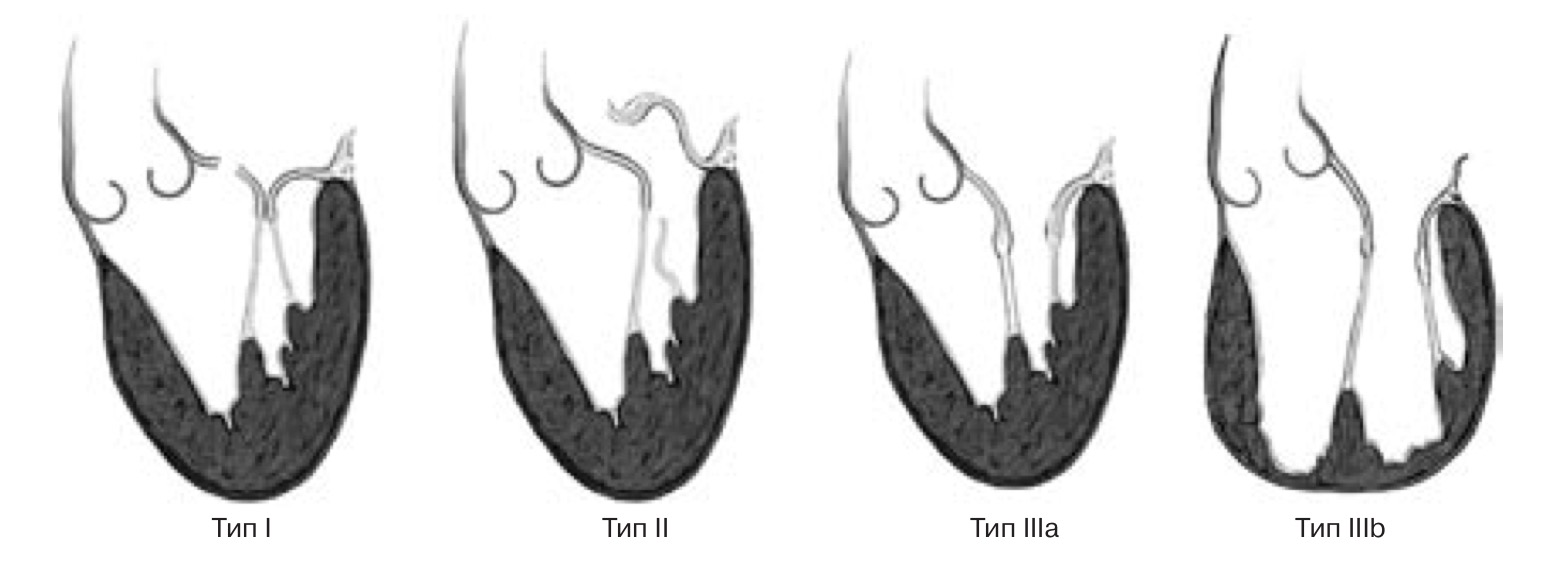
Функциональная классификация митральной регургитации по Carpentier. Классификация диапазона движения митральной створки: тип I – движение не ограничено; тип II – чрезмерная подвижность; тип III – рестрикция подвижности
Клиника
В периоде компенсации, который может длиться несколько лет, возможно бессимптомное течение митральной недостаточности. В стадии субкомпенсации появляются субъективные симптомы, выражающиеся одышкой, быстрой утомляемостью, тахикардией, ангинозными болями, кашлем, кровохарканьем. При нарастании венозного застоя в малом круге могут возникать приступы ночной сердечной астмы. Развитие правожелудочковой недостаточности сопровождается проявлением акроцианоза, периферических отеков, увеличением печени, набуханием шейных вен, асцитом. При компрессии возвратного гортанного нерва расширенным левым предсердием или легочным стволом возникает осиплость голоса или афония (синдром Ортнера). В стадии декомпенсации более чем у половины пациентов с митральной недостаточностью выявляется мерцательная аритмия.
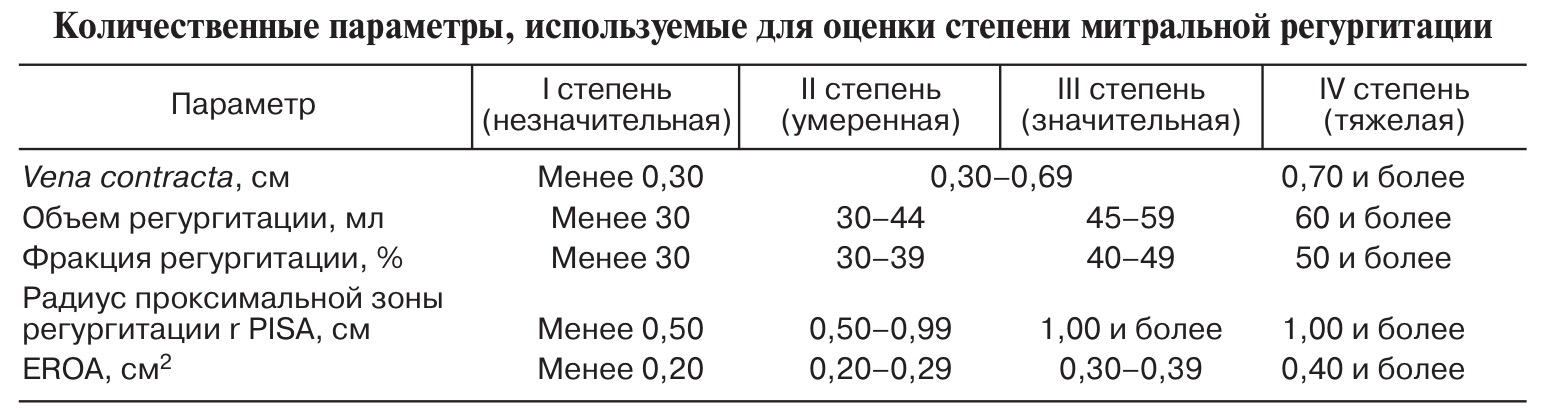
Для оценки степени митральной недостаточности существует целый ряд эхокардиографических показателей. В первую очередь, следует остановиться на таком параметре, как ширина vena contracta – размер конвергентного потока регургитации сразу под створками. Vena contracta коррелирует с диаметром отверстия регургитации и, следовательно, с тяжестью регургитации. Для регургитации легкой степени характерна узкая vena contracta, ширина которой менее 3 мм, при тяжелой МР величина этого параметра 7 мм и больше. Более точные показатели получают в парастернальной проекции по длинной оси сердца. Для оптимизации визуализации vena contracta и повышения точности измерений предпочтительно использовать режим увеличения. Поперечный срез vena contracta признан эффективным просветом регургитации, который также является рекомендуемым методом измерения.
Метод оценки проксимальной изоскоростной поверхности или проксимальной зоны регургитации – способ вычисления эффективной площади отверстия регурги- тации, основанный на оценке зоны конвер- генции потока регургитации. Если он составляет 1,0 см и более, то МР следует считать тяжелой. Определив радиус проксимальной зоны регургитации в начале диастолы, максимальную скорость потока регургитации и зная скорость, при которой появляется эффект aliasing (скоростной предел возникновения феномена разворота спектра), можно рассчитать величину эффективной площади отверстия регургитации согласно интегрированной в аппарат формуле EROA=6,28 R2 × Alias V / MR V. Эффективная площадь отверстия регургитации EROA 0,4 см2 и больше соответствует тяжелой МР, EROA не более 0,2 см2 указывает на регургитацию легкой степени.
Площадь потока (струи) регургитации
определяется при цветовой допплерографии как отношение площади потока регургитации к площади предсердия при пределе Nyquist от 50–60 см/с. Расчет индекса площади потока регургитации получают в четырех- или двухкамерной позиции в систолу ЛЖ планиметрическим способом обводки контуров струи регургитации с использованием поправочного коэффициента (0,785) к площади ЛП. Однако использование данной методики ограничено вероятностью ошибки или неправильной интерпретации полученных данных. При атриомегалии возможна недооценка выраженности митральной регургитации. При эксцентричности струи невозможно оценить ее значимость в одной плоскости. Таким образом, данная методика исследования позволяет получить скорее приблизительное представление об объеме регургитации, поэтому считается малоинформативной и крайне зависимой от установок усиления сигнала.
Метод интраоперационной трёхмерной чреспищеводной эхокардиографии у пациентов с выраженной недостаточности митрального клапана
Чреспищеводная эхокардиография (ЧП ЭхоКГ) — метод диагностики, который широко используется в клинической практике. Применение чреспищеводной эхокардиографии у кардиохирургических больных в условиях операционной — это эффективный, безопасный и высокоинформативный метод оценки анатомии и функции структур сердца, внутрисердечной гемодинамики. В настоящее время ЧП ЭхоКГ исследование является неотъемлемой составляющей стандартов обеспечения безопасности операции у пациентов кардиохирургического профиля. Существуют технологии двух- и трёхмерной чреспищеводной ЭхоКГ.
Трёхмерная чреспищеводная эхокардиография (3D-ЧП ЭхоКГ) по сравнению с двухмерной позволяет получить наиболее полное представление о морфометрии отдельных структур и сердца в целом. Методика интраоперационной 3D ЧП ЭхоКГ незаменима при выполнении реконструктивных вмешательств у пациентов с митральной недостаточностью (МН), которая занимает второе место в структуре пороков сердца. Согласно рекомендациям Европейского общества кардиологов (ESC) и Европейской ассоциации кардиоторакальных хирургов (EACTS) 2017 года, именно реконструктивные операции на митральном клапане у пациентов с недостаточностью приобретают приоритетное значение. Безусловными преимуществами пластических операций являются низкий риск развития тромбоэмболий и эндокардита, лучшая отдалённая выживаемость и свобода от приёма антикоагулянтов. Успех хирургического лечения с использованием реконструктивного подхода во многом зависит от уровня и качества выполненных диагностических исследований.
Представляем клинический случай использования интраоперационной чреспищеводной эхокардиографии с 3D режимом для определения тактики и оценки результатов операции у пациентки с выраженной недостаточностью митрального клапана.
Пациентка, 56 лет, поступила в отделение реконструктивной хирургии клапанов сердца и коронарных артерий ФГБУ «НМИЦ ССХ им. А.Н. Бакулева» Минздрава России с жалобами на одышку при умеренной физической нагрузке, сердцебиение. Из анамнеза: страдает ревматизмом с 15 лет. По данным трансторакальной эхокардиографии (ЭхоКГ) выявлена выраженная митральная недостаточность, дилатация левых отделов сердца.
На основании проведённого обследования поставлен диагноз: Ревматизм, неактивная фаза. Митральный порок сердца: выраженная недостаточность. Относительная умеренная недостаточность трикуспидального клапана. Дилатация левых камер сердца. Умеренная лёгочная гипертензия. ХСН 2А. ФК 3 по NYHA.
Была выполнена операция: Многокомпонентная реконструкция митрального клапана с ушиванием расщепления передней митральной створки, с аннулопластикой на опорном кольце; пластика трикуспидального клапана по de Vega, в условиях ИК, гипотермии и ФХКП. (хирург — директор Института коронарной и сосудистой хирургии ФГБУ «НМИЦ ССХ им. А.Н. Бакулева» МЗ РФ, профессор И.И. Скопин).
Рис. 1. Трёхмерная чреспищеводная эхокардиография. Среднепищеводный доступ. Трёхмерная реконструкция митрального клапана. (ЛП — левое предсердие, ЛЖ — левый желудочек, ПЖ— правый желудочек, ПМС — передняя митральная створка, ЗМС — задняя митральная створка). Расщепление передней митральной створки (белая стрелка).
Рис. 2. Чреспищеводная эхокардиография. Среднепищеводный доступ. Четырёхкамерная позиция. (ПП — правое предсердие). Площадь потока регургитации — 11,4 см².
Рис. 3. Чреспищеводная эхокардиография. Среднепищеводный доступ. Четырёхкамерная позиция. Vena contracta 0,9 см.
На основании дооперационной трансторакальной эхокардиографии планировалась имплантация опорного кольца и коррекция пролапса ПМС за счёт имплантации неохорд или транслокации хорд от задней митральной створки к передней. Данные интраоперационной трёхмерной ЧП ЭхоКГ позволили визуализировать расщепление передней створки митрального клапана и подтвердить дилатацию фиброзного кольца. Таким образом, тактика операции была изменена и выполнена пластика расщеплённой передней створки МК, имплантация опорного кольца Carpantier-Edwards №32, пластика трикуспидального клапана по de Vega.
После отключения искусственного кровообращения и стабилизации гемодинамики выполнено контрольное ЧП ЭхоКГ исследование. Показатели функционального состояния миокарда, клапанного аппарата были в норме.
В представленном клиническом случае больной с патологией митрального клапана – выраженной недостаточностью, в плановом порядке интраоперационно до основного этапа операции проведена чреспищеводная эхокардиография с построением в режиме реального времени трёхмерной модели клапана, позволившая детально оценить патологию и определить механизм формирования митральной недостаточности. С помощью трёхмерной реконструкции удалось диагностировать расщепление передней створки митрального клапана, определить точную локализацию патологии.
Полученные данные были подтверждены непосредственно в ходе операции при ревизии клапана и явились основанием выбора тактики хирургического вмешательства.
Сокольская Н.О., Скопин И.И., Копылова Н.С.
Пресс-служба ФГБУ «НМИЦ ССХ им. А. Н. Бакулева»
Минздрава России
Vena contracta что это
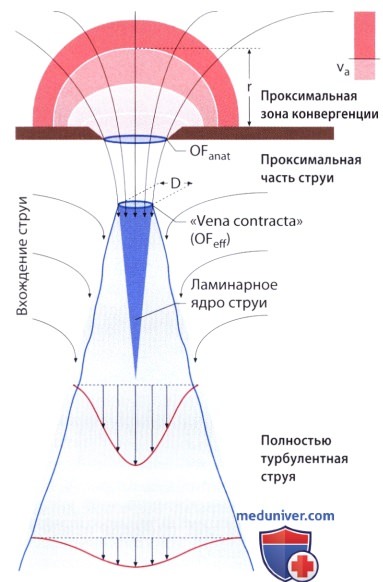
а) Струя регургитации и ее площадь. Струя крови, регургитирующая с высокой скоростью в предсердие через атриовентрикулярное отверстие при недостаточности митрального клапана, вначале носит ламинарный характер (ламинарное ядро). Усилия сдвига на границе между струей, регургитирующей в предсердие с высокой скоростью, и окружающей «застойной» кровью вызывают турбулентные завихрения, которые проникают в струю и нарушают ламинарный ток в ее центральной части. В результате она на определенном расстоянии от митрального отверстия оказывается полностью турбулентной, и ее диаметр в 6 раз превышает диаметр на уровне отверстия. Поскольку турбулентная струя в немалой степени состоит из крови уже находящейся в предсердии и как бы «увлекающейся» в струю регургитации, то объем турбулентной струи не равен объему струи регургитации (закон сохранения масс не применим). Рассчитанная планиметрически площадь профильного сечения турбулентной струи лишь весьма умеренно коррелирует с площадью профильного сечения струи регургитации.
1. Скорость потока крови. Величина «турбулентного повреждения» (а именно площадь профильного сечения струи) зависит не только от объема регургитации, но и от скорости струи регургитации подобно тому, как величина вмятины, которая образуется при падении шарообразного тела на капот автомобиля, зависит не только от массы этого тела, но и от высоты его падения (скорости падения). Импульс струи на всем ее протяжении остается неизменным на любом сечении (применим закон сохранения импульса). Площадь профильного сечения струи регургитации (Jet-S) пропорциональна импульсу струи (объемная скорость регургитации Q • линейная скорость струи V):
Поскольку Q равна произведению площади отверстия несостоятельного митрального клапана, т.е. поперечного сечения струи регургитации (Sрегургитации), на линейную скорость струи (V), то площадь профильного сечения струи регургитации Jet-S можно найти также по формуле:
где V 2 в соответствии с уравнением Бернулли пропорциональна градиенту давления АР.
Поскольку площадь профильного сечения струи зависит от квадрата ее скорости, то высокая скорость (при высоком градиенте давления на митральном клапане) при одинаковой объемной скорости регургитации обусловливает большую площадь профильного сечения струи, чем низкая (при низком градиенте давления на клапане). Поэтому у больных с примерно одинаковой степенью митральной недостаточности и повышенным давлением в левом желудочке (например, связанным с сопутствующей артериальной гипертензией, аортальным стенозом и гипертрофической обструктивной кардиомиопатией) площадь профильного сечения струи регургитации может оказаться больше, чем у больных с нормальным давлением в левом желудочке.
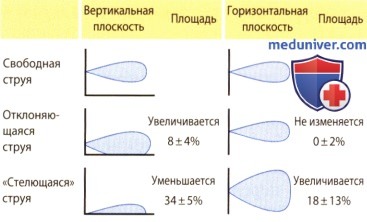
2. Пристеночная адгезия струи. Еще одним гидродинамическим фактором, влияющим на размер струи регургитации, является эффект Коанды, или пристеночной адгезии. Суть его в том, что между струей крови, забрасываемой в предсердие, и стенкой предсердия образуется зона пониженного давления, которая вызывает отклонение струи к стенке и изменение ее пространственной конфигурации: струя часто течет практически вдоль стенки, что уменьшает ее размер в вертикальном направлении (при сканировании сердца из апикальной позиции). В горизонтальном направлении (при сканировании сердца из парастернальной позиции) размер струи умеренно возрастает. С помощью ЭхоКГ выявить такое увеличение трудно, так как струя регургитации следует соответственно изгибу стенки предсердия, а плоскость сканирования датчика прямая.
При сопоставимом объеме регургитации максимальная площадь профильного сечения пристеночной струи по сравнению с таковой центральной струи в среднем на 40% меньше. Поэтому при оценке степени митральной недостаточности следует учитывать, насколько эксцентрична струя.
3. Настройка эхокардиографа. Еще одной трудностью при оценке размера струи регургитации является зависимость от настройки эхокардиографа, в частности от степени акустического усиления и частоты датчика.
б) Диаметр проксимальной части струи регургитации. Поскольку линии кровотока дистальнее отверстия несостоятельного клапана на небольшом протяжении продолжают конвергировать, то минимальный диаметр струи достигается сразу после выхода ее из отверстия несостоятельного клапана в зоне, известной как «сжатая вена» (vena contracta). Этот проксимальный диаметр несколько меньше диаметра, соответствующего отверстию клапана (изменения гемодинамики подчиняются тем же принципам, что и при стенозе митрального клапана), и существенно не зависит от градиента давления на клапане. Особенно точно его можно измерить при ЧПЭ в области «горловины» струи между зоной конвергенции проксимальной части потока и дистальной областью турбуленции. Измерять следует по возможности меньший диаметр (обычно при исследовании вдоль длинной оси сердца или в позиции четырехкамерного сердца), а не больший (при сканировании в двухкамерной позиции). Ошибка при измерении (завышенное значение) тем больше, чем меньше разрешающая способность цветового допплеровского аппарата.
в) Метод, основанный на конвергенции проксимальной части потока. Принцип данного метода был изложен в разделе «Количественная оценка степени митрального стеноза». В отличие от митрального стеноза, в данном случае осуществляют коррекцию угла наклона.
1. Максимальный объем регургитации. Максимальный объем регургитации Qmax определяют из формулы:
Qmax = 2πr 2 × Valias (формула для полусферических слоев).
Из-за уплощения изокинетических полусферических слоев вблизи отверстия несостоятельного митрального клапана и связанной с этим возможности заниженной оценки площади поверхности (которая рассчитывается по формуле площади полусферы), а также увеличения измеряемого радиуса конвергирующего потока предел Найквиста смещается в сторону низких скоростей. С другой стороны, возможность смешения с кровью выносящего тракта левого желудочка вследствие вытягивания полусферических слоев при отдалении от отверстия несостоятельного клапана либо приближения к свободной стенке («молотящая» задняя створка митрального клапана) или выносящему тракту левого желудочка («молотящая» передняя створка митрального клапана) может стать причиной заниженного значения Qmax. Поэтому этот предел выбирают не слишком низким. С учетом особенностей геометрии струи используются в основном скорости в диапазоне между 24 и 58 см/с. Применение высокочастотного фильтра для подавления шума от колебаний стенок теоретически может привести к тому, что фактическая скорость при данном пределе Найквиста окажется заниженной. На практике избегание завышенной оценки на основе описанных геометрических факторов более важно. Метод не зависит от выбранного усиления и значения градиента давления на митральном клапане.
в) Традиционное допплеровское исследование. Объем и фракция регургитации. По разнице между митральным и аортальным ударным объемом, если нет аортальной недостаточности или дефекта межжелудочковой перегородки, можно определить ударный объем регургитации. Аортальный ударный объем определяют как произведение площади поперечного сечения выносящего тракта левого желудочка на интеграл линейной скорости струи крови по времени. Митральный ударный объем определяют путем умножения площади митрального кольца на определенный на этом уровне интеграл скорости по времени. Площадь митрального кольца рассчитывают по длине двух взаимно-перпендикулярных полуосей открытого митрального клапана (по формуле эллипса: a× b× π/4). Разделив объем регургитации на ударный объем митрального клапана, получим фракцию регургитации, деление объема регургитации на интеграл максимальной линейной скорости по времени (определяемой с помощью непрерывноволновой допплерографии) позволяет получить площадь поперечного сечения струи регургитации на уровне митрального клапана.
Во избежание завышенных значений при измерении допплеровского сигнала от митрального кольца рекомендуется использовать модальный, а не внешний контур скоростей. Необходимость определения площади митрального кольца и выполнения длинной цепи измерений и расчетов (и связанный с этим рост погрешности) являются слабой стороной данного метода.
г) Непрерывноволновая допплерография. Интенсивность сигнала от отверстия несостоятельного клапана при непрерывноволновой допплерографии коррелирует (если он параллелен направлению струи) с количеством частиц в потоке, отражающих эхо-сигналы (в частности, эритроцитов), и тем самым со степенью митральной недостаточности. Высокая интенсивность сигнала типична для тяжелой митральной недостаточности. Надежная количественная оценка с помощью данного метода на практике невозможна.
д) Кровоток по легочным венам:
1. Фазы. Кровоток по легочным венам при синусовом ритме состоит из трех фаз:
— систолического прямого кровотока (S), который соответствует наполнению предсердия;
— диастолического прямого кровотока (D) при открытом митральном клапане. Предсердие в этом случае играет роль кондуита («трубопровода»);
— ретроградной A-волны (АR), обусловленной непродолжительным и небольшим обратным кровотоком, вызванным сокращением предсердия.
При низком (нормальном) давлении в предсердии отличить раннее наполнение предсердия в результате релаксации от позднего, связанного с опущением митрального кольца, можно по зазубрине, обозначаемой как S-волна. При повышении давления в предсердии (V-волна) отношение S/D снижается и может достичь отрицательных значений, если появляется систолический реверсивный (обратный) кровоток.
2. Хроническая митральная недостаточность. При хронической митральной недостаточности с дилатацией предсердия V-волна необязательно высокая, даже при выраженной регургитации, пока функция левого желудочка остается нормальной (за исключением случаев тяжелой митральной недостаточности, соответствующей IV степени). Поэтому S/D слабо коррелирует со степенью регургитации.
е) Автоматическая количественная оценка цветового допплеровского сигнала. Многообещающим методом количественной оценки потока жидкости, который можно применять и при митральной недостаточности, является метод, основанный на автоматической интеграции допплеровских сигналов вдоль любого выбранного сечения через путь кровотока (сосуд, выносящий тракт левого желудочка, клапанное кольцо). В отличие от традиционного допплеровского исследования, диаметр сечения, через которое проходит поток, не измеряется, так как он определяется автоматически расположенными последовательно цветовыми пикселями. Результаты определения почти не зависят от угла а, образуемого ультразвуковым лучом и направлением потока. При косом срезе заниженное значение скорости осевого кровотока (V • cosα) в точности соответствует завышенному значению площади поперечного сечения (A/cos а):
Q = A/cosα • V • cosα = А • V
ж) Оценка. Наиболее подходящим методом количественной оценки гемодинамики при митральной регургитации является определение площади поперечного сечения струи регургитации по методу, основанному на конвергенции проксимальной части потока, а также измерение диаметра проксимальной части струи (особенно с помощью ЧПЭ). При эксцентрическом течении струи с помощью трансторакальной ЭхоКГ часто бывает легче измерить радиус конвергирующего потока. В предельных случаях, когда струя дистальнее отверстия несостоятельного клапана видна нечетко, этот метод все же позволяет надежно оценить степень митральной регургитации. Более широкая проксимальная часть струи и конвергирующая ее зона, выделяющаяся без смещения предела Найквиста, позволяют уже на основании качественной оценки диагностировать гемодинамически значимую регургитацию.
Степень митральной недостаточности. В таблице ниже приведены граничные значения, отделяющие легкую (I и II степень) митральную недостаточность от тяжелой (III и IV степень). Значение стандартной количественной оценки при явной или тривиальной тяжелой митральной недостаточности невелико. Однако при широком «промежуточном» диапазоне митральной регургитации такая оценка обязательна, с тем чтобы отдифференцировать гемодинамически значимую митральную недостаточность от легких форм, при которых нарушения гемодинамики незначительны, а также уточнить степень митральной недостаточности, если результаты исследования неоднозначны. В зависимости от механизма митральной недостаточности всегда следует учесть динамику ее развития.
Редактор: Искандер Милевски. Дата публикации: 3.1.2020
Недостаточность аортального клапана
Аортальная недостаточность характеризуется неполным смыканием створок клапана во время диастолы, что приводит к возникновению обратного диастолического тока крови из аорты в ЛЖ.
Изолированная недостаточность аортального клапана встречается в 4% случаев всех пороков сердца и еще в 10% — она сочетается с поражениями других клапанов. Мужчины страдают недостаточностью клапана аорты значительно чаще.
Наиболее частые причины:
— Ревматизм (около 70% случаев заболевания) ;
К более редким причинам этого порока относятся:
— системная красная волчанка (волчаночный эндокардит Либмана–Сакса)
— ревматоидный артрит и др.
Следует иметь в виду возможность возникновения относительной недостаточности аортального клапана в результате резкого расширения аорты и фиброзного кольца клапана при следующих заболеваниях:
Недостаточность клапана аорты приводит к возврату значительной части крови (регургитация), выброшенной в аорту, назад, в левый желудочек во время диастолы.
Таким образом, в период диастолы левый желудочек наполняется в результате как поступления крови из левого предсердия, так и аортального рефлюкса, что приводит к увеличению конечного диастолического объема и диастолического давления в полости левого желудочка. Вследствие этого, левый желудочек увеличивается и значительно гипертрофируется (конечный диастолический объем левого желудочка может достигать 440 мл, при норме 60- 130 мл).
Изменения гемодинамики при аортальной недостаточности:
Митрализация порока
— створки клапана не изменены, но полностью не смыкаются во время систолы желудочка.
— изменения развиваются в поздних стадиях заболевания, при возникновении систолической дисфункции ЛЖ и резко выраженной миогенной дилатации желудочка.
— регургитация крови из ЛЖ в ЛП, расширению последнего и значительному усугублению застоя в малом круге кровообращения.
Основные гемодинамические последствия недостаточности аортального клапана:
1) Компенсаторная эксцентрическая гипертрофия ЛЖ (гипертрофия + дилатация), возникающая в самом начале формирования порока.
2) Признаки левожелудочковой систолической недостаточности, застоя крови в малом круге кровообращения и легочной гипертензии, развивающихся при декомпенсации порока.
3) Некоторые особенности кровенаполнения артериальной сосудистой системы большого круга кровообращения:
— повышенное систолическое АД;
— пониженное диастолическое АД;
— нарушение перфузии периферических органов и тканей за счет относительного снижения эффективного сердечного выброса и склонности к периферической вазоконстрикции.
4) Относительная недостаточность коронарного кровотока.
Эксцентрическая гипертрофия левого желудочка
— Увеличение диастолического наполнения ЛЖ кровью приводит к объемной перегрузке этого отдела сердца и увеличению КДО желудочка. В результате развивается выраженная эксцентрическая гипертрофия ЛЖ (гипертрофия миокарда + дилатация полости желудочка) — главный механизм компенсации данного порока. В течение длительного времени увеличение силы сокращения ЛЖ, которое обусловлено возросшей мышечной массой желудочка и включением механизма Старлинга, обеспечивает изгнание возросшего объема крови. Еще одним своеобразным компенсаторным механизмом является характерная для аортальной недостаточности тахикардия, ведущая к укорочению диастолы и некоторому ограничению регургитации крови из аорты.
Сердечная декомпенсация
Со временем происходит снижение систолической функции ЛЖ и, несмотря на продолжающийся рост КДО желудочка, его ударный объем больше не увеличивается или даже уменьшается. В результате повышается КДД в ЛЖ, давление наполнения и, соответственно, давление в ЛП и венах малого круга кровообращения. Таким образом, застой крови в легких при возникновении систолической дисфункции ЛЖ (левожелудочковая недостаточность) — второе гемодинамическое следствие недостаточности аортального клапана. В дальнейшем, при прогрессировании нарушений сократительной способности ЛЖ, развивается стойкая легочная гипертензия и гипертрофия, а в редких случаях, и недостаточность ПЖ. В этой связи следует заметить, что при декомпенсации недостаточности аортального клапана, так же как при декомпенсации аортального стеноза, всегда преобладают клинические проявления левожелудочковой недостаточности и застоя крови в малом круге кровообращения, тогда как признаки правожелудочковой недостаточности выражены слабо или (чаще) отсутствуют совсем.
Особенности кровенаполнения артериальной сосудистой системы большого круга кровообращения:
Это возникает в результате значительного увеличения УО ЛЖ (повышение систолического АД) и быстрого возврата части крови в ЛЖ (“опустошение” артериальной системы), сопровождающегося падением диастолического АД.
«Фиксированный» сердечный выброс
В течение длительного времени ЛЖ может обеспечивать изгнание в аорту увеличенного систолического объема крови, который полностью компенсирует избыточное диастолическое наполнение ЛЖ. Однако при физической нагрузке, т. е. в условиях еще большей интенсификации кровообращения, компенсаторно увеличенной насосной функции ЛЖ оказывается недостаточно для того, чтобы «справиться» с еще больше возросшей объемной перегрузкой желудочка, и происходит относительное снижение сердечного выброса.
Недостаточность коронарного кровообращения, причины
Низкое диастолическое давление в аорте. Наполнение коронарного сосудистого русла ЛЖ происходит во время диастолы, когда падает внутримиокардиальное напряжение и диастолическое давление в полости ЛЖ и быстро возрастает градиент давления между аортой (около 70–80 мм рт. ст. ) и полостью ЛЖ (5–10 мм рт. ст). Это приводит к уменьшению аортально-левожелудочкового градиента, и коронарный кровоток значительно падает. Выраженная дилатация желудочка сопровождается увеличением внутримиокардиального напряжения его стенки. В результате резко возрастают работа ЛЖ и потребность миокарда в кислороде, которая не обеспечивается полностью коронарными сосудами, функционирующими в неблагоприятных с гемодинамической точки зрения условиях.
Клинические проявления
— Ощущение усиленной пульсации в области шеи, в голове, а также усиление сердечных ударов («ощущаю свое сердце»)
— Боли в сердце (стенокардия).
Боли в сердце могут возникать у больных с выраженным дефектом аортального клапана задолго до наступления признаков декомпенсации ЛЖ. Боли локализуются обычно за грудиной, но нередко отличаются по своему характеру от типичной стенокардии. Они не так часто связаны с физической нагрузкой или эмоциональным напряжением, как приступы стенокардии у больных ИБС. Боли нередко возникают в покое и носят давящий или сжимающий характер, продолжаются обычно достаточно долго и не всегда купируются нитроглицерином. Приступы ночной стенокардии, сопровождаются обильным потоотделением. Типичные ангинозные приступы у больных с недостаточностью аортального клапана, как правило, свидетельствуют о наличии сопутствующей ИБС и атеросклеротического сужения коронарных сосудов.
Симптомы:
— усиленная пульсация сонных артерий (“пляска каротид”), а также видимая на глаз пульсация в области всех поверхностно расположенных крупных артерий (плечевой, лучевой, височной, бедренной, артерии тыла стопы и др. ) ;
— симптом де Мюссе — ритмичное покачивание головы вперед и назад в соответствии с фазами сердечного цикла (в систолу и диастолу) ;
— симптом Квинке («капиллярный пульс», «прекапиллярный пульс») — попеременное покраснение (в систолу) и побледнение (в диастолу) ногтевого ложа у основания ногтя при достаточно интенсивном надавливании на его верхушку. У здорового человека при таком надавливании как в систолу, так и в диастолу сохраняется бледная окраска ногтевого ложа. Сходный вариант «прекапиллярного пульса» Квинке выявляется при надавливании на губы предметным стеклом;
— симптом Ландольфи — пульсация зрачков в виде их сужения и расширения;
— симптом Мюллера — пульсация мягкого неба.
Пальпация и перкуссия сердца:
— Усиление верхушечного толчка
— Систолическое дрожание на основании сердца
— Диастолическое дрожание в прекардиальной области
— Характерна аортальная конфигурация с подчеркнутой «талией» сердца.
— При «митрализации» порока, может произойти сглаживание «талии» сердца.
Аускультация сердца:
Сосудистые аускультативные феномены:
Артериальное давление:
— повышение систолического давления
— снижение диастолического АД
Инструментальная диагностика:
При недостаточности аортального клапана на ЭКГ определяются:
— Признаки выраженной гипертрофии ЛЖ без его систолической перегрузки, т. е. без изменения конечной части желудочкового комплекса.
— Депрессия сегмента RS–Т и сглаженность или инверсия Т наблюдаются только в период декомпенсации порока и развития сердечной недостаточности.
— При «митрализации» аортальной недостаточности, помимо признаков гипертрофии ЛЖ, на ЭКГ могут появляться признаки гипертрофии левого предсердия (Р-mitrale)
Рентгеновское исследование: В прямой проекции уже на самых ранних стадиях развития заболевания определяется значительное удлинение нижней дуги левого контура сердца и смещение верхушки сердца влево и вниз. При этом угол между сосудистым пучком и контуром ЛЖ становится менее тупым, а “талия” сердца — более подчеркнутой (“аортальная” конфигурация сердца). В левой передней косой проекции происходит сужение ретрокардиального пространства. Помимо описанных рентгенологических признаков, у больных аортальной недостаточностью определяется расширение восходящей части аорты. Наконец, декомпенсация порока сопровождается появлением признаков венозного застоя крови в легких.
Эхокардиография: Конечный диастолический размер левого желудочка увеличен. Определяется гиперкинезия задней стенки левого желудочка и межжелудочковой перегородки. Регистрируется высокочастотный флаттер (дрожание) передней створки митрального клапана, межжелудочковой перегородки, а иногда и задней створки во время диастолы. Митральный клапан закрывается преждевременно, а в период его открытия амплитуда движения створок уменьшена.
Катетеризация сердца: При катетеризации сердца и проведении соответствующих инвазивных исследований у больных аортальной недостаточностью определяют увеличение сердечного выброса, КДД в ЛЖ и объем регургитации. Последний показатель рассчитывают в процентах по отношению к ударному объему. Объем регургитации достаточно хорошо характеризует степень недостаточности аортального клапана.
Лечение:
1. Медикаментозное лечение:
2. Эндоваскулярные методы:
3. Хирургическое лечение: Иногда возможна пластика аортального клапана. Она предпочтительна в том случае, если аортальная недостаточность вызвана пролапсом двустворчатого или трехстворчатого аортального клапана. При перфорации створки клапана, вызванной инфекционным эндокардитом, возможна ее пластика с помощью перикардиальной заплаты.
Прогноз