Аберрантная экспрессия что это такое
Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo
Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo
Иногда самый безопасный и эффективный вариант генной терапии — не вводить вектор непосредственно пациенту, а наоборот, выделить клетки пациента, произвести с ними генно-инженерные манипуляции и ввести обратно ему же. В таком случае непревзойденный инструмент — лентивирусные векторы. Рисунок в полном размере.
Автор
Редакторы
Генная и клеточная терапии
Спецпроект о генной и клеточной терапиях, тернистом пути их развития, первых успехах и надеждах, а также о сложностях регулирования, производства и изучения этих новейших методов лечения.
Партнер спецпроекта — Департамент разработки генотерапевтических препаратов одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
Со времени зарождения генной терапии — начиная с самых первых исследований и клинических испытаний — дорога к ее широкому внедрению была тернистой. Впечатляющие успехи чередовались с досадными провалами, отбросившими на новое лечение порочащую тень, что в какой-то момент резко затормозило развитие области [1].
Вы читаете пятую статью спецпроекта «Генная и клеточная терапии». Ранее мы уже информировали вас, как вообще устроены лекарства будущего [2], а также достаточно подробно останавливались на аденоассоциированных вирусах [3] как важном инструменте «генных терапевтов».
Подробнее о тернистом пути разработки и производства генного лечения читайте в статье: «Генные и клеточные лекарства: сложное регулирование для сложных продуктов» [4]; ну а об экономических перипетиях при внедрении сверхдорогих инновационных лекарств (да и не только их) расскажет статья: «Фармакоэкономика: лечить или экономить?» [5].
Однако генная терапия по-прежнему более чем актуальна, ведь она предлагает регулирование молекулярных процессов на новом уровне, тем самым позволяя подбирать ключи к лечению ранее неприступных болезней.
Существующие ныне генные терапии в основном работают по принципу внедрения нужного генетического материала в определенные клетки пациента, что и позволяет модулировать происходящее в организме с лечебными целями. Поэтому для такого лечения критически важна успешная доставка требуемого гена в целевые клетки и ткани, что чаще всего осуществляют с использованием особых носителей — векторов.
In vivo vs Ex vivo
В предыдущих статьях нашего цикла о генной терапии уже были довольно подробно разобраны имеющиеся ныне решения. Не будем сильно повторяться, но отметим особо важные для дальнейшего повествования моменты.
Терапия in vivo — это прямой перенос векторов в организм пациента путем внутривенной инфузии раствора, содержащего такие носители. В такой доставке наилучшим образом проявили себя аденоассоциированные векторы, поскольку имеют широкий тропизм — специфичность к различным типам клеток, а также низкий уровень генотоксичности и соответственно бóльшую безопасность [3].
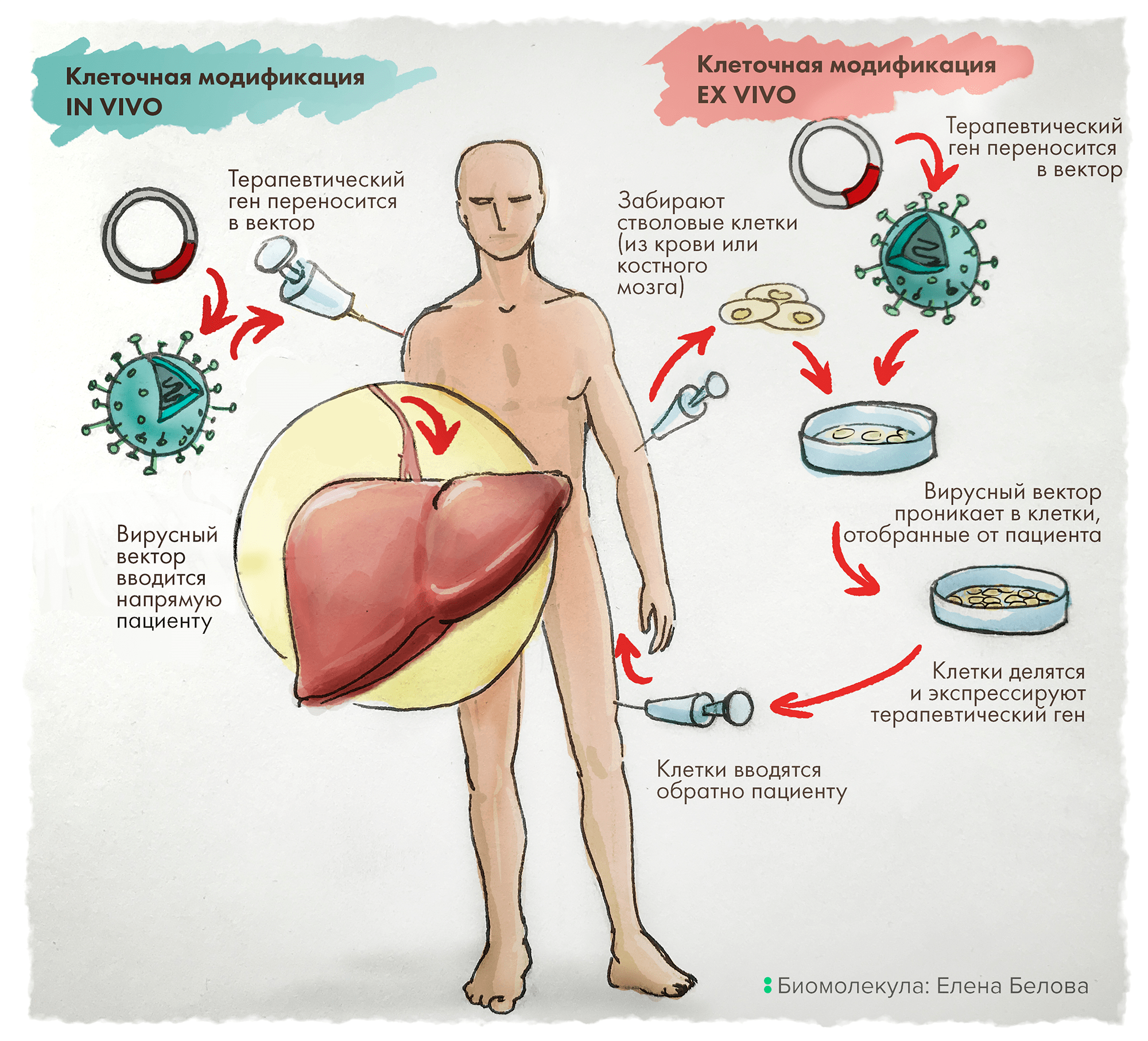
Альтернативно терапевтический ген может быть доставлен ex vivo: для этого клетки сначала отбирают у пациента, генетически модифицируют и культивируют вне организма. И только после этого такие несущие целевые (читай — терапевтические) гены клетки вводят путем инфузии обратно пациенту (рис. 1) [6].
Рисунок 1. In vivo vs Ex vivo. Терапия in vivo заключается в прямой доставке в организм пациента векторов, содержащих терапевтические гены. В отличие от этого, подход ex vivo включает предварительный отбор клеток у пациента, их генетическую модификацию in vitro (это, как правило, внедрение нужного — лечебного — гена), затем отбор эффективно трансдуцированных клеток с последующим размножением и введением такой культуры клеток обратно пациенту.
Для клинических приложений терапии ex vivo изначально были особо интересны γ-ретровирусы и лентивирусы, — ведь они способны перманентно интегрировать свой генетический материал в геном клеток организма-хозяина, что подразумевает передачу генов интереса при делении в ряду клеточных поколений, а значит, низкую элиминацию и долгоиграющую экспрессию.
Однако по сравнению с γ-ретровирусными векторами лентивирусы оказались безопаснее в доклинических исследованиях, а потому сейчас преимущественно используются именно они [7]. Лентивирусные векторы способны еще и трансдуцировать как постмитотические, так и неделящиеся клетки, в то время как для эффективного инфицирования с использованием других ретровирусных платформ требуется, чтобы клетка активно делилась [6]. Дело в том, что среди всех ретровирусов только лентивирусы способны проникать через ядерную мембрану.
Серьезными плюсами лентивирусных векторов являются также относительно низкая стоимость и возможность масштабирования производства. Эта платформа была выбрана для создания одной из наиболее многообещающих ныне генных терапий ex vivo: онколечения с использованием CAR-T-клеток [8], — и используется сегодня при разработке таких препаратов наряду с γ-ретровирусами. К этому мы еще вернемся.
Лентивирусы в природе: что они собой представляют?
Строение
Под положительной (+) РНК понимают геномную нуклеиновую кислоту вируса, похожую на мРНК, благодаря чему информация в ходе трансляции — синтеза полипептидной цепи вирусного белка в зараженной клетке — может считываться непосредственно с нее. Такую (+)РНК называют также смысловой. В отличие от этого, антисмысловая (−) РНК комплементарна мРНК, и для перевода в аминокислотную цепочку ее требуется сначала реплицировать в (+)-форму с помощью фермента РНК-репликазы.
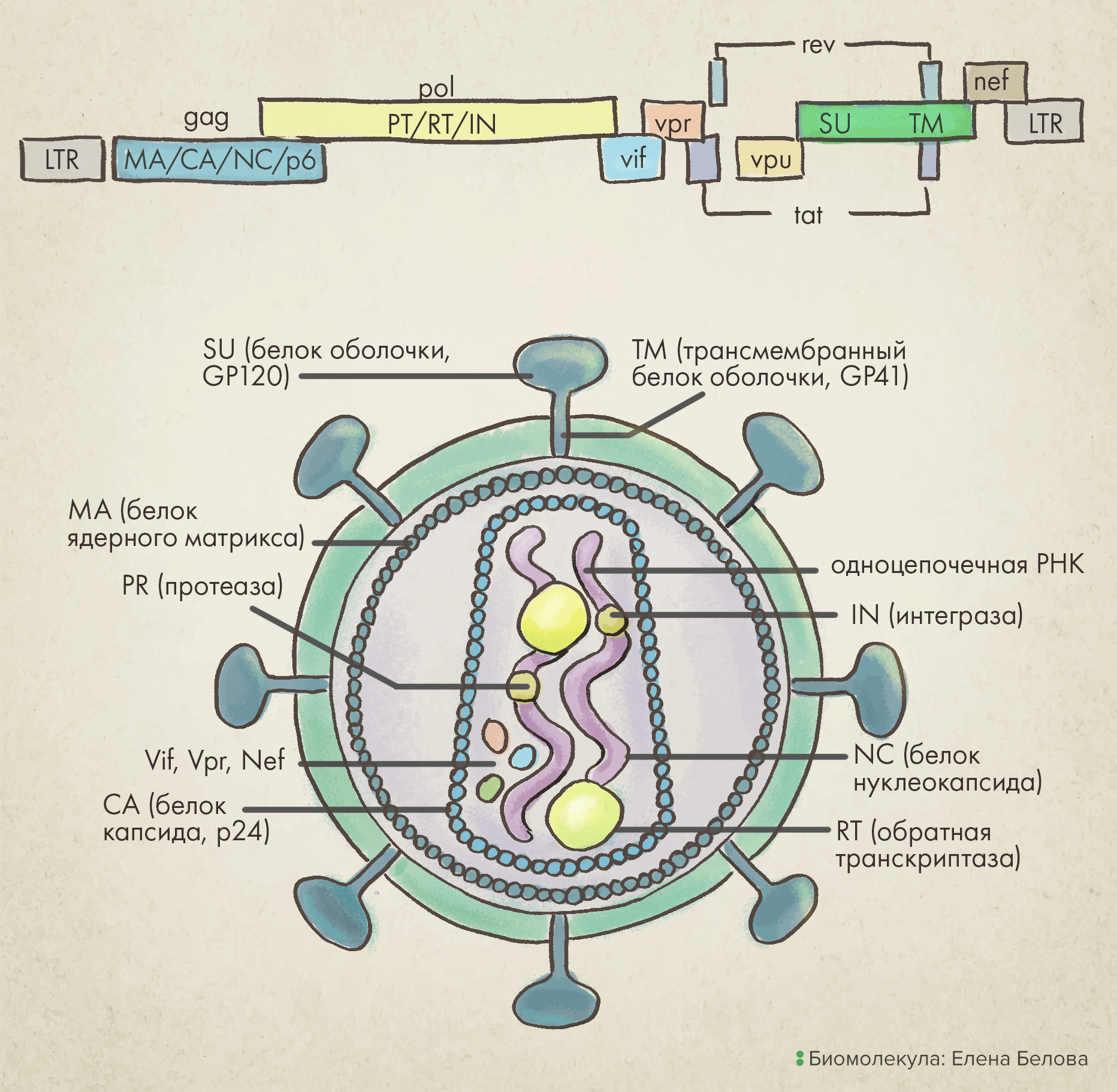
Рисунок 2. Лентивирус: геномная карта и структура вириона. Важный для проникновения в клетку ген env обозначен зеленым цветом.
Ген gag первым транскрибируется в незрелую пре-мРНК, которая затем расщепляется на отдельные транскрипты, кодирующие три белка вирусного кора:
Ген pol кодирует ферменты, необходимые для репликации генетического материала: вирусную протеазу (PRO), обратную транскриптазу (RT) и интегразу (IN).
Наконец, ген env кодирует белок вирусной поверхности: гликопротеин gp160, который в процессе созревания вирусной частицы расщепляется на белок поверхности вириона gp120 (SU) и трансмембранный белок gp41 (TM).
Кроме того, вирусный геном содержит регуляторные гены (tat и rev), которые после инфицирования вирионом экспрессируются первыми и нужны для ускорения продукции мРНК, а также четыре вспомогательных гена (vif, vpr, vpu, и nef) [10].
Жизненный цикл лентивирусов
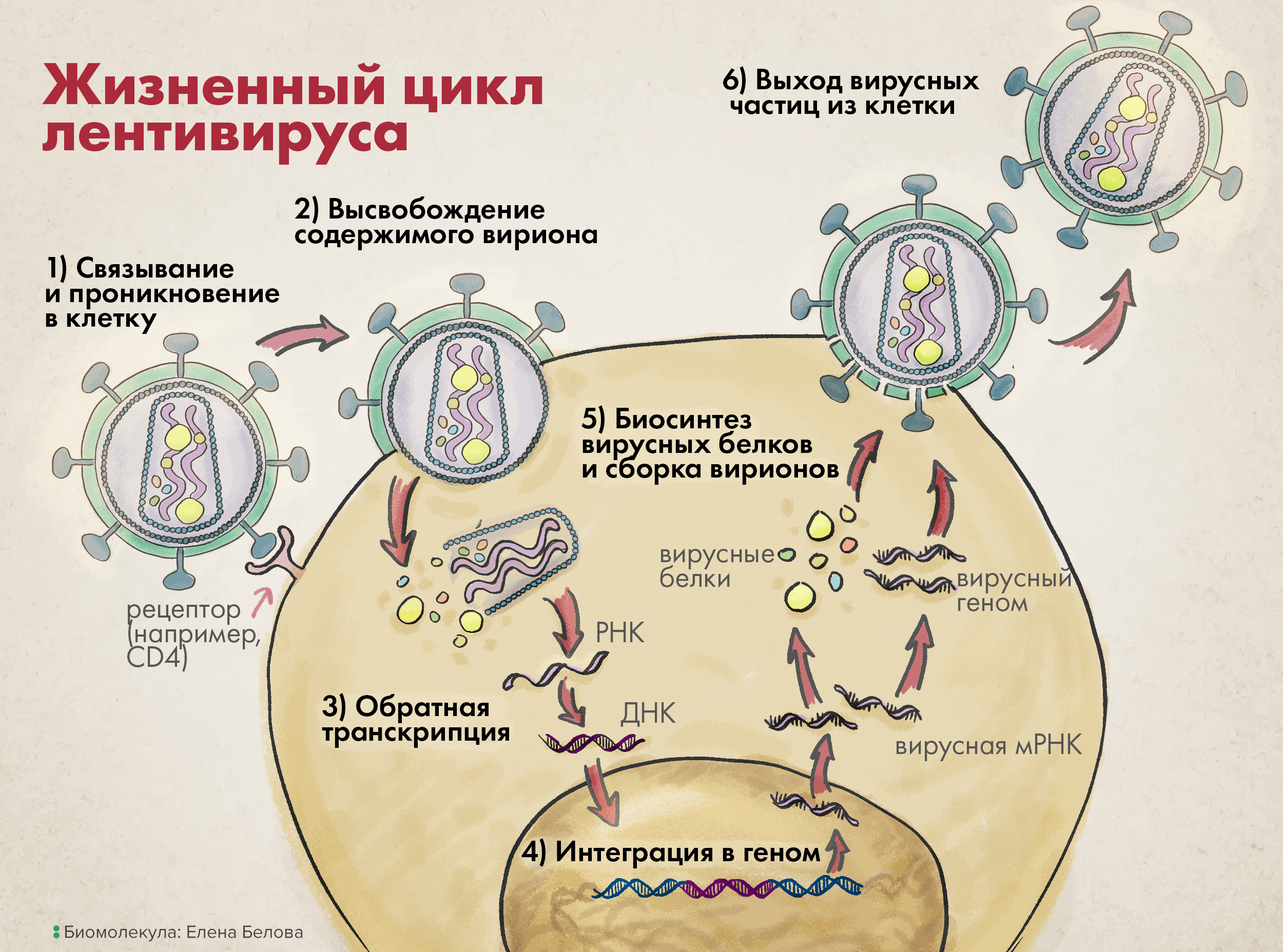
Жизненный цикл лентивируса можно немного обобщить и представить в виде шести основных шагов (рис. 3).
На первой стадии вирион связывается со своей клеткой-мишенью через взаимодействие между белком вирусной оболочки gp120 (SU) и особым рецептором клеточной поверхности.
Существование этих поверхностных и специфичных белков-рецепторов собственно и определяет особую способность вирусов инфицировать строго определенные типы клеток (известную также как тропизм).
Рисунок 3. Жизненный цикл лентивируса. 1. Связь с клеточной поверхностью и проникновение в клетку. 2. Высвобождение содержимого вириона во внутриклеточную среду. 3. Обратная транскрипция. 4. Интеграция в геном. 5. Биосинтез вирусных белков и сборка вирионов. 6. Выход вирусных частиц из клетки.
При инициации цикла заражения вирусом ВИЧ, помимо взаимодействия гликопротеина SU с первичным рецептором СD4 на поверхности лимфоцитов Т-хелперов (что и определяет патогенез ВИЧ-инфекции), происходит также его связывание с корецепторами: CXCR4 или CCR5.
Затем вирусные трансмембранные белки (TM) изменяют свою конформацию, чтобы сблизить вирион и клетку, что приводит к слиянию их мембран и проникновению вируса в клетку (этап 1 на рисунке 3).
После входа в клетку матрикс вируса — то есть все его содержимое, кроме слившегося с мембраной клетки суперкапсида, — распределяется в цитоплазме на составляющие элементы: структурные белки капсида, нуклеиновые кислоты вирусного генома, а также ферменты, необходимые для успешной репродукции генетического материала (этап 2 на рисунке 3).
Используя вирусную РНК как шаблон, а также нуклеотиды зараженной клетки, обратная транскриптаза начинает синтезировать комплементарную вирусную ДНК, а точнее — провирусную ДНК (этап 3 на рисунке 3); последняя затем импортируется в клеточное ядро, вставляясь там с использованием вирусной интегразы в геном клетки-мишени (этап 4).
Дальнейшая репродукция генетического материала идет уже как по нотам: в соответствии с центральной догмой молекулярной биологии. Из последовательности провируса в геноме транскрибируются одноцепочечные (+)РНК, затем с них транслируются вирусные белки (этап 5); они упаковывают вирусные нуклеиновые кислоты так, чтобы в одном вирионе таких последовательностей было две (этап 5).
После этого сформированные вирусные частицы, прорывая цитоплазматическую мембрану, выходят из клетки, формируя из ее фрагментов свой суперкапсид (этап 6 на рисунке 3). Ну а такие новые вирионы заражают уже другие клетки, и весь описанный цикл повторяется [10].
Создание лентивирусных векторов
Теперь мы знаем, как структурно устроены лентивирусы, каков их жизненный цикл, но пока еще не разобрались, что собой представляют лентивирусные векторные системы, — как они работают и как их производят. Что же, рассмотрим и этот вопрос.
Безопасность превыше всего
Рекомбинация
Лентивирусы имеют высокую частоту рекомбинации (обмена частями генома между двумя вирусами) и быстро мутируют. Отсюда естественные опасения, что векторы на их основе смогут самопроизвольно воспроизводиться в организме человека и благодаря дальнейшей «перетасовке генов» приводить к появлению суперинфекций. Чтобы снизить подобные риски при разработке векторных систем, основные гены исходных вирусов стали распределять в отдельные плазмиды. При этом полученные векторы (уже неспособные к репликации) — далее еще и последовательно улучшали: на сегодняшний день сменилось уже три поколения таких частиц.
Инсерционный мутагенез
Помимо образования репликационно компетентного вируса, вторым основным риском при применении ретровирусных векторов является онкогенез, возникающий за счет так называемого инсерционного мутагенеза. Критически важно оценивать такие риски, ведь γ-ретровирусы имеют тенденцию встраиваться вблизи генных регуляторных последовательностей, что представляет большую опасность. В частности, в клинических исследованиях с использованием таких частиц фиксировались случаи смерти от развившегося лейкоза [11].
Именно поэтому в поле генной терапии наблюдается постепенное смещение в пользу преимущественного использования лентивирусных векторов, которые намного безопаснее [12]. Они предпочитают транскрипционно активные регионы, но интегрируются в основном в «тело гена» (преимущественно в интроны), избегая энхансеров и промоторов, — что и снижает (и довольно существенно) риски онкогенеза [11], [12].
Поскольку инсерция в транскрипционно активные регионы все же может быть генотоксичной, для усиления биобезопасности разработали так называемые самоинактивирующиеся векторы (self-inactivating, SIN). Они обладают делецией в регионе 3′-LTR вирусного генома: во время обратной транскрипции эта делеция переносится на 5′-LTR провирусной ДНК, что подавляет транскрипционную активность.
Это предотвращает продукцию полноразмерного вируса (после интеграции векторного генома в геном клетки-хозяина), минимизируя тем самым вероятность возникновения репликационно активных вирусных частиц [13]. Более того, такая делеция снижает вероятность, что клеточные кодирующие последовательности, в которые встроился вектор, будут аберрантно экспрессироваться в связи с активностью промотора или через энхансерный эффект. Наконец, дизайн SIN предотвращает потенциальную транскрипционную интерференцию между LTR и промотором, управляющим экспрессией трансгена [13].
Другая повышающая безопасность модификация заключается во включении синтетического инсулятора хроматина в лентивирусные векторы, что снижает взаимодействия между трансгеном и ближайшими к нему генами, также уменьшая возможность аберрантной экспрессии.
Кроме того, правильный подход к дозированию векторов позволяет избегать множественных интеграционных событий в клетке. В идеале требуется подобрать такую дозу, чтобы интеграция происходила в среднем один раз на клетку [12].
В совокупности, все перечисленные меры снижают риск генотоксичности, однако говорить о том, что он сведен на нет, пока еще рано. В нескольких последних исследованиях с использованием лентивирусных векторов были зафиксированы случаи возникновения онкологических заболеваний. В двух из них после проведения расследования испытания продолжили, так как вероятность связи генной терапии и онкозаболеваний посчитали пренебрежимо малой.
Три поколения векторов
Первые лентивирусные векторные системы содержали три плазмиды: трансферную (transfer), оболочечную (envelope), и упаковочную (packaging).
Упаковочная плазмида содержала бóльшую часть генома исходного вируса: структурные, ферментативные, регуляторные и вспомогательные последовательности, — и не включала гены, кодирующие поверхностные белки вириона. А ведь именно они нужны для связи с клеткой и проникновения в нее, что является ключевым этапом репликативного цикла. Поэтому такие векторные системы (с удаленным геном env) — к репликации уже неспособны, однако уметь проникать в клетку они ведь все же должны — иначе как же они доставят туда целевые гены?
За это отвечает оболочечная плазмида, несущая последовательность вирусного гликопротеина (такого как оболочечный гликопротеин G вируса везикулярного стоматита VSV-G) для помощи векторной частице в связывании с рецепторным белком на поверхности клетки.
Эта технология, основанная на общем свойстве большинства ретровирусов, — возможности формировать так называемые псевдотипы (частицы, в оболочку которых включается поверхностный белок какого-то другого вируса) — позволила расширить диапазон поражаемых ими клеток. Псевдотипированные белком VSV-G векторы обладают уникальными преимуществами: большей стабильностью, а также способностью связываться с рецепторами LDL (липопротеинов низкой плотности), присутствующим на поверхности множества клеток, — что и определяет широкий тропизм этих частиц [10]. Существуют и другие варианты псеводтипирования векторов, расширяющие их тропизм (табл. 1).
| Лентивирусные псевдотипы | Исходный вирус (у которого «позаимствован» поверхностный гликопротеин вирусной оболочки) | Клеточный рецептор, с которым связывается псевдотип | Клеточный тропизм | Эффективность |
|---|---|---|---|---|
| VSV-G | Вирус везикулярного стоматита | LDL-R | Широкий тропизм в не первичных (подвергнутых хотя бы одному пассивированию) культурах клеток | Высокая |
| BaEV | Эндогенный ретровирус павиана | ASCT-1 ASCT-2 | CD34+ клетки | 30% |
| Наивные Т-клетки | До 80% | |||
| Наивные В-клетки | 40% | |||
| В-клетки памяти | 20% | |||
| Натуральные киллеры | 40% | |||
| Ранние тимоциты | До 80% | |||
| RD114 | Эндогенный ретровирус кошек | ASCT-2 | Наивные Т-клетки | До 60% |
| Наивные В-клетки | До 30% | |||
| H/F | Вирус кори | SLAM CD46 | CD34+ клетки | ── |
| Покоящиеся Т-клетки памяти | ── | |||
| Наивные Т-клетки | До 50% | |||
| Покоящиеся В-клетки | ||||
| Покоящиеся гемопоэтические стволовые клетки | До 70% | |||
| Дендритные клетки | ||||
| G/F | Вирус Нипах | EphinB2/B3 | Перициты | 20–40% |
| Клетки эндотелия опухоли | ||||
| COCV | Везиколовирус Кокал | LDL-R | Стимулированные клетки CD34+ | До 80% |
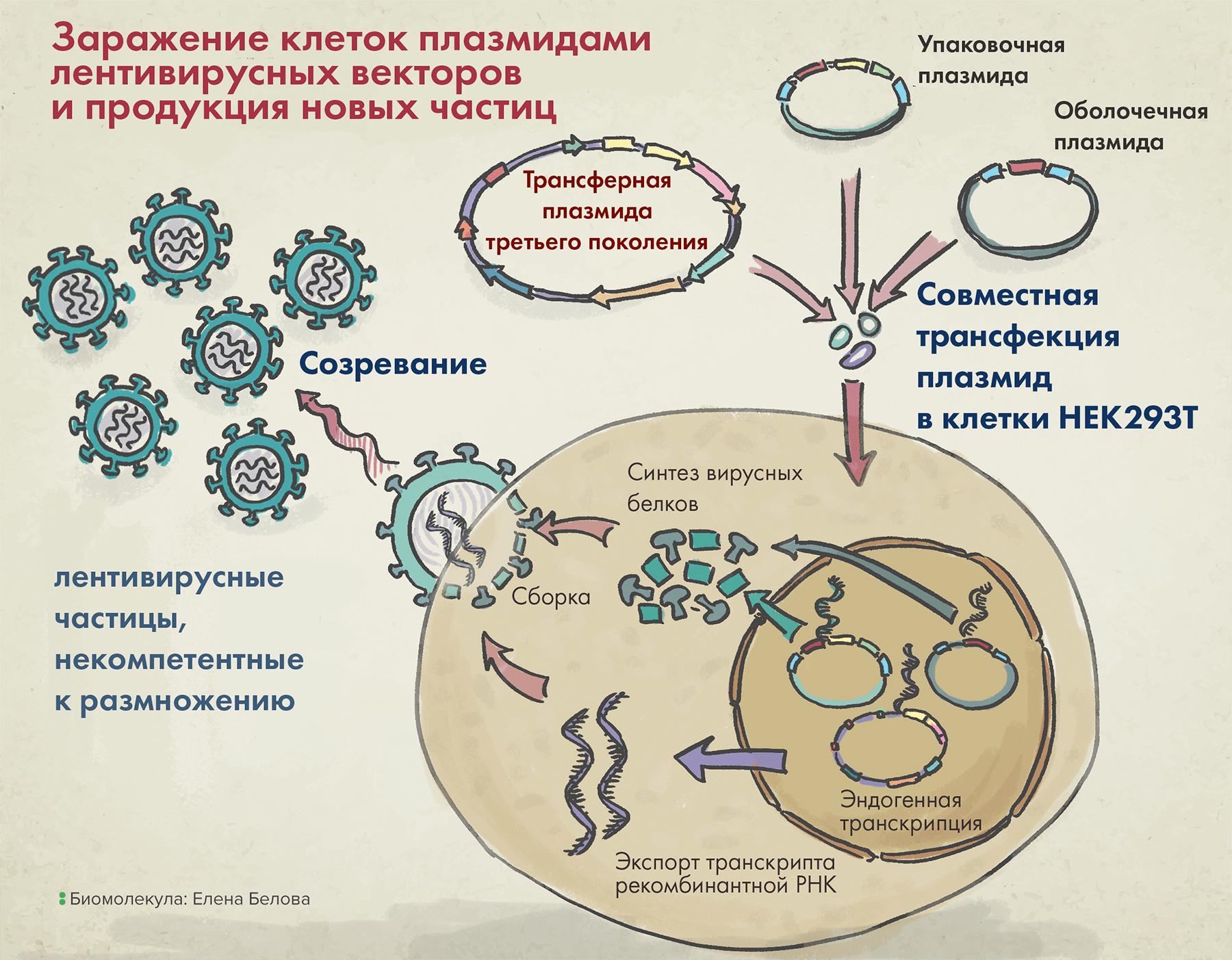
Наконец, последний компонент векторной системы первого поколения — трансферная плазмида — несет целевой трансген, а также так называемую последовательность пси-петли (ψ-петли), — и все это в обрамлении длинных терминальных повторов (long terminal repeats, LTRs). Последние два элемента необходимы для упаковки вирусной РНК в вирион (рис. 4).
Рисунок 4. Упаковка лентивирусных векторов в клетке (на примере третьего поколения таких систем).
После заражения клеток тремя вышеназванными плазмидами в них происходит сборка вирусных частиц, а затем уже их выход наружу. Высвобождаемые векторы содержат VSV-G (он помогает им впоследствии проникать в клетки), но внутри них нет гена, кодирующего этот белок. Так происходит потому, что в кодирующей VSV-G плазмиде отсутствуют генетические последовательности, необходимые для сборки белковой вирусной оболочки, а значит, все ее содержимое запаковаться в вирион уже не сможет.
Поэтому такие частицы умеют доставлять гены в клетку, но не способны размножаться. Чтобы они вдруг снова научились этому, необходима рекомбинация между нашими векторами и, например, природными лентивирусами. Гипотетически это возможно, хоть и маловероятно, — ведь для восстановления репликативно компетентного генома должно многое совпасть: одновременное заражение клеток и вектором, и вирусом, а также прицельный обмен между ними генетическим материалом, — что в силу случайного характера рекомбинации вряд ли случится.
Тем не менее чтобы обезопаситься еще больше, исследователи стали менять исходный геном лентивируса еще сильнее: разбивать его на большее число плазмид, удалять еще больше нецелевых генов, а также модифицировать все необходимые в векторе нативные последовательности. Такие стратегии легли в основу создания лентивирусных векторов второго и третьего поколений (табл. 2).
| Характеристика | Второе поколение | Третье поколение |
|---|---|---|
| Количество плазмид | 3 | 4 |
| Наличие делеции в области U3 в 3′ LTR — для создания самоинактивирующегося вектора (Self-INactivation, SIN) | Нет | Да |
| 5′ LTR | Дикого типа (5′ LTR) | Химерные (RSV) |
| Количество упаковочных плазмид | 1 | 2 |
| Вспомогательные гены: vif, vpr, vpu, nef | Отсутствуют | Отсутствуют |
| tat и rev гены | В упаковочной плазмиде | Ген tat удален, rev в отдельной упаковочной плазмиде |
| gag и pol гены | В упаковочной плазмиде, вместе с tat и rev | Вместе в отдельной плазмиде |
| Псевдотипирование | Псевдотипированы (VSV-G) | Псевдотипированы (VSV-G) |
| Количество рекомбинационных событий, необходимых для генерации репликационно компетентных вирусов | 3 рекомбинации | 4 рекомбинации |
Производство
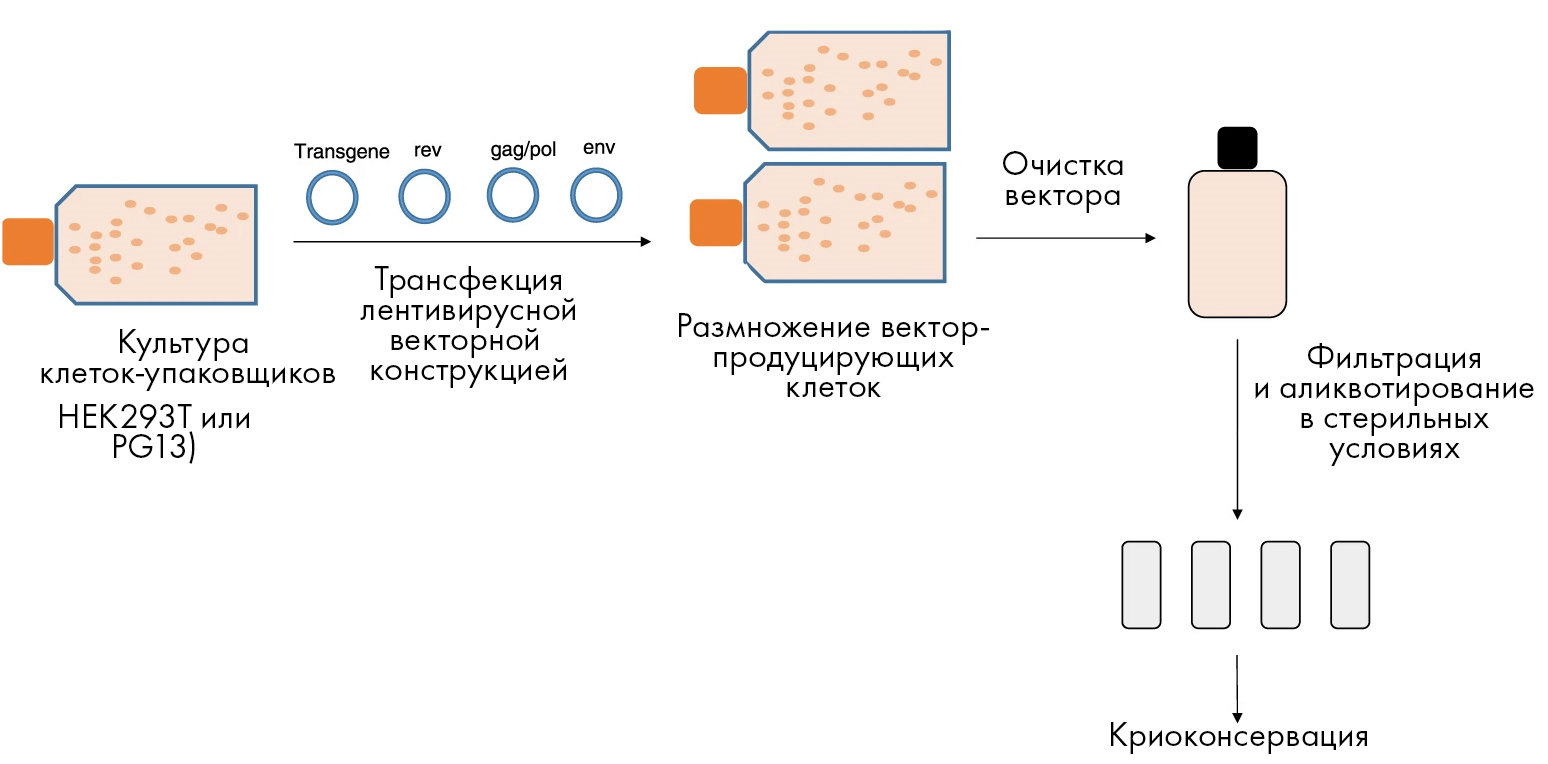
Создание эффективных векторных систем — это лишь первый этап к достаточной продукции нужного материала. Не менее важна разработка технологии производства и ее последующее масштабирование на большие объемы, — чтобы можно было получать требуемые частицы в нужных количествах. При этом в современном мире продукция вирусных частиц для лечебного применения должна идти по Правилам надлежащей производственной практики (известной также как GMP). На рисунке 5 даны основные стадии производства лентивирусных векторов.
Рисунок 5. Основные этапы продукции вирусных векторов на современном производстве, работающем в соответствии с принципами GMP. Все начинается с культуры специальных «клеток-упаковщиков» (таких как HEK293T или PG13). Эти особые упаковочные линии культивируют в течение нескольких дней, заражают плазмидами третьего поколения лентивирусного вектора, и затем уже такие вектор-продуцирующие клетки снова размножают в культуре. После этого векторы выделяют и очищают от остатков клеток (т.н. дебриса: различных клеточных органелл, плазмалеммы и т.д.), а также других загрязняющих примесей. После очистки содержащий векторы полупродукт фильтруют через мембрану с определенным размером пор, не пропускающюю микроорганизмы (что позволяет достичь стерильности). Далее полученный сток асептично распределяют по отдельным аликвотам и криоконсервируют. Сообщалось, что такие замороженные при −80 °С векторы могут сохранять свою стабильность до 9 лет после криоконсервации. Стоит также отметить, что в течение всего описанного процесса очень важен контроль качества, ведь, например, не до конца удаленный из стоков вектора клеточный дебрис может вызывать воспалительные реакции, что было показано в исследованиях как in vitro, так и in vivo [15].
Альтернатива: стабильные упаковщики
Еще один способ получать лентивирусные векторы, помимо временной трансфекции плазмидами, — создание стабильных линий клеток-упаковщиков. Для этого геном клеток (чаще всего это клетки почки человеческого эмбриона HEK293T) модифицируют так, чтобы они смогли стабильно экспрессировать бóльшую часть вирусного генетического материала.
Такие клетки-упаковщики, как правило, экспрессируют гены gag, pol и rev, а зачастую также ген капсида VSV-G. Далее для использования в качестве продуцентов векторов их нужно заразить плазмидой, несущей целевой ген.
Пока что такие стабильные линии используют реже чем «стандартные» клетки-продуценты, ─ но перспективы расширения их применения весьма заманчивы. Они могут осуществлять долгоиграющую экспрессию, что крайне желательно, ─ так как позволит упростить производство, снизив тем самым и его стоимость [16].
Применение лентивирусных векторов в клинике
С момента первых применений лентивирусные векторы стали одним из основных инструментов арсенала генной и клеточной терапии с заметными успехами в клинических исследованиях [17]. Одна из причин — они изначально обладали большим потенциалом благодаря способности эффективно трансдуцировать CD34 + стволовые клетки. Из последних, как известно, в процессе гемопоэза появляются все остальные типы кровяных клеток [18], а потому их генетическая модификация была крайне привлекательна. Ведь после дифференциации эти измененные клетки теоретически смогут остановить (или хотя бы притормозить) патогенез самых разных связанных с ними болезней.
Ученым и медикам оставалось лишь проверить эту теорию практикой, и вскоре перенос генов с использованием лентивирусного вектора в CD34+ стволовые клетки был осуществлен для лечения нескольких генетических заболеваний. Среди них: бета-талассемия, серповидноклеточная анемия, Х-сцепленная адренолейкодистрофия, метахроматическая лейкодистрофия, синдром Вискотта—Олдрича и др. При этом о наличии каких-либо связанных с вектором серьезных нежелательных явлениях в этих исследованиях заявлено не было (о первом тревожном сигнале, связанным с онкогенезом, рассказано выше) [15].
Ранние успехи подстегнули развитие такого лечения, и, согласно регистру клинических испытаний ClinicalTrials.gov, функциональность лентивирусного вектора сейчас уже тестируют более чем в 4000 исследований. При этом известно, что и количество подобных испытаний непрерывно и экспоненциально растет, например: в 2017 г. их было около 200, в 2020-м — более 600 [19], ну а сегодня, как видим, — уже на порядок больше. Из такого обширного поля настоящими прорывами можно назвать уже одобренное лечение, — а это пока что два генных продукта:
Заключение и перспективы
Одно из направлений улучшения генной терапии — разработка новых векторов-носителей. В частности, представляют интерес не интегрирующиеся лентивирусные векторы (non-integrating lentiviral vectors, NILVs) — они привлекательны в плане снижения вероятности инсерционного мутагенеза. В них выключен фермент вирусная интеграза (как мы помним, отвечающая за внедрение провирусной последовательности в геном клетки) — и они точно так же умеют инфицировать как делящиеся, так и неделящиеся клетки. При этом вирусный геном остается в клетке в виде эписомы, а не интегрируется в геномную ДНК [15].
NILVs стабильно экспрессируют трансгены из эписомальной ДНК в неделящихся клетках, и временно — если клетки-мишени размножаются. Было показано, что такие векторы имеют широкий тропизм ко множеству различных типов клеток и тканей, что вкупе с повышенной безопасностью делает их идеальными кандидатами для использования в вакцинации и иммунотерапии.
Это также открывает перспективы использования NILVs как инструмента для доставки компонентов CRISPR/Cas9 — революционной технологии, которая ныне широко используется в исследованиях генного редактирования. Она включает так называемую направляющую РНК, помогающую распознавать нужные участки генома в клетке для связи с ними нуклеазы Cas9. Последняя начинает в этом месте расщеплять спираль ДНК, создавая двухцепочечные разрывы, которые затем могут быть репарированы определенным образом — с удалением (делецией) каких-либо «поломанных» генов, или внедрением в этом месте каких-то новых кодирующих последовательностей.
Сегодня существуют лентивирусные системы, умеющие доставлять в клетку как направляющие РНК, так и нуклеазу Cas9 (точнее кодирующие их последовательности — для последующей экспрессии).
Лентивирусные векторы также часто используют в исследовательских целях для изменения экспрессии генов посредством использования короткой шпилечной РНК или антисмысловой РНК [23], — что является частью уже известного механизма РНК-интерференции (об этом интересном феномене «Биомолекула» писала уже не раз).
Конечно, пока что большинство из таких перспективных подходов все еще находится на ранних стадиях разработки, и необходимы дальнейшие исследования, чтобы определить, насколько лентивирусные векторы по настоящему «жизнеспособны» — как инструмент для терапевтической доставки компонентов редактирования/регуляции экспрессии тех или иных генов [15].