Аденома фатерова сосочка что
Аденома фатерова сосочка что
Будзинский С. А., к. м. н.,
старший научный сотрудник научно-исследовательской лаборатории хирургической гастроэнтерологии и эндоскопии кафедры госпитальной хирургии № 2 лечебного факультета РНИМУ им. Н. И. Пирогова, старший ординатор отделения эндоскопии № 1 ГКБ № 31
Орлов С. Ю., к. м. н.,
заведующий отделением эндоскопии ГКБ № 4
Федоров Е. Д., д. м. н.,
профессор, главный научный сотрудник научно-исследовательской лаборатории хирургической гастроэнтерологии и эндоскопии РНИМУ им. Н. И. Пирогова
Бахтиозина Д. В.,
интерн кафедры госпитальной хирургии № 2 лечебного факультета РНИМУ им. Н. И. Пирогова
Шаповальянц С. Г., д. м. н.,
профессор, зав. кафедры госпитальной хирургии № 2 лечебного факультета РНИМУ им. Н. И. Пирогова
г. Москва
Аденомы большого дуоденального сосочка (БДС) составляют 1 % всех новообразований желудочно-кишечного тракта и являются потенциально злокачественными, в 15–30 % приводящими к развитию рака БДС [1].
В последние два десятилетия появился ряд работ, демонстрирующих высокую эффективность эндоскопических операций при аденомах БДС. Методики лечения в основном, представлены различными вариантами эндоскопической папиллэктомии [2].
В настоящее время эндоскопическая папиллэктомия в первую очередь показана пациентам с аденомами БДС низкой и высокой степенями дисплазии, а также раком in situ [3]. Это связано с небольшой частотой осложнений и летальности по сравнению с традиционными хирургическими методами лечения, а также экономической выгодой. В то же время при подобном подходе к лечению образований БДС существует целый ряд трудностей и ограничений. В первую очередь таковыми являются возможность нерадикального удаления аденомы БДС с риском ее рецидива [4]. Технически выполнение подобного вмешательства возможно в 98 % случаев, при этом единым блоком образование удалимо в 88,8 % наблюдений. [5]. Однако, даже после успешного эндоскопического удаления опухоли в 7,4 % — 14 % случаев при наличии опухолевых клеток в краях резекции требуется повторная полостная операция [6].
Наиболее частыми осложнениями эндоскопической папилэктомии, встречающимися в 4–29 % случаев, являются кровотечение из области операции, перфорация стенки даенадцатиперстной кишки (ДПК), острый холангит, острый постманипуляционный панкреатит (ОПМП) и формирование стриктуры терминального отдела главного панкреатического протока (ГПП) с развитием клинической картины хронического панкреатита (ХП) в отдаленные сроки [6,7].
В клинике госпитальной хирургии № 2 РНИМУ им. Н. И. Пирогова на базе 31 ГКБ с 01.2008 по 01.2015 выполнено 3107 оперативных ретроградных вмешательств на БДС. Эндоскопическое удаление образований БДС методом папиллэктомии было произведено в 16 случаях (0,5 %). При этом послеоперационное осложнение в виде кровотечения из области операции возникло в 1 случае (6,3 %). Еще в 1 наблюдении имело место развитие ХП на фоне стриктуры терминального отдела ГПП в отдаленные сроки.
Мы хотим представить одно из успешных клинических наблюдений радикального эндоскопического удаления аденомы БДС с высокой степенью дисплазии, а также интраоперационной коррекции возникших при данной операции осложнений.
У больного А., 66 лет при амбулаторном обследовании по данным УЗИ была выявлена дилатация общего желчного протока до 10 мм и панкреатического протока до 4 мм. При ЭГДС визуализировано полиповидное образование БДС, выполнена биопсия. При гистологическом исследовании полученный материал представлен тубулярной аденомой с дисплазией 1–2 степени. Неделю спустя пациент отметил пожелтение кожных покровов и был госпитализирован в ГКБ № 31 г. Москвы.
По результатам предоперационной диагностики в биохимическом анализе крови уровень общего билирубина составил 59 мкмоль/л, АЛТ — 92 е/л, АСТ — 101 е/л, щелочная фосфатаза — 285 е/л. При традиционном ультразвуковом исследовании выявлены признаки билиарной и панкреатической гипертензии (ширина общего желчного протока — 11 мм, ГПП — 4 мм) при отсутствии патологии со стороны желчного пузыря.
При эндоскопической ультрасонографии были подтверждены билиарная и панкреатическая гипертензия, а также выявлено образование БДС в виде гипоэхогенной структуры в области Фатерова сосочка, диаметром 18 мм, без распространения на терминальные отделы желчного и панкреатического протоков.
Таким образом, клинический диагноз был сформулирован следующим образом: тубулярная аденома БДС с билиарной и панкреатической гипертензией без распространения на терминальные отделы холедоха и ГПП, осложненная механической желтухой.
Учитывая предоперационные находки, больному было решено выполнить эндоскопическую папиллэктомию.
Целями эндоскопической процедуры были декомпрессия общего желчного и главного панкреатического протоков, лечение желтухи и собственно удаление аденомы.
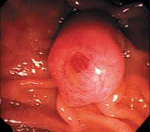
Операция производилась под внутривенной седацией в условиях рентгенопрерационной. Первоначально была выполнена хромоскопия с использованием индиго-кармина для четкого определения границ образования и зоны резекции (Рис. 1)
Затем при помощи игольчатого папиллотома KD‑17Q‑1 (Olympus, Japan) произведена разметка краев резекции и выполнен циркулярный разрез. При этом отмечено возникновение струйного кровотечения из области разреза, которое с техническими трудностями было остановлено комбинированным способом путем инъекции р‑ра адреналина и точечной моноактивной коагуляцией сосуда (Рис. 2).
После этого по завершении циркулярного разреза, на аденому была наложена полипэктомическая петля и в смешанном режиме коагуляции и резания образование было удалено. Выполнена дополнительная канюляционная папиллосфинктеротомия. Кровотечения не было, однако, при ревизии области вмешательства в нижнем ее краю был обнаружен дефект стенки ДПК диаметром 2–3 мм. С целью закрытия перфорации было выполнено клипирование дефекта посредством наложения 2 клипс HX‑610–135 (Olympus, Japan) с достижением полной герметизации области перфорации (Рис. 3).
Затем с целью профилактики ОПМП и формирования стриктуры терминального отдела ГПП была произведена установка пластикового панкреатического стента диаметром 5 Фр типа PBD‑230–0704 (Olympus, Japan).
Послеоперационный период протекал гладко, панкреатический стент был удален на 4‑е сутки. Пациент был выписана из стационара на 5‑е сутки после операции.
По данным гистологического исследования операционного материала была выявлена тубулярно-ворсинчатая аденома высокой (2–3) степени дисплазии.
При контрольной дуоденоскопии и биопсии через 1 год данных за рецидив аденомы выявлено не было.
Таким образом, эндоскопическая папиллэктомия, являющаяся методом выбора в лечении доброкачественных новообразований БДС, обладает рядом серьезных, а иногда и фатальных осложнений. В то же время при их интраоперационном выявлении или развитии в раннем послеоперационном периоде, технически возможна и показана их эндоскопическая коррекция. При этом основными способами лечения при возникновении кровотечения являются инфильтрационный и коагуляционный методы, при перфорации — клипирование, а при развитии ОПМП — стентирование ГПП.
Список литературы:
1. Beger H. G., Staib L., Schoenberg M. H. Ampullectomy for adenoma of the papilla and ampulla of Vater// Langenbeck’s‑Arch Surg. 1998 Apr, 383 (2): 190–3,
2. Hirooka Y., Iton A., Goto H. EUS/IDUS And Endoscopic Papillectomy//Digestive Endoscopy 2004, 16 (Suppl.), S176‑S177
3. Attaallah, W. et al. Endoscopic snare excision of adenoma of the papilla of Vater without prophylactic pancreatic-duct stent. JOP. 2014 Nov 28;15 (6):587–90. doi: 10.6092/1590–8577/2639.
4. Moon J. H., Choi H. J., Lee Y. N. Current status of endoscopic papillectomy for ampullary tumors.. Gut Liver. 2014 Nov;8 (6):598–604. doi: 10.5009/gnl14099. Epub 2014 Nov 15.
5. De Palma G. D., et al. Endoscopic snare papillectomy: A single institutional experience of a standardized technique. A retrospective cohort study. Int J Surg. 2014 Dec 10;13C:180–183. doi: 10.1016/j. ijsu.2014.11.045.
6. Hauke S. Heinzow, Philipp Lenz et al. Feasibility of Snare Papillectomy in Ampulla of Vater Tumors: Meta-Analysis and Study Results from a Tertiary Referral Center. Hepato-Gastroenterology 2012; 59:332–335 doi 10.5754/ hge11414
7. Ismail, S. Marianne, U. et al. Endoscopic papillectomy, single-centre experience. Surg Endosc. 2014 Nov;28 (11):3234–9. doi: 10.1007/s00464–014–3596–5. Epub 2014 Jun 14.
Рак большого дуоденального сосочка
Рак большого дуоденального сосочка – злокачественная опухоль фатерова сосочка, расположенного в области двенадцатиперстной кишки. Характерен медленный рост и позднее метастазирование при раннем появлении механической желтухи. Наблюдаются боли, периодическое повышение температуры тела, увеличение печени и желчного пузыря. На поздних стадиях возможны кровотечения. Диагноз устанавливают с учетом симптоматики, данных рентгенографии, фиброгастродуоденоскопии и результатов биопсии. Лечение оперативное: гастропанкреатодуоденальная резекция, папиллэктомия, дуоденэктомия, паллиативные вмешательства.
Общие сведения
Рак большого дуоденального сосочка – злокачественная неоплазия большого дуоденального (фатерова) соска, локализующегося в нисходящей части двенадцатиперстной кишки и представляющего собой соустье главного панкреатического протока и общего желчного протока. Составляет 40% от общего количества онкологических поражений пилородуоденальной зоны, 5% от общего числа неоплазий ЖКТ и 1-2% от общего количества раков различных локализаций. Рак большого дуоденального сосочка является третьей по распространенности причиной возникновения механической желтухи. Обычно поражает пожилых пациентов, средний возраст больных составляет 54 года. Очень редко выявляется у детей. Женщины страдают реже мужчин. Лечение осуществляют специалисты в сфере онкологии, гастроэнтерологии и абдоминальной хирургии.
Причины рака фатерова сосочка
Причины возникновения опухоли точно не выяснены. Специалисты отмечают, что определенное значение имеет наследственная предрасположенность – заболевание нередко диагностируется в семьях, члены которой страдают семейным полипозом. Кроме того, у некоторых пациентов выявляется генетическая мутация K-ras. Установлено, что неоплазия может развиться в результате малигнизации аденомы фатерова соска. В список факторов риска также включают хронический панкреатит и заболевания гепатобилиарной системы.
Источником рака большого дуоденального сосочка являются трансформировавшиеся клетки эпителия слизистой двенадцатиперстной кишки, панкреатического протока либо общего желчного протока. Для новообразования характерен медленный экзофитный рост. По внешнему виду неоплазия напоминает папиллому, разрастание грибовидной формы или в виде соцветья цветной капусты. Реже выявляются эндофитные формы. При экзофитных формах рака большого дуоденального сосочка желтуха чаще ремиттирующая, при эндофитных – постоянная. Диаметр узла при его хирургическом удалении в среднем составляет 3 мм.
При микроскопическом исследовании выявляются клеточные скопления и отдельно лежащие эндокринные клетки веретенообразной, треугольной и цилиндрической формы. Число эндокринных клеток уменьшается по мере снижения уровня дифференцировки неоплазии. Обычно рак большого дуоденального сосочка прорастает общий желчный проток, возможно также поражение поджелудочной железы и стенки двенадцатиперстной кишки, лимфогенное и отдаленное метастазирование. Лимфогенные метастазы обнаруживаются у 21-51% больных. Отдаленные вторичные очаги выявляются достаточно редко. Обычно поражается печень, реже – кости, головной мозг, легкие и надпочечники.
Рак большого дуоденального сосочка может полностью обтурировать просвет желчного протока, реже выявляется стеноз. Даже при частичном сдавлении из-за отечности слизистой возникают грубые расстройства оттока желчи, становящиеся причиной развития механической желтухи. Появляется билиарная гипертензия, сопровождающаяся дилатацией желчевыводящих путей и протоков поджелудочной железы. Кишечная непроходимость развивается очень редко. При распространении процесса возможно прорастание стенки кишечника и распад неоплазии с развитием внутреннего кровотечения.
Симптомы рака фатерова сосочка
Первым проявлением болезни часто становится механическая желтуха, возникшая на фоне соматического благополучия. Вначале желтуха обычно перемежающаяся, нормализация биохимических показателей крови обусловлена уменьшением отека в области стенозированного желчного протока. При прогрессировании рака большого дуоденального сосочка желтуха становится более стойкой, изменение цвета кожи выявляется после интенсивных болей, сопровождающихся ознобами и проливными потами. Пациенты жалуются на выраженный зуд. Интермиттирующий характер желтухи на поздних стадиях (выявляется в 51% случаев) обусловлен распадом рака большого дуоденального сосочка, сопровождающегося временным восстановлением проходимости желчного протока.
При пальпации определяется гепатомегалия. У 60% пациентов под нижним краем печени прощупывается увеличенный желчный пузырь (симптом Курвуазье). При продолжительной обтурации желчевыводящих путей возникают цирроз печени и хронический панкреатит. При инвазии рака большого дуоденального сосочка в стенку кишечника и последующем распаде опухоли возможны кровотечения (острые массивные либо повторяющиеся незначительные) с развитием анемии. При региональном метастазировании отмечается изменение болевого синдрома.
Характерной особенностью рака большого дуоденального сосочка является ранняя потеря веса. Причиной похудания становятся стеноз либо обструкция панкреатических протоков, из-за которых в ЖКТ перестают поступать ферменты, необходимые для расщепления белков и жиров. Нарушение проходимости общего желчного протока еще больше усугубляет расстройства всасывания жиров и ухудшает всасываемость витаминов. Снижение веса и авитаминоз становятся причиной адинамии.
У больных раком большого дуоденального сосочка часто наблюдаются поносы, сопровождающиеся вздутием и болями в животе. Каловые массы зловонные, глинисто-серые. В запущенных случаях может выявляться жировой кал. При появлении регионарных метастазов отмечается изменение характера болевого синдрома. На поздних стадиях определяются истощение и расстройства функций органов, пораженных отдаленными метастазами.
Диагностика рака фатерова сосочка
Постановка диагноза сопряжена с существенными затруднениями из-за неспецифичности симптоматики. В процессе диагностики онколог ориентируется на жалобы, данные объективного осмотра, рентгенографии, чреспеченочной или внутривенной холангиографии, дуоденального зондирования, фиброгастродуоденоскопии и других исследований. При желтухе определяется высокий уровень билирубина с преобладанием прямой фракции, стеркобилин в кале отсутствует. На поздних стадиях рака большого дуоденального сосочка выявляется анемия.
Достаточно достоверным исследованием является дуоденальное зондирование, при проведении которого часто удается обнаружить кровь в дуоденальном содержимом. Иногда в ходе этого исследования выявляются клетки неоплазии и ферменты поджелудочной железы. Рентгенографическими признаками рака большого дуоденального сосочка являются неровность контуров либо дефект наполнения в зоне внутренней стенки двенадцатиперстной кишки, а также отсутствие проходимости либо деформация желчного протока в зоне, приближенной к фатеровому соску.
При проведении фиброгастродуоденоскопии обнаруживают опухолевидное образование и выполняют эндоскопическую биопсию подозрительного участка. В некоторых случаях диагноз рака большого дуоденального сосочка не удается установить при помощи стандартных методик, для уточнения характера патологии приходится проводить лапаротомию, рассекать фатеров сосок, осуществлять забор ткани, а затем принимать решение об объеме операции на основании данных срочного гистологического исследования. Дифференциальный диагноз осуществляют с гепатитом, раком головки поджелудочной железы и раком желчных путей.
Лечение рака фатерова сосочка
Основным способом лечения данной патологии является оперативное вмешательство, которое, в зависимости от распространенности процесса, может быть радикальным либо паллиативным. Группа паллиативных операций включает в себя около десяти различных вариантов анастомозов, позволяющих восстановить отток желчи в пищеварительный тракт либо (реже) предотвратить сдавление двенадцатиперстной кишки растущим раком большого дуоденального сосочка.
Радикальная операция является тяжелым и сложным вмешательством, поэтому проводится только после тщательного отбора пациентов в соответствии со стандартами, включающими в себя допустимую степень истощения, уровень белков в крови, определенные показатели пульса и жизненной емкости легких и т. д. Больным раком большого дуоденального сосочка проводят гастропанкреатодуоденальную резекцию. При наличии противопоказаний к радикальному вмешательству выполняют условно радикальные операции: папиллэктомию, дуоденэктомию либо экономную панкреатодуоденальную резекцию. Радиотерапия и химиопрепараты при раке большого дуоденального сосочка малоэффективны.
Аденома фатерова сосочка что
НИИ СП им. Н.В. Склифосовского
НИИ СП им. Н.В. Склифосовского, Москва
ГБУЗ Москвы «Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского» Департамента здравоохранения Москвы, Москва, Россия
НИИ скорой помощи им. Н.В. Склифосовского, Москва
Эндоскопическое удаление гигантской аденомы большого сосочка двенадцатиперстной кишки
Журнал: Эндоскопическая хирургия. 2014;20(4): 31-34
Миронов А. В., Рогаль М. Л., Тетерин Ю. С., Степан Е. В. Эндоскопическое удаление гигантской аденомы большого сосочка двенадцатиперстной кишки. Эндоскопическая хирургия. 2014;20(4):31-34.
Mironov A V, Rogal’ M L, Teterin Yu S, Stepan E V. Endoscopic removal of a giant adenoma of the ampulla of Vater. Endoscopic Surgery. 2014;20(4):31-34.
НИИ СП им. Н.В. Склифосовского
НИИ СП им. Н.В. Склифосовского
НИИ СП им. Н.В. Склифосовского, Москва
ГБУЗ Москвы «Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского» Департамента здравоохранения Москвы, Москва, Россия
НИИ скорой помощи им. Н.В. Склифосовского, Москва
В настоящее время число воспалительных и опухолевых заболеваний органов гепатопанкреатодуоденальной зоны, вызывающих непроходимость внепеченочных желчных протоков, продолжает увеличиваться. Среди этих заболеваний немаловажное место занимают опухолевые изменения большого сосочка двенадцатиперстной кишки (БСДПК).
Так, по данным литературы [1—3], рак БСДПК встречается в 11,7—24,5% среди всех злокачественных опухолей, приводящих к механической желтухе, а аденома БСДПК — в 0,15—4,2% случаев. Чаще всего у больных с доброкачественными опухолями выявляются одиночные опухолевидные образования диаметром от 2 до 4 мм, исходящие из слизистой оболочки переходной складки устья сосочка, реже — множественные, диаметром 2—3 мм, располагавшиеся в области устья БСДПК [4].
В последние годы в связи с широким внедрением эндоскопии частота выявления аденом БСДПК увеличилась. Как правило, это внутриампулярные аденомы и аденомы, исходящие из устья БСДПК, не превышающие 1,5—2,0 см в диаметре. Удаление таких аденом осуществляется эндоскопически с помощью петлевой электроэксцизии.
В клинике мы столкнулись с вариантом гигантской аденомы БСДПК, которую удалось удалить малоинвазивным способом в объеме эндоскопической аденомэктомии.
Пациентка С., 76 лет, поступила в НИИ СП им. Н.В. Склифосовского с жалобами на умеренные боли в эпигастрии, кожный зуд. Заболела остро 15.09.13, когда появились боли в верхних отделах живота. 16.09.13 отметила усиление боли, что и послужило поводом для госпитализации в хирургическое отделение НИИ СП им. Н.В. Склифосовского с диагнозом «острый панкреатит».
При поступлении кожные покровы чистые, видимые слизистые оболочки субиктеричные. Дыхание проводится во все отделы, хрипов нет. Частота дыхательных движений 17 в минуту. Тоны сердца ритмичные. Частота сердечных сокращений 80 уд/мин. Артериальное давление 130/80 мм рт.ст. Живот мягкий, не вздут, участвует в акте дыхания, при пальпации болезненный в эпигастрии. В правом подреберье пальпируется дно желчного пузыря. Симптомы Ортнера, Мейо—Робсона, Щеткина—Блюмберга отрицательные. Перистальтика выслушивается. Дизурии нет, моча темная. Общий билирубин крови составлял 42,8 мкмоль/л (прямой 17,24 мкмоль/л).
В отделении проводилась спазмолитическая, обезболивающая терапия. Болевой приступ купирован.
При УЗИ органов брюшной полости выявлены признаки увеличения и диффузных изменений печени, застойного желчного пузыря, выраженной внутри- и внепеченочной билиарной гипертензии, диффузных изменений поджелудочной железы, объемного образования в эпигастрии (головки поджелудочной железы?).
Динамическая холесцинтиграфия: выраженное нарушение желчевыделительной функции печени и транспорта по общему желчному протоку (ОЖП) с минимальным поступлением желчи в кишку. Нефункционирующий желчный пузырь.
По данным магнитно-резонансной томографии, гепатопанкреатодуоденальной зоны с магнитно-резонансной холангиографией выявлены признаки выраженной билиарной гипертензии (просвет ОЖП расширен до 3 см) и внутрипросветного объемного образования в дистальной части ОЖП размером 2,0×1,7×1,5 см.
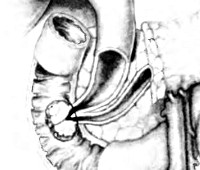
Пациентке выполнена эзофагогастродуоденоскопия, при которой выявлено, что в нисходящей части двенадцатиперстной кишки в зоне продольной складки определяется опухолевидное образование размером 5,0×3,0 см, исходящее из БСДПК и выступающее в просвет кишки на 2/3 (рис. 1). Поверхность образования ворсинчатая с умеренной контактной кровоточивостью. Сделано предположение об аденоме БСДПК, была взята биопсия. По данным гистологического исследования выявлена ворсинчатая аденома двенадцатиперстной кишки (ДПК) с умеренной дисплазией эпителия.

08.10.13 больная оперирована. Под наркозом выполнена дуоденоскопия аппаратом с боковой оптикой, при этом установлено, что протяженность опухоли вместе с БСДПК составляет около 7,0 см. Захватить опухоль единым блоком полипэктомической петлей не удалось из-за больших размеров. В связи с этим произведено удаление опухоли по частям путем электроэксцизии в 4 этапа (рис. 2). Опухоль удалена по границе устья БСДПК. Устье БСДПК было растянуто до 1,5—2,0 см. Затем выполнена атипичная папиллотомия длиной около 2,0—2,5 см и произведены 3 радиальных разреза длиной около 1,0 см по медиальной полуокружности крыши БСДПК. После чего в зоне рассеченной ампулы БСДПК визуализировались частично некротизированные опухолевые ткани в виде розетки диаметром около 2,5 см, выступающие в просвет на 0,5 см. Без технических трудностей выполнено канюлирование и контрастирование холедоха. При контрастировании — ОЖП расширен до 3,0 см просвет гомогенный, дистальная треть практически не контрастируется. С учетом высокого риска кровотечения на фоне длительной гипербилирубинемии от удаления части опухоли, располагающейся в просвете ОЖП, решено воздержаться, поэтому для адекватного дренирования ОЖП выполнено его стентирование (длина стента 5,0 см, диаметр 10 Fr). По стенту выделилось значительное количество темно-зеленой желчи (рис. 3).


Течение послеоперационного периода без осложнений. Проводилась антисекреторная, обезболивающая, антацидная терапии. На этом фоне клинико-биохимические показатели гомеостаза нормализовались. Пациентка выписана из стационара с рекомендациями повторной госпитализации через 1 мес для выполнения второго этапа аденомэктомии.
19.11.13 пациентка повторно поступила в НИИ СП им. Н.В. Склифосовского для выполнения второго этапа эндоскопической аденомэктомии.
За 1 мес больная прибавила в массе тела на 4 кг. Кожные покровы и видимые слизистые оболочки обычной окраски. Дыхание проводится во все отделы, хрипов нет. Число дыхательных движений 17 в минуту. Тоны сердца ритмичные. Частота сердечных сокращений 78 уд/мин. АД 140/90 мм рт.ст. Живот не вздут, участвует в акте дыхания, при пальпации мягкий, болезненный в верхних отделах. Перитонеальные симптомы отрицательные. Перистальтика выслушивается. Дизурии нет, моча светлая. Общий билирубин крови 20,1 мкмоль/л (прямой 5,7 мкмоль/л).
По данным УЗИ органов брюшной полости выявлены признаки диффузных изменений печени и поджелудочной железы, застойного желчного пузыря, стента в проекции ОЖП.
28.11.13 под внутривенной седацией пациентке выполнена дуоденоскопия. В нисходящем отделе ДПК по заднемедиальной стенке определяется зона папиллотомии, в верхнем полюсе которой имеются аденоматозные разрастания диаметром около 1,5—2,0 см, выступающие в просвет на 0,5 см. Поверхность их ворсинчатая с незначительной контактной кровоточивостью. Из центральной части разрастаний в просвет ДПК на 1,5 см выступает билиодуоденальный стент, по которому отделяется светлая желчь. Стент удален. Выполнена электроэксцизия интрадуоденальных аденоматозных разрастаний в зоне выполненной ранее папиллотомии петлей и дополнительная папиллосфинктеротомия длиной около 1,0 см. Устье ОЖП не визуализируется. Затем селективно катетеризирован ОЖП, выполнена холангиография, при которой контрастированы желчевыводящие пути на всем протяжении. Долевые протоки расширены до 7 мм, просвет гомогенный. Гепатикохоледох расширен до 2,5 см, просвет гомогенный. ОЖП также расширен до 2,5 см, в средней и дистальной трети просвет негомогенный (за счет разрастаний опухолевой ткани).
Вывести внутрипросветную часть аденомы из ОЖП при помощи петли не удалось. Повторно в область конфлюенса заведен катетер и произведено тугое наполнение ОЖП изотоническим раствором натрия хлорида. После этого в просвет ДПК дислоцировалась часть аденомы, находящейся в просвете ОЖП. Размер внутрипросветной части аденомы составил около 3,0×2,5×2,5 см (рис. 4). Произведено ее удаление путем электроэкцизии. Устье ОЖП диаметром около 1,5 см. Выполнена санация ОЖП 0,01% раствором диоксидина. Из просвета ОЖП в ДПК эвакуировались множественные мелкие фрагменты аденомы диаметром 0,4—0,6 см и конкременты мягкой консистенции диаметром от 0,5 см до 1,0×0,5 см. Кровотечения в зоне выполненной манипуляции в конце исследования не отмечалось.

Течение послеоперационного периода гладкое. Проводилась спазмолитическая, инфузионная, обез-боливающая, антацидная терапия. В удовлетворительном состоянии выписана из стационара под наблюдение хирурга по месту жительства.
Заключение
Таким образом, в нашем клиническом наблюдении аденома БСДПК с основанием в интраампулярной части распространялась и в ДПК с сужением просвета на 2/3, и в просвет дистального отдела ОЖП, что обусловливало признаки билиарной гипертензии и механической желтухи. Считаем целесообразным даже при гигантских размерах аденомы у пациентов с верифицированным диагнозом рассматривать эндоскопическую аденомэктомию как метод выбора.