Аденовирусный вектор что это такое
Чем на самом деле является вакцина от коронавируса? Испытания, скрытые компоненты и правда о сроках разработки «Спутник V»
Чем на самом деле является вакцина от коронавируса? Испытания, скрытые компоненты и правда о сроках разработки «Спутник V»

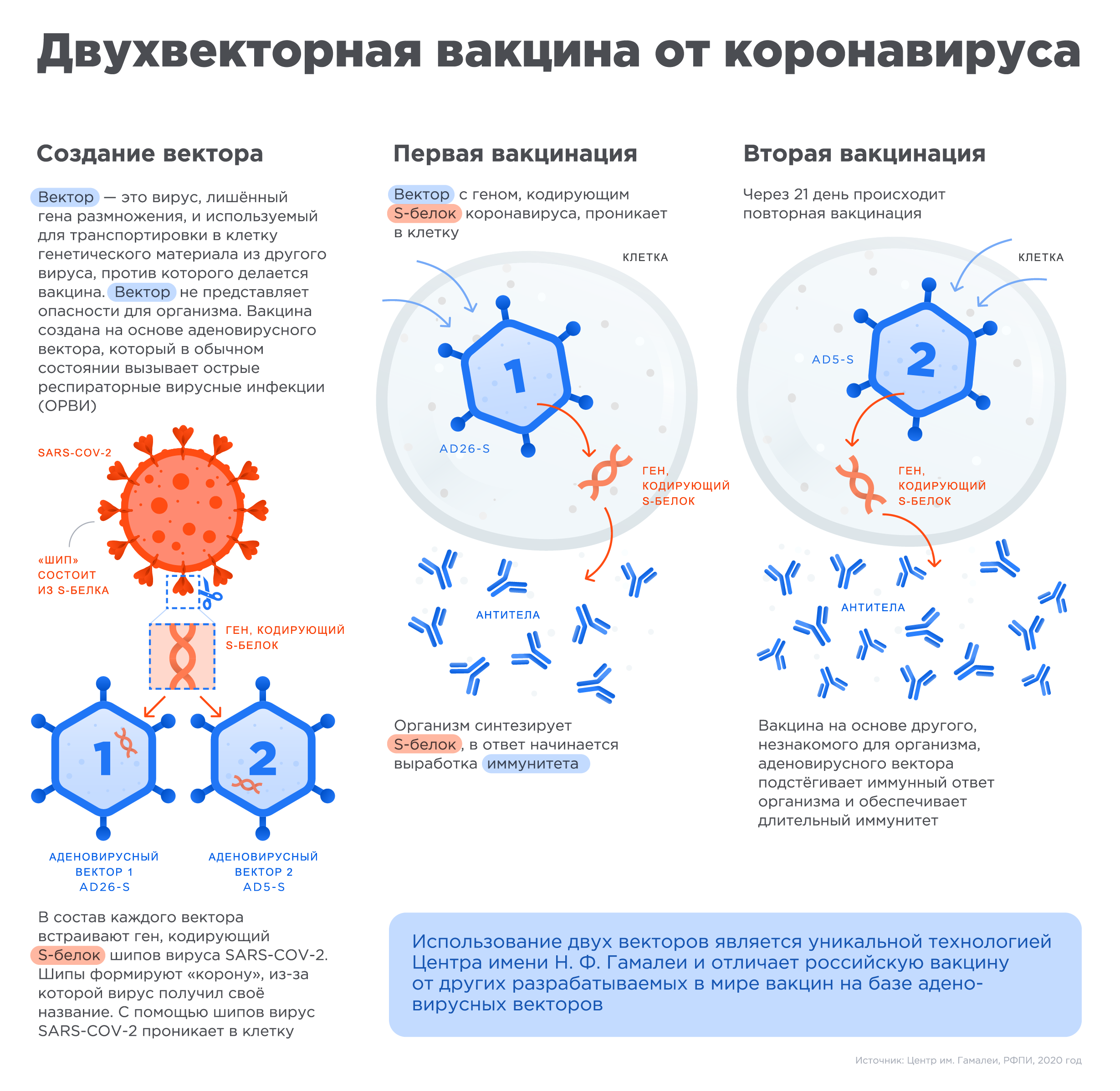
Институт им. Гамалеи, где и был синтезирован «Спутник V», создавал вакцины на основе аденовируса с 2015 г., поэтому ученым в относительно небольшие сроки удалось создать вакцину от коронавируса. Она защищает организм от заражения следующим образом: в аденовирусный вектор (вирус), который искусственно лишили возможности размножаться, вшили ген, кодирующий S-белок шипа коронавируса. Вектор доставляет кусочек РНК-вируса в клетку, а та, в свою очередь, реагирует на это так же, как реагировала бы на вторжение SARS-CoV-2. Начинают вырабатываться специфические антитела, которые и создают иммунитет против коронавируса.
Что входит в состав вакцины от коронавируса и содержатся ли в ней опасные «ингредиенты»?
Аденовирусный вектор – основное действующее вещество вакцины. Это главное составляющее, но, для работы прививки необходимы и другие компоненты. Они помогают сохранить эффект действующего вещества и облегчают его проникновение в клетки человека.
Помимо самого аденовирусного вектора в состав «Спутник V» входят:
Каждый «ингредиент» прививки от коронавируса абсолютно безвреден. Для того чтобы проверить, формируют ли в связке все эти компоненты устойчивый иммунитет к коронавирусу, проводятся испытания.
Какие испытания прошла вакцина от коронавируса?
Сразу после синтеза нового препарата, ученые провели доклиническое тестирование на хомячках и приматах. Проверяли токсичность, безопасность и эффективность новой вакцины. Никаких осложнений, побочных реакций у животных не возникло, поэтому ученые приступили к клиническим испытаниям на людях.
Первая фаза испытаний обычно проводится на небольшой группе здоровых добровольцев. Для тестирования российской вакцины «Спутник V» было привлечено 76 военных возрастом от 18 до 60 лет. Фаза была разделена на два этапа.
Первый этап длился 28 дней. Девятнадцати добровольцам поставили первую часть вакцины, основанной на ослабленном аденовирусе 26 типа, другим девятнадцати – вторую, с аденовирусом 5 типа. Так была проверена безопасность обоих компонентов вакцины. Результатом этапа стала хорошая переносимость препарата всеми добровольцами. Побочные эффекты были легкими или умеренными:
Опасных для жизни побочных эффектов обнаружено не было.
Во время второго этапа исследовался уже формирующийся после вакцинации иммунитет. Все добровольцы получили обе части вакцины с разницей в 21 день между ними. На 28 день после введения второй дозы, с помощью высокоточных тестов, у 100% добровольцев были обнаружены антитела к SARS-CoV-2. Более того, было доказано формирование другого – клеточного иммунитета. Обычно он сохраняется в «памяти» организма несколько лет.
Спустя три месяца после старта третьей фазы клинических испытаний в декабре 2020 г. российский Минздрав принял решение совместить последний этап исследований с массовой вакцинацией населения прививкой «Спутник V». Решение приняли оперативно, основываясь на предварительных результатах, опубликованных разработчиками вакцины в ноябре 2020 г.
В основе проведенных расчетов лежат случаи заболевания COVID-19 среди уже привитых добровольцев. Из общего числа участников испытаний, получивших обе положенные инъекции вакцины или плацебо (18 794), к концу третьей недели после второго укола вирус был диагностирован у 39 человек.
31 случай заражения был выявлен у тех, кто получил плацебо. В группе волонтеров, привитых настоящей вакциной, COVID-19 был диагностирован у восьмерых (группа получивших вакцину – в три раза больше группы плацебо). Сопоставление результатов по двум группам дает результат эффективности вакцины в 95%.
«Набранная группа участников исследований позволяет в полной мере исследовать профиль безопасности и профилактической эффективности вакцины на длительном промежутке времени», – пояснили в Минздраве.
Несмотря на то, что прививка «Спутник V» стала доступна всем желающим (за исключением группы с противопоказаниями), ученые продолжили наблюдение за добровольцами, принявшими участие в третьей фазе клинических испытаний. Второго февраля 2021г. разработчики вакцины представили результаты исследования в авторитетном медицинском издании The Lancet.
Результаты последней третьей фазы клинических испытаний вакцины «Спутник V»
Третья фаза испытаний вакцины «Спутник V» длилась с 7 сентября по 24 ноября. В ней приняли участие 21 977 человек, из них 16 427 были привиты, а 5435 – получили плацебо (раствором, в который входят все ингредиенты «Спутник V», кроме самого аденовирусного вектора).
Согласно выводам ученых специфические антитела против коронавируса вырабатывались через 42 дня после первой прививки или через 21 день после второй у 95,8% добровольцев. Более того, в день первой инъекции и через 28 дней после второй у добровольцев уже определялся клеточный иммунитет.
Что касается побочных эффектов, они проявились у 7966 привитых, при этом у 94% из них были легкими и включали повышение температуры, неприятные ощущения в месте инъекции, головную боль и слабость. Лишь 0,3% привитых имели серьезные побочные эффекты, однако, независимая комиссия не доказала связи между ними и вакцинацией.
Эффективность вакцины при таких показателях составляет 91.6%.
«Спутник V» также исследовали на добровольцах старше 60 лет – всего 2144 человека. Эффективность вакцины в этой группе практически не отличается от общей и составляет 91.8%.
Таким образом, вакцина показала свою эффективность и безопасность как у людей от 18 до 60 лет, так и у пожилых добровольцев. При этом серьезных побочных эффектов, связанных с вакциной, обнаружено не было.
Быстро не значит плохо: почему вакцину от коронавируса разработали за короткие сроки?
Разработка и тестирование вакцины заняли около года. Это уникальный, но объяснимый, случай. Прежде всего, ускорило создание «Спутник V» то, что вакцина была сделана на основе аденовирусного вектора. Такая технология уже давно известна ученым, а сам центр им. Гамалеи имел опыт в выпуске подобных вакцин. Ранее была разработана вакцина от ближневосточного респираторного синдрома. Вирус, который его вызывает – MERS, также относится к группе коронавирусов.
Быстрое распространение и способность к мутации вируса требовали кардинальных решений. При этом безопасность и эффективность вакцины на первом месте. Именно поэтому первые фазы исследования были проведены с соблюдением всех международных правил: количество добровольцев на каждой фазе, критерии оценки их состояния здоровья после вакцинации. Только после того, как вакцина показала свою безопасность и способность защищать от коронавируса, было принято решение о массовой вакцинации.
Как изменится мир после массовой вакцинации?
Идея коллективного иммунитета заключается в том, что, когда достаточно большое число людей в популяции уже обладает иммунитетом, инфекция лишается каналов распространения. Из-за этого вспышки заболевания быстро сходят на нет. Добиться коллективного иммунитета против коронавируса можно только путем вакцинации.
После массовой вакцинации будет снижена нагрузка на медицинский персонал и больницы, многие люди, особенно те, которые находятся в группе риска, смогут вернуться к привычной жизни. Вакцинация не только положит конец пандемии, но и поможет не бояться новых вспышек коронавируса.
Как сделать аденовирусную вакцину?
Введение: Аденовирусы и инфекции
Аденовирусы долгое время используются как инструменты в молекулярной биологии, потому что они способны переносить модифицированную ДНК, они не проявляют склонности интегрировать ДНК в человеческие геномы и умеют заражать как делящиеся, так и неделящиеся клетки. Но, как показывают вышеприведенные цифры, обратная сторона их использования в качестве терапии для людей, состоит в том, что у многих людей с самого начала могут быть антитела для борьбы с вирусным вектором, что, несомненно, снизит эффективность терапии. По этой причине ведется длительный поиск редких и необычных Ad-форм, что объясняет, почему J&J и НИЦЭМ им. Н. Ф. Гамалеи используют Ad26, Oxford / AZ использует вирус от шимпанзе (а не человеческий), ReiThera использует аденовирус гориллы и т.д. Собственно, поэтому люди задаются вопросом об общей эффективности CanSino, поскольку они используют Ad5 подтип.
Создание аденовирусного вектора
Очистка и упаковка
Выделение вирусных частиц, вероятно, устроена очень похожим образом во всех обсуждаемых вакцинах. Мне не удалось (что неудивительно) найти подробную информацию о производстве какой-либо из текущих вакцин, но, вероятно, этот этап был одним из менее сложных частей оптимизации процесса, учитывая всю работу, которая уже была проделана над аденовирусами в течение многих лет. Вы лизируете клетки культур и делаете грубую фильтрацию, чтобы пропустить вирусные частицы и удержать клеточный мусор. Согласно этой странице от AstraZeneca, похоже, что они применяют несколько этапов фильтрации, а затем используют мембранную хроматографию (вероятно, используют какой-то варианта ионообменной технологии, разделения по заряженным остаткам поверхностных белков вируса) с последующей ультрафильтрацией. Можно поспорить, что все обсуждаемые компании уже имели довольно четкое представление о том, какие именно шаги они собираются предпринять, даже если все шаги требовали некоторой настройки оптимизаций, а также верификации на каждом шаге. Соответствующие регуляторы, знают обо всех деталях, но я не думаю, что мы увидим подробности.
подробнее про то, где производятся и упаковываются аденовирусные вакцины
Я заметил, что самые ранние партии вакцины от Oxford/AZ были произведены в самом Оксфорде, а позже были произведены и упакованы компанией Advent (в Помезии, Италия) и COBRA Biologics (в Килле, Великобритания) с заправкой флаконов. от Symbiosis (в Стерлинге, Великобритания). Они работают с крупной контрактной фирмой Catalent как в США (Харманс, штат Мэриленд), так и в Европе (Ананьи, Италия) в области разлива/финализации. Также есть производство в в Нидерландах (Halix) и Бельгии (Novasep, в Seneffe). В последней фабрике, по-видимому, и наблюдались проблемы с выходом вакцины. Он также финализируется в Дессау, Германия, компанией IDT Biologika. Русский производитель R-Pharm имеет завод в Германии, производящий на экспорт в страны СНГ (там же производится вакцина НИЦЭМ им. Н. Ф. Гамалеи). Испанский Insud также задействован, как и их новый завод в Аргентине. AZ также имеет крупное производственное соглашение с Сывороточным институтом Индии, а WuXi участвует в Китае и на заводе в Вуппертале, Германия. Я уверен, что пропустил несколько сделок.
J&J, со своей стороны, имеет большие мощности в Нидерландах (например, в Лейдене), а также они подписали соглашения с Emergent на производство вакцины в Балтиморе (которые также работают с AstraZeneca и, с Novavax, которая делает пептидную вакцину на отдельном заводе в Мэриленде). Они также работают с Catalent (на их заводе в Блумингтоне, Индиана, а также на заводе Ананьи, в Италии), Reig Jofre в Барселоне, Aspen Pharmacare (в Порт-Элизабет, Южная Африка), Biological E в Индии (которые только что купили еще один завод в Химачал-Прадеше), а также с PCI Pharma для хранения и транспортировки. Без сомнения, есть и другие сделки.
Итак, теперь вы знаете про весь процесс, по крайней мере в общих чертах. Любой из этапов можно рассматривать детальнее, но по большей части текст должен дать вам базовое представление о том, что происходит (а во многих случаях, дает вам даже больше, чем вы когда-либо хотели знать!). Как видите, это принципиально иной процесс, нежели производство вакцины мРНК, со своей спецификой (хорошей и плохой). Все это может стать важным, если нам придется переоборудовать существующие вакцины-кандидаты для новых вариантов, но это тема для другого дня!
В предыдущей публикации о мРНК вакцинах, Дерек писал чуть более структурированно, но в этой статье, к сожалению, текст разделен еще меньше. Если еще дальше уходить от деталей, то этапы, приблизительно, можно разделить таким образом:
создание вирусной ДНК (обычно в бактериях)
лизис бактерий, раскрытие циклической ДНК в линейную
внедрение линейных ДНК в культуру человеческих клеток (вероятно самый сложный и капризный этап)
О Спутник V
О Спутник V
«Спутник V» — первая в мире зарегистрированная вакцина на основе хорошо изученной платформы вектора аденовируса человека. Она одобрена в 71 стране с общим населением 4 млрд человек.
Вакцина названа в честь первого советского космического спутника. Запуск «Спутника-1» в 1957 году дал новый импульс космическим исследованиям во всем мире, создав так называемый «момент Спутника» для мирового сообщества.
Эффективность вакцины составляет 97,6% по результатам анализа данных о заболеваемости коронавирусом среди россиян, привитых обоими компонентами препарата в период с 5 декабря 2020 года по 31 марта 2021 года.
Фаза 1 и 2 клинических испытаний вакцины были завершены 1 августа 2020 года. Итоги третьей фазы клинических испытаний в России опубликованы в журнале Lancet 2 февраля 2021 года. Клинические испытания третьей фазы «Спутник V» также успешно проходят в ОАЭ, Индии, Венесуэле и Беларуси.
Вакцина «Спутник V» создана на проверенной и хорошо изученной платформе аденовирусных векторов человека, которые вызывают обычную простуду и с которыми человечество сталкивалось на протяжении тысячелетий.
В вакцине «Спутник V» впервые среди вакцин против коронавируса был применен подход гетерогенного бустирования, в основе которого лежит применение двух разных векторов для двух уколов в процессе вакцинации. Такой подход формирует более стойкий иммунитет по сравнению с вакцинами, которые используют одинаковый механизм доставки для обоих уколов.
Безопасность, эффективность и отсутствие долгосрочных негативных последствий у аденовирусных вакцин доказаны в более чем 250 клинических исследованиях на протяжении двух десятилетий.
«Спутник V» не вызывает сильной аллергии.
Температура хранения на уровне +2+8 градусов Цельсия позволяет хранить вакцину в обычном холодильнике без необходимости инвестиций в дополнительную инфраструктуру холодовой цепи.
Как работают вакцины на основе аденовирусного вектора
«Векторы» являются носителями, которые могут доставить генетический материал из другого вируса в клетку. При этом генетический материал аденовируса, который вызывает инфекцию, удаляется и вставляется материал с кодом белка от другого вируса, в данном случае от шипа коронавируса. Этот новый элемент безопасен для организма, но он помогает иммунной системе реагировать и вырабатывать антитела, которые защищают от инфекции.
Технологическая платформа векторов на основе аденовирусов упрощает и ускоряет создание новых вакцин путем модификации исходного вектора-носителя генетическим материалом из новых появляющихся вирусов, что позволяет получать новые вакцины в сжатые сроки. Такие вакцины вызывают сильный ответ со стороны иммунной системы человека.
Человеческие аденовирусы считаются одними из самых простых для модификации, поэтому они стали очень популярными в качестве векторов.
Преимущества прайм-буст иммунизации

Безопасность и эффективность
После начала пандемии российские исследователи извлекли фрагмент генетического материала нового коронавируса SARS-COV-2, кодирующий информацию о структуре S белка шипа вируса (белок формирующего «корону» вируса и отвечающий за его связывание с клетками человека), и вставили его в уже знакомый им аденовирусный вектор для доставки в человеческую клетку, создав, таким образом, первую в мире вакцину против коронавируса SARS-COV-2.
Чтобы обеспечить длительный иммунитет, российские ученые предложили использовать два разных типа аденовирусных векторов для первой и второй вакцинации, усиливая действие вакцины.
Использование аденовирусов человека в качестве векторов безопасно, так как данные вирусы, вызывающие ОРВИ, не являются новыми и существуют уже тысячи лет.
Эффективность против новых штаммов
Вакцинация препаратом вырабатывает защитные нейтрализующие титры антител против новых штаммов, включая Alpha B.1.1.7 (впервые выявлен в Великобритании), Beta B.1.351 (впервые выявлен в ЮАР), Gamma P.1 (впервые выявлен в Бразилии), Delta B.1.617.2 и B.1.617.3 (впервые выявлены в Индии) и выявленных в Москве вариантов B.1.1.141 и B.1.1.317 с мутациями в рецептор-связывающем домене (RBD).Методология исследования основана на оценке вируснейтрализующей активности (ВНА) с применением живого вируса, что позволяет получить наиболее достоверные данные и является «золотым» стандартом. В ходе исследования сравнивалась ВНА сыворотки крови людей после вакцинации препаратом «Спутник V» на образцах штаммов, имеющих международное распространение, с ВНА против исходного штамма B.1.1.1. Сыворотка крови была собрана у лиц, иммунизированных обоими компонентами «Спутника V».
Полученные данные демонстрируют, что «Спутник V» сохраняет защитные свойства против новых штаммов. Снижение уровня вируснейтрализующей активности у препарата «Спутник V» к ряду штаммов оказалось значительно меньшим по сравнению с данными, опубликованными производителями других вакцин, которые ранее подтвердили эффективность своих препаратов против новых мутаций коронавирусной инфекции.
Аденовирусные вакцины
Аденовирусные вакцины
Аденовирусные векторы считаются абсолютно безопасными, а также наиболее подходящими для генетической модификации. Вектор – это вирус, лишенный гена размножения, поэтому он не представляет опасности заражения для организма. Ученые используют векторы для транспортировки генетического материала из другого вируса, против которого делается вакцина, в клетку.
Аденовирусы, извлекаемые из аденоидов и в обычном состоянии вызывающие острые респираторные вирусные инфекции (ОРВИ), стали наиболее часто используемыми вирусами для создания векторов. В мире существует более 350 научных исследований в различных источниках на тему создания и безопасности аденовирусных векторов.
АДЕНОВИРУСЫ ЧЕЛОВЕКА – ЭТО ХОРОШО ИЗУЧЕННАЯ ПЛАТФОРМА С ПОДТВЕРЖДЕННОЙ ДОЛГОСРОЧНОЙ БЕЗОПАСНОСТЬЮ
В клинических испытаниях препаратов на основе аденовирусных векторов приняли участие более 20 тысяч человек по всему миру.
Препараты на основе аденовируса человека массово применяются уже более 50 лет.
Одобренный для гражданского оборота в Китае препарат для лечения раковых опухолей был принят уже более 30 000 пациентами.
УСПЕШНЫЙ ОПЫТ ЦЕНТРА ИМЕНИ Н.Ф. ГАМАЛЕИ
Ученые из Центра имени Н.Ф. Гамалеи работали с вакцинами на основе аденовирусных векторов с 1980-х годов и стали мировыми лидерами в разработке такого рода вакцин.
Вакцина на основе аденовирусных векторов против ближневосточного респираторного синдрома проходит последние клинические испытания. Многие вакцины-кандидаты против COVID-19 также основаны на аденовирусных векторах, но пока ни одна не использует двухвекторную систему вакцинации, созданную в Центре имени Н.Ф. Гамалеи.
В процессе создания вакцины ген, кодирующий S-белок шипа коронавируса встраивается в аденовирусный вектор. Вставленный элемент является безопасным для организма, но он заставляет иммунную систему реагировать и вырабатывать антитела, которые защищают нас от инфекции.
Используя векторы на основе аденовируса, ученые Центра имени Н.Ф. Гамалеи успешно создали и получили регистрационное удостоверение Министерства Здравоохранения РФ на вакцину против лихорадки Эбола на основе аденовирусных векторов.
Ниже представлены ссылки на подтверждающие официальные документы и научные публикации по вакцинам Центра имени Н.Ф. Гамалеи против лихорадки Эбола и ближневосточного респираторного синдрома (MERS).
Вакцина против лихорадки Эбола
Регистрационные удостоверения Министерства здравоохранения
Аденовирусный вектор что это такое
Трансфекция соответствующих клеток-мишеней является первым решающим этапом процесса переноса генов, поэтому разработка методов переноса генов представляет собой огромное поле для исследований. В работах по переносу генов в клетки сосудистой системы используют как вирусные, так и безвирусные векторы. Общей особенностью этих методов является эффективная доставка генов в клетки. Однако векторы различаются по способам процессинга чужеродной ДНК и частоте интеграции в хромосомную ДНК.
В случае ретровирусных и лентивирусных векторов переносимые последовательности стабильно интегрируются в хромосомную ДНК клетки-мишени. Эти векторы чаще всего рассматривают с точки зрения их применения лля генной терапии в условиях ex vivo. Осуществление переноса генов с помощью других методов приводит к внедрению чужеродной ДНК в ядро клетки-мишени в неинтегрированной форме. Этими методами удается получить высокую, но временную экспрессию гена. Такие векторы, в т.ч. аденовирус, аденосвязанный вирус и катионные липосомы, используют в основном для изучения переноса генов в условиях in vivo.
Ретровирусы были первыми векторами, которые в 1980-х гг. использовали для изучения переноса генов. Первоначальный интерес к ретровирусам был связан с чем, что эти векторы стабильно трансдуцируют 100% пролиферирующих и культуре клеток-мишений. Сначала рстропируспые векторы использовали при изучении переноса генов сосудистой системы п основном в исследованиях ex vivo, однако их применение было ограничено низкой эффективностью трансфекции.
Недавно ретровирусные векторы нашли применение в клинических исследованиях по генной терапии для лечения тяжелого комбинированного иммунодефицита. К сожалению, в одном из исследований у двух детей выявили осложнение в виде внедрения ретровируса и онкогенный сайт хромосомы X, что привело к развитию лейкемии.
Аденовирусы типа 2 и 5 — это два серотипа, которые используют в качестве векторов при переносе генов ССС. Геном аденовируса представлен линейной двухцепочечной ДНК длиной 36 тыс. п.н., разделенной на генетической карте на 100 единиц, длина каждой из которых составляет 360 п.н. И конце генома молекула ДНК содержит короткие инвертированные терминальные повторы (ITR, inverted terminal repeats), необходимые для репликации вирусной ДНК.
Продукты гена организуются в «ранние» (Е1-Е4) и «поздние» области на основании экспрессии до инициации репликации ДНК и после нее. Жизненный цикл аденовирусов характеризуется быстрым растворением в соматических клетках: связываясь со специфическим гликопротеиновым рецептором на поверхности клеток млекопитающих, они проникают в клетки путем рецептор-опосредованного эндоцитоза. Белки внешней оболочки аденовируса (капсиды) защищают его от лизосомальной деградации, и вирусная ДНК переносится в ядро.
Экспрессия вирусных генов зависит от клеточных факторов транскрипции и экспрессии участка Е1 аденовируса, который кодирует экспрессию трансактиватора вирусного гена.
Во время лизирующей инфекции происходит репликация вирусного генома в количестве нескольких тысяч копий на клетку. Геном вируса ассоциируется с белками ядра и упаковывается в капсиды путем самосборки основных капсидпых белков.
Репликация генома аденовируса происходит неполностью, что недостаточно для генерации вектора. Векторы конструируются посредством гомологичной рекомбинации в клеточной линии 293 путем котрансфекции: (1) бактериальной плазмиды, содержащей целевую кДНК и короткую последовательность аденовирусного генома, вырезанного из участков Е1А и Е1В (эти участки регулируют аденовирусную транскрипцию и необходимы для репликации вируса); (2) неполного аденовирусного генома.
В результате гомологичной рекомбинации между двумя молекулами ДНК образуется рекомбипантный геном, в котором чужеродный ген замещает участок Е1. Далее вирусный штамм репродуцируется в клетки линии 293 до достижения высокого титра, обычно 109-1010 бляшкообразующих единиц (pin, plaque forming units) на 1 мл.
Аденовирусные векторы обладают рядом дополнительных преимуществ, включая способность эффективно инфицировать клетки млекопитающих и экспрессировать в неделящиеся клетки как in vitro, так и in vivo. Эти векторы относительно стабильны и могут достигать высоких титров. Внехромосомная репликация вектора существенно снижает вероятность мутации путем случайной интеграции и дизрегуляции генов в клетках хозяина. Однако ряд присущих им недостатков ограничивает их применение в качестве векторов для переноса генов. Экспрессия генов в клетках кровеносных сосудов и миокарда после их инфицировании аденовирусом продолжается недолго (всего несколько недель). Иммунная реакция хозяина на аденовирусные белки существенно ограничивает их использование в условиях in vivo.
Низкий уровень нейтрализующих антител вряд ли способен вызвать нежелательные клинические проявления, однако остается неясным, сможет ли иммунный ответ хозяина на аденовирус препятствовать повторному введению аденовируса того же серотипа. Рекомбинантные аденовирсуные векторы первого поколения (деления генов Е1А и Е1В и частичная деления генов ЕЗ) применяли в клинических исследованиях с целью генной терапии, хотя па животных моделях наблюдали ассоциацию этих векторов с воспалением тканей, особенно в печени и легких. Прямое взаимодействие больной печени с аденовирусными векторами высокого титра было высокотоксичным, а в одном случае оказалось смертельным. Инактивация гена Е2А удлиняла время экспрессии гена и сопровождалась снижением воспалительного процесса в печени и легких.
В исследованиях по переносу генов с помощью аденовирусных векторов в адвентиции периферических и легочных артерий наблюдали инфильтраты мононуклеарных воспалительных клеток, однако некроз или васкулит отсутствовали. Инфицирование легочных артерий аденовирусом ассоциировалось со слабо выраженным периваскулярным воспалением; в легочных артериях, обработанных физраствором или липосомами, также обнаруживали небольшое накопление периваскулярных мопонуклеарных клеток. Несмотря на ограниченный иммунный ответ на капсидные белки аденовирусов, аденовирусные векторы кажутся привлекательным средством переноса генов в условиях in vivo на животных моделях, что связано с высокой эффективностью трансфекции. Будущее покажет, найдут ли аденовирусные векторы применение в клинике.