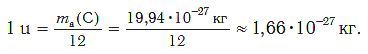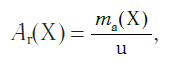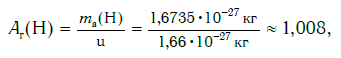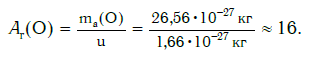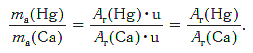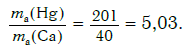Аем это что в химии
Атомная единица массы
А́томная едини́ца ма́ссы (обозначение а. е. м.), она же дальто́н (обозначение Da), — внесистемная единица массы, применяемая для масс молекул, атомов, атомных ядер и элементарных частиц. Атомная единица массы выражается через массу нуклида углерода 12 C и равна 1/12 массы этого нуклида.
Рекомендована к применению ИЮПАП в 1960 и ИЮПАК в 1961 годах. Официально рекомендованными являются англоязычные термины atomic mass unit (a.m.u.) и более точный — unified atomic mass unit (u.a.m.u.) (универсальная атомная единица массы, но в русскоязычных научных и технических источниках он употребляется реже).
В 1997 году во 2-ом издании справочника терминов ИЮПАК установлено численное значение а. е. м.:
1 а. е. м. ≈ 1,660 540 2(10)·10 −27 кг = 1,660 540 2(10)·10 −24 г
1 а. е. м. ≈ 0,931 494 028(23) ГэВ/c²; 1 ГэВ/c² ≈ 1,073 544 188(27) а. е. м.
1 а. е. м. 
История
Понятие атомной массы ввёл Джон Дальтон в 1803 году, единицей измерения атомной массы сначала служила масса атома водорода (так называемая водородная шкала). В 1818 Берцелиус опубликовал таблицу атомных масс, отнесённых к атомной массе кислорода, принятой равной 103. Система атомных масс Берцелиуса господствовала до 1860-х годов, когда химики опять приняли водородную шкалу. Но в 1906 они перешли на кислородную шкалу, по которой за единицу атомной массы принимали 1/16 часть атомной массы кислорода. После открытия изотопов кислорода ( 16 O, 17 O, 18 O) атомные массы стали указывать по двум шкалам: химической, в основе которой лежала 1/16 часть средней массы атома природного кислорода, и физической с единицей массы, равной 1/16 массы атома нуклида 16 O. Использование двух шкал имело ряд недостатков, вследствие чего с 1961 перешли к единой, углеродной шкале.
Ссылки
Примечания
Полезное
Смотреть что такое «Атомная единица массы» в других словарях:
АТОМНАЯ ЕДИНИЦА МАССЫ — (а. е. м.) единица массы, применяемая для выражения масс микрочастиц. За 1 а. е. м. принята 1/12 часть массы изотопа углерода с массовым числом 12 (т. н. углеродная шкала). 1 а. е. м. 1,6605655(86).10 27 кг … Большой Энциклопедический словарь
АТОМНАЯ ЕДИНИЦА МАССЫ — (а. е. м.) единица массы (см.), (см.) и элементарных частиц, равная 1/ массы изотопа углерода с массовым числом 12 … Большая политехническая энциклопедия
АТОМНАЯ ЕДИНИЦА МАССЫ — значение массы атома, принятое за единицу. До 1961 г. были приняты два значения величины А. е. м.: химическая для выражения атомных масс хим. элементов и их соединений, равная 1,66022•10 24 г, составляющая 1/16 атомной массы элемента кислорода, и … Геологическая энциклопедия
атомная единица массы — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN atomic mass unitatomic weight unitamu … Справочник технического переводчика
атомная единица массы — (а. е. м.), единица массы, применяемая для выражения масс микрочастиц. За 1 а. е. м. принята 1/12 часть массы изотопа углерода с массовым числом 12 (так называемая углеродная шкала). 1 а. е. м. = 1,6605655(86)·10 27кг. * * * АТОМНАЯ ЕДИНИЦА МАССЫ … Энциклопедический словарь
атомная единица массы — atominės masės vienetas statusas T sritis fizika atitikmenys: angl. amu; atomic mass unit vok. atomare Masseneinheit, f; Atommasseneinheit, f rus. атомная единица массы, f; единица атомной массы, f pranc. unité de masse atomique, f … Fizikos terminų žodynas
АТОМНАЯ ЕДИНИЦА МАССЫ — (а. е. м.), единица массы, применяемая для выражения масс микрочастиц. За 1 а. е. м. принята 1/12 часть массы изотопа углерода с массовым числом 12 (т. н. углеродная шкала). 1 а. е. м. = = 1,6605655(86) х 10 27 кг … Естествознание. Энциклопедический словарь
Атомная единица массы — (a. е. м.) единица массы, применяемая для выражения масс микрочастиц. За 1 a. е. м. принята 1/12 часть массы изотопа углерода с массовым числом 12 (т. н. углеродная шкала). 1 a. е. м. = 1,6605655(86).10 27 кг … Концепции современного естествознания. Словарь основных терминов
АТОМНАЯ ЕДИНИЦА МАССЫ — ед. массы, применяемая в атомной физике и равная 1/12 массы изотопа углерода с массовым числом 12. Обозначение а. е. м. 1 а. е. м. 1,6605402 10 27 кг … Большой энциклопедический политехнический словарь
Урок 2. Относительная атомная масса химических элементов
В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.
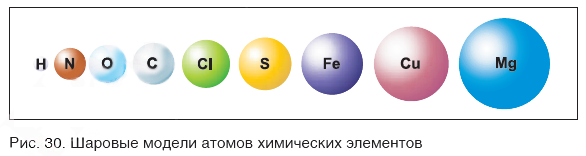
Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
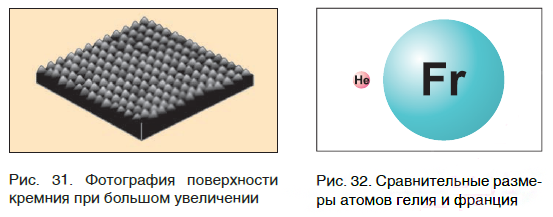
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10 −27 кг и 9,8·10 −10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10 −27 кг, а атома кислорода — ma(О) = 26,56·10 −27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.
В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10 −27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar ( А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах ( ma(O) = 26,56·10 −27 кг) или атомных единицах массы ( ma(O) = 16· u ).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
Ответ: в 5,03 раза.
Краткие выводы урока:
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Атомная единица массы (дальтон, углеродная единица)
Атомная единица массы (дальтон, углеродная единица).
Атомная единица массы (дальтон, углеродная единица) – единица измерения массы атомов и молекул. Имеет русское обозначение – а.е.м. и международное обозначение – u.
Другие единицы измерения
Атомная единица массы (дальтон, углеродная единица), как единица измерения:
Атомная единица массы она же дальтон (русское обозначение – Да, международное – Da), она же углеродная единица – внесистемная единица массы, применяемая для масс молекул, атомов, атомных ядер и элементарных частиц.
Атомная единица массы имеет русское обозначение – а.е.м. и международное обозначение – u.
Атомная единица массы определяется как 1⁄12 массы свободного покоящегося атома углерода 12 C, находящегося в основном состоянии.
Атомная единица массы не является единицей Международной системы единиц (СИ), но Международный комитет мер и весов относит её к единицам, допустимым к применению наравне с единицами СИ.
В Российской Федерации в соответствии с Постановлением Правительства РФ от 31 октября 2009 г. N 879 “Об утверждении Положения о единицах величин, допускаемых к применению в Российской Федерации” атомная единица массы допущена для использования в качестве внесистемной единицы без ограничения срока действия допуска с областью применения «атомная физика».
Применение атомной единицы:
Атомная единица массы (дальтон, углеродная единица) применяется для масс молекул, атомов, атомных ядер и элементарных частиц.
Перевод в другие единицы измерения:
1 а.е.м. = 1,660 539 066 60(50)⋅10 −27 кг.
Молярная масса определённого вещества, выраженная в граммах на моль (г/моль), численно совпадает с массой молекулы этого вещества, выраженной в а. е. м.
1 а.е.м. = 0,931 494 102 42(28) ГэВ/c 2 ;
1 ГэВ/c 2 = 1,073 544 102 33(32) а.е.м.
где а. е. м. – атомная единица массы, кг – килограмм, ГэВ – гигаэлектронвольт, c – скорость света.
Кратные и дольные единицы:
В соответствии с ГОСТ 8.417-2002 и «Положением о единицах величин, допускаемых к применению в Российской Федерации», наименование и обозначение единицы «атомная единица массы» не допускается применять с дольными и кратными приставками СИ. Однако дольные и кратные единицы допустимы для использования с синонимичным названием единицы «дальтон»; например, массы биологических макромолекул часто выражаются в килодальтонах (кДа) и мегадальтонах (МДа), а чувствительность масс-спектрометрической аппаратуры может выражаться в миллидальтонах (мДа) и микродальтонах (мкДа).
| Кратные | Дольные | ||||||
| величина | название | обозначение | величина | название | обозначение | ||
| 10 1 Да | декадальтон | даДа | daDa | 10 −1 Да | децидальтон | дДа | dDa |
| 10 2 Да | гектодальтон | гДа | hDa | 10 −2 Да | сантидальтон | сДа | cDa |
| 10 3 Да | килодальтон | кДа | kDa | 10 −3 Да | миллидальтон | мДа | mDa |
| 10 6 Да | мегадальтон | МДа | MDa | 10 −6 Да | микродальтон | мкДа | µDa |
| 10 9 Да | гигадальтон | ГДа | GDa | 10 −9 Да | нанодальтон | нДа | nDa |
| 10 12 Да | терадальтон | ТДа | TDa | 10 −12 Да | пикодальтон | пДа | pDa |
| 10 15 Да | петадальтон | ПДа | PDa | 10 −15 Да | фемтодальтон | фДа | fDa |
| 10 18 Да | эксадальтон | ЭДа | EDa | 10 −18 Да | аттодальтон | аДа | aDa |
| 10 21 Да | зеттадальтон | ЗДа | ZDa | 10 −21 Да | зептодальтон | зДа | zDa |
| 10 24 Да | иоттадальтон | ИДа | YDa | 10 −24 Да | иоктодальтон | иДа | yDa |
Интересные факты:
Понятие атомной массы ввёл Джон Дальтон в 1803 году, единицей измерения атомной массы сначала служила масса атома водорода (так называемая водородная шкала).
В 1818 году Берцелиус опубликовал таблицу атомных масс, отнесённых к атомной массе кислорода, принятой равной 103. Система атомных масс Берцелиуса господствовала до 1860-х годов, когда химики опять приняли водородную шкалу. Но в 1906 году они перешли на кислородную шкалу, по которой за единицу атомной массы принимали 1⁄16 часть атомной массы кислорода.
После открытия изотопов кислорода ( 16 O, 17 O, 18 O) атомные массы стали указывать по двум шкалам: химической, в основе которой лежала 1⁄16 часть средней массы атома природного кислорода, и физической с единицей массы, равной 1⁄16 массы атома нуклида 16 O. Использование двух шкал имело ряд недостатков, поэтому в 1960 году сначала X Генеральная ассамблея Международного союза теоретической и прикладной физики (ИЮПАП), а в 1961 году и конгресс Международного союза теоретической и прикладной химии (ИЮПАК) приняли углеродную шкалу.
Молекулярная физика. Атомная единица массы. Атомная масса.
Атомная единица массы.
Атомная единица массы (а.е.м.) — единица массы, равная 1/12 массы атома изотопа углерода 12 С:
Чтобы перевести значение массы атомов или молекул, выраженной в а.е.м., т. е. относительную молекулярную (или атомную) массу вещества Mr, в единицу массы СИ (кг), пользуются формулой:

Относительная молекулярная масса (атомная масса) — относительное значение массы молекулы (атома), выраженное в атомных единицах массы:

где Mr — относительная молекулярная (атомная) масса; m0 — масса молекулы (атома), выраженная в единицах СИ (кг); m0С — масса молекулы изотопа углерода 12 С, выраженная в тех же единицах, что и m0.

Атомная масса была взята Д. И. Менделеевым за основную характеристику элемента при открытии им периодической системы элементов. Атомная масса — дробная величина, в отличие от массового числа — количества нуклонов в атоме.
Относительная молекулярная масса вещества складывается из относительных атомных масс (а.м.) входящих в молекулу элементов.
Атомные массы всех химических элементов точно измерены.
атомная единица массы
Полезное
Смотреть что такое «атомная единица массы» в других словарях:
АТОМНАЯ ЕДИНИЦА МАССЫ — (а. е. м.) единица массы, применяемая для выражения масс микрочастиц. За 1 а. е. м. принята 1/12 часть массы изотопа углерода с массовым числом 12 (т. н. углеродная шкала). 1 а. е. м. 1,6605655(86).10 27 кг … Большой Энциклопедический словарь
АТОМНАЯ ЕДИНИЦА МАССЫ — (а. е. м.) единица массы (см.), (см.) и элементарных частиц, равная 1/ массы изотопа углерода с массовым числом 12 … Большая политехническая энциклопедия
АТОМНАЯ ЕДИНИЦА МАССЫ — значение массы атома, принятое за единицу. До 1961 г. были приняты два значения величины А. е. м.: химическая для выражения атомных масс хим. элементов и их соединений, равная 1,66022•10 24 г, составляющая 1/16 атомной массы элемента кислорода, и … Геологическая энциклопедия
атомная единица массы — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN atomic mass unitatomic weight unitamu … Справочник технического переводчика
Атомная единица массы — У этого термина существуют и другие значения, см. Дальтон. Атомная единица массы (обозначение а. е. м.), она же дальтон (обозначение Da), внесистемная единица массы, применяемая для масс молекул, атомов, атомных ядер и элементарных частиц.… … Википедия
атомная единица массы — atominės masės vienetas statusas T sritis fizika atitikmenys: angl. amu; atomic mass unit vok. atomare Masseneinheit, f; Atommasseneinheit, f rus. атомная единица массы, f; единица атомной массы, f pranc. unité de masse atomique, f … Fizikos terminų žodynas
АТОМНАЯ ЕДИНИЦА МАССЫ — (а. е. м.), единица массы, применяемая для выражения масс микрочастиц. За 1 а. е. м. принята 1/12 часть массы изотопа углерода с массовым числом 12 (т. н. углеродная шкала). 1 а. е. м. = = 1,6605655(86) х 10 27 кг … Естествознание. Энциклопедический словарь
Атомная единица массы — (a. е. м.) единица массы, применяемая для выражения масс микрочастиц. За 1 a. е. м. принята 1/12 часть массы изотопа углерода с массовым числом 12 (т. н. углеродная шкала). 1 a. е. м. = 1,6605655(86).10 27 кг … Концепции современного естествознания. Словарь основных терминов
АТОМНАЯ ЕДИНИЦА МАССЫ — ед. массы, применяемая в атомной физике и равная 1/12 массы изотопа углерода с массовым числом 12. Обозначение а. е. м. 1 а. е. м. 1,6605402 10 27 кг … Большой энциклопедический политехнический словарь