Аллотропия что это в химии
Аллотропия
Изучение простых веществ и их свойств чрезвычайно важно для неорганической химии и закладывает основу для ее изучения. Кардинальная особенность простых веществ заключается в том, что при рассмотрении их свойств не нужно учитывать изменения их состава, поскольку он всегда один и тот же. Но и у простых веществ необходимо уделить особое внимание явлению аллотропии. Это позволит выявлять зависимость свойств веществ от их химического строения.
Аллотропия (от греческого «tropos» — признак) — это процесс, при котором один химический элемент может трансформироваться в два или больше простых веществ. К примеру, атомы кислорода могут преобразоваться в два других различных вещества – кислород и озон, а сера – кристаллическую и пластическую серу. Вещества, которые образовались из атомов одно химического элемента, называют аллотропными модификациями этого элемента. Аллотропия вызвана разнящимся набором молекул в простом веществе или разным местонахождением частиц в кристаллической решётке этого вещества.
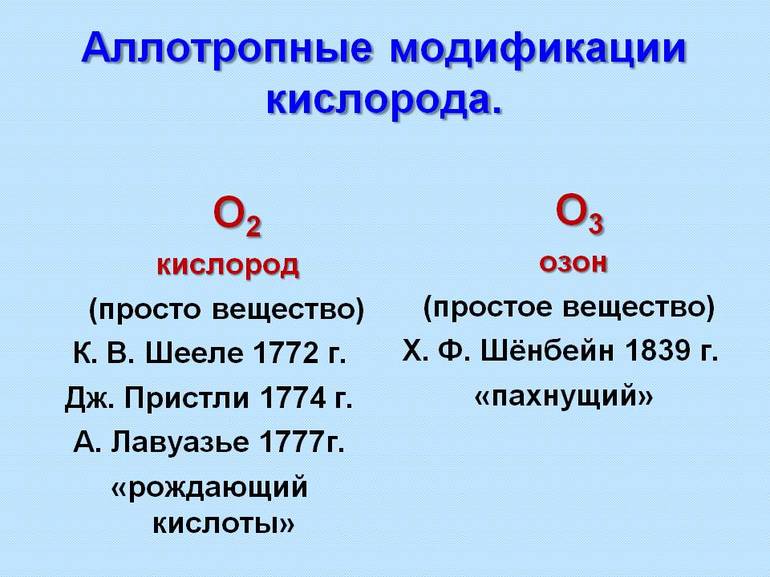
В 1841 году явление аллотропии стало известно науке благодаря ученому Йенсу Якобу Берцелиусу, позднее тщательные и долгие исследования этого явления были проделаны А. Шреттером. В 1860 году, вскоре после того как был открыт закон Авогадро, по которому в веществах одного объема, где установлены равные температуры и давление, существует равное количество молекул, ученые поняли, что элементы имеют возможность находиться в форме молекул со множеством атомов. К примеру, О2 — кислород и О3 — озон. В самом начале двадцатого века стало понятно, что отличия в кристаллической конструкции простых веществ — это еще одна причина аллотропии.
Аллотропные модификации
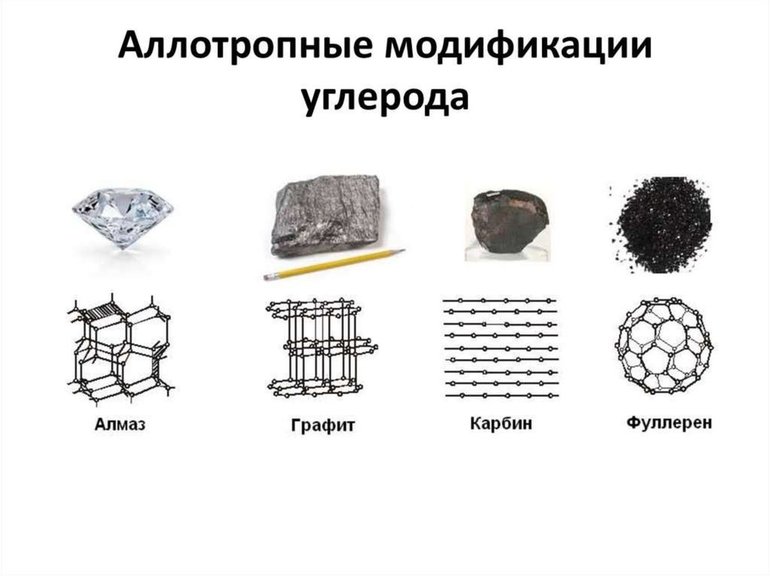
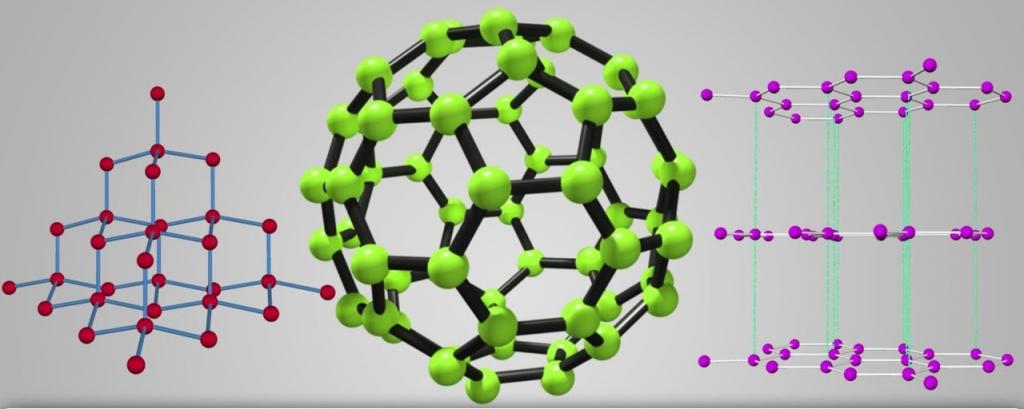
На сегодняшний день насчитывается больше четырехсот аллотропных модификаций простых веществ. К примеру, алмаз и графит – это аллотропные модификации углерода, хотя эти вещества внешне совершенно непохожи. У графита структура гексагональная слоистая, а у алмаза выглядит как правильно соединенная с друг другом сетка тетраэдрических образований.
Иногда это явление объединяют с полиморфизмом. Это возможность веществ твердого агрегатного состояния находится в двух или больше видоизменениях с различной кристаллическим построением и свойствами при одинаковом химическом составе. Но аллотропия имеет отношение лишь к простым веществам, вне зависимости от их агрегатного состояния, а полиморфизм — к любому твердому вещество, без указания на то, простое оно или сложное.Несмотря на количество аллотропных модификаций у химического элемента, самым стойким и не разрушающимся оказывается, в большинстве, только одно. Вот примеры одних из самых распространенных примеров аллотропии веществ: углерод может образовать множество аллотропных модификаций — алмаз, графит, карбин и т.д. Кремний образует два аллотропных видоизменения: аморфный и кристаллический кремний.

в) графит; г) аморфный углерод; д) C60 (фуллерен); е) графен;
ж) однослойная нанотрубка
Разнообразие сложных веществ наблюдается из-за их разного количественного состава. Его можно определить по набору электронов, находящихся на электронном уровне атома и количественное содержание протонов и нейтронов в ядре. Но было обнаружено, что химические элементы могут образовывать различные вариации, у которых у ядер один и тот же заряд, но при этом у них разные массы. Такие разновидности атомов называются изотопами. Явления аллотропии и изотопии являются подтверждениями многообразия неорганических веществ.
Аллотропия
Аллотро́пия (от др.-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того же химического элемента в виде двух и более простых веществ, различных по строению и свойствам — так называемых аллотропических (аллотропных) модификаций или форм.
Явление аллотропии обусловлено либо различным составом молекул простого вещества (аллотропия состава), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы).
Содержание
История
Понятие аллотропии введено в науку Й. Берцелиусом в 1841 году для обозначения разных форм существования элементов; одновременно он предполагал, по-видимому, применить его и к изомерии соединений. После принятия гипотезы А. Авогадро в 1860 году стало понятно, что элементы могут существовать в виде многоатомных молекул, например, О2 — кислород и О3 — озон.
Примеры аллотропии
В настоящее время известно более 400 разновидностей простых веществ. Способность элемента к образованию аллотропных форм обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов.
Как правило, большее число аллотропных форм образуют элементы, имеющие переменные значения координационного числа или степени окисления (олово, фосфор). Другим важным фактором является катенация — способность атомов элемента образовывать гомоцепные структуры (например, сера). Склонность к аллотропии более выражена у неметаллов, за исключением галогенов и благородных газов, и полуметаллов.
Принято обозначать различные аллотропические формы одного и того же элемента строчными буквами греческого алфавита; причём форму, существующую при самых низких температурах, обозначают буквой α, следующую — β и т. д.
Неметаллы
Водород может существовать в виде орто- и пара-водорода. В молекуле орто-водорода o-H2 (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины параллельны, а у пара-водорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — антипараллельны.
Множество модификаций: алмаз, графит, фуллерен, карбин, графен, углеродные нанотрубки, лонсдейлит и др. Точное число модификаций указать затруднительно вследствие разнообразия форм связывания атомов углерода между собой. Наиболее многочисленны молекулярные структуры фуллеренов и нанотрубок.
Известно 11 аллотропных модификаций фосфора. Основные модификации: белый, красный и чёрный фосфор. Белый фосфор ядовит, светится в темноте, способен самовоспламеняться, красный фосфор не ядовит, не светится в темноте, сам по себе не воспламеняется.
Две аллотропные модификации: О2 — кислород и О3 — озон. Кислород бесцветен, не имеет запаха; озон имеет выраженный запах, имеет бледно-фиолетовый цвет, он более бактерициден.
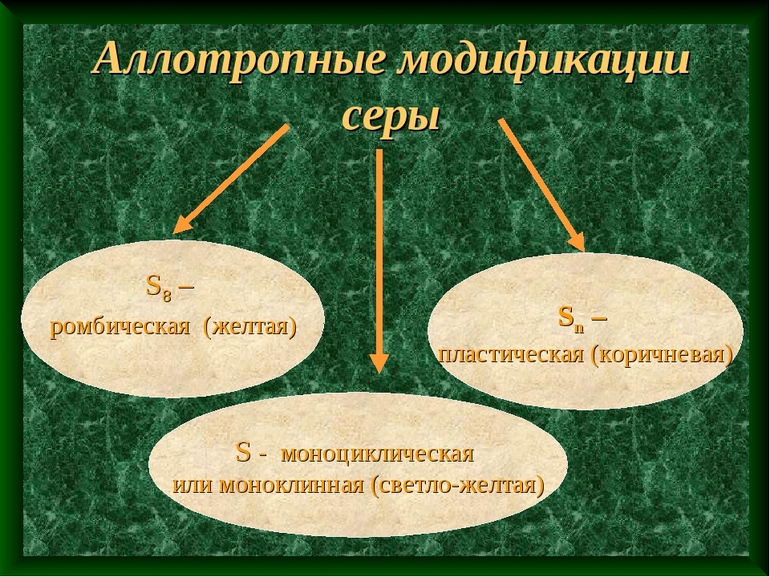
Большое число аллотропных модификаций, второе место после углерода. Основные модификации: ромбическая, моноклинная и пластическая сера.
Красный цикло-Se8, серый полимер Se и чёрный селен.
Полуметаллы
Бор существует в аморфном и кристаллическом видах. Аморфный бор – порошок бурого цвета. Обладает большей реакционной способностью, чем кристаллический бор. Кристаллический бор – вещество черного цвета. Известно более 10 аллотропных модификаций бора, которые кристаллизуются в ромбической и тетрагональной сингониях. Наиболее устойчивая модификация – β-ромбический бор – состоит из икосаэдров B12, которые образуют слои, объединенные в бесконечную структуру.
Известны четыре металлических аллотропных модификаций сурьмы, существующих при различных давлениях, и три аморфные модификации (взрывчатая, чёрная и жёлтая сурьма), из которых наиболее устойчива металлическая форма серебристо-белого цвета с синеватым оттенком
Полоний существует в двух аллотропных металлических модификациях. Кристаллы одной из них – низкотемпературной – имеют кубическую решетку (α-Po), а другой – высокотемпературной – ромбическую (β-Po). Фазовый переход из одной формы в другую происходит при 36 °C, однако при обычных условиях полоний находится в высокотемпературной форме вследствие разогрева собственным радиоактивным излучением.
Металлы
Среди металлов, которые встречаются в природе в больших количествах (до U, без Tc и Pm), 28 имеют аллотропные формы при атмосферном давлении: Li, Be, Na, Ca, Sc, Ti, Mn, Fe, Co, Sr, Y, Zr, Sn, La, Ce, Pr, Nd, Sm, Gd, Tb, Dy, Yb, Hf, Tl, Th, Pa, U. Также важны аллотропные формы ряда металлов, образующиеся при их технологической обработке: Ti при 882˚C, Fe при 912˚C и 1394˚C, Co при 422˚C, Zr при 863˚C, Sn при 13˚C и U при 668˚C и 776˚C.