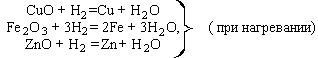Амфотерные оксиды что это
Химические свойства амфотерных оксидов
Перед изучением этого раздела рекомендую изучить следующие темы:
Химические свойства амфотерных оксидов
Амфотерные оксиды проявляют свойства и основных, и кислотных. От основных отличаются только тем, что могут взаимодействовать с растворами и расплавами щелочей и с расплавами основных оксидов, которым соответствуют щелочи.
1. Амфотерные оксиды взаимодействуют с кислотами и кислотными оксидами.
При этом амфотерные оксиды взаимодействуют, как правило, с сильными и средними кислотами и их оксидами.
амфотерный оксид + кислота = соль + вода
амфотерный оксид + кислотный оксид = соль
2. Амфотерные оксиды не взаимодействуют с водой.
Оксиды взаимодействуют с водой, только когда им соответствуют растворимые гидроксиды, а все амфотерные гидроксиды — нерастворимые.
амфотерный оксид + вода ≠
3. Амфотерные оксиды взаимодействуют с щелочами.
При этом механизм реакции и продукты различаются в зависимости от условий проведения процесса — в растворе или расплаве.
В растворе образуются комплексные соли, в расплаве — обычные соли.
Формулы комплексных гидроксосолей составляем по схеме:
Основные продукты взаимодействия соединений амфотерных металлов со щелочами сведем в таблицу.
| Металлы | В расплаве щелочи | В растворе щелочи |
| Металлы – простые вещества, в которых атомы связаны между собой металлической связью. |
Из этого определения видно, что главным признаком, позволяющим нам разделить простые вещества на металлы и неметаллы, является тип химической связи.
В большинстве неметаллов связь ковалентная. Но есть еще и благородные газы (простые вещества элементов VIIIA группы), атомы которых в твердом и жидком состоянии связаны только межмолекулярными связями. Отсюда и определение.
| Неметаллы – простые вещества, в которых атомы связаны между собой ковалентными (или межмолекулярными) связями. |
По химическим свойствам среди металлов выделяют группу так называемых амфотерных металлов. Это название отражает способность этих металлов реагировать как с кислотами, так и со щелочами (как амфотерные оксиды или гидроксиды) (рис. 13.1-б).
Кроме этого, из-за химической инертности среди металлов выделяют благородные металлы. К ним относят золото, рутений, родий, палладий, осмий, иридий, платину. По традиции к благородным металлам относят и несколько более реакционно-способное серебро, но не относят такие инертные металлы, как тантал, ниобий и некоторые другие. Есть и другие классификации металлов, например, в металлургии все металлы делят на черные и цветные, относя к черным металлам железо и его сплавы.
Из сложных веществ наибольшее значение имеют, прежде всего, оксиды (см.§2.5), но так как в их классификации учитываются кислотно-основные свойства этих соединений, мы сначала вспомним, что такое кислоты и основания.
Кислоты – сложные вещества, содержащие в своем составе ионы оксония или при взаимодействии с водой образующие в качестве катионов только эти ионы.
Основания – сложные вещества, содержащие в своем составе гидроксид-ионы или при взаимодействии с водой образующие в качестве анионов только эти ионы.
Таким образом, мы выделяем кислоты и основания из общей массы соединений, используя два признака: состав и химические свойства.
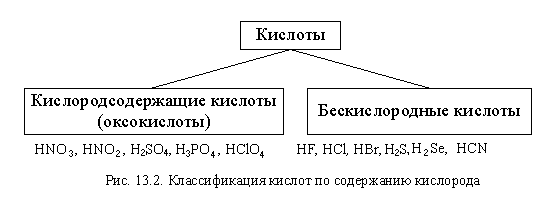
По составу кислоты делятся на кислородсодержащие (оксокислоты) и бескислородные (рис. 13.2).
Кислородсодержащие кислоты (оксокислоты) – кислоты, в состав которых входят атомы кислорода.
Бескислородные кислоты – кислоты, молекулы которых не содержат кислорода.
Следует помнить, что кислородсодержащие кислоты по своему строению являются гидроксидами.
Примечание. По традиции для бескислородных кислот слово кислота» используется в тех случаях, когда речь идет о растворе соответствующего индивидуального вещества, например: вещество HCl называют хлороводородом, а его водный раствор – хлороводородной или соляной кислотой.
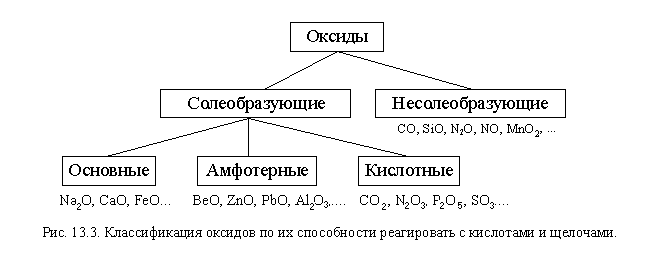
Теперь вернемся к оксидам. Мы относили оксиды к группе кислотных или основных по тому, как они реагируют с водой (или по тому, из кислот или из оснований они получаются). Но с водой реагируют далеко не все оксиды, зато большинство из них реагирует с кислотами или щелочами, поэтому оксиды лучше классифицировать по этому свойству.
Основные оксиды – оксиды, способные реагировать с кислотами и не способные реагировать со щелочами.
Кислотные оксиды – оксиды, способные реагировать со щелочами и не способные реагировать с кислотами.
Амфотерные оксиды – оксиды, способные реагировать и с кислотами, и со щелочами.
Существует несколько оксидов, которые в обычных условиях не реагируют ни с кислотами, ни со щелочами. Такие оксиды называют несолеобразующими. Это, например, CO, SiO, N2O, NO, MnO2. В отличие от них, остальные оксиды называют солеобразующими (рис. 13.3).
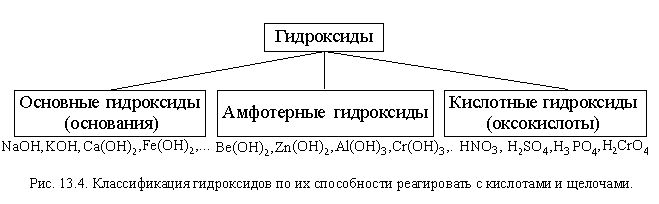
Как вы знаете, большинство кислот и оснований относится к гидроксидам. По способности гидроксидов реагировать и с кислотами, и со щелочами среди них (как и среди оксидов) выделяют амфотерные гидроксиды (рис. 13.4).
| Амфотерные гидроксиды – гидроксиды, способные реагировать и с кислотами, и со щелочами. |
Теперь нам осталось дать определение солей. Термин » соль» используется издавна. По мере развития науки, его смысл неоднократно изменялся, расширялся и уточнялся. В современном понимании соль – это ионное соединение, но традиционно к солям не относят ионные оксиды (так как их называют основными оксидами), ионные гидроксиды (основания), а также ионные гидриды, карбиды, нитриды и т. п. Поэтому упрощенно можно сказать, что
Соли – ионные соединения, но не гидриды, не оксиды и не гидроксиды.
Можно дать и другое, более точное, определение солей.
Соли – ионные соединения, в состав которых в качестве анионов входят кислотные остатки.
Давая такое определение, соли оксония обычно относят и к солям, и к кислотам.
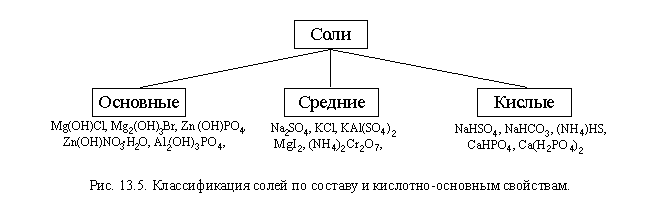
Соли принято подразделять по составу на кислые, средние и основные (рис. 13.5).
Кислые соли – соли, в состав которых входят анионы, способные отдавать протон.
То есть в состав анионов кислых солей входят атомы водорода, связанные ковалентными связями с другими атомами анионов и способные отрываться под действием оснований.
| Основные соли – соли, в состав которых входят катионы, способные принимать протон и содержащие гидроксильные группы (группы – О– Н). |
Основные соли обычно имеют очень сложный состав и часто нерастворимы в воде. Типичный пример основной соли – минерал малахит Cu2(OH)2CO3.
Как видите, важнейшие классы химических веществ выделяются по разным классификационным признакам. Но по какому бы признаку мы не выделяли класс веществ, все вещества этого класса обладают общими химическими свойствами.
В этой главе вы познакомитесь с наиболее характерными химическими свойствами веществ-представителей этих классов и с самыми важными способами их получения.


2.Напишите формулы пяти металлов и пяти неметаллов.
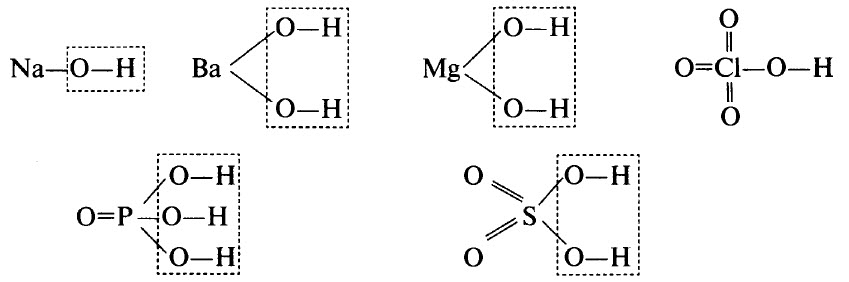
3.Составьте структурные формулы следующих соединений:
(H3O)Cl, (H3O)2SO4, HCl, H2S, H2SO4, H3PO4, H2CO3, Ba(OH)2, RbOH.
4.Каким оксидам соответствуют следующие гидроксиды:
H2SO4, Ca(OH)2, H3PO4, Al(OH)3, HNO3, LiOH?
Каков характер (кислотный или основный) каждого из этих оксидов?
5.Среди следующих веществ найдите соли. Составьте их структурные формулы.
KNO2, Al2O3, Al2S3, HCN, CS2, H2S, K2[Zn(OH)4], SiCl4, CaSO4, AlPO4
6.Составьте структурные формулы следующих кислых солей:
NaHSO4, KHSO3, NaHCO3, Ca(H2PO4)2, CaHPO4.
В кристаллах металлов и в их расплавах атомные остовы связывает единое электронное облако металлической связи. Как и отдельный атом элемента, образующего металл, кристалл металла обладает способностью отдавать электроны. Склонность металла отдавать электроны зависит от его строения и, прежде всего, от размера атомов: чем больше атомные остовы (то есть чем больше ионные радиусы), тем легче металл отдает электроны.
Металлы – простые вещества, поэтому степень окисления атомов в них равна 0. Вступая в реакции, металлы почти всегда изменяют степень окисления своих атомов. Атомы металлов, не обладая склонностью принимать электроны, могут только их отдавать или обобществлять. Электроотрицательность этих атомов невелика, поэтому даже при образовании ими ковалентных связей атомы металлов приобретают положительную степень окисления. Следовательно, все металлы в той или иной степени проявляют восстановительные свойства. Они реагируют:
1) С неметаллами (но не все и не со всеми):
4Li + O2 = 2Li2O,
3Mg + N2 = Mg3N2 (при нагревании),
Fe + S = FeS (при нагревании).
Наиболее активные металлы легко реагируют с галогенами и кислородом, а с очень прочными молекулами азота реагирует только литий и магний.
Реагируя с кислородом, большинство металлов образует оксиды, а наиболее активные – пероксиды (Na2O2, BaO2) и другие более сложные соединения.
2) С оксидами менее активных металлов:
2Ca + MnO2 = 2CaO + Mn (при нагревании),
2Al + Fe2O3 = Al2O3 + 2Fe (с предварительным нагреванием).
Возможность протекания этих реакций определяется общим правилом (ОВР протекают в направлении образования более слабых окислителя и восстановителя) и зависит не только от активности металла (более активный, то есть легче отдающий свои электроны металл восстанавливает менее активный), но и от энергии кристаллической решетки оксида (реакция протекает в направлении образования более » прочного» оксида).
3) С растворами кислот (§ 12.2):
Mg + 2H3O = Mg 2B + H2 + 2H2O, Fe + 2H3O
= Fe 2
+ H2 + 2H2O,
Mg + H2SO4p = MgSO4p + H2 , Fe + 2HClp = FeCl2p + H2
.
В этом случае возможность реакции легко определяется по ряду напряжений (реакция протекает, если металл в ряду напряжений стоит левее водорода).
4) C растворами солей (§ 12.2):
Fe + Cu 2 = Fe 2
+ Cu, Cu + 2Ag
= Cu 2
+2Ag,
Fe + CuSO4p = Cu + FeSO4p, Cu + 2AgNO3p = 2Ag
+ Cu(NO3)2p.
Для определения возможности протекания реакции здесь также используется ряд напряжений.
5) Кроме этого, наиболее активные металлы (щелочные и щелочноземельные) реагируют с водой (§ 11.4):
2Na + 2H2O = 2Na + H2 + 2OH
, Ca + 2H2O = Ca 2
+ H2 + 2OH
,
2Na + 2H2O = 2NaOHp + H2 , Ca + 2H2O = Ca(OH)2p + H2
.
Во второй реакции возможно образование осадка Ca(OH)2.
Большинство металлов в промышленности получают, восстанавливая их оксиды:
Fe2O3 + 3CO = 2Fe + 3CO2 (при высокой температуре),
MnO2 + 2C = Mn + 2CO (при высокой температуре).
В лаборатории для этого часто используют водород:
Наиболее активные металлы, как в промышленности, так и в лаборатории, получают с помощью электролиза (§ 9.9).
В лаборатории менее активные металлы могут быть восстановлены из растворов их солей более активными металлами (ограничения см. в § 12.2).

1.Какие из приведенных веществ являются неметаллами: Be, C, Ne, Pt, Si, Sn, Se, Cs, Sc, Ar, Ra?
2.Приведите примеры неметаллов, при обычных условиях представляющих собой а) газы, б) жидкости, в) твердые вещества.
3.Приведите примеры а) молекулярных и б) немолекулярных простых веществ.
4.Приведите по три примера химических реакций, в которых окислительные свойства проявляет а) хлор и б) водород.
5.Приведите три примера химических реакций, отсутствующие в тексте параграфа, в которых водород проявляет восстановительные свойства.
6.Осуществите превращения:
а) P4 P4O10
H3PO4; б) H2
NaH
H2; в) Cl2
NaCl
Cl2.

Вы уже знаете, что все основные оксиды – твердые немолекулярные вещества с ионной связью.
К основным оксидам относятся:
а) оксиды щелочных и щелочноземельных элементов,
б) оксиды некоторых других элементов, образующих металлы, в низших степенях окисления, например: СrO, MnO, FeO, Ag2O и др.
В их состав входят однозарядные, двухзарядные (очень редко трехзарядные катионы) и оксид-ионы. Наиболее характерные химические свойства основных оксидов как раз и связаны с присутствием в них двухзарядных оксид-ионов (очень сильных частиц-оснований). Химическая активность основных оксидов зависит прежде всего от прочности ионной связи в их кристаллах.
1) Все основные оксиды реагируют с растворами сильных кислот (§ 12.5):
Li2O + 2H3O = 2Li
+ 3H2O, NiO + 2H3O
= Ni 2
+3H2O,
Li2O + 2HClp = 2LiClp + H2O, NiO + H2SO4p = NiSO4p + H2O.
В первом случае кроме реакции с ионами оксония протекает еще и реакция с водой, но, так как ее скорость значительно меньше, ею можно пренебречь, тем более, что в итоге все равно получаются те же продукты.
Возможность реакции с раствором слабой кислоты определяется как силой кислоты (чем сильнее кислота, тем она активнее), так и прочностью связи в оксиде (чем слабее связь, тем активнее оксид).
2) Оксиды щелочных и щелочноземельных металлов реагируют с водой (§ 11.4):
Li2O + H2O = 2Li + 2OH
BaO + H2O = Ba 2
+ 2OH
Li2O + H2O = 2LiOHp, BaO + H2O = Ba(OH)2p.
3) Кроме того, основные оксиды реагируют с кислотными оксидами:
BaO + CO2 = BaCO3,
FeO + SO3 = FeSO4,
Na2O + N2O5 = 2NaNO3.
В зависимости от химической активности тех и других оксидов реакции могут протекать при обычной температуре или при нагревании.
В чем причина протекания таких реакций? Рассмотрим реакцию образования BaCO3 из BaO и CO2. Реакция протекает самопроизвольно, а энтропия в этой реакции уменьшается (из двух веществ, твердого и газообразного, образуется одно кристаллическое вещество), следовательно, реакция экзотермическая. В экзотермических реакциях энергия образующихся связей больше, чем энергия рвущихся, следовательно, энергия связей в BaCO3 больше, чем в исходных BaO и CO2. И в исходных веществах, и в продуктах реакции два типа химической связи: ионная и ковалентная. Энергия ионной связи (энергия решетки) в BaO несколько больше, чем в BaCO3 (размер карбонатного иона больше, чем оксид-иона), следовательно, энергия системы O 2 + CO2 больше, чем энергия CO3 2
.
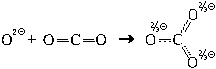
Иными словами, ион CO3 2 более устойчив, чем отдельно взятые ион O 2
и молекула CO2. А большая устойчивость карбонат-иона (его меньшая внутренняя энергия) связана с распределением заряда этого иона (– 2 е) по трем атомам кислорода карбонат-иона вместо одного в оксид-ионе (см. также § 13.11).
4) Многие основные оксиды могут быть восстановлены до металла более активным металлом или неметаллом-восстановителем:
MnO + Ca = Mn + CaO (при нагревании),
FeO + H2 = Fe + H2O (при нагревании).
Возможность протекания таких реакций зависит не только от активности восстановителя, но и от прочности связей в исходном и образующемся оксиде.
Общим способом получения почти всех основных оксидов является окисление соответствующего металла кислородом. Таким способом не могут быть получены оксиды натрия, калия и некоторых других очень активных металлов (в этих условиях они образуют пероксиды и более сложные соединения), а также золота, серебра, платины и других очень малоактивных металлов (эти металлы не реагируют с кислородом). Основные оксиды могут быть получены термическим разложением соответствующих гидроксидов, а также некоторых солей (например, карбонатов). Так, оксид магния может быть получен всеми тремя способами:
2Mg + O2 = 2MgO,
Mg(OH)2 = MgO + H2O,
MgCO3 = MgO + CO2.

а) Li2O + CO2 б) Na2O + N2O5
в) CaO + SO3
г) Ag2O + HNO3 д) MnO + HCl
е) MgO + H2SO4
2.Составьте уравнения реакций, протекающих при осуществлении следующих превращений:
а) Mg MgO
MgSO4 б) Na2O
Na2SO3
NaCl
в) CoO Co
CoCl2 г) Fe
Fe3O4
FeO
3.Порцию никеля массой 8,85 г прокалили в токе кислорода до получения оксида никеля(II), затем обработали избытком соляной кислоты. К полученному раствору добавили раствор сульфида натрия до прекращения выделения осадка. Определите массу этого осадка. 

3.С какими из следующих оксидов может реагировать гидроксид калия: SiO2, MgO, Al2O3, FeO, SeO3, Mn2O7. Укажите условия протекания этих реакций.
4.Определите массу гидроксида натрия, минимально необходимого для полного поглощения 33,6 л углекислого газа при нормальных условиях.

ZnO + 2OH + H2O = [Zn(OH)4] 2
.