Амт что это в медицине
Что такое гормон АМГ и для чего нужно за ним следить
Что такое АМГ?
АМГ — Антимюллеров гормон — является точным маркером овариального резерва. Этот гормон вырабатывается фолликулами яичника и показывает репродуктивный потенциал женщины. Помимо показателя АМГ специалист обращает особое внимание на возраст пациентки, а также на количество антральных фолликулов на 2–3 день менструального цикла. В совокупности данных врач оценивает овариальный резерв женщины и прогнозирует шансы наступления беременности.
АМГ и возраст.
На западе уже сложилась тенденция, когда врачи рекомендуют контролировать уровень АМГ начиная с 12 лет. И если после достижения 14 лет его показатель понижается, это служит основанием для замораживания яйцеклетки. Возможно такая позиция является чрезмерной, но, однозначно, это касается женщин после 35 лет, планирующих беременность. Им обязательно следует контролировать уровень АМГ и учитывать, что снижение АМГ˂ 1 — является признаком приближающейся менопаузы.
Как косвенно можно узнать о снижении АМГ?
К сожалению, распознать это, не сдав соответствующий анализ — невозможно. Выработка АМГ не связана с количеством других гормонов. Кроме того, на данный гормон не оказывает влияние питание, образ жизни и какие‐либо другие внешние факторы.
Анализ крови дает точное представление об АМГ?

Что нужно делать, если анализ показал низкий уровень АМГ?
Могут ли контрацептивы (КОК) сохранить фолликулярный резерв и повысить АМГ?
Контрацептивы не могут оказывать какого‐либо влияния на фолликулярный резерв вообще. Это распространенное заблуждение женщин, принимающих КОК, не только в целях предохранения, но и в целях «сохранения» яйцеклеток.
Как повысить уровень АМГ?
Повысить уровень АМГ принудительными способами невозможно.Помните, что величина АМГ в течение жизни женщины изменяется обычно в сторону уменьшения. Низкое значение гормона необходимо расценивать как побуждение к действию (если вы планируете когда‐либо иметь детей).
АМГ предсказывает наступление менопаузы?
Показатель АМГ считается в достаточной степени объективным не только с точки зрения оценки репродуктивного потенциала женщины, но и с точки зрения прогноза наступления менопаузы. Более того, среди прочих гормональных маркеров — снижение АМГ является наиболее достоверным свидетельством приближения менопаузы.
АМГ — надежный маркер наступления беременности при ЭКО?

Как работать с пациентками с низким АМГ?
Да, таких пациенток в клинике «ЭмбриЛайф» много. К сожалению, при АМГ меньше 1 получить направление на ЭКО по ОМС практически невозможно. В этом случае женщины вынуждены делать ЭКО платно. Мы проводим ряд манипуляций, направленных на повышение шансов на успешное ЭКО у женщин с низким АМГ, а также используем специальные протоколы стимуляции.
У вас остались вопросы?
Наша клиника готова ответить на все интересующие вас темы, и поддержать в трудные минуты. Просто оставьте заявку, и мы свяжемся с вами для обсуждения всех деталей.
Антимюллеров гормон
Оглавление
Антимюллеров гормон (АМГ), названный так по имени ученого, выделившего у женского и мужских эмбрионов общую канал‑трубку, является биологически активным веществом, определяющим способность к зачатию. Его отклонения от норм могут свидетельствовать о серьезных проблемах со здоровьем. Выделяется антимюллеров гормон и у женщин, и мужчин. У представителей сильного пола его концентрация в организме существенно ниже.
Особенно важной оценка показателей содержания гормона в организме является на этапе планирования беременности. Также анализы сдаются для определения задержек и преждевременного полового созревания, решения иных задач.
Роль в организме женщины
Антимюллеров гормон производится клетками яичников. Он вырабатывается организмом уже на 32 недели зародышевого состояния. Особенно важную роль гормон играет на этапе полового созревания. В это время его концентрация постепенно увеличивается. В 20‑30 лет содержание гормона максимально. Спад показателя отмечается после 30 лет. Свое существование он прекращает после наступления менопаузы. Это обусловлено тем, что в данный период процесс образования яйцеклеток останавливается.
АМГ указывает на фолликулярный запас яичников. При этом уровень гормона может варьироваться от цикла к циклу (как снижаться, так и повышаться). С качеством яйцеклеток АМГ не связан. Поэтому нельзя точно утверждать, что его низкий показатель свидетельствует о бесплодии.
Когда нужно пройти исследование?
Сдать анализ на антимюллеров гормон следует:
Также исследование проводится при неуспешных попытках ЭКО, выявлении причин бесплодия и в ряде других случаев.
Важно! Особенно важно исследовать показатели антимюллерова гормона при проблемах с зачатием. Если обнаруживается риск бесплодия, рекомендуют провести извлечение здоровых яйцеклеток и выполнить их витрификации ооцитов (отложенное материнство).
Как подготовиться к сдаче анализа?
Для получения достоверных результатов исследования следует пройти небольшую подготовку:
Кровь на анализ не сдают после перенесенных острых заболеваний.
Важно! Об остальных особенностях подготовки к диагностике расскажет лечащий врач. Он же проведет и расшифровку результатов анализа.
На какой день цикла сдают анализ на антимюллеров гормон? Срок прохождения исследования не играет существенной роли. Это связано с тем, что концентрация гормона на протяжении всего менструального цикла практически не меняется. Тем не менее, лучше всего проходить диагностику с 3 по 5 день цикла. Это обусловлено тем, что АМГ обычно сдают вместе с ФСГ (фолликулостимулирующий гормон). Показатели нормы антимюллерова гормона в лаборатории подбираются с учетом фазы менструального цикла. Его пациентка указывает при сдаче крови. Благодаря этому повышается точность получаемых результатов. Чтобы отследить необходимые показатели в динамике, диагностику повторяют несколько раз.
Нормы антимюллерова гормона (по возрасту):пониженные и повышенные показатели
Показатели содержания вещества зависят от ряда факторов. Одним из них является возраст пациентки.
В период с 18 до 25 лет нормальными считаются показатели от 1,2 до 13,4 нг/мл, например. Отклонения могут свидетельствовать о различных патологических процессах.
Следует учитывать, что на показатель влияют и такие факторы, как:
Антимюллеров гормон может быть повышен при:
Понижен антимюллеров гормон при уменьшении количества плодотворных фолликулов. Низкий уровень также может указывать на сокращение функции яичников в связи с их истощением.
Пониженный показатель может свидетельствовать о:
Влияние на беременность
Антимюллеров гормон важен для зачатия. При этом вопрос естественного оплодотворения при низком уровне АМГ остается спорным. В этом случае сниженным считается уровень менее 1,2 нг/мл. При этом шансы на зачатие уменьшаются. Но они сохраняются в случае, если в пределах нормы будет находиться уровень фолликулостимулирующего гормона (ФСГ).
Успешное зачатие даже при низком показателе АМГ возможно с применением методик ЭКО (экстракорпорального оплодотворения). Обычно в таких случаях рекомендуют японский протокол. Обеспечивается минимальная стимуляция, которая разделяется перерывами и позволяет получить в каждом цикле 1‑2 жизнеспособные яйцеклетки. Их замораживают и переносят в матку в наиболее благоприятный период. Также возможно применение ЭКО в естественном цикле и другие модифицированные протоколы стимуляции овуляции.
Высокие показатели АМГ также могут негативно сказаться на возможностях зачатия. Это обусловлено тем, что они указывают на нарушения репродуктивной функции. Обычно рост АМГ отмечается при опухолях, поликистозе и генетических проблемах. Зачатие рекомендуют отложить до выяснения причины повышения уровня антимюллерова гормона и ее устранения. Лечение не стоит откладывать.
Преимущества обращения в МЕДСИ
Чтобы сдать анализ на антимюллеров гормон, уточнить его цену, достаточно позвонить Записаться в клинику можно не только по указанному номеру, но и с помощью приложения SmartMed.
Не нужно бояться хронического аутоимунного тиреоидита
В практике эндокринолога существует 2 страшилки: гормоны и хронический аутоимунный тироидит (ХАИТ). И если гормоны бывают разные, среди них могут попасться те, которых опасаться следует, то опасность ХАИТа явно переоценена.
Что такое ХАИТ? Это выработка организмом антител к своей щитовидной железе. Антитела долгое время атакуют ни в чём неповинный орган и очень часто могут уничтожить его совсем. Страшно.
Первый кошмар, с которым сталкиваются пациенты – повышение антител к тиреопероксидазе (ТПО). Причём, нормальные значения антител очень низкие (обычно до 6 ед), на этом фоне даже 30 ед кажутся кошмаром. Между тем, изолированное повышение антител к ТПО (т.е. если уровень гормонов ТТГ, Т4 свободного и Т3 свободного находятся в пределах нормы), ещё не повод для лечения.
С антителами к тиреоглобулину (ТГ) ситуация ещё интереснее: они к ХАИТу отношения сами по себе не имеют, могут подняться «за компанию». Изолированное повышение антител к тиреоглобулину (когда антитела к ТПО не повышены) диагностически значимо только при полностью удалённой щитовидной железе. В остальных ситуациях это случайная находка, скажем так «личное дело самого организма, не касающееся эндокринолога».
Второй «кошмар» ХАИТа: изменения на УЗИ. Они обычно очень красочно описываются врачами, будя разные ассоциации у пациентов. На самом деле, врачи просто описывают типичную ситуацию, которая происходит со щитовидной железой, если она в беде.
Только по УЗИ диагноз ХАИТа поставить нельзя.
Чем грозят человеку изменения щитовидной железы при ХАИТе? Ничем. В рак это состояние не перерастёт, оперировать его не надо, на другие органы не расползётся.
Когда антитела к ТПО всё-таки имеют значение?
И вот мы плавно подошли к третьему кошмару ХАИТа: пожизненная заместительная гормональная терапия (ЗГТ). Звучит ужасно, но на деле это означает всего одна таблетка с утра. Ограничений и противопоказаний, в принципе, нет никаких.
Четвёртый кошмар ХАИТа – набор веса на ЗГТ. Его не будет. Вы просто заменяете натуральный гормон искусственно произведённым. К счастью, произведённым очень хорошо, поэтому организм разницу не чувствует и живёт себе дальше.
Следует отметить, что ХАИТ был впервые описан японцем Хашимото (поэтому заболевание иногда и называют тироидит Хашимото) в 1912 году, ЗГТ пациенты получают уже не менее 30-ти лет. За это время по препаратам накоплен обширный материал, подтверждающий, что они не влияют ни на продолжительность жизни, ни на её качество.
Наблюдаться с ХАИТом обязательно нужно, но кратность обследований должен определить врач индивидуально. Она зависит от нескольких причин: возраста, уровня ТТГ исходно, назначенной дозы препарата. Скажем сразу, что ежегодное УЗИ в этот список однозначно не войдёт.
Автор: Эндокринолог, кандидат медицинских наук Таныгина Наталья Ивановна.
Амт что это в медицине
Российская медицинская академия последипломного образования; Тушинская детская городская больница, Москва
Кафедра неврологии факультета усовершенствования врачей и кафедра нервных болезней педиатрического факультета Российского государственного медицинского университета, Москва
Тушинская городская детская больница, Москва
ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава России, Москва, Россия
Современная диагностика агенезии мозолистого тела у детей
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2017;117(1): 63-66
Милованова О. А., Алиханов А. А., Тамбиев И. Е., Тараканова Т. Ю. Современная диагностика агенезии мозолистого тела у детей. Журнал неврологии и психиатрии им. С.С. Корсакова. 2017;117(1):63-66.
Milovanova O A, Alikhanov A A, Tambiev I E, Tarakanova T Yu. Modern diagnostic of agenesis of the corpus callosum in children. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2017;117(1):63-66.
https://doi.org/10.17116/jnevro20171171163-66
Российская медицинская академия последипломного образования; Тушинская детская городская больница, Москва
В статье представлены наблюдения авторов, касающиеся основных нейровизуализационных (МРТ) проявлений агенезии мозолистого тела (АМТ). Этому предпослан обзор литературы по строению МТ в норме и патологии. Подчеркивается, что часть случаев изолированной АМТ выявлена при рутинном пренатальном УЗИ. Пренатальная МРТ более эффективна в этом отношении. В 74% наблюдений у больных с АМТ результаты МРТ совпадают с данными УЗИ и КТ. МРТ обладает преимуществом в диагностике врожденных пороков развития МТ, а также дифференциации сопутствующих аномалий ЦНС.
Российская медицинская академия последипломного образования; Тушинская детская городская больница, Москва
Кафедра неврологии факультета усовершенствования врачей и кафедра нервных болезней педиатрического факультета Российского государственного медицинского университета, Москва
Тушинская городская детская больница, Москва
ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава России, Москва, Россия
Мозолистое тело (МТ) — самая крупная церебральная комиссура, располагающаяся по срединной продольной линии головного мозга. Оно соединяет филогенетически наиболее молодые участки больших полушарий мозга, обеспечивая межполушарную передачу информации [1].
Агенезия мозолистого тела (АМТ) — отсутствие пересечения средней линии комиссуральными волокнами М.Т. По классификации врожденных пороков развития головного мозга и черепа D. Harwood-Nash [2] АМТ относится к группе нарушений органогенеза и занимает 10-е место среди всех других пороков развития ЦНС. Частота АМТ составляет 0,3—0,7% в общем населении и 2—3% — среди инвалидов с умственной отсталостью [3].
В сочетании с АМТ могут встречаться такие пороки развития, как липомы МТ, полимикрогирия, шизэнцефалия, межполушарные кисты, мальформация Денди—Уокера и др. Как правило, АМТ не имеет самостоятельной клинической картины, что обусловливает сложности ее диагностики [4]. Прижизненная визуализация АМТ стала возможной благодаря внедрению в клиническую практику магнитно-резонансной томографии (МРТ) головного мозга.
Механизмы формирования МТ до настоящего времени остаются предметом дискуссий. Известно, что нервная система развивается из медуллярной трубки. На 4-й неделе гестации образуются три первичных мозговых пузыря, на 6—7-й неделе — пять. МТ образуется из первого мозгового пузыря и формируется из покровной части конечной пластинки Гиса, дорсальный конец которой утолщается, образуя так называемый поперечный вал [5]. Согласно результатам ряда исследований [5—7], на 15—17-й неделе внутриутробного развития появляются комиссуральные волокна МТ, соединяющие большие полушария мозга. По данным G. Davilla-Gutierrez [8], вначале МТ увеличивается рострально, затем каудально, при этом волокна ростральной части пересекаются приблизительно на 74-й день, а на 115-й день происходит его утолщение. L. Richards и соавт. [7], напротив, указывают, что часть каудальных аксонов МТ, зависящих от гиппокампа, может одновременно пересекаться с ростральными аксонами МТ. К 20-й неделе МТ практически сформировано [9]. У недоношенных детей его формирование замедляется [10]. У младенцев к 8—10-му месяцу жизни происходит окончательная миелинизация ростральной части МТ [11].
АМТ может быть результатом недостаточного развития комиссуральной пластинки, агенезии или деструкции третьего слоя нейронов [12]. Есть данные, подтверждающие, что первичная АМТ формируется до 12—16-й недели внутриутробного развития [13]. После 18—20-й недели происходит вторичное повреждение МТ, являющееся следствием энцефаломаляции на более поздних этапах развития плода [14]. При вторичной АМТ чаще происходит недоразвитие задней части (валик) МТ, а передняя или средняя части МТ (колено, клюв и часть корпуса) отсутствуют [12].
Определенные трудности в диагностике АМТ сохраняются и в наши дни. Время ее внутриутробного обнаружения напрямую зависит от стадии онтогенеза МТ.
По данным R. Achiron и соавт. [15], которые обследовали 270 беременных между 16-й и 37-й неделями гестации, при ультразвуковом исследовании (УЗИ) плода удалось измерить длину, ширину и толщину МТ в 258 случаях. Это позволило выявить линейную зависимость между увеличением роста МТ и гестационным возрастом плода, а также установить, что на 19—21-й неделях гестации происходит его максимальное увеличение. A. Barkovich и соавт. [16] предположили, что определенные подтипы АМТ зависят от пола. Это нашло подтверждение в экспериментах на животных: у лабораторных животных (мыши) линии BALB/cCF с нарушениями развития МТ было выявлено преобладание самок [17].
Согласно исследованиям P. Govaert и L. de Vries [11], после 20-й недели беременности на УЗИ определяются следующие признаки АМТ: вентрикуломегалия; высокое расположение III желудочка; отсутствие полости прозрачной перегородки, а по данным С.М. Воеводина [18], на УЗИ плода при условии технической чистоты получения сагиттальной проекции АМТ выявляется на сроках 15—36 нед беременности. К сожалению, значительная доля случаев изолированной АМТ при рутинном пренатальном УЗИ не улавливается.
Пренатальная МРТ наиболее эффективна при диагностике АМТ [11]. В 74% наблюдений у больных с АМТ результаты МРТ совпадают с данными УЗИ и КТ-диагностики [19].
Постнатальная ультразвуковая картина АМТ характеризуется отсутствием изображения МТ; исчезновением нормальной архитектоники борозд и извилин в сагиттальной плоскости сканирования; веерообразным отхождением борозд от крыши III желудочка; широким расположением боковых желудочков с изменением ориентации передних рогов в коронарных плоскостях и смещением вверх или расширением III желудочка. На К.Т. определяются параллельный ход и увеличение расстояния между телами боковых желудочков, расширение задних рогов и преддверий боковых желудочков (кольпоцефалия) [11].
В данной публикации приведены собственные наблюдения АМТ и анализ соответствующих данных прижизненной нейровизуализации мозга.



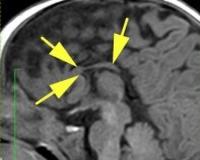
Важной находкой при АМТ на МРТ является параллельная ориентация тел боковых желудочков по отношению друг к другу (рис. 4, а), расширенные фронтальные отделы желудочков, так называемый «симптом ухвата».

При МРТ мы обращали внимание также на описанное в литературе [12] изолированное расширение задних рогов — кольпоцефалию, обусловленную гипоплазией ассоциативных трактов белого вещества затылочных долей. Диагностический ряд на МРТ дополняют отсутствие нормально сформированных перикаллезных извилин (рис. 5, а) и радиальная центростремительная позиция борозд медиальной поверхности теменной доли (рис. 5, б).

Появилась также новая нейровизуализационная технология — магнито-резонансная морфометрия, которая помогает оценить степень поражения М.Т. Можно вычислить каллозальный индекс — отношение площади МТ к площади внутреннего сечения черепной коробки, оценить размер, общую площадь, толщину колена, корпуса, перешейка и валика МТ [22—24].
Нередко изменения структуры МТ обнаруживаются случайно, при КТ- или МРТ-исследованиях по поводу других заболеваний. Так, описано [25] наличие АМТ у пациента с ювенильной болезнью Гентингтона в сочетании с множественными соединительнотканными дисплазиями, остеохондропатией.
Таким образом, среди множественных врожденных пороков развития ЦНС, которыми страдают около 1% детей [26], одно из ведущих мест принадлежит АМТ. В настоящее время совершенствуются методы нейровизуализации, такие как МРТ плода, применяются методики ультразвукового сканирования плода во внутриутробном периоде на ранних сроках гестационного развития, позволяющие заподозрить тот ли иной наследственный синдром в пренатальном периоде.
Адекватное и своевременное распознавание врожденных пороков развития МТ представляет собой непростую задачу, решение которой требует владения новейшими методиками нейровизуализационной диагностики. В данной статье представлены основные нейровизуализационные проявления АМТ.
Агенезия мозолистого тела
Агенезия мозолистого тела — это врожденное отсутствие мозолистого тела либо его части. Аномалия обусловлена генетическими нарушениями, сосудистыми мальформациями, тератогенными факторами. Основные признаки заболевания: двигательные расстройства, задержка психоречевого развития, судорожные приступы. При негрубом (частичном) варианте патологии возможно малосимптомное течение. Для диагностики состояния назначается церебральные КТ или МРТ, нейросонография у новорожденных, генетические исследования. Лечение симптоматическое: медикаментозная коррекция осложнений, реабилитационные программы.
МКБ-10
Общие сведения
Агенезия мозолистого тела (АМТ) — один из наиболее частых пороков нервной системы. Распространенность болезни в популяции составляет от 0,05% до 7% среди новорожденных, причем в группе детей с замедленным становлением психики агенезия встречается у 2,3%. Калифорнийская программа по изучению врожденных пороков предоставляет другие данные по частоте агенезии — 1,4 на 10000 живых новорожденных. Впервые состояние было описано в 1812 году в ходе аутопсии, проведенной немецким анатомом И. Рэйлем, и названо «природной моделью рассеченного мозга».
Причины
Точные этиологические факторы заболевания не установлены. В современной неврологии преобладает мультифакториальная теория, согласно которой для формирования врожденного порока ЦНС требуется комбинация неблагоприятных экзогенных и эндогенных причин. Ученые выделяют несколько наиболее вероятных предпосылок развития агенезии:
Основным фактором риска выступает недоношенность. У новорожденных, родившихся до 27-недельного срока гестации МТ истончено в задних отделах, между 28 и 30 неделями — только в области валика. У рожденных после 30 недели в неонатальном периоде изменения не обнаруживаются, хотя при нейропсихологическом исследовании у школьников зачастую выявляется дефицит межполушарной передачи познавательной информации.
Патогенез
Мозолистое тело (МТ) представляет собой крупный пучок комиссуральных нервных волокон. Это важный аксональный путь, который соединяет соответствующие зоны коры правого и левого полушарий. Анатомическая структура имеет длину 7-9 см, состоит из более 300 млн. аксонов. Формирование МТ начинается на этапе позднего нейроонтогенеза (8-9 недели эмбриогенеза). Его созревание в норме продолжается до 20-25 лет.
Агенезия возникает при нарушении дифференциации нервной трубки в период со 2 до 5 месяца внутриутробного развития. При полном отсутствии МТ третий мозговой желудочек остается открытым, не формируются столбы свода мозга, отсутствуют прозрачные перегородки. В 60% случаев при АМТ передней комиссуры нет вообще. В 10% она увеличена и берет на себя часть функций мозолистого тела у новорожденных, а также на следующих этапах постнатального периода.
Характерным анатомическим изменением является колпоцефалия, при которой расширены задние отделы боковых церебральных желудочков. Состояние не относится к истинной гидроцефалии новорожденных, а обусловлено уменьшением кортикальных ассоциативных путей. Еще один типичный признак порока — пучки Пробста, представляющие собой неправильно ориентированные аксоны, расположенные параллельно межполушарной щели.
Классификация
В практической неврологии состояние подразделяют на тотальное, когда орган полностью отсутствует, и частичное (парциальное), при котором визуализационные методы не обнаруживают отдельные участки МТ. Это имеет решающее значение для тяжести клинической картины, возможных осложнений. В соответствии с патогенетическими особенностями формирования врожденных пороков, выделяют следующие 3 формы болезни:
Симптомы
Клиническая картина агенезии мозолистого тела широко варьирует от практически бессимптомных форм (при гипоплазии) до критических нервно-психических расстройств при его грубом недоразвитии, сопровождающемся другими врожденными пороками ЦНС. У новорожденных признаки патологии могут вовсе отсутствовать и проявляться по мере взросления младенца задержкой психомоторного развития.
Двигательные нарушения определяются у 35-40% пациентов. Они проявляются мышечной гипотонией или дистонией, гипер- или гипорефлексией, нарушением глотательного и сосательного рефлексов. Дети позже начинают держать голову, испытывают затруднения при обучении сидению, ползанию, ходьбе. Могут отмечаться координационные нарушения, неуклюжая походка. Из пароксизмальных расстройств у новорожденных и детей первого года жизни преобладают судороги.
Мозолистое тело поддерживает связь между церебральными зонами, формирует межполушарную организацию высших психических процессов. При его агенезии либо гипоплазии у детей выявляются когнитивные расстройства. У новорожденных пациентов и в раннем детстве наблюдается задержка речи, снижение динамического компонента игровой деятельности. В дошкольном и школьном возрасте возникают проблемы с концентрацией внимания, расстройства памяти, при тотальной АМТ снижен коэффициент интеллекта.
Осложнения
Около 65% случаев заболевания сопровождаются сопутствующими врожденными патологиями, среди которых преобладают мальформации кортикального развития (22,8%), межполушарные кисты (14,3%), голопрозэнцефалия (14,3%). К более редким сопутствующим аномалиям относят кисты и гипоплазию мозжечка, синдром Арнольда-Киари. До 20% новорожденных, кроме структур ЦНС, имеют пороки нескольких внутренних органов.
У 75% больных с тотальным поражением наблюдается симптоматическая эпилепсия височно-лобной локализации, в 66% случаев выражены когнитивные нарушения. У 16% пациентов формируются расстройства аутистического спектра. Изредка встречаются патологии органа зрения в виде хориоретинальных лакунарных очагов, сочетанной аномалии зрительных нервов.
Диагностика
В качестве первичного метода обследования в пренатальном периоде проводится акушерское УЗИ. У новорожденных для скрининговой диагностики используется нейросонография, однако этот метод не всегда показывает хорошую информативность, особенно при парциальной агенезии. Для верификации диагноза назначаются следующие методы исследования:
Лечение агенезии мозолистого тела
Специфическая терапия отсутствует. Медикаментозное лечение назначается неонатологом или педиатром индивидуально с учетом ведущих патологических синдромов: у новорожденных, детей раннего возраста используются антиконвульсанты, нейрометаболические препараты, дегидратационная терапия. Основу медицинской помощи составляет комплексная реабилитация, которая включает следующие составляющие:
Прогноз и профилактика
Прогноз определяется видом врожденной аномалии мозолистого тела, наличием сопутствующих пороков развития ЦНС. Благоприятный исход наблюдается при частичной гипоплазии МТ, а в случае комбинированных церебральных пороков у новорожденных могут быть жизнеугрожающие осложнения. Профилактические меры включают медико-генетическое консультирование, исключение тератогенных влияний в гестационном периоде.